| J Korean Neurol Assoc > Volume 41(4); 2023 > Article |
|
62세 남자 환자가 좌우 혼동(right left disorientation)과 진행하는 기억력장애로 타 병원에서 의뢰되어 외래 진료를 위해 방문하였다. 오른손잡이고 고등학교 졸업의 학력으로 부인과 딸과 함께 살고 있었다. 특이 병력과 음주력은 없었으며 20세부터 40세까지 하루에 반 갑씩 20년간의 흡연력이 있었고, 치매 가족력은 없었다. 환자는 젊은 시절 자동차 정비공으로 일하다가 15년 전부터는 버스 운전을 하고 있었다. 환자는 내원 1년 전부터 네비게이션을 보면서 낯선 길을 운전할 때 좌회전 혹은 우회전을 하라는 안내를 받으면 좌우가 헷갈려서 반대로 회전해서 잘못된 경로로 간 적이 수차례 있었다. 또한 오랜만에 만나 친구와 인사할 때 상대방이 우측으로 악수를 청했는데 본인도 모르게 왼쪽 손으로 악수를 하려고 해서 당황한 적도 있었다. 기억력 저하도 동반되어서 물건을 두고 찾지 못하고, 집 현관문 비밀번호를 헷갈리는 일도 생겼다. 내원 3개월 전부터는 행동이 느려지고 자세가 다소 구부정했다고 하였다. 내원 당시 다소 구부정한 자세로 느리게 걸어서 진료실로 들어왔으며, 단기 기억력 저하가 심해져서 하루 전에 있던 일을 기억하지 못하고, 친구와의 약속을 잊어버려 나가지 못하고, 병원 예약일을 가족들이 이야기해줘도 반복해서 물어봤다고 하였다. 내원 당시에는 시공간기능도 떨어져서 낯선 길을 찾아가는데 몇 차례 길을 헤매서 찾아가는데 시간이 오래 걸린 적이 있었다. 예전에는 친구들과 모임에 자주 나갔는데, 최근 통제력이 상실되어 사소한 일로 화를 내며 모임에서 친구들과 자주 언쟁을 하는 등 갈등이 있었고, 이로 인해 예전보다 모임에 잘 나가지 않았다. 의처증도 동반되어서 배우자의 외출 및 용모 관리를 외도로 의심하고 배우자가 좋아하는 가수를 질투하고 가수의 사진을 찢어버린 적도 있었다. 원래 행동이 빠른 편이였는데, 행동 및 걸음걸이 속도가 눈이 띄게 느려졌다. 원래는 기계를 다루는 데 익숙해서 본인 집이나 이웃집에서 기계가 고장이 났을 때 잘 고쳐주곤 했는데, 이제는 기계를 다루는 일도 힘들어졌다. 운전은 아직 하고 있었지만 예전보다 많이 서툴러진 것이 느껴져서 사고가 날까 걱정되어 그만둬야 되나 고민을 하고 있었다. 돈 계산도 서툴러져서 슈퍼에서 거스름돈을 잘못 받아오는 일이 잦아져 카드만 사용하게 되었다. 개인 위생을 포함한 간단한 일상생활은 문제없이 수행하였다.
신경계진찰에서 상하지의 심부건반사가 다소 저하된 것 외에 국소 신경학적 결손은 없었다. 다만 양쪽 손에서 경한 정도의 서동증과 경직이 관찰되었다. 한국판 간이 정신상태 검사(Korea version of mini mental status examination, K-MMSE)는 30점 만점에 19점, 임상치매 평가 척도(clinical dementia rating, CDR)는 1점, 종합 임상치매 평가 척도(CDR-sum of boxes, CDR-SOB)는 5점이었다. 치매단계 평가 척도(global deterioration scale, GDS)는 4점, 바텔지수(Barthel index)는 20점이었다. 서울 신경심리선별 종합 검사 2판(Seoul neuropsychological screening battery-second edition, SNSB-Ⅱ)에서 기억력, 시공간기능, 전두엽집행 기능 항목에서 기능 저하 소견이 관찰되었고 계산 실수 및 좌우 혼동이 확인되었다(Table 1).
2011년 발표된 National Institute of Aging and Alzheimer Association (NIA-AA) criteria 임상치매 진단 기준(Table 2)에 따르면 다음의 4가지 조건을 만족하여야 치매로 진단할 수 있다[1]. 첫째, 일상활동의 장애, 둘째, 섬망 또는 주요 신경정신 질환으로 설명되지 않음, 셋째, 병력과 객관적인 인지 검사에서 인지장애가 확인됨, 넷째, 기억장애, 추론 능력 저하/판단력 저하/복잡한 업무수행장애, 시공간기능장애, 언어기능장애, 성격 변화/이상 행동 등의 다섯 가지 중 최소 두 가지 항목에 해당하는 인지 또는 행동장애가 있음. 환자의 병력을 확인해 보면 내원 1년 전부터 서서히 진행하는 기억장애, 좌우 혼동, 시공간기능장애가 있었으며, 치매 선별 검사인 K-MMSE에서 19점으로 인지기능의 저하가 의심되었고, SNSB-Ⅱ에서 여러 인지 영역(기억력, 시공간기능, 전두엽집행기능)에 걸쳐 같은 연령대의 기대 수준 이하로 인지기능 저하가 확인되었다. 이로 인해 이전에 잘 수행하던 모임 참석, 장보기, 돈 계산 등의 일상활동에도 지장이 있었고, 동반된 섬망 또는 주요 신경정신 질환이 없었으므로, 환자는 치매로 진단할 수 있다.
치매는 원인에 따라 치료가 가능한 치매와 치료가 불가능한 치매로 구분할 수 있다. 먼저 치료 가능한 치매 여부(대사 질환, 약물, 감염 등 전신 질환)를 확인하기 위해 신체 검사와 신경계 진찰은 물론이고, 기본 혈액 검사를 실시한다. 추가적으로 뇌의 구조적 변화를 확인하기 위해 뇌 자기공명영상(brain magnetic resonance imaging, MRI)을 시행할 수 있다. 최근에는 알츠하이머병의 병리 소견인 아밀로이드 단백질 축적을 확인할 수 있는 양전자단층촬영(positron emission tomography, PET) 리간드가 개발되어 살아 있는 상태에서도 아밀로이드 PET를 통한 알츠하이머병의 병리 수준 진단이 가능해지게 되었다.
이 환자의 경우 신체 검사와 신경계 진찰에서 경한 서동증 및 경직이 관찰되는 것 이외에는 이상 소견이 없었고, 고혈압이나 당뇨병 같은 혈관 위험인자도 없었다. 평소 복용하던 약물은 없었고, 전체 혈구 계산, 일반화학 검사, 갑상샘기능 검사, 혈청 비타민B12는 모두 정상 범위였으며 매독혈청 검사와 매독균 혈구 응집 검사는 음성이었다. 뇌 MRI에서는 나이를 고려했을 때 두정엽과 내측측두엽 위축을 포함한 전반적인 대뇌피질 위축이 확인되었으며 혈관성 병변은 관찰되지 않았다(Fig. 1).
검사 결과를 바탕으로 치료 가능한 치매 및 혈관 치매는 배제할 수 있었다. 비교적 서서히 진행하는 양상이였으며 기억장애가 첫 증상으로 나타난 점을 고려해볼 때 퇴행 치매 중 알츠하이머병 치매를 의심해 볼 수 있었다. 실제로 2011년 발표된 NIA-AA criteria 진단 기준에 따르면 가능성 있는 알츠하이머병 치매에 합당하였다(Table 3).1 가능성 있는 알츠하이머병 치매 진단 기준은 다음 4가지 조건을 모두 충족시켜야 한다. 첫째, 인지 저하는 수개월 또는 수년에 걸쳐 서서히 진행하는 경과를 가져야 한다. 둘째, 병력에서 인지기능의 악화가 뚜렷해야 한다. 셋째, 병력에서 증상 초기에 가장 두드러진 인지 기능장애의 형태는 기억장애 발현 또는 비기억장애 발현(언어기능장애, 시공간기능장애 혹은 집행기능장애) 중 하나에 해당하여야 한다. 넷째, 다음 5가지를 동반하지 않아야 한다: 1) 뇌혈관 질환, 2) 루이소체 치매의 핵심 증상, 3) 행동 변이전두측두 치매의 핵심 증상, 4) 의미변이원발진행실어증 또는 비유창/비문법변이원발진행실어증의 핵심 증상, 5) 진행 신경 질환, 비신경성 내과 질환, 또는 인지기능에 상당한 영향을 미칠 수 있는 약물 사용의 증거.
하지만 이 환자는 전형적인 알츠하이머병과 비교하였을 때 특이한 증상이 있었고, 이를 요약하면 다음과 같다. 첫째, 초기에 좌우 혼동이 두드러지고, 계산 실수를 보이는 두정엽 증상이 있었고, 이와 거의 비슷한 시기에 기억력 저하가 발생하였다. 둘째, 비교적 빠른 시점(첫 증상 발생 후 1년이 지난 이후)부터 전두엽 기능 저하가 발생하였다. 구체적으로 의처증 및 충동 조절이 잘 되지 않는 증상과 인지기능 검사상에서 심한 전두엽 집행기능장애가 확인되었다. 셋째, 비교적 초기부터 동작의 둔함과 구부정한 자세와 같은 파킨슨증이 두드러지게 되었다.
환자의 질환 발현 양상이 전형적인 알츠하이머병에 비하여 다소 비전형적이고, 증상 발생 당시 나이가 65세 미만인 조기 발현이라는 점을 고려하여 확진을 위해 아밀로이드 PET을 시행하였다. 시행한 아밀로이드 PET에서는 미만성 아밀로이드판(amyloid plaque)의 축적이 관찰되어서 조기 발현 알츠하이머병 치매(early onset Alzheimer’s disease dementia, EOAD)로 확진할 수 있었다(Fig. 2).
아밀로이드 PET를 활용해서 부검 없이 생전에 알츠하이머병 병리 소견인 아밀로이드 축적을 확인할 수 있게 되었고 이를 통해 알츠하이머병을 확진할 수 있게 되었다. 2013년도에 Alzheimer’s Association과 Society of Nuclear Medicine and Molecular Imaging이 주축이 되어 다음과 같이 아밀로이드 PET의 적응증에 대해 제시하였다.2 먼저 대상자는 다음 3가지 조건을 모두 만족해야 한다: 첫째, 주관적 기억력 저하 호소와 함께 객관적 검사를 통해 인지기능의 저하 확인, 둘째, 알츠하이머병으로 진단될 가능성이 있지만 치매 전문가에 의한 평가 이후에도 진단이 불명확한 경우, 셋째, 아밀로이드 축적 유무에 따라 진단의 정확도가 올라가고 치료에 변화가 예상되는 경우. 이후 다음과 같은 3가지 경우 중 1가지에 해당할 경우 정확한 진단을 위해 아밀로이드 PET를 촬영해 볼 수 있다. 첫째, 원인을 잘 모르는 경도인지장애가 지속적으로 있거나 혹은 진행하는 양상인 경우, 둘째, 임상 증상이 비전형적이거나 다양한 원인이 혼재된 양상으로 발현하여 가능 알츠하이머병 치매의 진단 기준을 만족하는 경우, 셋째, 진행하는 치매를 보이면서 비전형적으로 발병 연령(65세 이하)이 빠른 경우이다. 이번 증례의 경우 가능성 있는 알츠하이머병 치매에 합당하였으나 발병 연령이 빠르고, 두정엽 증상, 파킨슨증, 전두엽기능장애로 인한 행동 변화 증상이 발병 후 1년 이내에 같이 동반되어 전형적인 알츠하이머병 치매의 경과와 차이가 있어서 정확한 진단을 위해 아밀로이드 PET를 촬영하였고, 이를 통해 조기 발현 알츠하이머병으로 진단할 수 있었다.
EOAD 진단 후 아세틸콜린에스테라제억제제와 NMDA수용체길항제 치료를 시작하였으며 신경행동 증상(neurobehavior symptom) 조절을 위해 소량의 비전형정신병약을 투약하였다. 투약 이후 화를 내는 증상이나 의처증은 사라졌지만 인지기능은 첫 내원 후 1년간 서서히 나빠졌다. 내원 1년 뒤 추적 관찰한 신경심리 검사에서 K-MMSE는 17점, CDR은 1점, CDR-SOB는 7점, GDS는 5점이였다. SNSB-Ⅱ에서는 기억력, 시공간능력, 전두엽집행기능 항목에서 인지기능 저하가 진행되었다는 소견이 관찰되었다(SNSB-D 점수, 90.6). 내원 1년 6개월이 지난 시점부터 환자의 증상이 빠르게 나빠지지 시작하였다. 당시 내원하였을 때 샤워를 하고 마무리가 잘 되지 않아서 씻고 나오면 거품이 그대로 있고, 뒤집어 놓은 옷을 제대로 입지 못하는 옷입기실행증도 관찰되었다. 3개월 뒤에 다시 내원하였을 때는 집 바로 앞에 나가도 집을 찾아오지 못했다. 내원 2년 뒤 추적 관찰한 신경심리 검사에서 K-MMSE는 15점, CDR은 2점 CDR-SOB는 14점, GDS는 6점, 바텔지수는 16점이었다. SNSB-Ⅱ에서는 실서증이 새롭게 관찰되었으며 모든 인지 영역에서 인지기능이 큰 폭으로 저하된 것으로 확인되었다(SNSB-D 점수, 45.5). 내원 2년 뒤 추적 관찰한 뇌 MRI에서도 전반적인 뇌위축이 진행된 것으로 확인되었다(Fig. 1). 내원 2년 3개월이 지난 시점부터는 소변 실수가 발생하기 시작하였고, 딸 이름도 기억하지 못하였다.
환자는 증상 발생 시점 기준으로 3년이 지난 시점에 진행한 신경심리 검사상 중기 치매 상태로 진행하였으며, 3년 3개월 이후부터는 소변 실수 및 가까운 가족도 알아보지 못하는 증상이 발생하는 등 진행이 빠르고 예후가 좋지 않았다.
EOAD는 65세 이전에 증상이 발현하는 알츠하이머병을 의미하며, 전체 알츠하이머병 치매 중에 10%를 차지한다[3]. 65세 이후에 발생하는 후기 발현 알츠하이머병 치매(late onset Alzheimer’s disease dementia, LOAD)는 비교적 최근에 발생한 일에 대한 삽화 기억력 저하로 증상이 시작되며, 이후에 언어능력, 시공간능력, 주의력 등이 떨어지면서 마지막에 전두엽집행기능 저하 및 이상 행동이 나타나는 진행 양상을 보인다[4]. 하지만 EOAD는 증례의 환자처럼 초기에 두정엽 증상, 언어능력 저하, 혹은 전두엽집행기능 저하와 같이 비전형적인 증상이 나타나는 비율이 22-64%에 달해 진단이 어려운 경우가 많다[5,6]. 실제 LOAD와 EOAD 간의 임상 증상을 비교한 연구에 따르면 EOAD에서 기억력 저하가 아닌 임상 증상이 LOAD보다 5배 더 많이 발생한다고 하며, 흔한 증상으로는 시공간능력 저하, 실행증이 있었고, 언어장애, 전두엽기능 저하가 그 다음을 차지했다[7].
REFERENCES
1. McKhann GM, Knopman DS, Chertkow H, Hyman BT, Jack CR Jr, Kawas CH, et al. The diagnosis of dementia due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement 2011;7:263-269.


2. Johnson KA, Minoshima S, Bohnen NI, Donohoe KJ, Foster NL, Herscovitch P, et al. Appropriate use criteria for amyloid PET: a report of the Amyloid Imaging Task Force, the Society of Nuclear Medicine and Molecular Imaging, and the Alzheimer’s Association. J Nucl Med 2013;54:476-490.


3. Chiaravalloti A, Koch G, Toniolo S, Belli L, Lorenzo FD, Gaudenzi S, et al. Comparison between early-onset and late-onset Alzheimer’s disease patients with amnestic presentation: CSF and (18)F-FDG PET study. Dement Geriatr Cogn Dis Extra 2016;6:108-119.



4. Joubert S, Brambati SM, Ansado J, Barbeau EJ, Felician O, Didic M, et al. The cognitive and neural expression of semantic memory impairment in mild cognitive impairment and early Alzheimer’s disease. Neuropsychologia 2010;48:978-988.


5. Stopford CL, Snowden JS, Thompson JC, Neary D. Variability in cognitive presentation of Alzheimer’s disease. Cortex 2008;44:185-195.


6. Mendez MF, Lee AS, Joshi A, Shapira JS. Nonamnestic presentations of early-onset Alzheimer’s disease. Am J Alzheimers Dis Other Demen 2012;27:413-420.



7. Koedam EL, Lauffer V, van der Vlies AE, van der Flier WM, Scheltens P, Pijnenburg YA. Early-versus late-onset Alzheimer’s disease: more than age alone. J Alzheimers Dis 2010;19:1401-1408.


8. Alberici A, Benussi A, Premi E, Borroni B, Padovani A. Clinical, genetic, and neuroimaging features of early onset Alzheimer disease: the challenges of diagnosis and treatment. Curr Alzheimer Res 2014;11:909-917.


9. Kim EJ, Cho SS, Jeong Y, Park KC, Kang SJ, Kang E, et al. Glucose metabolism in early onset versus late onset Alzheimer’s disease: an SPM analysis of 120 patients. Brain 2005;128:1790-1801.


10. Rabinovici GD, Furst AJ, Alkalay A, Racine CA, O’Neil JP, Janabi M, et al. Increased metabolic vulnerability in early-onset Alzheimer’s disease is not related to amyloid burden. Brain 2010;133:512-528.



Figure 1.
Magnetic Resonance Imaging of the patient at baseline and 2-year follow up. Axial T1 images of the patient at baseline (A) and 2-year follow up (B) represent significant progression of diffuse cortical atrophy, especially in parietal and temporal regions.
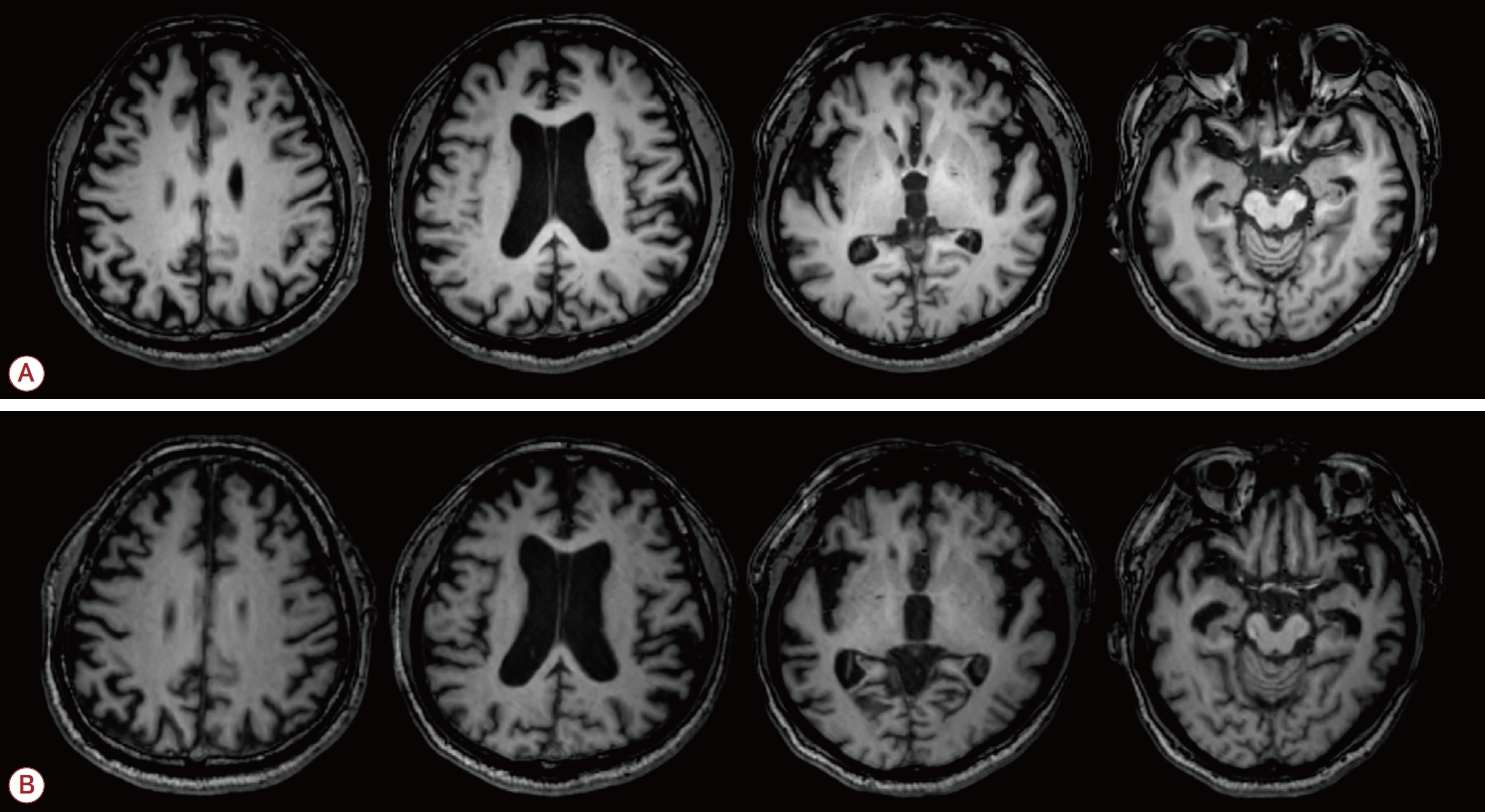
Figure 2.
Amyloid PET image of the patient. Amyloid PET image represents the diffuse cortical amyloid uptake. PET; positron emission tomography.

Table 1.
Results of neuropsychological tests conducted 5 months after symptoms occurred
NL; within normal limit, K-BNT; Korean version of the Boston naming test, AB; abnormal, SVLT; Seoul verbal learning test, RCFT; Rey complex figure test, K-MMSE; Korean version of mini-mental status examination, CDR; clinical dementia rating, CDR-SOB; CDR-sum of boxes, GDS, global deterioration scale.
Table 2.
NIA-AA criteria for all-cause dementia
Table 3.
NIA-AA criteria for probable Alzheimer’s disease dementia
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 296 View
- 25 Download
- Related articles
-
Clinical Reasoning: A 62-year-old Woman Presenting with Ptosis and Diplopia2023 February;41(1)
Clinical Reasoning: A 26-Year-Old Man Presenting with Insomnia2021 November;39(4)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



