| J Korean Neurol Assoc > Volume 42(2); 2024 > Article |
|
Abstract
Sjögren’s syndrome (SS) is an autoimmune disease in which lymphocytes invade salivary and tear glands, leading to dry mouth and dry eyes. It is also associated with extraglandular manifestations. The most frequently reported neurological extraglandular manifestations are sensory polyneuropathies. Movement disorders have been reported in only 2% of primary SS patients. In this case, we present a case of primary SS initially manifesting as generalized chorea, which was initially misdiagnosed as tardive dyskinesia.
쇠그렌증후군은 침샘과 눈물샘에 림프구가 침범하여 구강 및 안구 건조 증상이 발생하는 만성 자가면역질환이다. 일차 쇠그렌증후군에 의한 선외 증상 중 신경계 침범의 경우 주로 말초신경계를 침범하여 다발신경병증을 일으키나 드물게 중추신경계를 침범하기도 한다. 일차 쇠그렌증후군 환자 중 2%에서만 운동장애가 보고되었다[1].
저자들은 약물로 인한 지연이상운동증의 가능성을 두고 치료 중이던 환자에서 일차 쇠그렌증후군을 진단하였고 쇠그렌증후군 치료 후 이상운동증이 호전된 증례를 경험하여 이를 보고하고자 한다.
72세 여자가 5시간 전부터 악화된 이상운동증 및 구음장애로 본원 응급실에 왔다. 이상운동증은 주로 팔다리, 몸, 목에 전신적으로 사지를 불규칙적으로 꼬거나 비트는 움직임이 나타났으며 얼굴을 불수의적으로 찡그리거나 혀를 반복적으로 날름거리는 증상이 관찰되었다. 환자의 무도증은 하지보다 상지에서 두드러졌고 수초 정도는 의식적인 억제가 가능하였으며 수면 중에는 중단되었다. 운동완만이나 근간대경련, 떨림은 관찰되지 않았다.
딸의 보고에 따르면 환자는 11년 전 우울증과 원인 불명의 무도증을 진단받아 타 병원 정신건강의학과 및 신경과에서 리스페리돈(risperidone) 1-2 mg, 알프라졸람(alprazolam) 0.125 mg, 플루옥세틴(fluoxetine) 및 플루복사민(fluvoxamine), 이미프라민(imipramine), 트리아졸람(triazolam), 발프로산(valproate) 500 mg, 토피라메이트(topiramate) 50 mg 투약 후 중단한 이력이 있었다. 본원 내원 시 약 2년 전부터 클로나제팜(clonazepam) 0.25-0.5 mg, 에스시탈로프람(escitalopram) 10 mg을 투약하여 치료받고 있었다고 하였고 올란자핀(olanzapine) 2.5 mg을 약 8년간 복용해 왔다고 하였다. 딸의 보고에 의하면 해당 약제 투여 후 아예 증상이 소실되지는 않았고 무도증의 빈도와 강도가 감소되어 익숙해진 상태로 지냈다고 하였다. 환자의 스트레스가 많거나 컨디션이 좋지 않으면 증상이 심해지는 형태로 호전과 악화를 반복하며 지냈는데, 금일 증상이 악화되어 본원 응급실로 내원하였다고 하였다.
환자는 정확한 진단 시기는 알지 못하나 우안 지류망막정맥 폐색과 양안 결막염을 진단받고 치료받은 병력이 있었으며 고혈압약으로 암로디핀(amlodipine) 5 mg을 복용하고 있었다. 남동생이 폐암을 진단받은 것 외에 가족력상 특이 소견은 없었으며 부모와 형제 및 자녀 중 환자와 유사 증상을 호소하는 사람은 없다고 보고하였다. 신경계진찰에서 경미한 구음장애가 있었고 그 외 동공 빛반사를 포함한 뇌신경 검사 및 운동 및 감각, 심부건반사, 소뇌 검사 모두 정상이었다. 혈액 검사에서 간기능 검사, 신장기능 검사, 갑상선기능 검사 결과 정상이었으며 당화혈색소 및 공복 혈당 역시 정상 범위에 해당하였고 경미한 혈소판감소증(129,000/μL)이 관찰되었다.
급작스러운 운동장애와 구음장애의 급격한 악화를 조사하기 위해 뇌자기공명영상(magnetic resonance imaging, MRI)을 시행하였고 확산강조영상(diffusion-weighted image) 및 겉보기확산계수 지도(apparent diffusion coefficient map), 액체감쇠역전회복영상(fluid attenuated inversion recovery image)에서 우측 측두부로 국소적으로 작은 급성 뇌경색 병변이 관찰되었으나(Fig. 1) 이 병변과 운동장애의 악화 간에는 직접적인 상관관계는 없었다고 판단하였다. 뇌파 결과에서 뇌전증모양방전(epileptiform discharge)은 관찰되지 않았다. 유전이상운동질환 감별을 위해 헌팅턴병(Huntington’s disease), 치아적핵담창구루이체위축증(dentatorubro-pallidoluysian atrophy), 척수소뇌실조증17 (spinocerebellar ataxia 17, SCA17) 유전자 검사를 진행하였고 6번 염색체, 12번 염색체, 4번 염색체 단완의 CAG 반복 수는 정상으로 모두 음성 결과가 확인되었다.
저자들은 입원 전 타원에서의 약제 투약 기록과 환자의 안면부, 혀, 팔, 체간의 불수의적이고 불규칙적인 움직임 증상을 바탕으로 환자의 증상을 지연이상운동증(tardive dyskinesia)으로 생각하였고 클로나제팜 0.5 mg과 에스시탈로프람 10 mg은 유지하면서 올란자핀 2.5 mg을 중단 후 아리피프라졸을 서서히 증량하여 5 mg으로 변경하였다. 약제 조절 이후 환자의 사지 불규칙한 불수의 운동 및 얼굴을 찡그리거나 혀를 움직이는 무도증 및 구음장애의 빈도와 강도는 다소 개선되었으나 완전히 호전되지는 않았다. 입원 중 환자는 안구건조증 및 따끔거리는 통증을 호소하여 안과 협의 진료를 의뢰하여 마른눈증후군(dry eye syndrome)으로 진단받아 인공 눈물을 처방받았다. 또한 혓바닥 갈라짐, 혀가 따가운 증상에 대해 이비인후과 진료 후 구강작열감증후군(burning mouth syndrome)을 진단받고 혀의 불편한 부위에 클로나제팜 가루를 바르고 헹궈서 뱉도록 권고를 받았다.
퇴원 후 2주 뒤 외래로 내원하였을 때 아리피프라졸 5 mg 복용 후 어지럼증을 호소하여 2.5 mg으로 감량하였음에도 오심, 구토 증상 등의 부작용을 자주 호소하였다고 하여 아리피프라졸은 중단하였고 아만타딘(amantadine) 복용을 50 mg으로 시작하여 100 mg 하루 한 번으로 유지하였다. 아리피프라졸의 투약 기간은 총 한 달이었다. 아만타딘 복용 이후에도 환자의 사지 불규칙한 불수의적인 운동 및 얼굴을 찡그리거나 혀를 움직이는 무도증은 퇴원 시와 비슷한 빈도와 강도로 발견되었다.
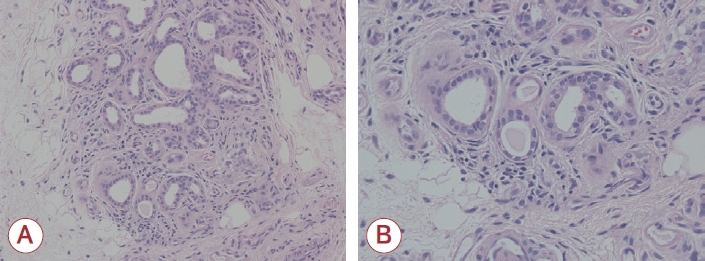
입원 시 환자는 초기 경미한 혈소판감소증이 관찰되었는데(129,000/μL) 외래에서 시행한 추적 검사에서 혈소판감소증(89,000/μL)이 진행되어 혈액종양내과 협진을 의뢰하였고 혈소판감소증의 원인으로 약물, 특발 혈소판감소증 또는 자가면역질환을 감별하기 위해 자가면역항체 검사를 시행하였다. 검사상 형광항핵항체(fluorescent anti-nuclear antibody, FANA) 양성으로 확인되어 류마티스내과 협진을 의뢰하여 이후 시행한 혈액 검사에서 루푸스항응고인자(lupus anticoagulant) 양성(1:20), 항핵항체(FANA titration) ≥1:640 homogeneous, 항베타2-당단백-1항체(anti β2-glycoprotein immunoglobulin M) 양성 및 항-Sjögren’s syndrome A (SSA) 항체 양성 소견이 관찰되었다. 또한 침샘 조직 검사(Fig. 2) 및 시르머 검사(Schirmer test)에서 양성 소견을 보여 쇠그렌증후군으로 최종 진단하였다.
환자는 쇠그렌증후군에 대해 하이드록시클로로퀸(hydroxychloroquine) 200 mg 하루 한 번 복용으로 치료를 시작하였고 하이드록시클로로퀸 200 mg 복용 후 약 3개월 뒤 신경과 외래에 내원하였을 때 환자에게 관찰되었던 무도증은 완전히 호전되는 경과를 보였다. 투약 중이던 클로나제팜은 감량 후 중단하였으나 현재까지 증상 재발은 관찰되지 않았으며 보호자가 원하여 아만타딘 100 mg 및 에스시탈로프람은 유지하고 있다.
본 증례의 경우 환자의 약물 투약력으로 인해 초기에 지연이 상운동증으로 진단하여 쇠그렌증후군 진단이 지연되었던 경우이다.
쇠그렌증후군의 진단 기준은 개정된 2016 American College of Rheumatology-European League against Rheumatism criteria (ACR/EULAR)에 따르면 항-SSA항체 양성이거나 작은 침샘조직 검사(minor salivary gland biopsy, MSGB)에서 림프구성 침샘염(focal lymphocytic sialadenitis)이 확인되어야 하며 적어도 한쪽의 안구 표면 염색 점수(ocular surface staining score)가 5점 이상이거나 반 비슈테르벨트 점수(van Bijsterveld score)가 4점 이상, 시르머 검사 시 적어도 한 쪽에서 5 mm/5 min 이하 그리고 비자극 타액 속도 검사에서 0.1 mL/min 이하를 만족시켜야 한다[2,3]. 본 환자의 경우 항-SSA향체 양성 소견이 확인되었으며 침샘조직 검사에서 침샘조직 위축과 섬유화, 경미한 림프조직구 침윤 소견을 보였다. 또한 시르머 검사상 우안에서 15 mm/5 min, 좌안에서 3 mm/5 min 미만으로 한쪽에서 5 mm/5 min 이하에 해당하여 ACR/EULAR 진단 기준에 따라 쇠그렌증후군으로 진단할 수 있었다.
또한 본 환자의 경우 무도증 및 지속된 혈소판감소증이 관찰되어 추가 검사를 통해 쇠그렌증후군을 진단하게 되었다. 자가면역질환 환자에서 종종 면역혈소판감소증(immune thrombocytopenia, ITP)이 발생한다고 보고되어 있으나 혈소판 파괴의 정확한 기전은 아직 밝혀지지 않았다. ITP의 병인 기전은 혈소판 및 혈소판응고인자에 대한 자가항체 및 T세포 매개 면역반응으로 이루어진다. 한 연구에 따르면 혈장 P-셀렉틴 자가항체 상승이 일차 쇠그렌증후군 환자에서 ITP의 발병 기전에 관여한다고도 알려져 있고 중증 혈소판감소증이 있는 일차 쇠그렌증후군 환자에서 B세포의 Fc감마수용체 IIB (Fc immunoglobulin G receptor IIB, FcγRIIB) 발현이 현저히 감소하였다고 한다[4]. 고용량의 호르몬 치료 후 기억 B세포에서 FcγRIIB의 발현이 상향 조절되고 혈소판 수가 유의하게 증가한다고 보고한 연구는 체액성 면역반응으로 인한 혈소판 파괴를 시사한다. 하지만 혈소판 파괴 역할을 하는 자가항체의 종류 및 ITP가 발생한 일차 쇠그렌증후군 환자에서의 T세포 역할에 대해서는 아직 연구가 진행 중이다[4].
쇠그렌증후군은 안구 및 구강 건조와 같은 증상 외에도 다양한 선외 증상을 유발할 수 있다고 알려져 있으며 일차 쇠그렌증후군의 20% 환자에서는 신경계를 침범하여 중추신경계 및 말초신경계 증상을 보일 수 있다고 알려져 있다[3]. 특히 쇠그렌증후군이 중추신경계를 침범하는 기전에 대해서는 정확하지는 않지만 크게 다음과 같은 두 가지 가설이 제시되고 있다[5]. 첫 번째로는 중추신경계통에서 대뇌동맥혈관염(cerebral arteries vasculitis) 또는 말초신경계통에서 정맥혈관염(vasa-nervorum vaculitis) 등의 혈관염을 통한 간접적인 기전을 들 수 있다. 중추신경계통 혈관염의 경우 MRI에서 두드러지게 대뇌피질하백색질을 포함하여 뇌경색과 같은 허혈성 비정상 소견이 관찰된다. 두 번째로는 MRI상 비정상 소견 없이 항신경세포체항체(anti-neuronal antibodies)를 형성하여 직접적인 기전으로 침범하는 가설이다.
본 증례와 같이 쇠그렌증후군이 이상운동증으로 발현되는 경우는 매우 드물다. 일차 쇠그렌증후군이 중추신경계를 침범하는 증례 보고는 흔하지 않으며 주로 국소 부위를 침범하여 척수 병증, 시신경 병증, 편마비 또는 소뇌실조 등의 증상을 일으키는 것으로 보고되고 있고 드물게 미만성 침범으로 경련, 뇌염 등을 일으키는 것으로 보고된 바 있다[6,7]. 저자들이 경험한 사례와 유사하게 해외에서도 이상운동증을 보이거나 얼굴과 목에 국한된 국소 근긴장이상증(dystonia)을 주소로 쇠그렌증후군이 나타난 경우가 있으며 모든 경우 스테로이드를 포함한 면역 억제 치료를 통하여 이상운동증이 호전되었음을 보고한 바 있다[8-10].
본 증례는 다음과 같은 제한점이 있다. 첫째, 약 10년 전부터 원인 미상의 무도증으로 타 병원에서 약제 복용 중이었다는 의무 기록은 있으나 당시 환자의 증상에 대해서는 보호자의 진술을 통해서만 확인할 수 있어 환자의 증상이 이번에 발견된 이상운동증과 얼마나 차이가 있는지, 타 병원에서 약제 변경 후 증상이 얼마나 좋아졌다가 다시 악화되었는지 정확한 확인이 어려웠다. 뿐만 아니라 당시 타 병원 기록에는 안구건조증이나 구강 작열감에 대한 기록은 없어 10년 전 진단받은 환자의 무도증이 쇠그렌증후군과 연관이 있었는지는 확인이 어려운 점이 있었다. 둘째, 환자는 본원에 내원하기 전에도 간헐적으로 양안에 따끔거리는 통증과 건조함, 구강 작열감을 호소하였으나 해당 증상이 정확히 언제부터 발생하였는지 확인이 어려웠으며 타 병원 안과에서 결막염 및 지류망막정맥폐색을 진단받은 기록이 있으나 시르머 검사 등은 시행되지 않아서 환자의 쇠그렌증후군이 정확하게 언제부터 시작되었는지 확인이 어려웠다. 셋째, 환자의 무도증이 쇠그렌증후군 진단 이후 이에 대한 치료 약제인 하이드록시클로로퀸(hydroxychloroquine)을 시작하면서 확연히 호전되었지만 환자의 증상 호전이 지연이상운동증을 의심하여 향정신병약물 변경 후 단순히 시간이 더 지나면서 호전되었을 가능성도 완전히 배제할 수는 없다.
그럼에도 불구하고 본 증례는 고령 환자에서 나타나는 이상 운동증의 원인으로 쇠그렌증후군과 같은 자가면역질환을 고려해야 함을 시사한다는 점에서 의의가 있다. 쇠그렌증후군의 경우 다양한 말초신경계와 중추신경계를 침범하는 증례들이 보고되고 있으므로 이상운동 등 신경계 증상을 보이는 환자에서 자가면역질환을 찾기 위한 검사들을 초기에 함께 진행하여 신속하고 정확한 진단 및 치료를 통해 환자들의 삶의 질 개선에 기여할 수 있을 것으로 보인다. 저자들은 국내에서 처음으로 이상운동증으로 시작된 일차 쇠그렌증후군을 경험하였기에 이를 보고하는 바이다.
REFERENCES
1. Alvarado-Franco NL, Gonzalez-Marques C, Olguín-Ramírez LA, Garza-Alpirez A, Femat-Roldan G, Martinez-Ramirez D. Athetoid movements as initial manifestation of primary Sjögren syndrome. Tremor Other Hyperkinet Mov (N Y) 2018;8:573.



2. Lee KA, Kim HR, Lee SH. New classification criteria for primary Sjögren’s syndrome and salivary gland ultrasonography. Korean J Med 2017;92:499-505.

3. Berkowitz AL, Samuels MA. The neurology of Sjogren’s syndrome and the rheumatology of peripheral neuropathy and myelitis. Pract Neurol 2014;14:14-22.


4. Dai F, Yang G, Rao P, Wu P, Chen R, Sun Y, et al. Clinical characteristics of secondary immune thrombocytopenia associated with primary Sjogren’s syndrome. Front Med (Lausanne) 2020;7:138.


5. Fanchke PV, Sinning M, Miranda M. Primary Sjögren’s syndrome presenting as a generalized Chorea. Parkinsonism Relat Disord 2005;11:193-194.


6. Kim HA, Ma EJ, Lee J, Ha CK. The primary Sjogren’s syndrome involving central and peripheral nervous system. J Korean Neurol Assoc 2007;25:108-111.
7. Lin WY, Huang CC, Chang HS, Kuo HC, Wu YR. Various movement disorders in a patient with Sjögren syndrome. Mov Disord 2009;24:786-788.


8. Menezes R, Pantelyat A, Izbudak I, Birnbaum J. Movement and other neurodegenerative syndromes in patients with systemic rheumatic diseases: a case series of 8 patients and review of the literature. Medicine (Baltimore) 2015;94:e0971.
Figure 1.
Brain magnetic resonance imaging (MRI). (A) DWI (left), ADC (middle), and FLAIR (right) brain MRI show focal high signal intensity in the right temporal region in DWI, which is suggestive of acute ischemic changes (indicated by the red arrow). (B) T1-weighted (left), contrast-enhanced T1-weighted (middle) and contrast-enhanced FLAIR (right) brain MRI reveal no abnormal parenchymal enhancement. DWI; diffusion-weighted image, ADC; apparent diffusion coefficient map, FLAIR; fluid attenuated inversion recovery.
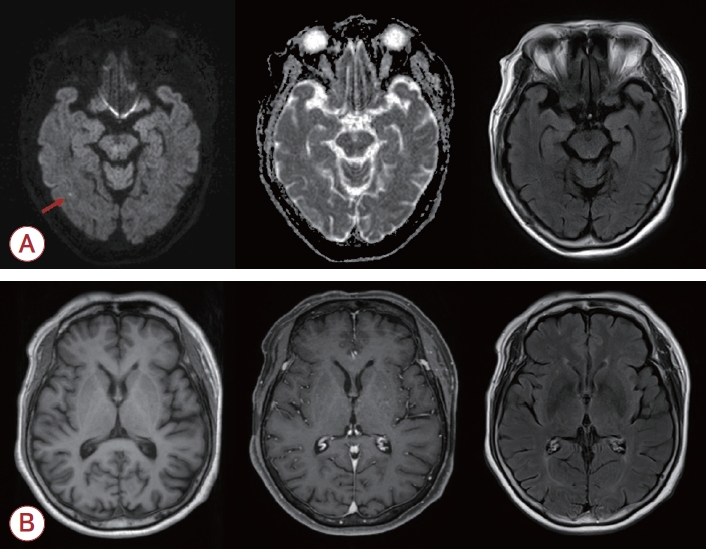
Figure 2.
Tissue from lower lip, minor salivary gland, right, biopsy. (A) Minor salivary gland tissue showing moderate atrophy with fibrosis, and mild lymphohistiocytic infiltration (H&E stain, ×200). (B) Minor salivary gland tissue showing moderate atrophy with fibrosis, and mild lymphohistiocytic infiltration (H&E stain, ×400), consistent with Sjögren’s syndrome (focus score is 1 focus/4 mm2). H&E; hematoxylin and eosin.
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 228 View
- 23 Download
- Related articles
-
A 52-Year-Old Female Presenting with Dysphagia2021 August;39(3)
Osmotic Demyelination Syndrome Presenting with Emotional Incontinence2019 August;37(3)
Corticobasal Syndrome Initially Presenting with Apraxia of Speech2016 November;34(4)
Neuro-Behcet Syndrome Presented with Diplopia 2015 November;33(4)
Postural Tachycardia Syndrome Presented With Acrocyanosis2014 ;32(1)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



