| J Korean Neurol Assoc > Volume 41(1); 2023 > Article |
|
This article has been corrected. See "Neurological Manifestations of MTHFR-related Hyperhomocysteinemia" in Volume 41 on page 167.
Abstract
Methylene-tetrahydrofolate reductase (MTHFR) is a homocysteine metabolism-related enzyme and defects of MTHFR is a risk factor for hyperhomocysteinemia and related various neurological disease. Among them, 665C>T polymorphism is the most common form. We report a 48 years old man presenting with progressive psychiatric problems along with severe demyelinating polyneuropathy due to homozygous c.665C>T homozygote polymorphism superimposed by compound heterozygous mutation (c.1417C>T, p.Arg473Trp) in the MTHFR gene, without thromboembolic changes.
메틸렌테트라하이드 로폴산염환원효소(methylenetetrahydrofolate reductase, MTHFR)는 엽산(folic acid)과 메싸이오닌(methionine) 대사에 필수적인 효소로서 MTHFR 유전자가 중요하게 관여된다. 이 유전자에 돌연변이가 발생하면 고호모시스테인혈증(hyperhomocysteinemia) 및 엽산대사장애가 생긴다[1]. MTHFR 변이로 고호모시스테인혈증이 발생하고 그 결과로 혈관 및 신경계 독성, 메틸화장애가 생겨 후성(epigenetic) 변성, 엽산대사물 부족으로 인한 신경전달물질 변화 등의 기전을 통해 다양한 기관의 기능장애를 유발하며 이 중 c.655C>T 동형접합변이가 가장 흔한 것으로 알려져 있다[2,3]. 이 변이는 MTHFR의 기능을 정상인의 50-60% 정도로 감소시키는 것으로 알려져 있으며, 10-20%는 변이가 있음에도 불구하고 뚜렷한 신경계증상이 보이지 않는 것으로 알려져 있다[2,4]. MTHFR 유전자에서 이형접합변이 발생 시, 효소기능 저하와 함께 심한 고호모시스테인혈증, 다발신경계질환 및 혈전 발생을 동반한 다양한 신경계증상에 대한 보고가 있다[5]. 저자들은 20대부터 발생한 인지기능장애와 함께 발생한 다양한 신경계이상을 보인 환자에서 MTHFR 유전자의 복합이형접합변이에 의한 고호모시스테인혈증을 진단하였고, 이후 비타민 보충 치료를 통해 호전을 보인 48세 남자를 보고한다.
48세 남자가 6개월간 진행하는 하지의 원위부 쇠약을 동반한 보행장애로 신경과 외래를 방문했다. 환자는 초등학교 때까지는 정상 발달과정을 보였으나, 이후 서서히 진행하는 인지기능 저하, 기분장애 및 비특이 정신과질환으로 성인이 된 이후에는 정신과 병원이나 시설에서 지내왔으나, 시설에서도 6개월 이전까지는 사지쇠약 없이 보행은 가능했다고 한다. 이후 타 병원에서 파킨슨병 배제를 위해 도파민수송체양성자방출단층촬영(18F-fluorinated N-3-fluoropropyl-2-betacarboxymethoxy-3-beta-[4-iodophenyl] nortropane positron emission tomography) 등의 검사를 하였으며 이상은 발견되지 않았다. 신체진찰에서 양측 하지 및 원위부에 더 심한 대칭적 근쇠약(양측 상지 근위부 Medical Research Council [MRC] 5, 양측 상지 원위부 MRC 4, 양측 하지 근위부 MRC 4, 양측 하지 원위부 MRC 2)을 관찰할 수 있었고, 양쪽 무릎 아래에서 고유감각, 진동감각 저하가 있었으며, 깊은힘줄반사가 나타나지 않았다. 시진에서 특별한 신체 변형은 보이지 않았다. 침근전도검사에서 광범위한 상하지의 탈수초감각운동신경병이 확인되었다. 간이정신상태검사는 15점이었고, 서울신경심리기능검사는 전반적인 영역에서 인지기능 저하를 보였으며, 뇌파검사는 정상이었다. 뇌 자기공명영상에서는 내측두엽에 더 심한 전반적인 뇌위축이 확인되었으나, 백질변성 및 동맥경화 등은 관찰되지 않았다(Fig. 1) 당화혈색소를 비롯한 일반 혈액검사와 갑상샘기능검사, 항강글리오사이드항체검사 및 혈청 면역전기영동검사에서는 이상이 없었고, 뇌척수액검사에서도 백혈구 및 단백질 증가 등의 이상은 없었다. 탈수초말초신경병 소견을 보여 가장 흔한 유전원인에 대한 감별을 위해 우선 시행한 peripheral myelin protein 22(PMP22) 유전자검사에서는 중복이나 결손은 관찰되지 않았다. 하지만 말초혈액펴바른표본에서 거대적혈모구가 관찰되었다. 혈액검사에서 비타민B12는 324 pg/mL (정상 범위 187-883 pg/mL), 메틸말론산(methylmalonic acid)은 0.22 μM/L (정상 범위 <0.56 μM/L)로 정상 범위였으나, 호모시스테인(homocysteine)이 87 μmol/L (정상 범위 <15 μmol/L)로 증가해 있었고, 엽산은 2.2 pg/mL 이하로 감소되어 있었다. 비타민 흡수장애를 배제하기 위해 시행한 위 및 대장내시경상에서 흡수장애를 일으킬 만한 이상은 관찰되지 않았다. 심한 호모시스테인 대사장애와 연관한 만성 인지기능 저하 및 늦게 발병한 탈수초말초신경병이 동반된 것으로 생각되어 시행한 혈액 아미노산 프로필에서 메싸이오닌의 유의한 감소(9.2 nmol/mL, 정상 범위 10-42 nmol/mL)와 함께 정상 범위 이내의 시스틴(cystine) 수치(10.2 nmol/mL, 정상 범위 5-82 nmol/mL)가 확인되었고, 심한 고호모시스테인혈증을 시사하는 호모시스틴(homocystine, 24.6 nmol/mL, 정상 범위 0 nmol/mL)의 증가가 관찰되었다[6,7]. 심한 고호모시스테인혈증 및 메싸이오닌 감소를 일으킬 수 있는 선천대사질환 감별이 필요하여 선천 대사이상 유전자 패널검사를 시행하였고, MTHFR 유전자에서 c.677C>T 동형접합다형성 및 아미노산 변화를 동반하는 c.1417C>T (p.Arg473Trp) 복합이형접합변이가 추가로 확인되었다. 위의 검사들을 바탕으로 MTHFR 복합이형접합변이(c.665C>T homozygote + c.1417C>T heterozygote)에 의한 고호모시스테인혈증으로 진단하였고, 치료를 위해 비타민B6 (100 mg/day), B12 (1 mg/day), 엽산 (25 mg/day)을 처방하였고, 이후 인지기능과 양측 발목쇠약이 MRC 3 정도로 호전을 보이며 외래에서 경과관찰 중이다.
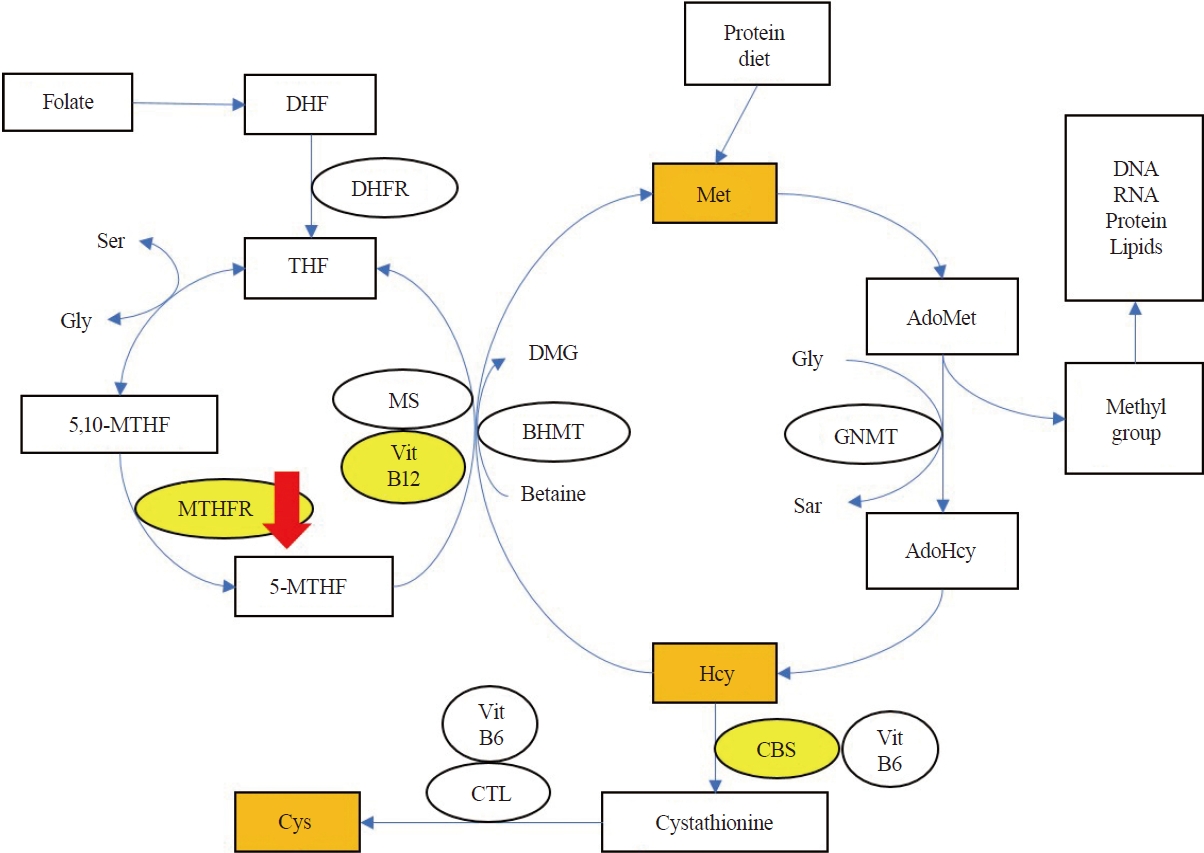
호모시스테인은 음식물로부터 대사되는 필수아미노산인 메싸이오닌의 중간 대사물이며, 다음과 같은 두 가지의 경로를 통해 대사된다. 첫 번째는 비타민B6의 동반과 함께 cystathione beta synthase (CBS)를 통해 시스틴을 형성하는 황전환작용(trans-sulfuration)이고, 두 번째는 비타민 B12 의존 메싸이오닌합성효소(methionine synthase, MS)를 통해 5-methyl tetrahydrofolate (THF)로부터 메틸기를 받아서 메싸이오닌을 형성하는 재메틸화(remethylation) 과정이다(Fig. 2) [7]. 이 과정에서 MTHFR은 5,10-methyl THF(5,10-MTHF)를 5-MTHF로 전환하는 데 필수적이며, 호모시스테인의 재메틸화 속도를 조절하는 효소로 작용한다. 혈중 호모시스테인 농도가 60 μmol/L 이상으로 중등도 이상의 고호모시스테인혈증이 관찰될 경우, MS, MTHFR이나 CBS 결핍을 의심해야 하며, 메티오닌 농도의 증가나 감소 확인을 통해 황전환작용이나 재메틸화 과정의 문제를 감별할 수 있다.7 고호모시스테인혈증을 보인 본 증례의 아미노산 프로필검사에서 시스틴의 증가 없이 메싸이오닌 감소가 보인 점에서 재메틸화 과정에 대사장애가 있음을 알 수 있었고, 이는 MTHFR 기능장애와 연관할 수 있다.
MTHFR 유전자 변이가 다양한 기관에 작용하여 신경계 문제를 일으키는 기전은 아직 정확히 알려져 있지 않으나, 호모시스테인 축적에 의한 혈관, 신경계독성에 의한 것으로 설명되고 있다[1]. 또한 엽산 대사와 연관된 신경전달물질 교란, 퓨린 및 피리미딘 합성 변화, 메싸이오닌 합성 저하와 연관된 메틸화장애로 인한 후성유전 변화 등의 가설로 설명하기도 한다[3]. 환자의 전반적 뇌위축과 만성정신 문제는 호모시스테인 대사 장애가 영향을 줬을 것으로 생각된다. 탈수초말초신경병과 MTHFR 변이의 경우, 비타민B12 감소 및 고호모시스테인혈증이 말초신경병이나 아급성연합변성 같은 탈수초척수질환에서도 고위험인자라는 보고가 있었다[8]. 수초 형성과 세포 분열에 호모시스테인의 메틸화 과정이 필요한데, MTHFR 기능 저하가 호모시스테인의 재메틸화 과정에서 메틸기 공여자로 작용하는 5-MTHF의 결핍으로 이어지면서, 이것이 중추신경계 탈수초질환인 아급성연합변성을 일으킨다고 제시하였다(Fig. 2).8 본 증례에서는 엽산 결핍 또한 수초 형성에 영향을 끼쳤을 것으로 생각되며, 이러한 원인들로 인해 탈수초말초신경병이 발생한 것으로 유추할 수 있다. 하지만 호모시스테인 대사와 말초신경의 탈수초와의 연관성에 대한 추가 연구가 필요할 것으로 생각된다.
MTHFR 유전자변이 중에서는 유전자의 c.665C>T 변이가 가장 흔히 알려져 있으며, 이 유전변이는 MTHFR의 기능 저하를 일으키는 것으로 알려져 있다. 또한 이형접합보다 동형접합다형성에서 더 심한 기능 저하 및 고호모시스테인혈증을 보인다[2,3]. 이 변이로 인해 발생하는 신경계이상은 다양하며 치매, 뇌혈관질환, 말초신경병, 아급성연합변성, 정맥혈전증 및 다양한 정신질환을 유발하는 위험인자로 작용한다. 하지만 c.665C>T 동형접합변이는 전체 인구의 10-20% 정도에서까지 발견되며, 표현형이 다양하다. 이러한 원인에 대해서는 아직 연구가 더 되어야 하나, 효소기능 저하와 함께 추가적인 환경 혹은 유전적 요인이 질환 발생에 영향을 주는 것으로 설명되고 있다[4,5].
흥미롭게도 Rommer 등5은 두 위치 이상에서 발생한 MTHFR 변이에 의해 심한 고호모시스테인혈증이 발생한 경우, 동일 돌연변이를 가진 가족 내에서도 표현형이 심한 가족들은 혈전증 및 심한 신경계이상을 보였다고 보고하였다. 이러한 가족 내 표현형의 차이는 추가적으로 c.665C>T, c.1632+2T>G, c.202C>G의 복합이형접합변이를 가지는 환자에서 정맥혈전증, 다발신경병, 대뇌백질병변 및 정신 증상을 더 많이 보였으며, 변이 유전자가 중첩된 자손 세대에서 더 심한 증상을 보였다. 또한, 이를 뒷받침할 수 있게 MTHFR 기능도 정상의 4% 정도로 매우 감소되어 있었음을 확인하였다. 유사하게도 두 위치 이상의 MTHFR 변이가 복합이형성으로 관찰된 이전 증례들에서도 발현의 다양성을 보이는 중추신경계 및 말초신경계 모두를 포함한 증상이 있었고, 심한 고호모시스테인혈증을 보였다[5,9]. 본 증례에서도 c.1271C>T 이형접합 변이가 c.665C>T 동형접합변이와 동반되면서 MTHFR의 심한 기능 저하로 이어졌고, 이로 인해 엽산 대사와 관련된 신경전달물질 교란, 메틸화장애 등의 기전으로 인해 만성인지기능 저하 및 탈수초말초신경병을 동반하는 광범위한 신경계증상을 보인 것으로 여겨진다. 혈관병이 본 증례에서 저명하게 확인되지 않은 점은 이전 보고에서처럼, 동일한 변이가 확인된 가족 증례에서도 증상 발현의 다양성을 보이는 것과 연관성이 있을 것으로 생각된다[5,9]. 또한 환자가 아직 40대로 비교적 젊은 연령인 점에서 혈관병이 아직 드러날 정도로 진행하지 않았을 가능성도 있다. 가족검사나 MTHFR 기능 저하를 직접 확인하지 못한 것이 한계점으로 생각되며, 표현형의 다양성을 일으킬 수 있는 후천적 요인에 대한 연구가 추가적으로 필요하겠다.
고호모시스테인혈증에 의한 신경계증상은 비타민B6, B12와 엽산을 포함한 복합비타민을 보충해줌으로도 증상의 호전을 보일 수 있다[10]. 특히 효소대사장애에 의한 고호모시스테인 혈증은 중증도가 심하게 나타나고, 만성정신질환으로 오인되기 쉬우며, 가역적인 신경정신계 및 재발혈전질환의 적절한 치료 시기를 놓칠 수 있다[9]. 중등도 이상의 고호모시스테인혈증에서는 비타민B12 수치 외에도 메틸말론산, 메싸이오닌, 시스틴 등의 아미노산 수치와 MTHFR 유전자검사가 도움이 될 수 있으며, 필요시 호모시스테인 대사 관련 차세대염기서열분석을 고려할 수 있다.
본 증례에서 MTHFR 유전자의 두 위치 이상의 변이로 인해 중등도 이상의 고호모시스테혈증 및 말초신경병, 인지기능 저하를 포함한 다양한 신경계증상을 일으킬 수 있음을 확인하였다. 특히 MTHFR c.665C>T 다형성의 경우 일반 인구에서도 빈도가 높으며, 또한 증상이 매우 심한 고호모시스테인혈증의 경우 c.665C>T 다형성 이외에 추가적인 변이에 대한 가능성도 고려가 필요할 것으로 생각된다. 그리고 진단될 경우 비타민 보충을 통해 진행을 멈추게 하는 등의 어느 정도는 치료 가능한 신경계질환이기 때문에 임상의들은 고호모시스테인혈증 및 연관 대사질환에 대해 적극적으로 인식을 제고할 필요가 있을 것으로 생각된다.
REFERENCES
1. Kim J, Kim H, Roh H, Kwon Y. Causes of hyperhomocysteinemia and its pathological significance. Arch Pharm Res 2018;41:372-383.


2. Liew SC, Gupta ED. Methylenetetrahydrofolate reductase (MTHFR) C677T polymorphism: epidemiology, metabolism and the associated diseases. Eur J Med Genet 2015;58:1-10.


3. Wan L, Li Y, Zhang Z, Sun Z, He Y, Li R. Methylenetetrahydrofolate reductase and psychiatric diseases. Transl Psychiatry 2018;8:242.



4. Jin H, Cheng H, Chen W, Sheng X, Levy MA, Brown MJ, et al. An evidence-based approach to globally assess the covariatedependent effect of the MTHFR single nucleotide polymorphism rs1801133 on blood homocysteine: a systematic review and metaanalysis. Am J Clin Nutr 2018;107:817-825.


5. Rommer PS, Zschocke J, Fowler B, Födinger M, Konstantopoulou V, Möslinger D, et al. Manifestations of neurological symptoms and thromboembolism in adults with MTHFR-deficiency. J Neurol Sci 2017;383:123-127.


7. Al Mutairi F. Hyperhomocysteinemia: clinical insights. J Cent Nerv Syst Dis 2020;12:1179573520962230.


8. Zhang X, Hou C, Liu P, Chen L, Liu Y, Tang P, et al. Methylenetetrahydrofolate reductase (MTHFR) C677T polymorphism and subacute combined degeneration: revealing a genetic predisposition. Front Neurol 2019;9:1162.



Figure 1.
Brain MRI of the patient. (A) MRI illustrates the atrophy of medial temporal lobe and cerebellum. (B) No vascular stenosis was found in the intracranial and carotid MR angiography. MRI; magnetic resonance imaging, MR; magnetic resonance.
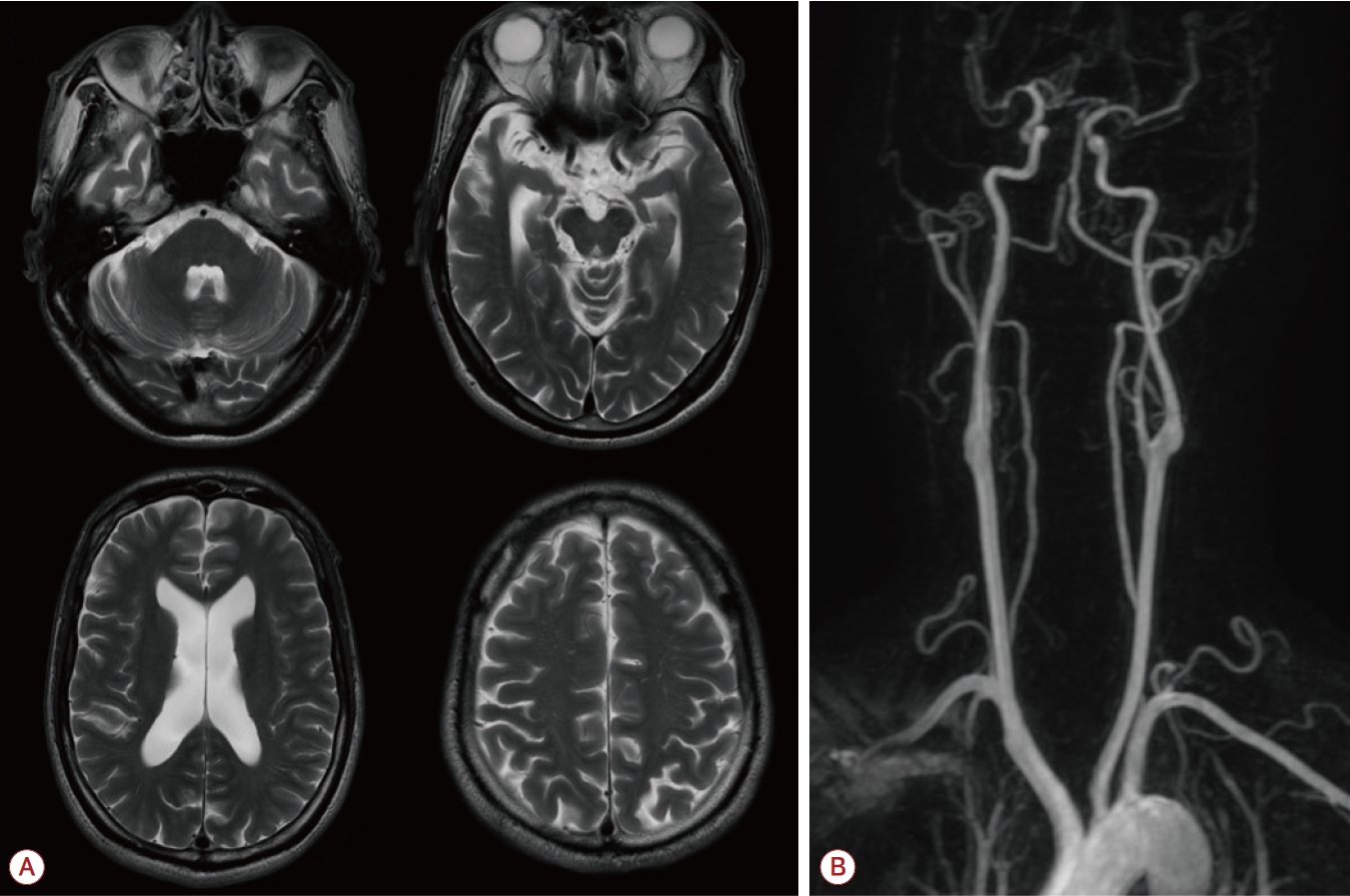
Figure 2.
Metabolism of homocysteine. Metabolites and enzymes related to this case are highlighted in orange square and yellow circle. Compound heterozygote mutation of MTHFR gene and MTHFR enzyme deficiency (red arrow) causes homocysteine metabolism disorder, leading to various neurologic manifestations of this patient [7]. MTHFR; methylenetetrahydrofolate reductase, AdoHCys; S-adenosyl homocysteine, AdoMet; adenosyl methionine, BHMT; betaine-homocysteine methyltransferase, CBS; cystathionine beta-synthase, CTL; cystathionine gama lyase, DHFR; dihydrofolate reductase, DMG; dimethylglycine, Gly; glycine, GNMT; glycine N-methyltransferase, Hcy; homocysteine, MTHF; methyltetrahydrofolate, MS; methionine synthase, DHF; dihydrofolate, Ser; serine, THF; tetrahydrofolate, VitB12; vitamin B12, VitB6; vitamin B6, Met; methionine, Cys; cysteine, Sar; sarcosine, DNA; dioxyribonucleic acid, RNA; ribonucleic acid.
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 232 View
- 5 Download
- Related articles
-
Clinical Manifestations of Freezing of Gait2023 November;41(4)
Neurological Manifestations of MTHFR-related Hyperhomocysteinemia2023 May;41(2)
Neurological Symptoms of Intracranial Hypotension2019 May;37(2)
Aphasic Seizure as a Manifestation of Non-Ketotic Hyperglycemia2012 ;30(4)
Rheumatoid Meningitis: Neurologic Manifestation and Pathologic Findings2012 ;30(4)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



