| J Korean Neurol Assoc > Volume 41(1); 2023 > Article |
|
Abstract
Acute hyperammonemic encephalopathy is generally associated with severe liver disease, manifesting with neuropsychiatric symptoms including confusion, lethargy, seizure, coma, and even death. Electroencephalogram (EEG) is a proven diagnostic, prognostic, and therapeutic tool in patients with acute and chronic encephalopathies. EEG changes in acute hyperammonemic encephalopathy are associated with background slowing in theta to delta ranges, accompanied by presence of triphasic waves. We reported a patient with acute hyperammonemic encephalopathy showing an unusual burst-suppression pattern, which was reversible with proper treatment.
급성 고암모니아뇌병증(acute hyperammonemic encephalopathy)은 간질환, 요소회로이상증, 항경련제 등의 약물에 인해 발생하며, 혼돈, 혼수 상태의 의식 변화, 경련 발생 및 사망까지 이를 수 있다[1]. 급성 고암모니아뇌병증의 특징적인 뇌파 소견은 세타 및 델파 범위의 광범위 서파, 삼상파(triphasic wave)이며 돌발파억제양상(burst-suppression pattern)은 드물다[2]. 저자들은 돌발파억제양상을 보인 급성 고암모니아뇌병증에서 고암모니아 치료 후 돌발파억제양상의 회복을 보인 증례를 경험하여 이를 보고하고자 한다.
71세 남자 환자가 내원 3일 전부터 복통, 복부팽만 및 배꼽탈장을 통한 복수 누출로 내원하였다. 2020년 복수, 정맥류출혈이 발생하여 알코올간경화증으로 진단받은 후 복수 및 배꼽탈장이 반복되어 복수천자를 시행한 과거력이 있고, 고혈압, 당뇨에 대해 약물을 복용하고 있었다. 내원 당시 활력징후는 혈압 131/82 mmHg, 심박수 90/min, 호흡수 20/min, 체온 36.3℃였다. 신경계진찰에서 의식은 명료하였고 언어 및 감각, 운동기능 등은 모두 정상이었다. 신체진찰에서 복부팽만 및 장음이 감소되어 있었고, 복부압통이나 반발통은 없었으나 이동성 둔탁음이 있었다. 혈액검사에서 백혈구 6,100/μL, 혈색소 9.7 g/dL, 혈소판 132,000/μL, 프로트롬빈시간 65%, 국제표준화비율 1.34, 알부민 3.0 g/dL, 아스파트산아미노기전달효소/알라닌아미노기전달효소 71/50 IU/L, 암모니아 25 μg/dL였고, B형간염바이러스표면항원및 C형간염바이러스항체는 검출되지 않았다. 복수천자검사에서 백혈구 80/μL로 감염은 없었고 그람염색 및 세균배양검사에서 모두 음성이었다. 배꼽탈장을 통한 복수 누출이 지속되어 내원 당일 배꼽탈장교정술을 시행 후 복통, 복부팽만, 복수 누출은 모두 호전되었다. 수술 다음 날 활력징후는 혈압 116/73 mmHg, 심박수 84/min, 호흡수 20/min, 체온 36.5℃였다. 수술 9일째 구역, 두통을 호소하였고 서서히 호흡곤란 및 의식 저하가 발생하여 기관 내 삽관 및 기계호흡을 적용하였다. 활력징후는 혈압 66/52 mmHg, 심박수 105/min, 호흡수 22/min, 체온 38.4℃였고 백혈구 17,580/μL, 혈색소 10.7 g/dL, 혈소판 260,000/μL, 프로칼시토닌 0.8 ng/mL로 세균감염에 의한 패혈증으로 진단하 수액 요법 및 승압제와 항생제를 사용하였다. 혈중 암모니아 농도는 >500 μg/dL로 측정 상한을 넘는 수치를 보여 고암모니아뇌병증이 동반되었을 가능성이 있다고 판단하여 락툴로스 관장 및 단백질 섭취를 제한하였다. 다음 날 활력징후가 안정화되고 암모니아 농도는 146 μg/dL로 비교적 낮아졌지만 의식수준은 혼수상태가 지속되었다. 뇌 자기공명영상(magnetic resonance imaging, MRI)상 양측 전두엽, 두정엽, 측두엽의 대뇌피질 및 뇌섬엽(insular cortex), 기저핵(basal ganglia), 시상(thalamus)에서 확산강조영상(diffusion-weighted image, DWI), 액체감쇠역전회복영상(fluid attenuated inversion recovery)의 고강도신호 및 겉보기확산계수(apparent diffusion coefficient)의 감소가 관찰되었다(Fig. 1-A). 뇌파검사상 돌발파억제양상이 관찰되었고(Fig. 1-B) 규칙적인 양측 눈 깜빡임이 동반되어 레비티라세탐(levetiracetam) 2,000 mg을 투여하였으나 돌발파억제양상과 규칙적인 양측 눈 깜빡임의 호전은 없었다. 락툴로스 관장 치료 후 혈중 암모니아 농도는 62 μg/dL로 정상 수치로 회복되었고, 의식수준도 기면(drowsy) 상태로 호전되었으며 간단한 의사소통은 가능하였다. 증상 발생 10일 후 MRI에서 양측 전두엽, 두정엽, 측두엽의 대뇌 피질 및 뇌섬엽에서 관찰되던 고강도신호는 지속되었으나, 기저핵, 시상에서 관찰되 던 고강도신호는 DWI에서 호전 추세를 보였다(Fig. 2-A). 추적 검사한 뇌파검사에서 양측 전두엽의 세타 범위의 서파가 지속되며 배경파 진폭의 감소가 보였고 돌발파억제양상은 더 이상 관찰되지 않았다(Fig. 2-B). 그러나 증상 발생 14일 후 혈압 63/45 mmHg, 심박수 105/min, 호흡수 16/min, 체온 38.0℃로 패혈증이 재발하며 사망하였다.
급성 고암모니아뇌병증은 급성 또는 만성 간질환의 합병증으로 나타나거나, 드물게 유전질환, 요소회로이상증, 약물, 감염, 장관 내 출혈의 비간경화(noncirrhotic condition)의 증상으로 나타날 수 있다[1]. 급성 고암모니아뇌병증은 다양한 신경계증상을 보이며 뇌부종과 두개내고혈압으로 인해 사망까지 초래할 수 있다. 고암모니아에 의한 신경 독성의 정확한 병인 기전은 아직 잘 알려져 있지 않으나 고암모니아혈증(hyperammonemia)에 의한 신경전달물질(neurotransmitter)의 변화로 야기된다고 추정된다. 간기능 저하 시 요소 합성의 감소로 암모니아 대사가 충분히 일어나지 못하여 고암모니아혈증이 발생하면, 이온화되지 않은 암모니아(NH3)와 이온화된 암모니아(NH4+)는 각각 확산(diffusion) 및 활성운반체(active transport)에 의해 혈액뇌장벽(blood-brain barrier)을 통과하여 대뇌 암모니아 수치가 상승한다. 대뇌 암모니아 수치의 상승은 글루타민합성효소(glutamine synthetase)의 활성을 증가시켜 별아교세포(astrocyte)에서 글루타민을 축적시키는데, 글루타민이 삼투용질(osmolyte)로 작용하여 별아교세포 내 수분 유입(water influx)으로 뇌부종 및 두개내고혈압을 유발한다. 또한, 대뇌암모니아 수치의 상승은 글루타메이트(glutamate)의 세포 내재흡수를 억제하여 과도한 N-methyl-D-aspartate 수용체의 활성으로 경련 역치를 낮추어 경련을 일으킨다[3]. 그 외 감마아미노부티르산(gamma aminobutyric acid, GABA), 도파민(dopamine), 세로토닌(serotonin)의 신경전달물질의 변화 및 산화스트레스, 뇌혈류 증가, 염증성 사이토카인 분비 등에 의해서도 신경 독성이 일어날 수 있다[4].
뇌파검사는 뇌병증(encephalopathy) 환자의 예후 평가 및 치료 반응을 모니터링하기 위해 사용된다. 급성 고암모니아뇌병증에서 뇌파는 초기에 후두부우세리듬(posterior dominant rhythm)이 느려지고 뇌증의 중증도가 심해질수록 배경파(background rhythm)가 세타파 및 델타파의 전반적인 서파로 나타나며 전두엽간헐리듬델타활동(frontal intermittent rhythmic delta activity)도 관찰될 수 있다. 특히 양측 전두엽 우세 삼상파와 전반적 고진폭 델타파가 나타나는 것이 전형적인 특징이다[2].
급성 고암모니아뇌병증에서 뇌 MRI는 좌우 뇌섬엽(insula), 띠다발이랑(cingulate gyrus)의 고신호강도가 나타나며, 주로 세포독성부종(cytotoxic edema)을 보인다. 양측 전두엽, 측두엽, 두정엽의 피질에서도 대칭적인 고신호강도가 보이나 후두엽 및 롤란드피질 주변부(peri-rolandic cortex)는 상대적으로 보존된다. 드물게 시상(thalamus), 중뇌의 뒤판(tegmentum of the midbrain), 기저핵(basal ganglia)에서의 신호 이상도 보고된다[5].
급성 고암모니아뇌병증의 적절한 치료를 위해서는 유발 인자를 교정하는 것이 필요하나, 통상적으로 내재적 암모니아 생성 및 흡수를 제한하는 치료에 초점이 맞춰져 있다. 삼투성하제인 락툴로스(lactulose)는 장내 세균에 의해 초산(acetic acid)과 젖산(lactic acid)으로 분해되어 대장을 산성화하여 요소(urea)를 암모니아로 전환하는데 필요한 요소분해효소(urease)를 생산하는 장내 세균의 생존이 어려운 환경이 조성된다. 또한, 대장의 산성화는 암모니아(NH3)가 장내 흡수가 어려운 암모늄(NH4+)으로 전환되는 현상을 초래하여 대장 내 암모늄을 가두어 혈중 암모니아 농도를 감소시킨다[6]. 그 외 요소분해효소를 생산하는 장내 세균을 줄이기 위한 목적으로 메트로니다졸(metronidazole), 리팍시민(rifaximin) 등의 항생제를 사용해 볼 수 있다[7].
본 환자에서 락툴로스 관장 시행 후 혈중 암모니아 수치가 감소하며 의식이 혼수에서 기면 상태로 회복되었고, 뇌 MRI에서 일부 병변의 회복 및 뇌파검사에서 돌발파억제양상이 세타 범위의 광범위 서파로 호전된 점을 고려 시 의식 저하의 원인은 패혈증연관뇌병증(sepsis-associated encephalopathy)보다 급성 암모니아뇌병증일 것으로 판단한다. 뇌 MRI에서 급성 암모니아뇌병증에서 보이는 특징적인 위치의 신호 변화 또한 급성 암모니아뇌병증 진단에 뒷받침한다. 급성 고암모니아뇌병증의 특징적인 뇌파 소견은 세타 및 델타 범위의 광범위 서파와 삼상파이나, 본 환자에서는 돌발파억제양상이 관찰되었다는 점이 흥미롭다. 돌발파억제양상은 뇌의 비활성화(brain inactivation)와 관련하여 저산소증(hypoxia), 저체온증(hypothermia), 고용량 GABA성 마취제에서 발생하고 대사뇌병증(metabolic encephalopathy)에서는 매우 드물다[8]. 아직 국내에서는 돌발파억제양상를 보이는 급성 고암모니아뇌병증 증례는 보고된 바 없다. 최근 국외에서 영양불량(malnutrition)에 의한 고암모니아뇌병증에서 돌발파억제양상이 관찰됨을 보고하였고 영양불량이 원인인 비간경화성 고암모니아뇌병증에서 돌발파억제양상이 관찰되었던 것에 비해[9], 본 증례에서는 간경경화성고암모니아뇌병증에서 돌발파억제양상을 확인하였다. 또한, 뇌 MRI에서 뚜렷한 고암모니아뇌병증의 특징을 확인했을 뿐 아니라 혈중 암모니아 농도의 정상 수치 회복 후 돌발파억제양상의 소실 및 뇌 MRI에서 일부 고강도신호의 호전 추세를 확인했다는 점이 다르다. 일반적으로 돌발파억제양상은 생리적으로 피질 과민성(cortical hypersensitivity)과 뇌대사율(cerebral metabolic rate) 저하로 설명되는데[10] 고암모니아뇌병증에서도 뇌대사율 저하가 동반됨을 고려할 때, 본 환자의 급성 고암모니아뇌병증에서 돌발파억제양상 발생에도 피질과민성 및 뇌대사율이 역할을 할 것으로 추정되나, 이에 대해서는 향후 연구가 필요할 것으로 생각된다.
알코올간경화 환자에서 의식 저하 등의 신경계상태 변화 시 혈중 암모니아 농도를 측정하여 급성 고암모니아뇌병증의 발생 가능성에 항상 주의를 기울이고, 치료가 지연되면 영구적인 신경계손상 및 사망에 이를 수 있기 때문에 확인 시 즉각적인 치료가 필요하다. 급성 고암모니아뇌병증 진단은 임상 증상과 혈액검사뿐 아니라 특징적인 뇌 MRI 및 뇌파 소견이 고암모니아뇌병증의 진단, 예후 평가 및 치료 반응에 도움이 될 수 있다. 저자들은 알코올간경화 환자에서 급성 고암모니아뇌병증 발생 시 뇌파검사에서 돌발파억제양상이 관찰되었고 락툴로스 관장 및 단백질 섭취 제한의 치료 후 세타 범위의 광범위 서파로 호전되며 돌발파억제양상이 소실됨을 경험하였기에 이를 보고하는 바이다.
REFERENCES
1. Savy N, Brossier D, Brunel-Guitton C, Ducharme-Crevier L, Du Pont-Thibodeau G, Jouvet P. Acute pediatric hyperammonemia: current diagnosis and management strategies. Hepat Med 2018;10:105-115.



3. Lemberg A, Fernández MA. Hepatic encephalopathy, ammonia, glutamate, glutamine and oxidative stress. Ann Hepatol 2009;8:95-102.


4. Auron A, Brophy PD. Hyperammonemia in review: pathophysiology, diagnosis, and treatment. Pediatr Nephrol 2012;27:207-222.


5. Reis E, Coolen T, Lolli V. MRI findings in acute hyperammonemic encephalopathy: three cases of different etiologies: teaching point: to recognize MRI findings in acute hyperammonemic encephalopathy. J Belg Soc Radiol 2020;104:9.


6. Liu J, Lkhagva E, Chung HJ, Kim HJ, Hong ST. The pharmabiotic approach to treat hyperammonemia. Nutrients 2018;10:140.



7. Alfadhel M, Mutairi FA, Makhseed N, Jasmi FA, Al-Thihli K, Al-Jishi E, et al. Guidelines for acute management of hyperammonemia in the Middle East region. Ther Clin Risk Manag 2016;12:479-487.



8. Shanker A, Abel JH, Schamberg G, Brown EN. Etiology of burst suppression EEG patterns. Front Psychol 2021;:12:673529.


Figure 1.
Initial brain MRI and EEG. (A) Brain MRI revealed high signal intensity in both frontal, parietal, and temporal cortex, insular cortex, basal ganglia, and thalamus on DWI and fluid attenuated inversion recovery. The high signal on the DWI has corresponding low signal on the apparent diffusion coefficient map. (B) EEG showed burst-suppression pattern. The mean burst duration was 0.5 seconds. The mean burst interval was 1 second. MRI; magnetic resonance imaging, EEG; electroencephalogram, DWI; diffusion-weighted image.
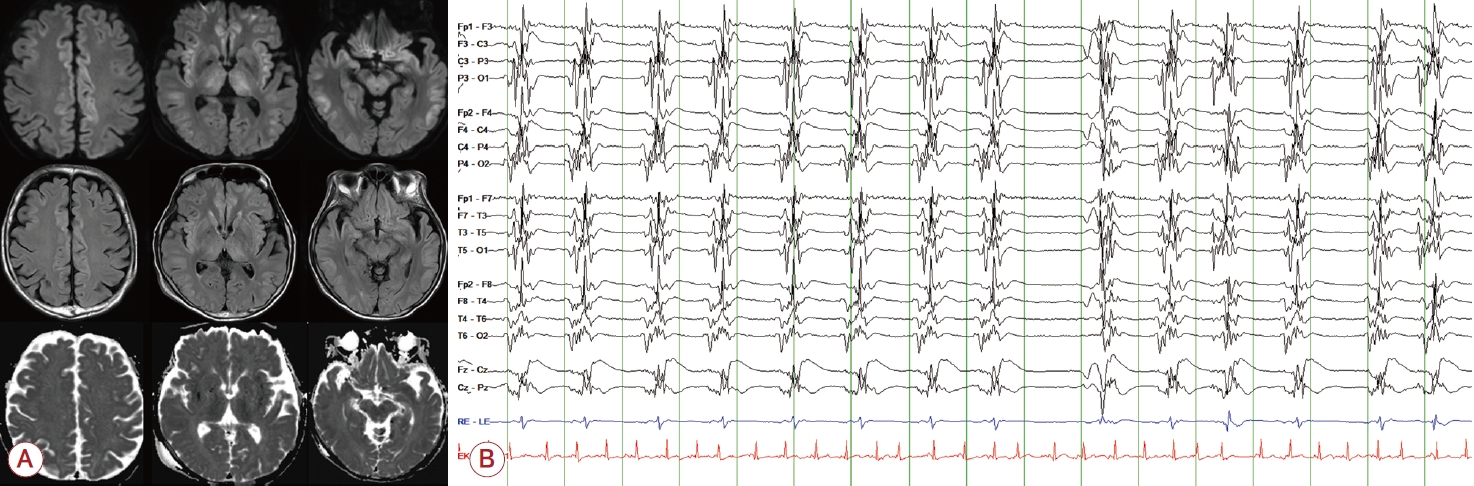
Figure 2.
Follow-up brain MRI and EEG. (A) On a follow-up brain MRI, DWI showed slight decreased extent of signal change in both basal ganglia and thalamus. However, high signal intensity in both frontal, parietal, and temporal cortex, and insular cortex persisted on DWI and was more prominent on fluid attenuated inversion recovery. (B) Follow-up EEG showed slow posterior dominant rhythm, as well as nearly continuous bilateral frontal dominant theta slow waves. MRI; magnetic resonance imaging, EEG; electroencephalogram, DWI; diffusion-weighted image.

- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 155 View
- 3 Download
- Related articles
-
Reversible Parkinsonism Associated with Acute Arsenic Intoxication2011 ;29(3)
Reversible Diffuse Brain Edema in Acute Encephalopathy with Shigellosis2007 ;25(1)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



