코로나바이러스감염증-19 (coronavirus disease 2019, COVID-19)의 범유행(pandemic) 동안 백신 접종의 중요성은 증가했고 전령RNA (messenger RNA, mRNA)를 이용한 BNT162b2 (Pfizer, New York, NY, USA; BioNTech, Mainz, Germany)와 mRNA-1273 (Moderna, Cambridge, MA, USA)이 개발되었다. COVID-19 mRNA 백신의 일반적인 기전은 severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) spike protein 발현을 통해 항체를 형성하는 것인데 이 기전에서 spike protein을 매개하여 자가면역 염증 반응이 일어날 수 있다고 보고되었다[1]. mRNA 백신 접종 후 자가면역 반응에 의해 발생하는 것으로 알려진 비교적 흔한 합병증으로는 심근염, 심장막염, 안면마비가 있고, 드물게 기앵-바레 증후군, 뇌염의 증상들도 보고되었다[2,3]. 본 증례는 BNT162b2 COVID-19 백신 접종을 받은 환자에서 접종 후 두통을 동반한 새롭게 발생한 뇌염을 동반한 난치 뇌전증지속상태를 보였고 여러 번의 면역글로불린과 스테로이드 치료 이후 호전되는 경과를 보인 사례에 대하여 보고하고자 한다.
증 례
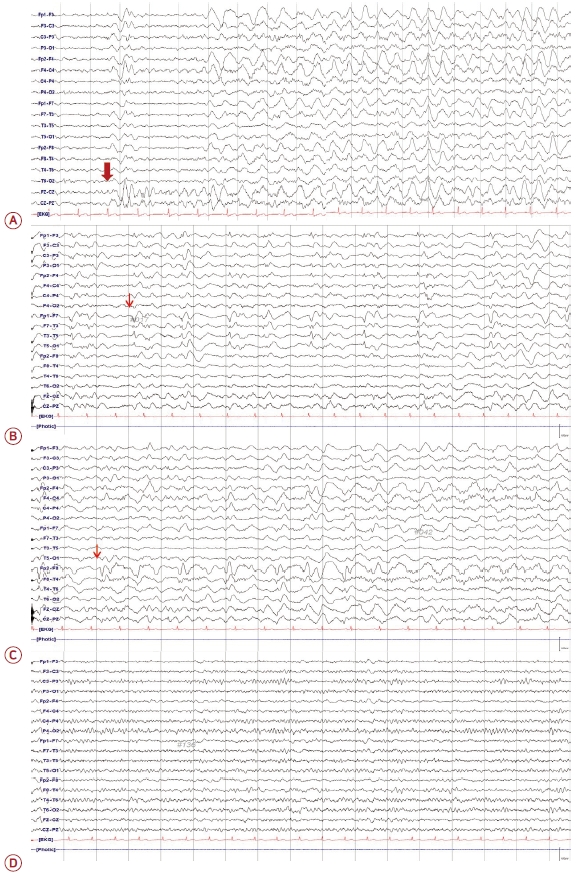
39세 남자가 내원 3주 전 BNT162b2 COVID-19 백신 1차 접종을 받은 후 두 번의 전신강직간대발작으로 신경과 외래에 내원하였다. 열발작을 포함한 기저 질환이 없고 뇌전증 가족력이 없는 건강한 환자로 백신 접종 이후 지속적인 두통과 인지 저하를 호소했으며 접종 후 19일째 첫 전신강직간대발작을 보였다. 첫 발작 당시 타 병원에 입원하여 시행한 뇌 자기 공명영상(magnetic resonance imaging, MRI), 뇌파 검사는 정상으로 항경련제 처방 없이 퇴원하였다. 그러나 이후에도 환자는 두통을 계속 호소하였으며, 환자의 보호자들에게 지속적인 반응 저하의 모습이 관찰되었다. 환자는 백신 접종 24일 후 본원 외래로 내원하였고, 외래 진료 중, 의식은 명료하였으나 질문에 느린 반응을 보이다가 전신강직간대발작을 보였다. 즉시 응급실로 옮겨진 후 산소를 공급하고 로라제팜(lorazepam) 4 mg을 정맥 투여했다. 응급실에서 측정한 활력 징후는 안정적이었으며 발열은 없었다. 로라제팜 투여 후 의식은 기면(drowsy)에서 명료(alert)해졌으나, 명료한 상태에서 지남력(orientation)이 없는 혼돈(confusion)이 지속되었고 묻는 질문에 느린 반응을 보이며 적절하게 반응하지 못하였다. 그 밖에 신경계진찰상 다른 국소 신경학적결손은 보이지 않았다. 경련 발작에 대한 대사 질환 감별을 위한 전체 혈구 계산(complete blood count), 전해질(Na, K, Cl), 신장 기능(혈액 요소 질소[blood urea nitrogen], 크레아티닌[creatinine], 요산[uric acid]), 알라닌아미노전달효소(alanine aminotransferase)는 정상이었고 아스파르테이트아미노전달효소(aspartate aminotransferase)는 47 IU/L, 크레아틴 키나아제(creatine kinase)는 1,878 U/L로 상승 소견을 보였다. 적혈구침강속도(erythrocyte sedimentation rate), C-반응단백질(C-reactive protein), 매독혈청 검사도 음성이었으며, 류마티스인자를 포함한 항핵항체, 항중성구세포질항체, 항카디오리핀항체, 항인지질항체, 루프스항응고인자, 항이중가닥DNA의 전신혈관염과 관련된 검사들도 모두 음성이었다. 그 밖에 혈당, 갑상샘호르몬(갑상샘자극호르몬[thyroid stimulating hormone], 유리티록신[free thyroxine])을 포함한 초기 검사실 검사 역시 모두 정상이었다. 세로양극 몽타주(longitudinal bipolar montage)로 검사한 뇌파에서 리듬세타활동이 리듬델타활동으로 중심 뇌고랑(central sulcus)에서 양측 전두엽으로 퍼져나가는 양상이 다수 관찰되었다(Fig. 1-A). 가로양극몽타주(transverse bipolar montage)로 시공간 진화(spatiotemporal evolution) 양상을 다시 확인하였으며, 그 외에 빠른 활동(fast activities)이 중심뇌고랑에서 좌측 전두엽으로 퍼져 나가는 양상도 관찰되었다(Supplementary Fig 1). 뇌 MRI는 정상이었으며(Supplementary Fig 2), 뇌척수액 검사 결과 white blood cells 6/mm3, red blood cells 0/mm3, 단백질 23 mg/dL, 포도당 69 mg/dL (뇌척수액과 혈청포도당 비 69/119)였다. 중추신경계 감염 원인 감별을 위한 그람염색, 세균배양 검사 및 단순포진바이러스, 수두대상포진바이러스, 거대세포바이러스, 엡스타인-바바이러스, 마이코박테륨에 대한 중합효소 연쇄반응 검사를 시행하였고, 결과는 모두 음성이었다. 신생물딸림증후군 및 자가면역뇌염을 감별하기 위한 항-신생물딸림항체 검사(항-anti-N-methyl-D-aspartate receptor, 항-leucine-rich glioma inactivated 1, 항-contactin-ass-ociated protein-li ke 2, 항-α-a mino-3-hydroxy-5-methyl-4-isoxazolepropionic acid receptor, 항-γ-aminobutyric acid receptor-B, 항-Hu, 항-Yo, 항-Ri, 항-Ma2, 항-CV2, 항-amphiphysin 항체) 역시 모두 음성이었다. 악성 종양이나 다른 염증성 병변을 찾기 위해 시행한 흉부, 복부 컴퓨터단층촬영(computed tomography)에서도 이상 소견은 관찰되지 않았다. 환자는 경련발작 이후 지속되는 가능 비경련뇌전증지속상태(possible nonconvulsive status epilepticus, pNCSE)로 생각되어 신경과 중환자실로 입원 후 정맥 내 레비티라세탐(levetiracetam) 1,000 mg, 라코사마이드(lacosamide) 200 mg을 주입하고, 뇌염을 고려하여 세프트리악손(ceftriaxone, 4 g/day)과 아시클로버(acyclovir, 30 mg/kg/day)를 투여했다. 이후 레베티라세탐 2,000 mg/day, 라코사마이드 300 mg/day로 유지하고 백신에 의한 자가면역 반응을 고려하여 면역 치료를 위해 고농도 메틸프레드니솔론(methylprednisolone, 1 g/day) 5일간 정주하였다. 입원 후 4일째, 스테로이드 및 항경련제 투약에도 뇌파 검사에서 왼쪽(Fig. 1-B) 또는 오른쪽(Fig. 1-C)에서 양측의 독립적인 주기편측뇌전증모양방전(bilateral independent periodic lateralized epileptiform discharges)이 관찰되며 의식의 뚜렷한 호전이 없어 메틸프레드니솔론 투약 4일째 되던 날 면역글로불린 정맥 내 주사(intravenous immunoglobulin, IVIG) 0.4 g/kg/day를 5일간 추가로 주입하였다. 또한 페노바비탈(5 mg/kg), 페람파넬(8 mg/day)을 부하 투약하고 유지하였다. IVIG 치료 2일 후 혼돈 상태는 호전되었고 12일 후 뇌파도 호전되어 페노바비탈은 조금씩 감량하여 중단하였다. 입원 23일째, 질문에 느린 반응을 보이는 환자의 의식이 완전히 정상으로 회복되었고 뇌파도 정상으로 호전되어(Fig. 1-D), 레비티라세탐(1,500 mg/day), 라코사마이드(300 mg/day), 토피라메이트(100 mg/day), 페람파넬(6 mg/day)과 프레드니솔론(90 mg/day) 경구 약제 유지 후 퇴원하였다. 외래에서 프레드니솔론은 일주일 간격으로 10 mg씩 감량하여서 중단하였다. 퇴원 후 두 달 뒤 환자는 전신강직간대발작이 재발하여 응급실로 내원 후 입원하였다. 당시 발작 이후 의식은 회복되었으며 신경계진찰상 정상이었다. 그러나 뇌파 검사에서 양측 전두엽에 이전과 같은 리듬델타활동이 다시 관찰되어(Fig. 2-A) IVIG (400 mg/kg/day) 치료를 다시 시작하였다. 면역글로불린 투약 2일째 되는 시점에 수축기 혈압이 80 mmHg 이하로 저하되는 부작용이 발생하여 남은 3일 동안은 면역글로불린을 기존의 절반 용량으로 투약하였고, 메틸프레드니솔론(1 g/day)을 5일간 함께 정주하였다. 이후 뇌파는 다시 호전되어 프레드니솔론(30 mg/day)을 포함한 항경련제는 이전과 동일한 용량을 유지하고 퇴원하였고, 프레드니솔론은 3주에 걸쳐서 5 mg씩 감량하여 중단하였다. 그러나 두 번째 퇴원 두 달 후 외래로 내원한 환자가 다시 이상한 냄새, 이 충만감, 졸림을 호소하여 뇌파 검사를 진행하였다. 뇌파에서 정상 배경 리듬을 보였으나 간헐적으로 반리듬 델타활동이 다시 관찰되어(Fig. 2-B), 재입원 후 IVIG 치료를 3일간 받은 후 회복되어 퇴원하였다. 현재 환자는 레비티라세탐(1,500 mg/day), 라코사마이드(300 mg/day), 토피라메이트(100 mg/day), 페람파넬(6 mg/day), 발프로산(1,000 mg/day)을 복용하고 있으며 뇌파는 정상 소견을 보이고 발작 재발 없이 1년간 추적 관찰하고 있다.
고 찰
본 증례는 이전 특이 병력이 없던 건강한 환자에서 COVID-19 백신 접종과 새로 발병한 뇌염을 동반한 난치 뇌전증지속상태의 연관성에 대한 사례이다. 환자는 내원 시 전신강직간대발작을 보인 뒤 의식이 회복되지 않으면서 뇌파 검사에서 0.5 Hz 이상의 지속적인 리듬세타활동과 리듬델타활동이 중심 뇌고랑(central sulcus) 부위에서 양측 전두엽을 향해 시공간(spatiotemporal)적으로 퍼져가는 양상이 관찰되었다. 이러한 양상을 통해, 잘츠부르크 기준(Salzburg criteria)에 의거하여 pNCSE로 진단하였다[3]. 또한 이러한 임상 양상과 함께 뇌척수액세포증가증, 반복된 고농도 스테로이드 치료나 면역글로불린 치료와 같은 면역 치료에 좋은 반응을 보인 것을 고려해볼 때, mRNA COVID-19 백신에 의한 자가면역, 염증에 의한 뇌염이 동반된 것으로 보았다. 그러나 검사에서 원인이 명확히 밝혀지지 않는 바이러스나 다른 자가면역뇌염의 가능성 역시 배제할 수는 없다.
본 증례와 유사하게 mRNA COVID-19 백신 접종 후 발생한 뇌전증에 대한 보고들이 있었다[4,5]. 이전 보고들에서 mRNA 백신과 발작 발생의 연관성에 대해 다음과 같은 기전들로 설명하고 있다. SARS-COV-2는 안지오텐신전환효소 2 (angiotensin-converting enzyme 2, ACE-2)에 결합하는 spike glycoprotein을 가지고 있는데 ACE-2 결합으로 인한 억제 기전은 brain-derived neurotrophic factor(BNDF)를 감소시킨다고 한다[6,7]. 뉴런 내 BNDF의 항염증작용을 감소시켜서 미세아교세포 활성화(microglial activation)를 약화시키고 결론적으로 염증 반응의 증가가 발작 발생 가능성을 증가시킨다는 것이다[8]. 백신과 연관된 자가면역 반응에 대해서 몇몇 연구들에서는 분자 단계의 유사성으로 인해 자가면역 반응이 발생한다고 보고하였다. SARS-COV-2 spike protein과 체내의 myelin basic protein의 분자 단계 유사성으로 인해 면역교차 반응을 일으켜 자가면역을 초래한다는 것이다[5,9]. 또한 mRNA나 백신 구성 요소들이 특정 개인에게 항원으로 감지되어 기이한 염증 전 사이토카인연쇄반응(proinflammatory cascade)을 유발, 면역신호 전달 경로를 활성화하기 때문에 그 결과로 체내 순환 사이토카인이 증가하여 염증 반응 및 이차적인 장기 손상을 일으키는 것으로 보았다[5].
최근에 발표된 홍콩에서 시행한 COVID-19 백신 접종과 발작의 연관성에 대한 연구에 따르면 mRNA COVID-19 백신 10만 도스당 1.04의 발작 발생을 보였고 백신을 맞지 않은 사람들의 자연적 발작 발생률과 비슷함을 고려해볼 때 연관성이 없는 것으로 보인다[10]. 그러나 mRNA COVID-19 백신의 개발과 승인 기간이 다른 백신들에 비해 짧고 이전과 다른 기전을 가진 만큼 지속적인 관심을 가지고 자가면역 반응에 의한 부작용들을 관찰해야 한다. 본 증례는 mRNA COVID-19 백신의 드문 신경계 부작용으로 생각되며, 향후 분자 단계에서의 부작용에 관한 기전을 증명하기 위한 지속적인 연구의 필요성을 제시하는 바이다.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Supplement1
Supplement1 Print
Print




