| J Korean Neurol Assoc > Volume 40(2); 2022 > Article |
|
Abstract
It is important for the diagnosis of Lambert-Eaton myasthenic syndrome (LEMS) to confirm the incremental response at high-rate stimulation or after brief exercise in the repetitive nerve stimulation (RNS) test. Therefore, it may be difficult to diagnose LEMS if the RNS test is normal initially. We report a patient with LEMS whose diagnosis was delayed due to normal RNS findings. We believe that anti-P/Q-type voltage-gated calcium channel antibody testing is crucial in the diagnosis of LEMS.
램버트-이튼근무력증후군(Lambert-Eaton myasthenic syndrome, LEMS)은 항P/Q형 전압작동칼슘통로(anti-P/Q-type voltage-gated calcium channels, VGCC)항체가 시냅스이전 신경종말에 작용하여 아세틸콜린 분비를 감소시켜 근쇠약을 유발하는 시냅스이전 신경근접합부질환이다[1]. 진단은 특징적인 전기진단검사 소견과 항P/Q형 VGCC항체검사를 통하여 이루어지지만, 반복신경자극검사에서 자발근수축운동(post-exercise test) 또는 고빈도자극 시 관찰되는 증가반응이 가장 중요한 요소로 간주된다. 항P/Q형 VGCC항체검사는 진단에 보완적인 역할을 하여 전기진단검사를 대체할 수 없는 것으로 알려져 있다[1]. 따라서 초기에 반복신경자극검사가 정상인 경우 LEMS를 진단하는 것은 매우 어려울 수 있다[2]. 본 증례는 정상 반복신경자극검사 소견으로 인해 진단이 늦어진 LEMS 환자를 보고하고 이를 통해 LEMS의 진단에 있어 항VGCC항체검사의 중요성을 되짚어 보려고 한다.
81세 여자가 약 2개월 전부터 점점 진행하는 양쪽 하지 쇠약과 발음 어둔함, 삼킴곤란으로 병원에 왔다. 환자는 또한 입마름을 호소하였다. 증상의 일중변동은 없었다. 환자는 1개월 전 상기 증상으로 타 병원에서 LEMS 의심 하에 저빈도자극 및 고빈도자극 반복신경자극검사를 시행하였으나 이상 소견이 없어 특별한 진단을 받지 못하고 지냈다. 환자는 1년 10개월 전 흉부 컴퓨터단층촬영에서 폐 우중엽에 종괴가 발견되었고 조직검사에서 샘암종(adenocarcinoma)이 확인되어 비소세포폐암종을 진단받았다. 양전자방출컴퓨터단층촬영에서 국소 림프절 전이 및 원격 전이는 관찰되지 않아 병기 IB (cT2aN0M0)로 우중엽 절제술을 고려하였으나 환자가 수술 치료는 원하지 않아 시행하지 못했다. 별다른 치료 없이 7개월 후 시행한 양전자방출컴퓨터단층촬영 추적검사에서 폐 우중엽의 종괴가 현저하게 감소된 소견을 보였고, 이에 비소세포폐암종에 대해서는 이후 특별한 치료 없이 본원 호흡기내과에서 추적 관찰만 하였다.
신경계진찰에서 양쪽 사지에 근력 약화가 관찰되었는데 특히 양쪽 어깨관절의 벌림과 모음(Medical Research Council [MRC] 3등급), 엉덩관절의 굽힘과 폄(MRC 3-등급)에서 두드러졌다. 목 굽힘 또한 MRC 4-등급으로 근력이 감소되어 있었다. 깊은힘줄반사는 사지에서 감소되어 있었다. 감각기능검사는 정상이었고, 병적반사는 관찰되지 않았다.
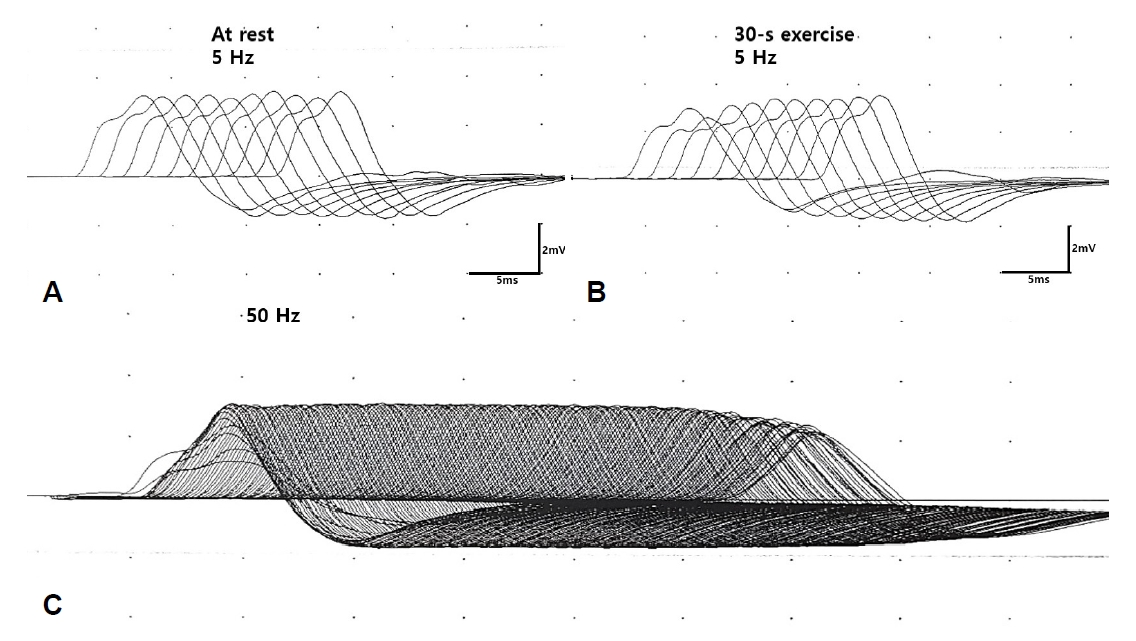
혈액검사에서 크레아틴인산화효소는 34 U/L로 정상이었고, 신생물딸림증후군항체 및 항아세틸콜린수용체항체는 모두 음성이었다. 뇌 및 척추 자기공명영상검사에서 환자의 증상을 유발할 만한 이상은 관찰되지 않았다. 운동신경전도검사에서 복합근육활동전위의 진폭이 감소되어 있었다. 침근전도검사에서 비정상자발전위 또는 근육병을 시사하는 소견은 관찰되지 않았다. 눈둘레근 및 새끼벌림근(abductor digiti minimi)에서 시행한 반복신경자극검사에서 저빈도자극(5 Hz), 30초의 자발근수축 운동 및 고빈도자극(50 Hz) 모두에서 의미 있는 진폭의 변화는 관찰되지 않았고(Fig.), 네오스티그민검사(neostigmine test)에서도 사지 근력의 뚜렷한 변화는 없었다. 자율신경기능검사에서 심호흡 시 심박수변이가 1.6 (정상치 >3.88), 발살바비 1.16 (정상치 >1.25)으로 감소되었고, 정량땀분비 축삭반응검사에서 원위부 다리 및 발에서 땀분비가 감소되어 있었다. 이에 복합자율신경중증도점수(composite autonomic severity score)가 4점으로 중등도의 자율신경기능이상이 관찰되었다.
반복신경자극검사에서 LEMS에 특징적인 소견은 관찰되지 않았지만, 비소세포폐암종의 병력 및 근위부 우세의 근쇠약, 깊음힘줄반사 감소, 자율신경이상을 고려하였을 때 LEMS가 강력히 의심되었다. 이에 항VGCC항체검사 후, 고용량 스테로이드 정맥 주사 치료를 5일간 시행하였다. 이후 프레드니솔론 50 mg 하루 1회(1주 간격으로 10 mg씩 감량), 마이코페놀레이트 모페틸 500 mg 하루 2회, 3,4-다이아미노피리딘(3,4-diaminopyridine) 10 mg 하루 3회 경구 복용하면서 지속적인 재활 치료를 병행하였다. 1개월 후 엉덩 관절 굽힘에서 MRC 5-등급의 경미한 근쇠약 외에 다른 사지의 근력은 모두 호전되었다. 항P/Q형 VGCC항체는 0.12 nmol/L (정상치 <0.02 nmol/L)로, 항N형 VGCC항체는 0.81 nmol/L (정상치 <0.03 nmol/L)로 모두 양성을 보였다. 이에 항VGCC항체 양성과 함께 치료에 대한 반응을 바탕으로 우리는 최종적으로 환자를 LEMS로 진단하였다[1,3]. 비소세포폐암종에 대해서 현재 상태의 확인을 위해 양전자방출컴퓨터단층촬영을 시행하였고 검사에서 이전과 비교하여 큰 변화는 없었다. 이에 비소세포폐암종에 대해서는 추가적인 치료 없이 추적 관찰하기로 하였다.
LEMS에서 반복신경자극검사는 진단에서 가장 중요한 전기진단검사로, 안정기 복합근육활동전위의 진폭 감소, 저빈도자극(2-5 Hz) 시 감소반응, 고빈도자극(20-50 Hz) 또는 10-30초의 자발적 근수축 운동 후 증가반응으로 구성되는 3가지의 특징을 보인다[1,2,4]. LEMS 환자에서 안정기 복합근육활동전위의 진폭 감소는 96-97%에서[5,6], 저빈도자극 시 10% 이상의 감소반응은 94-97%에서 관찰될 만큼 민감도가 높다[4,7]. 하지만 이 두 소견은 중증근무력증에서도 관찰되기 때문에 LEMS와 중증근무력증을 구분하지는 못한다. LEMS는 자율신경기능이상, 깊은힘줄반사 감소 및 주로 하지 근위부 근력 약화와 같은 특징이 있지만 임상증상의 상당 부분이 중증 근무력증과 겹치기 때문에 초기에 중증근무력증으로 잘못 진단되는 경우가 흔하다[8]. 특히 반복신경자극검사에서 저빈도자극 시 관찰되는 감소반응은 이런 혼동을 더 유발한다. 그렇기 때문에 이 두 질환을 구분하기 위해서 반복신경자극검사에서 고빈도자극 또는 자발적 근수축 운동 후 증가반응을 확인하는 것이 중요하다. 본 증례는 새끼벌림근에서 시행한 반복신경자극검사에서 저빈도자극 시 감소반응은 없었지만 안정기 복합근육활동전위의 진폭 감소를 보였다. 하지만 이 소견만으로는 앞서 언급한 것처럼 중증근무력증을 포함한 여러 아래운동신경세포증후군(lower motor neuron syndrome)과 구분하기 어렵다.
일반적으로 반복신경자극검사에서 고빈도자극 또는 자발적 근수축 운동 후 복합근육활동전위 진폭의 100% 이상 증가반응을 LEMS의 진단 기준으로 사용하고 있다[1,8]. 그러나 이 기준을 사용하였을 때 진단에 대한 민감도는 생각보다 높지 않다. 100% 증가 반응 기준을 적용하였을 때 반복신경자극검사에서 고빈도자극 없이 10-30초의 자발적 근수축 운동 후 검사만 시행한 Lipka 등[2]의 연구에서는 58.7%의 민감도를 보였고, 고빈도자극 및 30초의 자발적 근수축 운동 후 검사를 모두 시행한 Oh 등[4]의 연구에서는 85%의 민감도를 보였다. 이런 제한점 때문에 위 두 연구에서는 민감도를 높이기 위해 증가반응 기준을 60%로 조정하는 방안을 제안하였다[2,4]. 증가반응 기준을 60%로 변경시 민감도가 Lipka 등[2]의 연구에서는 58.7%에서 77.8%로, Oh 등[4]의 연구에서는 85%에서 97%로 증가되었다. 기준을 60%로 낮추어도 진단특이도는 Lipka 등[2]의 연구에서는 98.9%, Oh 등[4]의 연구에서는 99%로 높게 유지되었다. 본 증례의 경우 60% 증가반응 기준을 적용해도 새끼벌림근에서 시행한 반복신경자극검사에서 30초 자발적 근수축 운동 및 50 Hz 고빈도자극 후 의미 있는 증가반응은 관찰되지 않았다. 즉 본 증례는 증가반응 기준을 100%에서 60%로 낮추어 적용해도 LEMS의 진단을 놓치게 되는 경우를 보여준다. Lipka 등[2]의 연구 결과를 살펴보더라도 60%로 증가반응 기준을 낮췄을 때 민감도가 77.8%로 증가되었지만 이를 진단적으로 활용하기에는 충분치 않은 수준일 수 있으므로 주의가 필요하다.
LEMS는 근위부 근력 약화를 특징으로 하기 때문에 새끼벌림근과 같은 원위부 근육보다는 근위부 근육에서 반복신경자극검사를 시행하는 것이 진단의 민감도를 높이는 방법일 수 있다. 본 증례의 환자는 새끼벌림근 외에 상지의 근위부 근육에서 반복신경자극검사를 시행하지는 못하였다. Maddison 등[9]은 LEMS 환자를 대상으로 새끼벌림근, 짧은엄지벌림근(abductor pollicis brevis), 팔꿈치근(anconeus), 위팔두갈래근(biceps brachii) 및 등세모근(trapezius)에서 반복신경자극검사를 시행하여 각 근육의 진단민감도를 조사하였는데 가장 민감도가 높은 근육은 원위부 근육인 새끼벌림근이었고 가장 민감도가 낮은 근육은 근위부 근육인 등세모근이었다. Lipka 등[2]의 연구에서도 반복신경자극검사를 새끼벌림근과 등세모근에서 시행한 경우(100%의 증가반응이 기준일 때의 민감도는 58.7%, 60%의 증가반응이 기준일 때의 민감도는 77.8%)와 새끼벌림근에서만 시행한 경우(100%의 증가반응이 기준일 때의 민감도는 54.8%, 60%의 증가반응이 기준일 때의 민감도는 74.2%) 진단민감도에 차이는 없었다. 본 증례는 근위부 근육에서 반복신경자극검사를 시행하지 못했지만 이전 연구 결과를 고려하였을 때 이 부분이 진단민감도에 큰 영향을 주지는 못했을 것으로 생각된다.
그동안 항P/Q형 VGCC항체검사는 LEMS 진단에 있어 보조수단으로 여겨져 왔다[1]. 하지만 본 증례처럼 임상적으로 LEMS가 강력히 의심되는 환자에서 반복신경자극검사에서 LEMS에 특징적인 소견을 발견하지 못한 경우 항VGCC항체검사는 진단확실성을 제공해주는 결정적인 역할을 할 수 있다. Oh 등[10]의 연구에서 VGCC 항체 양성을 보인 13명의 LEMS 환자에서 12명은 반복신경자극검사에서 LEMS에 특징적인 소견을 보였지만 나머지 1명은 정상이었다. 이처럼 본 증례와 같은 경우가 많지는 않지만 분명히 LEMS 환자 중 일부를 차지하기 때문에 항체검사의 필요성을 기억하는 것이 중요하다. 이에 최근 한 연구에서는 LEMS가 의심되는 환자에서 반복신경자극검사에서 증가반응 없이 일부 특징적인 소견만 보이거나 또는 정상인 경우 항VGCC항체검사를 반드시 시행할 것을 제안하였다[1]. 항VGCC항체 검사는 국내에서 시행되지 않아 국외로 검사를 의뢰해야 하고 또 많은 비용이 소요되기 때문에 많은 제약이 따른다. 그래서 국내에서 LEMS를 진단하는 과정에서는 반복신경자극검사가 상대적으로 중요하게 되었지만 앞서 언급한 것처럼 다소 낮은 민감도를 반드시 고려하여야 한다.
본 증례는 반복신경자극검사에서 LEMS에 특징적인 소견을 보이지 않아 진단이 늦어진 환자를 보고하였다. 임상에서 이런 환자는 진단 딜레마가 될 수 있고 특히 항P/Q형 VGCC항체검사를 시행하는데 일부 제약이 따르는 국내에서는 더욱 그럴 가능성이 높다. 임상적으로 LEMS가 강력히 의심되는 환자에서는 반복신경자극검사에서 특징적인 소견을 보이지 않더라도 적절한 진단 및 치료 방향을 결정하기 위해 항P/Q형 VGCC항체검사를 적극적으로 고려하는 것이 중요하다.
REFERENCES
1. Ivanovski T, Miralles F. Lambert-Eaton myasthenic syndrome: early diagnosis is key. Degener Neurol Neuromuscul Dis 2019;9:27-37.


2. Lipka AF, Titulaer MJ, Tannemaat MR, Verschuuren J. Lowering the cut-off value for increment increases the sensitivity for the diagnosis of Lambert-Eaton myasthenic syndrome. Muscle Nerve 2020;62:111-114.



3. Schoser B, Eymard B, Datt J, Mantegazza R. Lambert-Eaton myasthenic syndrome (LEMS): a rare autoimmune presynaptic disorder often associated with cancer. J Neurol 2017;264:1854-1863.


4. Oh SJ, Kurokawa K, Claussen GC, Ryan HF Jr. Electrophysiological diagnostic criteria of Lambert-Eaton myasthenic syndrome. Muscle Nerve 2005;32:515-520.


5. Tim RW, Massey JM, Sanders DB. Lambert-Eaton myasthenic syndrome: electrodiagnostic findings and response to treatment. Neurology 2000;54:2176-2178.


6. Tim RW, Massey JM, Sanders DB. Lambert-Eaton myasthenic syndrome (LEMS). Clinical and electrodiagnostic features and response to therapy in 59 patients. Ann N Y Acad Sci 1998;841:823-826.


7. Oh SJ. Distinguishing features of the repetitive nerve stimulation test between Lambert-Eaton myasthenic syndrome and myasthenia gravis, 50-year reappraisal. J Clin Neuromuscul Dis 2017;19:66-75.


8. Hülsbrink R, Hashemolhosseini S. Lambert-Eaton myasthenic syndrome - diagnosis, pathogenesis and therapy. Clin Neurophysiol 2014;125:2328-2336.


Figure.
Findings of the repetitive nerve stimulation test on the abductor digiti minimi muscle. (A) No significant decremental response of more than 10% is observed with 5 Hz stimulation. No significant incremental response of more than 60% is observed (B) after 30 seconds of brief exercise or (C) at 50 Hz stimulation.
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 1,165 View
- 48 Download
- Related articles
-
Repetitive Nerve Stimulation Test in Myotonic Patients1994 ;12(4)
Diagnostic Sensitivity of Repetitive Nerve Stimulation Test in Myasthenia Gravis1993 ;11(2)
Quantitative Change of Repetitive Nerve StimulationTest in Myasthenia Gravis1992 ;10(4)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



