뇌신경계 수술에서는 과도한 견인, 직접적 손상, 뇌혈관손상 등의 다양한 원인에 의해 수술 중 신경계손상이 발생할 수 있다. 수술 중 신경계감시(intraoperative neurophysiological monitoring)는 수술 중 발생하는 신경계손상을 가역적인 단계에서 확인하고 회복하게 도움을 주는 방법으로 다양한 뇌신경계 수술에서 이용되고 있다. 난치성 뇌전증 환자의 효과적 수술 치료법인 전내측두엽절제 수술(anteromesial temporal resection)에서도 수술에 의한 주요 합병증은 3% 정도 발생한다. 그러나 난치성 뇌전증 환자의 수술에서 수술 중 신경계감시를 통해 가역적인 변화를 초기에 확인하여 교정하여 합병증을 낮출 수 있다고 확인되었지만 아직 보편적으로 이용되고 있지 못하다[1]. 또한 손상 원인 중 뇌혈관손상에 따른 뇌경색을 수술 중 신경계감시로 확인한 보고는 없다.
저자들은 뇌전증 수술에서 수술중 신경계감시를 시행하였고, 이를 통해 전내측두엽절제술 동안 발생한 뇌경색을 조기에 확인하였다. 이러한 뇌경색은 뇌전증 수술 이외에도 뇌종양 수술, 동맥류 수술, 경동맥 수술 등 다양한 수술에서 발생할 수 있으며[1-4], 특히 본 증례와 같이 수술 중 출혈을 전기소작하는 과정에서 뇌경색이 발생할 수 있는 뇌수술에서 수술 중 신경계감시의 유용성을 입증한 증례로 보고하고자 한다.
증 례
1. 임상 소견
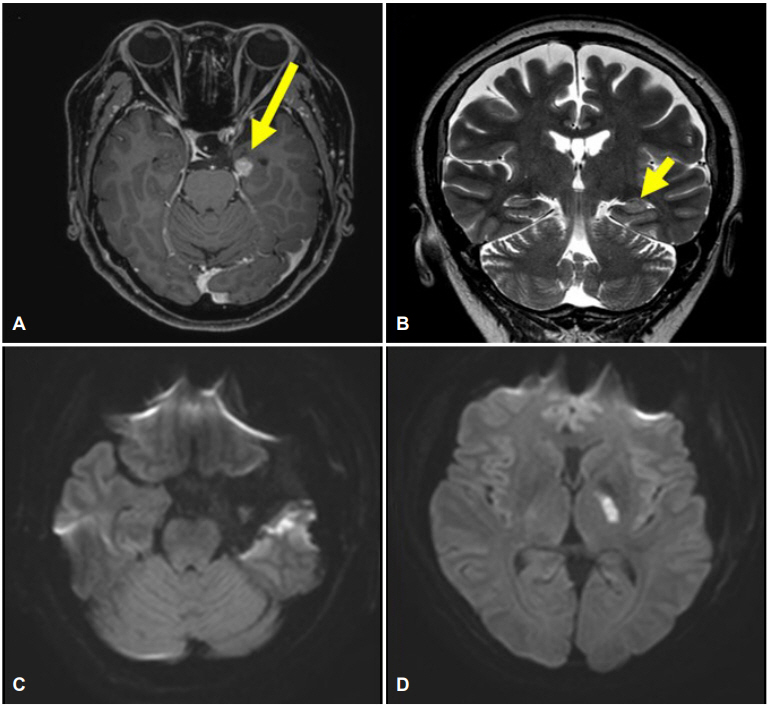
환자는 57세 여자로 27세에 발작할 것 같은 이상한 느낌 후에 멍 하면서, 반응이 없어지고, 입맛을 다시며, 손을 만지작거리는 자동증을 동반하는 복합부분발작이 시작되었다. 이러한 발작은 항뇌전증제 복합요법에도 주 1-2회 발생하였다. 뇌 magnetic resonance imaging에서 좌측 해마와 편도핵에 다초점 T2신호 증가된 군집성 낭종성 병변을 보이며, 선형의 조영증가를 보이고 있고, 좌측 해마 전장에 걸쳐 부어있는 모습을 보였다(Fig. 1-A, B) 비디오-뇌파검사를 6일간 진행하였으며, 발작은 2회 관찰되었는데, 기록된 발작 중 뇌파는 좌측 측두엽 중후반부에서 규칙적인 세타파형을 보이다가 좌반구 전체로 퍼지는 소견을 보였다. 수술 전 신경학적 진찰 소견은 정상이었다.
수술로 일반적인 전내측두엽절제술과 같이 좌측 개두술 후 좌측 전내측두엽을 병변과 함께 절제하였다. 내측두엽 종양 근처부터 뇌의 강도가 정상 조직과 달리 단단하게 느껴졌고, 주위조직과의 분리가 어려웠으며, 내측두엽부위의 뇌막과의 피하박리(subpial dissection)도 어려웠다. 병리 소견은 신경절교종(ganglioglioma)이었다.
2. 수술 중 신경계감시
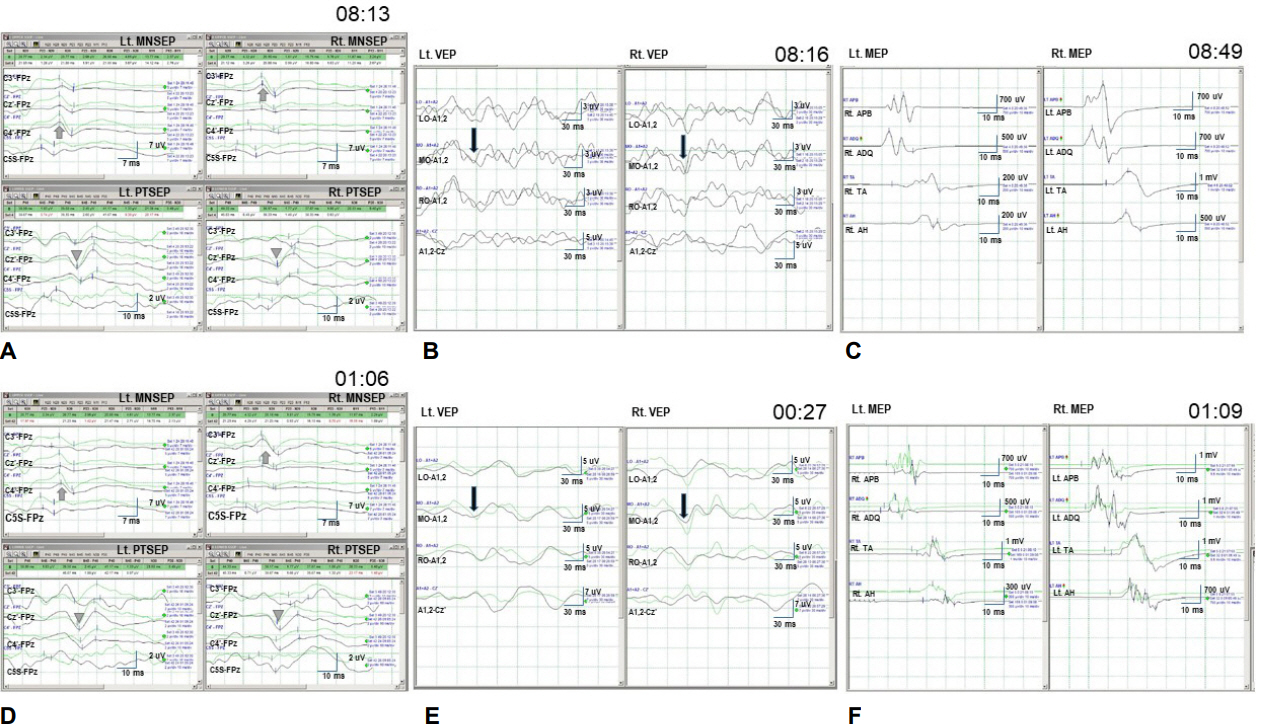
수술 동안 수술 중 신경계감시를 시행하였다(Fig. 2). 마취는 전체전정맥마취(total intravenous anesthesia, TIVA) 방법을 사용하였고, 프로포폴(propofol) 100-140 μg/kg/min, 레미펜타닐(remifentanil) 0.05-0.09 μg/kg/min, 베큐로니움(vecuronium) 0.3-0.9 μg/kg/min를 정맥주사하면서 사연속반응(train-of-four)을 2-3 강도로 유지하였다. 감시 종류는 정중신경 체성감각 유발전위(median nerve somatosensory evoked potentials, MNSEP)와 후경골신경 체성감각 유발전위(posterior tibial nerve somatosensory evoked potentials, PTSEP), 시각유발전위(visual evoked potentials, VEP), 운동유발전위(motor evoked potentials, MEP)를 시행하였다.
체성감각유발전위검사로 MNSEP는 반대측 C3’/4’에서 기록된 N20 파형과 Cz’에서 기록된 P40 파형을 기준으로 하였다. VEP는 LED 고글을 이용하여 자극을 주고, LO, MO, RO, Fz에 설치된 피하전극과 A1-2에 설치된 귀전극을 이용해 기록된 P100 파형을 사용하였다. MEP는 C3와 C4 부위 활동자극전극과 참고자극전극으로 경두개 전기자극을 주었고, 상지는 짧은엄지벌림근(abductor pollicis brevis, APB), 짧은새끼벌림근(abductor digiti quinti, ADQ)에서 하지는 앞정강근(tibialis anterior, TA), 엄지발가락벌림근(abductor halluces, AH)에서 형성된 다극성 복합운동단전위(compound muscle action potentials, CMAP)의 진폭 변화를 감시 기준으로 하였다.
3. 수술 중 신경계감시에서 나타난 변화
수술 시작과 종료에 MNSEP, PTSEP, VEP는 유의한 변화가 없었지만, MEP에서는 종료 MEP는 우측 상하지 CMAP 감소를 보였고, 특히 상지 APB, ADQ에서 CMAP가 감소되었다(Fig. 2). 시간에 따른 좌측 MEP 파형 변화를 보면 22시 30분에 측정한 CMAP는 APB, ADQ, TA, AH 모두 유의한 차이를 보이지 않았다. 그러나 22시 35분에 갑자기 CMAP가 소실되었고, 당시 종양과 주변부위를 박리하면서 출혈이 발생하여, 전기소작으로 출혈을 잡은 직후였다. 종양은 주위조직과 단단히 붙어 있어 내측두엽부위 뇌막과의 피하박리(subpial dissection)에 어려움을 겪었다. 파형소실 후 혈압증강 등의 뇌혈류 개선 처치를 시행하였지만 파형은 회복되지 않았다. 그후 23시 28분에 TA에서 지연된 작은 CMAP가 관찰되었다가 다시 소실되었고, 23시 55분부터 다시 파형이 나타나 호전되기 시작하여 0시 52분에 전과 유사한 파형을 얻을 수 있었다. AH에서는 23시 40분에 일시적으로 파형이 관찰되다 0시 55분경에 다시 파형이 호전되었지만, 다시 감소하여 종료 시점에 전보다 유의하게 감소된 파형을 보였다. 그러나 상지에서 기록된 APB와 ADQ는 일시적인 파형만 관찰되었고, 종료까지 회복되지 못하고 90% 이상 감소된 파형을 보였다(Fig. 3).
4. 수술 후 경과
수술 후 마취 회복 후 환자는 시각, 감각, 언어기능은 정상적이었지만, 우측 편마비, 구음장애와 연하장애를 보였다. 수술 직후 근력은 우측 상지 하지 모두 Medical Research Council (MRC) grade 0이었다. 수술 후 2일이 지나 시행한 확산강조영상에서 좌측 후 내포의 신호가 증가되어 급성 뇌경색 소견이 확인되었다(Fig. 1-C, D). 환자는 포괄적 재활 치료를 시행하였고, 수술 4주 후에는 구음장애와 연하장애는 정상화되었지만, 우측 상지는 MRC grade 0, 우측 하지는 MRC grade 2-3으로 보조기로 보행이 가능한 정도였다. 수술 후 발작은 나타나지 않았다.
고 찰
수술 중 신경계감시는 다양한 뇌, 척수, 신경과 관련된 수술에서 다양하게 이용되고 있지만, 뇌전증 수술 연구 결과는 MEP가 효율적이라는 보고는 있지만, 어떤 감시를 시행해야 할지 명확히 확립되지 않았다[1,5]. 본 증례는 SEP, VEP, MEP를 시행하였고, 우측 MEP는 이상이 없었지만, 좌측 MEP에서 CMAP가 소실되었다. 본 증례에서 좌측 MEP 소실을 보인 이유로는 좌측 MEP만 선택적으로 나타나고 전기소작이 있은 이후에 발생하였고, 수술 후 신경학적 진찰에서 편마비를 보이면서, 뇌 영상에서 내포 급성 뇌경색을 보인 점을 고려한다면 수술 중 운동 경로에 급성 뇌경색이 발생하면서 이루어진 변화일 가능성이 높다. 주변 조직에 견고하게 붙어 있었던 종양을 제거하기 위해 내측두엽 피하박리를 시행할 때 근접해서 주행하는 전맥락막동맥(anterior choroidal artery)이 전기소작술로 손상되었고, 이로 인한 전맥락막동맥 막힘이 발생하면서 뇌경색이 일어난 것으로 볼 수 있다. 따라서 MEP 추적감시는 매우 중요한 신경생리감시 방법이다. 수술 중 발생한 뇌경색 병변은 내포 후반부의 후외측보다는 무릎(genu) 쪽에 가까웠다. 해부학적인 추체로 경로를 고려한다면 뇌 영상의 뇌경색 소견과 MEP에서 종료 결과 상지 CMAP는 나타나지 않고, 하지 CMAP는 약하게 관찰된 상하지 차이 소견과 수술 후 임상과정에서 보이는 상하지 차이 소견은 일치하였다. 이러한 점 역시 수술 중 뇌경색의 조기발견으로 수술 중 신경계감시가 유용하게 사용될 수 있다는 점을 시사한다. 그러나 본 증례에서는 전기생리학적으로 안면마비, 연하장애와 구음장애를 확인하기 위한 검사를 시행하지 못하였고, 안면 MEP(facial MEP)와 피질-구 MEP (corticobulbar MEP)를 추가적으로 시행하는 것도 도움이 될 것으로 생각된다[6,7].
MEP에서 뇌자극은 국소적, 반구내 그리고 반구간 자극으로 구분할 수 있다[8]. 반구간 자극에서는 자극 강도에 따라 자극되는 부위가 운동피질, 내포, 추체로 교차부위, 대공(foramen magnum)까지 이루어질 수 있다고 하였다[9,10]. 그러나 본 증례에서는 400 volt 강도, 0.2 msec 기간의 자극 펄스를 2 msec 간격으로 5회 연속으로 자극하였고, 내포에서 발생한 병변을 확인할 수 있었다. 따라서 C3-C4 반구간 자극에 의해서 자극된 부위는 내포 이상에서 이루어진다고 볼 수 있으며, 상지와 하지의 파형이 기초 결과부터 상지의 APB, ADQ에서는 500에서 700 μV인데 비해 하지의 TA와 AH에서 200 μV로 작게 기록되었다. 이러한 상하지 반응 차이는 대뇌피질 일차운동영역과 그 하방 주행 경로인 추체로에 전달되는 전기 자극이 차이가 나면서 발생하는 것으로 생각할 수 있다. 특히 추체로가 밀집하는 내포와 그 이하보다는 그 이상의 부채살 경로까지 전기 자극이 이루어져야 상지와 하지의 반응이 다르게 나타날 수 있을 것이다. 또한 본 증례와 같이 내포의 뇌경색으로 파형이 소실된다면 MEP는 부채살 이상에서 주로 자극이 이루어지는 것으로 볼 수 있다. 따라서 본 증례는 과거 언급된 피질하 자극 추정부위에서 대뇌 부채살부위가 주로 자극된 것을 처음 입증한 증례로 볼 수 있다. 단 부채살의 자극으로 아주 미약한 파형이 상지에서도 있었던 것은 뇌경색으로 불안전한 축삭손상이 있을 수 있고 이로 일한 불완전 흥분일 것으로 판단된다.
뇌경색과 관련된 전기생리학적 변화에서 앞맥락막동맥 경색이 발생하는 과정에서 전기생리학적 검사가 보고된 적은 없다. 본 증례에서는 전기소작 직후 내맥락동맥손상으로 내포에 혈류 차단이 발생하고 바로 상지와 하지로 가는 전기 자극도 차단되었다. 그후 1시간이 지나면서 다극성 CMAP의 잠복기가 느려지면서 단독성으로 단순한 파형이 자극에 따라 간헐적으로도 나타나며, 다극성 파형을 만들 때도 초기 파형보다는 후반기 파형의 진폭이 크면서 회복되다가 1시간 40분 지나서 얻은 종료 무렵의 파형에서는 하지는 회복되었지만, 상지는 현저히 저하된 기록 위치에 따른 파형 변화를 보였다. 환자는 마취 회복 후 편마비를 보였지만, 전기생리학적으로는 하지부위의 경로는 1시간 정도 차단되었다가 회복된 것으로 보아 운동기능도 하지는 회복될 수 있을 것으로 예측할 수 있었다. 재활 치료를 받으면서 걸을 수 있는 보행이 가능한 것을 고려하면 전기생리학적 회복은 향후 기능적 호전을 예측할 수 있는 중요한 증거로 고려할 수 있을 것이다. 그러나 상지에서 종료 시에 미약한 파형이 관찰되었는데, 환자는 상지는 전혀 움직이지 못하였다. 이러한 점은 뇌경색에 의한 전기생리학적 차단이 관찰되고 미약한 파형이 이루어져도 기능적인 회복을 이루기에는 미약할 수 있다는 것을 시사한다고 볼 수 있다.
본 증례는 내측두엽 수술에서 종양절제 과정에서 전기소작으로 발생한 내포 후반부 경색을 수술 중 신경계감시를 통해 발생 당시 조기 확인하였고, 내측두엽절제 수술에서 수술 중 신경계감시, 특히 MEP 추적 관찰의 중요성을 입증한 증례이다.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print




