| J Korean Neurol Assoc > Volume 39(4); 2021 > Article |
|
Abstract
Cerebral infarction in cancer patients is often caused by thrombosis due to hypercoagulability, and in some cases, caused by direct tumor embolism. We report the case of cerebral infarction due to direct tumor embolism mixed with thrombus. Biopsy of blood clots obtained during thrombectomy is important for diagnosis. If there is a high risk of thrombosis among cancer patients with cerebral infarction, the use of appropriate antithrombotic agents along with maintaining a certain level of platelets should be considered.
암과 뇌경색은 노인에서 사망 원인으로 많은 비중을 차지하고 있다. 암환자의 15%는 동반된 뇌혈관질환이 있으며, 뇌경색 환자의 1/7-1/8은 동반된 암이 있는 것으로 알려져 있다[1]. 암이 동반된 환자의 뇌경색은 일반적인 뇌경색과 같은 원인(대혈관질환에 의한 뇌경색, 심장색전성 뇌경색, 소혈관성 뇌경색)으로 발생하는 경우도 많지만, 암과 관련해서 혈관내 응고 항진(intravascular coagulopathy), 판막에 가해지는 빠른 혈류 스트레스(high flow stress)에 의한 비감염심내막염, 동반된 열린타원구멍과 심부정맥혈전증으로 인한 색전증, 그외 직접적인 종양의 침범이나 색전, 항암 치료나 방사선 치료와 관련된 내피세포 손상이나 혈관병증 등이 원인으로 작용하게 된다[1-3].
저자들은 심장 전이가 있는 갑상샘암 환자에서, 종양의 직접색전과 동반된 혈전으로 인해 뇌경색이 발생한 증례를 경험하여 보고하고자 한다.
49세 여성 환자가 갑자기 발생한 좌측 편마비를 주소로 신경과에 입원하였다. 환자는 1년 전 좌측 골반뼈와 폐의 암 전이를 동반한 유두갑상샘암종이 확인되어 좌측 골반에 방사선 치료 및 방사성동위원소 치료(radioactive iodine therapy 200 mci 2회)를 시행하였으나, 호전 없어 치료저항성으로 판단 후 lenvatinib을 이용한 항암 치료를 고려하였다. Lenvatinib 사용 전 심장기능 확인을 위해 심장 초음파검사를 시행하였고, 좌심실에 선형 모양을 가진 유동성이 큰 종괴가 확인되었다(Fig. 1-A). 기저질환을 고려하였을 때 종양의 전이 가능성, 응고병증에 의한 혈전 가능성을 고려하였고, 이에 헤파린 정맥주입을 시작하였다. 일주일 뒤 종괴의 크기가 감소하였고(Fig. 1-B), 항응고 치료에 호전을 보여 전이보다는 혈전의 가능성이 높을 것으로 판단하였다(Fig. 1-B). 와파린으로 항응고제를 변경하였으나 일주일 뒤 심초음파에서 종괴의 크기가 다시 증가하였고(Fig. 1-C), 저분자량 헤파린(dalteparin)으로 변경하였으나 변경 3일 뒤부터 혈소판이 감소하기 시작하였으며, 저분자량 헤파린을 시작한 뒤 2주째에 심장의 종괴의 크기가 증가하였음에도 불구하고(Fig. 1-D) 혈소판 28×103/μL로 확인되어 항응고제를 중단하였다.
그로부터 2일 뒤 환자는 갑작스러운 흉통으로 응급실에 내원하였고, 시행한 관상동맥 컴퓨터단층촬영(computed tomography, CT)에서 색전으로 인한 좌전하행관상동맥의 부분 폐색, 심근효소의 상승(CK-MB 68.9 ng/mL, troponin-I 13.796 ng/mL)이 동반되어 확인되어 심장내과에 입원하였다. 동반된 혈소판감소증을 고려하였을 때 혈전제거술 및 항혈전제는 위험성이 있어 시행하지 못하였다.
환자 입원 2일째 갑작스러운 좌측 편마비와 함께 구음장애가 발생하여 신경과에 의뢰되었다. 신경계진찰에서 기면, 좌측 편마비, 편측무시, 좌측 안구편향이 확인되어 National Institutes of Health Stroke Scale 17점이었다. 뇌 비조영증강전산화단층촬영(CT)에서 출혈 소견은 없었으나 혈소판감소증으로 정맥내조직 플라스미노젠활성제는 투입하지 못하였다. 뇌 자기공명영상(magnetic resonance imaging)에서 우측중대뇌동맥 영역에 뇌경색이 확인되었고(Fig. 2-A, B), 우측중대뇌동맥 근위부 폐색이 관찰되었다(Fig. 2-C). 이에 대해 기계적 동맥내혈전제거술을 시행한 뒤 재관류되었다(Thrombolysis in Cerebral Infarction 2b) (Fig. 2-D). 시술 이 후 편측무시, 좌측 안구편향은 호전되었으나 편마비는 호전되지 않았다. 뇌경색 발생 당일의 D 이합체(D-dimer)는 8.3 µg/mL로 상승해 있었다. 혈소판 30×103/µL 미만으로 지속적으로 낮아 환자는 항혈전제를 사용하지 못하였다. 혈소판감소증의 원인으로는 암에 의한 응고병증, 이전 골반부위의 방사선 치료로 인한 생성저하를 고려하였고, 항헤파린/platelet factor 4 항체 IgG 음성으로 헤파린 유발 혈소판감소증 가능성은 낮을 것으로 판단하였다.
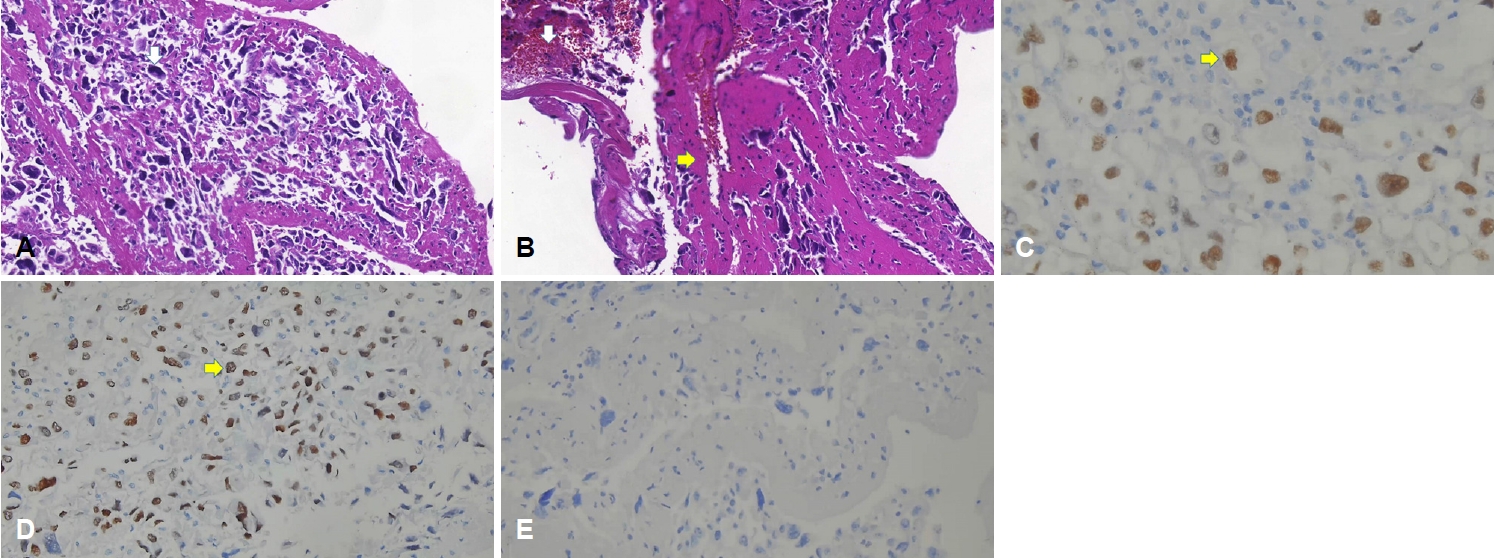
혈전제거술 당시 백색 혈전이 확인되었고, 조직검사에서 그 크기가 매우 크며 핵들의 크기가 상이한 세포들이 확인되었다(Fig. 3-A). 면역화학염색시 paired box gene 8 양성(Fig. 3-C), thyroid transcription factor 1 양성(Fig. 3-D), thyroiglobulin 음성(Fig. 3-E)으로 미분화갑상샘암이 확인되었다. 또한 적혈구와 섬유소가 섞인 혈전성분도 같이 동반되어 있었다(Fig. 3-B). 유두암의 미분화암으로의 변화가 확인되어 예후가 좋지 않을 것으로 판단하였다. 심장 초음파 추적검사에서 종괴의 크기가 감소하여(Fig. 1-E) 여기에서 발생한 색전증에 의해 뇌경색이 발생한 것으로 판단하였고, 심장의 병변은 갑상샘암의 심장전이에 혈전이 동반된 것으로 판단하였다(Fig. 1-E).
일주일 뒤 환자는 의식저하, 구토와 함께 새로 우측 편마비, 좌측 안구 편위가 발생하였고, 새로운 뇌경색 또는 뇌출혈이 발생하였을 가능성을 고려하여 뇌 영상검사를 시행하려고 하였으나, 산소포화도 저하와 함께 혈압 감소가 발생하여 사망하였다.
본 증례는 갑상샘 암의 좌심실 전이와 해당 부위에 암 관련 혈관 내 응고병증으로 인한 혈전이 동반되어 있던 환자에서 종양의 직접색전에 의한 뇌경색이 발생한 증례이다. 큰 혈관 폐색으로 인해 동맥내혈전제거술을 시행하였고, 이를 통해 얻어낸 색전의 병리를 분석해서 갑상샘암의 전이와 암종의 변화, 이차적인 혈전증을 진단해 낼 수 있었다.
암이 색전성 뇌경색을 일으킬 때에는 혈관내 응고병증, 기이성색전증 그리고 비감염심내막염을 우선 고려하게 된다[1]. 종양의 직접색전에 의한 색전성 뇌경색[2-4]은 드물기 때문에 원인으로 고려되지 못하는 경우가 많다. 종양의 직접색전에 의한 뇌경색은 심장점액종/육종 등 원발성 심장종양에 의해 발생하는 경우가 가장 흔하며, 전이성 암에 의해 발생하는 경우는 상대적으로 적다[3,4]. 전이성암에 의한 직접색전에 의한 뇌경색은 33년간 Mayo-Clinic에서 조사한 부검 문헌에서 단 7개의 증례만 보고되었다[3]. 본 증례에서는 심장초음파에서 확인되었던 병변이 환자의 암에 동반된 응고병증에 의한 혈전일지, 혹은 갑상샘암의 심장 전이일지 의문이 있었다. 뇌경색 발생 후 동맥내혈전제거술 및 조직검사를 통해 미분화갑상샘암종 성분과 혈전이 섞인 색전을 확인할 수 있었다. 이를 통해 심장에 있던 병변은 암의 전이이며, 여기에 응고병증에 의한 혈전이 동반되었고 적절한 항응고 치료를 시행하지 못하며 크기가 빠르게 커졌을 것으로 추론하였다.
암환자의 정맥혈전색전증에서는 와파린보다 저분자량 헤파린을 사용하는 것이 권고되고 있다. 이러한 사실을 근거로 암환자의 뇌경색에서도 저분자량 헤파린을 사용하는 경우가 많다. 최근에는 apixaban 등의 비타민 K 비의존경구항응고제(non-vitamin K antagonist or al anticoagulant, NOAC)의 사용도 low molecular weighted heparin과 비교해서 열등하지 않다는 연구 결과가 있어, 주사제의 불편감 등을 고려하여 NOAC의 사용을 권고하기도 한다[5]. 그러나 암환자는 질환 자체에 의한 응고병증, 항암제에 의한 부작용 등의 여러 이유로 혈소판감소증이 동반되는 경우가 많은데, 이는 출혈의 위험도를 증가시키나, 암에 의한 혈전증의 위험도를 감소시키지는 않는다[6]. 따라서 본 증례처럼 항혈전제가 필요함에도 불구하고 혈소판감소증으로 인해 제한이 있는 경우가 흔히 발생한다.
일반적으로 혈소판 숫자가 50×103/uL 이상일 경우 상용량의 항응고제 사용이 권고되며, 25-50×103/uL인 경우 50% 감량한 용량이, 25×103/uL 미만인 경우 약제 중단이 권고된다[7]. 급성(30일 이내)의 암 관련 혈전증이 있으면서, 증상을 유발하는 폐색전증이나 심부정맥혈전증을 동반하거나, 진행하는 혈전증의 병력이 있는 등 혈전의 진행 위험도가 큰 경우 혈소판 수혈을 진행하며 상용량의 항응고제를 사용하는 것이 권고된다[7]. 혈소판감소증을 동반한 암환자의 뇌경색에서 아스피린을 사용하는 것에 대해서는 아직까지 정립된 가이드라인은 없다. 뇌경색처럼 동맥성 혈전증에 의해 발생하는 급성관상동맥증후군의 경우, 2016년 미국심혈관중재시술학회(The Society for Cardiovascular Angiography and Interventions)에서 혈소판감소증이 있으면서 급성관상동맥증후군이 동반된 암환자의 경우 혈소판 수치가 10×103/uL 이상일 경우에도 아스피린 사용을 권고하기도 하는 등[8] 혈전의 위험성을 고려하였을 때 투약기준을 낮출 필요성은 꾸준히 제기되고 있다.
활동성 암이 있는 환자에서 발생한 뇌경색의 색전 성분은 심방세동에 의한 색전에 비해 혈소판 성분이 많고 적혈구 성분이 적은 것으로 알려져 있다. 이는 비감염심내막염에서 발생하는 색전의 성상과 유사하다[9]. 혈소판성분의 비율이 높은 혈전은 판막 주위처럼 혈류속도가 높은 환경에서 만들어지는 것으로 생각된다. 이는 백색 혈전을 형성하게 된다. 암과 관련된 뇌경색 또한 대혈관질환에 의한 뇌경색과 동일하게 혈소판의 비율이 높은 백색 혈전이 주로 확인된다는 점, 암환자에서 혈소판감소증이 동반되어 항응고 치료에는 제한이 있는 경우가 많다는 점을 고려하였을 때 아스피린과 같은 항혈소판제를 사용해서 이차 예방을 하는 것을 항응고제의 대안으로 고려해볼 수 있다. 최근 한 소규모의 전향성 파일럿 연구에서는 아스피린과 항응고제로 치료한 암환자군에서 반복적인 혈전색전증이 발생하는 비율에 유의미한 차이가 없다는 결과를 보여주었다[10].
본 증례는 두 가지 중요한 의의가 있다. 첫 번째로, 암환자에서 색전성 뇌경색이 발생하였을 때 종양의 직접색전 또한 원인으로 고려할 수 있으며, 동맥내혈전제거술을 시행하였을 때 조직검사를 통해 얻어진 색전의 성상을 확인하는 것이 중요하다. 본 증례에서는 이 과정을 통해 암이 심장에 전이되었다는 것과 본래는 유두갑상샘암종으로 확인되었던 암이 미분화갑상샘암으로 변화한 것을 확인할 수 있었고, 예후가 더욱 좋지 않을 것임을 예측할 수 있었다. 두 번째로, 얻어진 조직에서 암 조직뿐 아니라 혈전이 동반되었으며 항응고 치료를 시행하였을 때 심장의 종괴의 크기가 줄어들었던 점을 고려하였을 때, 암의 직접색전에 의한 뇌경색이라 하더라도 항응고제가 도움을 줄 수 있다. 또한 암환자는 여러 이유로 혈소판감소증이 동반되는 경우가 많으나, 그럼에도 혈전증의 진행 위험성이 높은 경우에는 일정 수준 이상의 혈소판 유지와 함께 적절한 항혈전제 사용을 고려해야 한다.
REFERENCES
1. Bang OY, Chung JW, Lee MJ, Seo WK, Kim GM, Ahn MJ, et al. Cancer-related stroke: an emerging subtype of ischemic stroke with unique pathomechanisms. J Stroke 2020;22:1-10.



2. Lee DK, Lee MA, Hwang BW, Lee CJ, Lim SC, Ha SW, et al. Acute cerebral artery occlusion by direct tumor embolus. J Korean Neurol Assoc 2021;39:30-33.

3. O’Neill BP, Dinapoli RP, Okazaki H. Cerebral infarction as a result of tumor emboli. Cancer 1987;60:90-95.


4. Lemus HN, Lu C, Shoirah H, Shigematsu T, Liang J, Van Denakker T, et al. Direct tumor embolism presenting as an acute ischemic stroke. Neurol Clin Pract 2019;9:490-493.



5. Agnelli G, Becattini C, Meyer G, Muñoz A, Huisman MV, Connors JM, et al. Apixaban for the treatment of venous thromboembolism associated with cancer. N Engl J Med 2020;382:1599-1607.


6. Cortelezzi A, Moia M, Falanga A, Pogliani EM, Agnelli G, Bonizzoni E, et al. Incidence of thrombotic complications in patients with haematological malignancies with central venous catheters: a prospective multicentre study. Br J Haematol 2005;129:811-817.


7. Samuelson Bannow BT, Lee A, Khorana AA, Zwicker JI, Noble S, Ay C, et al. Management of cancer-associated thrombosis in patients with thrombocytopenia: guidance from the SSC of the ISTH. J Thromb Haemost 2018;16:1246-1249.


8. Iliescu CA, Grines CL, Herrmann J, Yang EH, Cilingiroglu M, Charitakis K, et al. SCAI expert consensus statement: evaluation, management, and special considerations of cardio-oncology patients in the cardiac catheterization laboratory (endorsed by the Cardiological Society of India, and sociedad Latino Americana de Cardiologıa intervencionista). Catheter Cardiovasc Interv 2016;87:E202-E223.


Figure 1.
Transthoracic echocardiography (TTE). (A) Initial TTE showed hypermobile linear mass (white arrow) at left ventricle. (B) Seven days later after low molecular weighted heparin (LMWH) started, size of mass (white arrow) decreased. (C) After changing LMWH to warfarin, size of mass (white arrow) increased. (D) Changed warfarin to LMWH, but size of mass (white arrows) increased. (E) After causing cerebral embolic infarction, size of mass (white arrow) decreased.
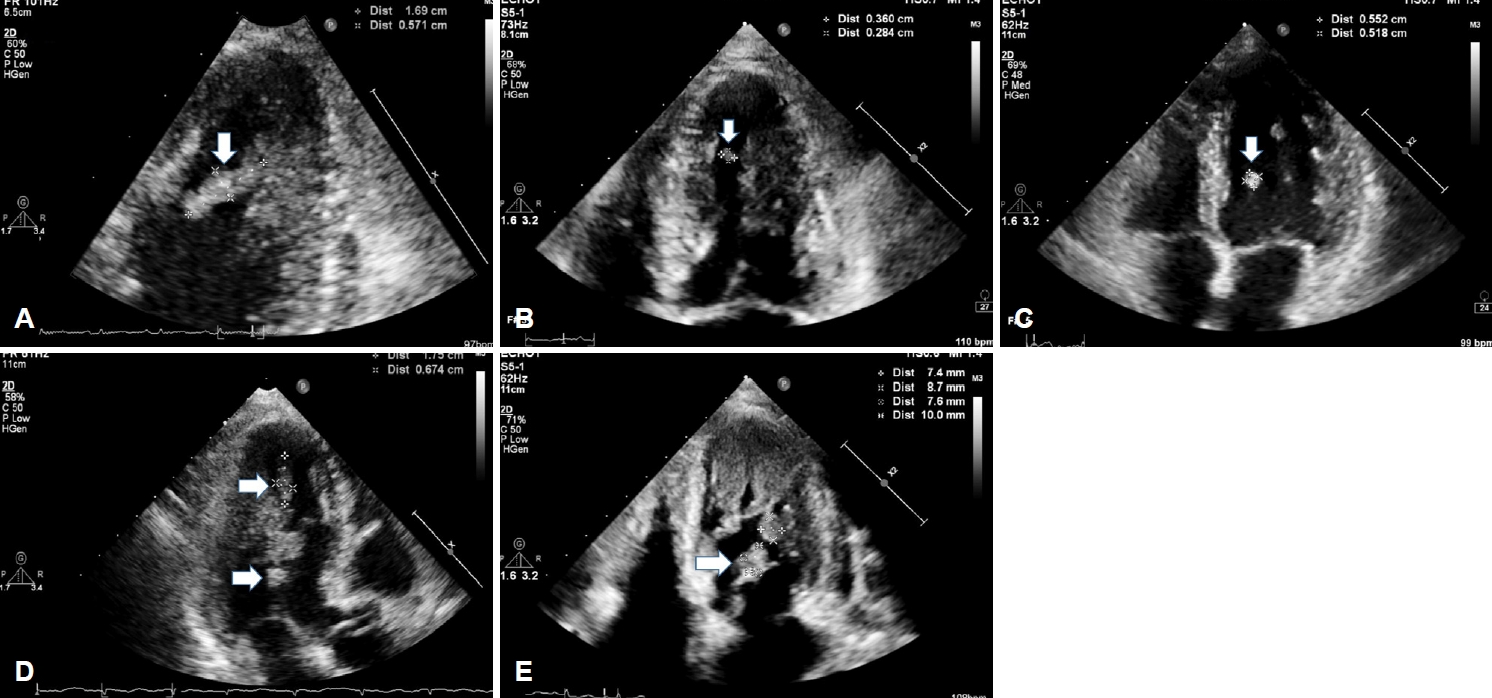
Figure 2.
Right middle cerebral artery (MCA) cerebral infarction. (A) Diffusion-weighted magnetic resonance imaging shows right MCA infarction. (B) Time to peak map shows perfusion delay of the right MCA territory. (C) Angiography shows right proximal M1 occlusion. (D) After thrombectomy, the vessel recanalized (Thrombolysis in Cerebral Infarction 2b).
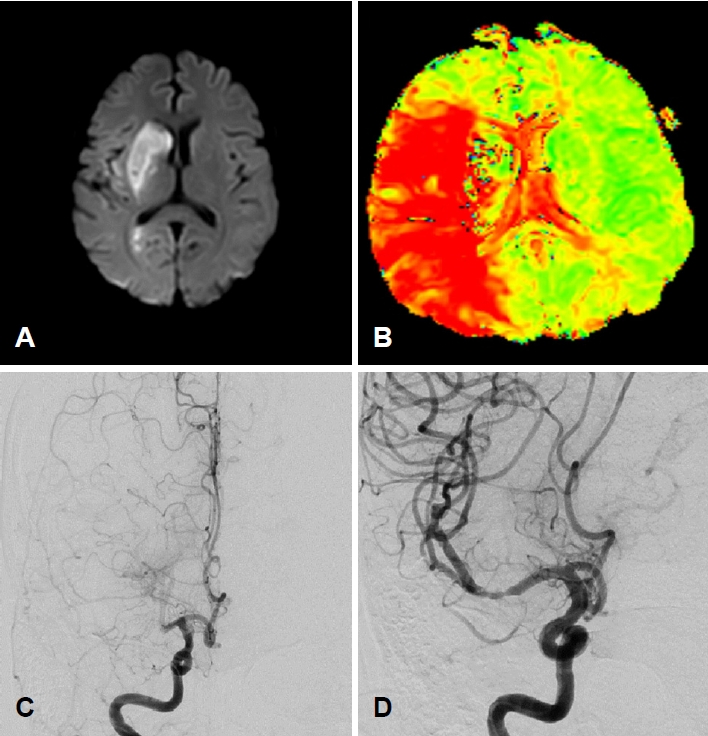
Figure 3.
Histopathologic findings of clots. (A) Hematoxylin-eosin staining (×400) reveals giant cells (white arrow) which have nuclear pleomorphism, suggesting undifferentiated carcinoma (B) and combined thrombus containing red blood cells (white arrow) and fibrins (yellow arrow). (C) Paired box gene 8 staining (×400) and (D) thyroid transcription factor 1 staining (×200) reveals that these tissues are originated from the thyroid gland (yellow arrow). (E) Negative results of thyroglobulin staining (×200) suggests that the tissues are components of anaplastic thyroid carcinoma.
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 1,076 View
- 54 Download
- Related articles
-
Recurrent Cerebral Infarction Associated with Uterine Adenomyosis2022 May;40(2)
Acute Cerebral Artery Occlusion by Direct Tumor Embolus2021 February;39(1)
Cerebral Infarction Caused by Painless Aortic Dissection2018 November;36(4)
Posterior Cerebral Artery Infarct Complicated by Bacterial Meningitis2011 ;29(2)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



