| J Korean Neurol Assoc > Volume 39(3); 2021 > Article |
|
Abstract
Cerebral intraventricular hemorrhage (IVH) is an extremely rare complication of carotid artery stenting (CAS). Fully dilated terminal arteries of a chronic, severely stenosed proximal artery could be ruptured by impaired autoregulation of cerebral blood flow. Hyperperfusion syndrome can occur even if there is no blood pressure fluctuation during the CAS. We report a case of an isolated IVH that occurred hours after CAS.
경동맥 협착에 의해 대뇌의 관류저하가 발생하면 일과성뇌허혈이나 뇌경색이 발생하며, 이에 대한 치료로 혈관성형술이나 스텐트삽입술은 효과적인 수단이다[1]. 그러나 혈류가 개선된 후 혈압이 높게 유지되면 자동 조절능력이 저하된 혈관에서 과관류증후군이 발생할 수 있다[2,3]. 과관류증후군은 주로 뇌출혈이나 지주막하출혈의 형태로 발생하며, 단독뇌실내출혈은 세계적으로 드물다[4]. 저자들은 경동맥협착에 의한 뇌경색 환자에서 혈관재개통 이후 단독으로 뇌실내출혈이 발생한 환자를 경험하였기에 이를 보고한다.
62세 남자가 내원 1일 전부터 말이 어눌하고 좌측 반신의 근력이 감소하여 병원에 방문하였다. 내원 시 촬영한 뇌 자기공명영상에서 우측 중대뇌동맥 영역의 경계부위뇌경색(borderzone infarction)이 발견되었고, 경동맥초음파검사에서 우측 내경동맥 근위부에 동맥경화반이 관찰되며 최대협착 부위의 최대수축기혈류속도가 22.4 cm/s로 폐색직전(near occlusion)을 시사하는 소견이 있었다. 10개월 전 타 병원에서 뇌경색을 진단받았으나, 자의로 약물을 중단한 상태였다. 40갑년의 흡연자였고 일주일에 7병 이상의 알코올을 섭취해왔다.
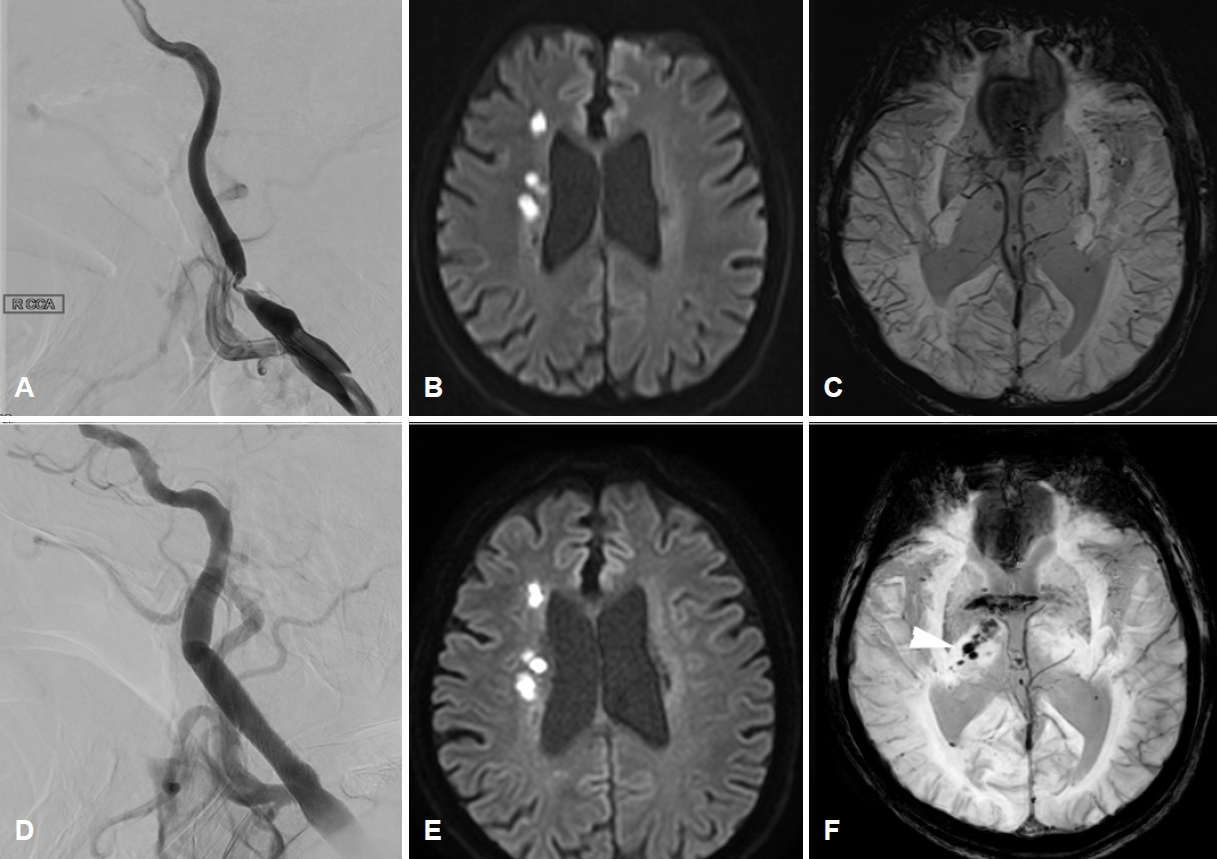
초기 활력징후는 혈압 177/80 mmHg, 맥박 64회/분, 호흡 20회/분, 체온 36.4℃였다. 신경계진찰에서 의식 수준과 내용, 언어이해력, 따라 말하기, 이름대기 기능은 정상이었으나, 심한 구음장애 때문에 유창함이 현저히 감소해 있었다. 뇌신경진찰에서 좌측에서 중추안면마비가 관찰되고, 경도의 삼킴곤란이 있었다. 안구나 혀, 목젖의 편위는 관찰되지 않았다. 좌측 상하지의 근력은 Medical Research Council 4등급이었고 좌측 상하지의 통각이 감소되어 있었다. 양측 바빈스키 징후는 음성이었다. 초기 National Institutes of Health 뇌졸중척도는 9점이었다. 혈액내 혈소판은 263×103개/µL (정상치 150×103-450×103개/µL), 활성화부분트롬보플라스틴 시간은 24초(정상치 20-36초), 프로트롬빈 시간-국제정상화비율은 0.99 (정상치 0.88-1.20)였다. 뇌경색 발생 3일째 시행한 대퇴동맥경유뇌혈관조영술에서 우측 경동맥 근위부에 North American Symptomatic Carotid Endarterectomy Trial 기준 90%의 협착을 확인하였다(Fig. 1-A). 뇌경색의 원인은 경동맥의 큰동맥죽경화증을 우선적으로 고려하여 아스피린과 클로피도그렐 두 가지 항혈소판제와 고용량 스타틴을 투약하기 시작하였다. 뇌경색 발생 4일째, 구음장애, 삼킴곤란이 악화되는 양상을 보여 시행한 확산강조영상에서 우측 중대뇌동맥 영역의 경계부위뇌경색이 진행하는 소견을 보여 당일 혈관내 치료를 시행하였다(Fig. 1-B). 환자의 체중은 입원시 45 kg으로 대퇴동맥천자 후 헤파린 2,000단위를 정맥으로 투여하였다. 시술 중 심한 협착 및 저항으로 색전예방장비(embolic protection device, EPD)를 협착 부위 원위부로 올리는데 실패하여, microwire (Transcend 300-cm exchange-length 0.014-inch microwire; Boston Scientific, Marlborough, MA, USA)를 우선 내경동맥 원위부에 안전하게 위치시켰다. 내경동맥 원위부의 직경 4.2 mm, 총경동맥 원위부의 직경 7 mm로 측정되어, EPD 없이 풍선혈관성형술 Sterling balloon catheter (Boston Scientific Corporation, Natick, MA, USA) 4×40 mm를 시행 및 스텐트 설치술 6-8×40 mm (Abbott Vascular; Abbott Park, IL, USA)를 시행하였다. 이후 Emboshield Embolic protection device (Abbott Vascular, Santa Clara, CA, USA)를 내경동맥 원위부에 위치시킨 뒤, 추가적인 풍선혈관성형술을 시행하였다(Fig. 1-D). 혈압과 맥박은 대퇴동맥 천자 직후 186/84 mmHg, 88회/분이었고 풍선혈관성형술 직전에 라베탈롤을 투여하여 149/80 mmHg, 80회/분까지 조절되었다. 시술 직후에는 142/82 mmHg, 90회/분으로, 큰 차이가 없었다. 경동맥소체반사(carotid body reflex)가 충분이 발생하지 않았다고 판단하여 라베탈롤을 정주한 뒤 니카르디핀을 정맥내 지속투여함으로써 수축기 혈압은 약 100 mmHg, 평균동맥압은 약 60 mmHg으로 조절되었다. 시술 후 환자는 경미한 오심을 호소하였으나, 신경계진찰 소견의 변화는 없었다. 시술 직후 촬영한 확산강조영상에서 새로 생긴 뇌경색이나 혈관성부종의 소견은 없었으나(Fig. 1-E), 자화율강조영상(susceptibility weighted imaging)에서 우측 시상과 뇌실막하공간에 불규칙한 모양의 출혈성 병변을 시사하는 저신호강도가 새롭게 관찰되었다(Fig. 1-C, F).
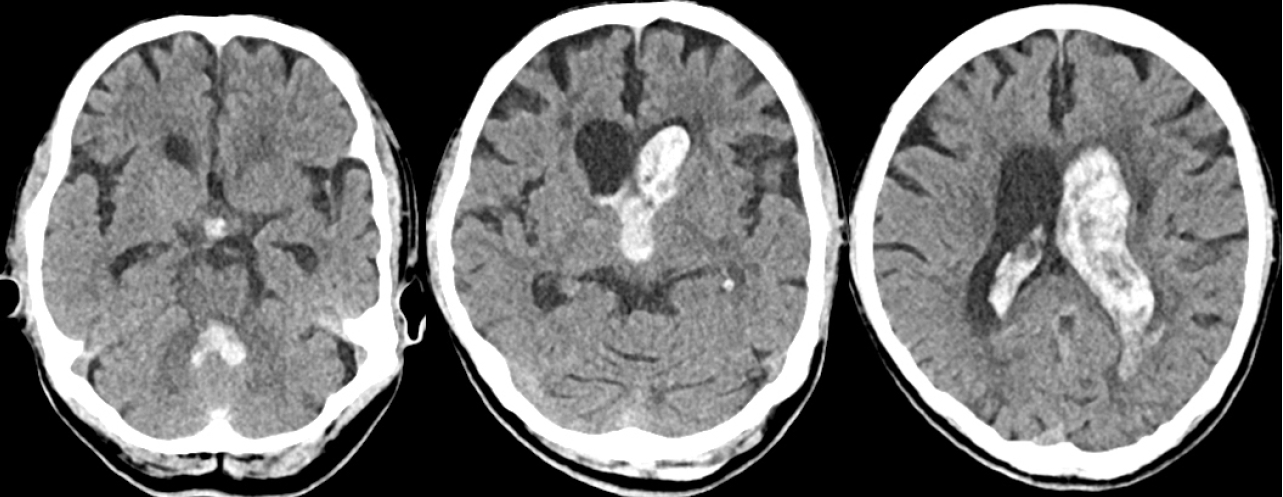
시술 4시간 후 갑자기 의식이 기면으로 저하되었고 이후 혈압과 맥박이 133/65 mmHg, 121회/분까지 상승하였다. 뇌 computed tomography (CT)에서 우측 시상 주변의 미세출혈 소견과 함께 양쪽 측뇌실과 제3, 4뇌실까지 분포한 뇌실내출혈(intraventricular hemorrhage)을 확인하였다(Fig. 2). 신속하게 혈소판농축물과 신선동결혈장을 투여하고, 응급 뇌실외배액술(extraventricular drainage)을 시행하였다. 니카르디핀 정맥주사를 이용하여 수축기 혈압 140 mmHg 이하를 목표로 혈압상승을 억제하였고, 아스피린과 클로피도그렐 복용을 중단하였다. 수술 2주째 뇌 CT에서 뇌실내출혈은 소실되었으며, 환자 재평가에서 의식과 좌측 반신 불완전마비는 회복되었으나, 시술 전부터 관찰되었던 구음장애, 삼킴곤란은 지속되었다.
경동맥의 심한 협착에 의해 발생하는 대뇌의 혈류역학적 관류저하에 대한 치료로 시행되는 풍선성형술 및 스텐트삽입술은 매우 효과적이다[1]. 그러나 심한 협착의 재개통 이후 약 7%에서 과관류증후군 또는 재관류증후군이 발생하고, 약 0.85%에서 병측 대뇌의 뇌출혈 발생 위험이 있다[5]. 과관류증후군은 대부분 뇌경색 부위를 포함한 병변 동측의 뇌내출혈이나 지주막하출혈의 형태로 나타나는 반면, 뇌실내출혈이 단독으로 발생한 사례는 매우 드물다. Ogasawara 등[4]이 4,494명의 경동맥 재개통술에 대한 합병증에 대해 보고하였는데, 뇌실내출혈은 없었으며, 해외에서는 2예가 보고되었으나 현재까지 국내 보고는 없다[6,7].
경동맥재개통술 후 과관류증후군에 의한 뇌내출혈은 상대적으로 흔하여 병태생리가 밝혀져 있으나 환자에서와 같은 뇌실내출혈은 극히 드물어 병태생리가 알려져 있지 않다. 저자들은 본 증례가 뇌내출혈과 같은 병태생리를 공유하는, 과관류증후군에 의한 드문 합병증이라고 평가하였다. 뇌실내출혈은 맥락막동맥(choroidal artery) 또는 중대뇌동맥에서 나온 렌즈핵줄무늬체동맥(lenticulostriate artery)의 분지 등에서 혈류를 공급받는 종말동맥의 파열로 발생한다[8]. 대표적인 종말동맥으로 뇌실막하동맥(subependymal artery)이 있다. 환자의 뇌영상에서 전맥락막동맥의 지배영역인 가쪽 시상과 속섬유막 주변으로 미세출혈이 관찰되었다는 점을 고려하면(Fig. 1-F), 전맥락막동맥에서 분지하는 뇌실막하동맥의 출혈에 의해 뇌실내출혈이 발생하였을 가능성이 높다고 판단된다, 유사한 증례보고에서는 혈관조영술과 부검에서 모두 보이지 않을 정도의 작은 동정맥혈관기형(arteriovenous malformation)이 존재하였을 것으로 추측하였으나, 이에 대한 근거는 제시하지 못하였다[6].
만성적인 고혈압에 의해 혈관 내피 손상이 내재된 상태에서 심한 경동맥협착에 의한 관류저하가 만성적으로 지속되면 원위부 소혈관은 최대 수준으로 확장되어, 정상적인 혈관 자동 조절능력을 상실하고 과관류에 취약한 상태가 된다[2]. 이 때 뇌혈류 감소에 대한 뇌혈관자동 조절(cerebral autoregulation)능력은 대혈관보다는 렌즈핵줄무늬체동맥과 같은 소혈관에서 더욱 변동성이 크기 때문에, 근위부 혈류가 갑작스럽게 개선되면 소혈관에 도달하는 혈류가 과도하게 증가하면서 약화된 소혈관이 파열될 수 있고, 실제로 경동맥 재개통술 후 적절한 혈압 조절을 하지 않을 경우 뇌출혈의 위험성이 증가하는 것으로 알려져 있다[3]. 환자는 시술 전 뇌관류를 유지하기 위해 높은 혈압을 유지하였으며, 시술 직후 경동맥소체 반사(carotid body reflex)가 강하게 발생하지 않아 충분한 혈압 강하가 이뤄지지 않았다. 이에 신속하게 약물로 혈압을 조절하였으나 시술 직후 시행한 뇌 자기공명영상의 자화율강조영상에서는 시술 전 관찰되지 않았던 미세출혈이 우측 시상과 속섬유막 주변으로 관찰되었다(Fig. 1-F).
과거 Suh 등[9]은 경동맥팽대 상방의 내경동맥 근위부에서 풍선성형술이나 스텐트삽입술을 할 경우, 혀인두신경(glossopharyngeal nerve)에서 경동맥소체로 분지되는 sinus nerve of Hering에 의한 압력반사(baroreflex)가 적절히 일어나지 않을 수 있고, 이는 뇌출혈 등 합병증의 위험성을 증가시킨다고 보고하였다. 본 증례의 병변 위치 역시 경동맥팽대 상방에 위치하였으며, 시술 중에는 충분한 압력반사가 발생하지 않았다.
과관류증후군의 알려진 위험인자는 90% 이상의 매우 심한 협착, 뇌혈관예비능(cerebrovascular reserve)의 감소, 시술 후 고혈압, 재개통 후 과관류 상태의 지속 여부 등이 알려져 있으며 저관류에 의한 증상이 있는 협착 같이 시술이 불가피할 경우, 이를 확인하여 적절히 대응해야 한다[3]. 경동맥초음파검사, 경두개도플러검사, 뇌 CT의 시술 전후 비교는 합병증 발생을 예측하고 진단하는데 도움이 될 수 있다[2]. Sahin 등[10]은 심한 경동맥협착에서 경동맥 스텐트삽입술에 앞서 작은 풍선카테터를 사용하여 혈관성형술을 시행 후 단계적인 스텐트삽입술을 하자고 제안하였으나, 이 방법은 침습적인 치료를 반복해야 하고 시술시간이 과도하게 길어진다는 점에서 실제 임상에 적용하기에는 제한이 있다. 따라서 경동맥 재개통술 후 과관류증후군에 대해 현실적으로 가장 효과적인 예방 및 치료법은 엄격한 수축기 혈압 조절로 보인다. 시술 중 또는 시술 후 과관류증후군에 대한 경각심을 갖고 적극적인 혈압 조절을 시행해야 한다. 본 증례에서도 비록 뇌실내출혈이 발생하였으나 신속히 혈압 강하와 뇌실외배액술을 시행하여 환자는 시술 전 상태로 회복될 수 있었다.
결론적으로, 경동맥스텐트삽입술 후 뇌실내출혈은 매우 드문 과관류증후군이다. 매우 심한 협착과 경동맥팽대 상방에 위치한 병변은 시술 후 과관류 발생의 위험을 높일 수 있다. 시술 후 이러한 합병증이 발생할 수 있음을 인지하고 세심한 신경계진찰 및 적극적인 혈압 조절을 해야 하며 합병증 발생 시 신속한 진단검사 및 치료가 필요하다.
REFERENCES
1. Chang HW, Shin SH, Suh SI, Jeong HW, Suh DC. Recommendations for carotid stenting in Korea. Neurointervention 2015;10:7-13.



2. van Mook WN, Rennenberg RJ, Schurink GW, van Oostenbrugge RJ, Mess WH, Hofman PA, et al. Cerebral hyperperfusion syndrome. Lancet Neurol 2005;4:877-888.


3. Moulakakis KG, Mylonas SN, Sfyroeras GS, Andrikopoulos V. Hyperperfusion syndrome after carotid revascularization. J Vasc Surg 2009;49:1060-1068.


4. Ogasawara K, Sakai N, Kuroiwa T, Hosoda K, Iihara K, Toyoda K, et al. Intracranial hemorrhage associated with cerebral hyperperfusion syndrome following carotid endarterectomy and carotid artery stenting: retrospective review of 4494 patients. J Neurosurg 2007;107:1130-1136.


5. Hussain MA, Alali AS, Mamdani M, Tu JV, Saposnik G, Salata K, et al. Risk of intracranial hemorrhage after carotid artery stenting versus endarterectomy: a population-based study. J Neurosurg 2018;129:1522.


6. Krajickova D, Krajina A, Nova M, Raupach J. Fatal intraventricular hemorrhage after the extracranial carotid artery angioplasty and stent placement. Cardiovasc Intervent Radiol 2005;28:502-505.


7. Mori T, Fukuoka M, Kazita K, Mima T, Mori K. Intraventricular hemorrhage after carotid stenting. J Endovasc Surg 1999;6:337-341.


8. Marinkovic S, Gibo H, Filipovic B, Dulejic V, Piscevic I. Microanatomy of the subependymal arteries of the lateral ventricle. Surg Neurol 2005;63:451-458 discussion 458.

9. Suh DC, Kim JL, Kim EH, Kim JK, Shin JH, Hyun DH, et al. Carotid baroreceptor reaction after stenting in 2 locations of carotid bulb lesions of different embryologic origin. Am J Neuroradiol 2012;33:977-981.



10. Sahin M, Yazicioglu MV, Acar G, Demir S, Kalkan ME, Ozkan B, et al. Safety of balloon pre-dilatation in the treatment of severe carotid artery stenosis. Eur Rev Med Pharmacol Sci 2013;17:788-793.
Figure 1.
Neuroimaging study of a patient before and after endovascular treatment for symptomatic carotid stenosis. (A) The initial right internal carotid angiogram demonstrates a 90% stenosis lesion in the apex of the carotid bulb. (B) The initial diffusion-weighted image before the endovascular treatment shows scattered diffusion restriction lesions indicating borderzone infarction of right middle cerebral artery territory. (C) There is no apparent low signal intensity within the right thalamus and periventricular space on the susceptibility-weighted image which is performed before the procedure. (D) Marked improvement of luminal patency and anterograde flow is shown after the stent placement. (E) Post-procedural diffusion-weighted image represents no evidence of a newly developed ischemic lesion or hemorrhage associated with the procedure. (F) Newly appeared are the low signal intensities along the ipsilateral thalamus and subependymal space on the susceptibility-weighted image (white arrowhead), which are regarded as the early sign of intraventricular hemorrhage.
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 1,208 View
- 61 Download
- Related articles
-
CADASIL with Intracerebral Hemorrhage after Acute Ischemic Stroke2022 October;40(4)
Periarterial Abscess in the Carotid Artery Stent2019 August;37(3)
Acute Exacerbation of Neovascular Glaucoma after Carotid Artery Stenting2018 November;36(4)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print