성인의 근육병에서 호흡근의 침범은 보통 질병의 말기에 나타나지만 드물게 질병의 초기부터 발생하기도 한다. 조기 호흡부전을 동반한 선천근육병증(hereditary myopathy with early respiratory failure, HMERF)은 1990년에 Edstrom 등[1]이 처음 보고하였다. 그는 16명의 임상 소견을 정리하여 HMERF 환자들은 발의 등쪽 굽힘근과 목의 굽힘근의 위약을 동반한 팔다리이음근을 침범하며, 증상의 시작부터 아급성으로 진행하는 호흡부전이 동반되었음을 보고하였다. 당시에는 유전자 분석을 할 수 없어 이에 대한 자료가 부족하였다. 이후 유전자 염기서열분석(sequencing) 기술이 발달함에 따라 HMERF 환자에서 TTN 유전자 변이가 발견되었다[2]. 국외에서는 TTN 유전자 변이가 보고되고 있으나 국내에서는 아직 보고되지 않았다. 이에 저자들은 TTN 유전자 변이를 동반한 HMERF 환자를 진단하여 HMERF에 대한 고찰과 함께 보고하고자 한다.
증 례
28세 여자가 진행하는 보행장애로 왔다. 중학교 때부터 달리기가 또래보다 느렸으며 20대 초부터 누워있다가 똑바로 일어나거나 쪼그리고 앉았다가 일어나기가 어려웠다. 20대 중반부터 서서히 보행장애가 진행하여 걸을 때 발의 앞꿈치로 걷게 되었다. 아버지가 젊었을 때부터 자주 넘어졌으나 교통사고로 다리 수술을 받은 후부터 절뚝거리며 걷기 시작하였기 때문에 보행장애는 교통사고의 후유증으로 생각하였다고 한다. 이전에 진단받았던 기저질환은 없었으며 보행장애 외에 호흡곤란이나 삼킴곤란 등의 증상은 없었다.
신경학적 진찰에서 종아리 비대나 척추의 경직은 없었다. 근력 검사에서 어깨의 굽힘과 벌림의 근력이 Medical Research Council (MRC) 3등급이었고, 하지의 근위부는 MRC 4등급, 발목의 등쪽 굽힘이 MRC 1등급으로 측정되었다. 심부건반사는 정상이었으며 병적반사는 나타나지 않았다. 감각기능을 포함한 기타 신경학적 진찰은 정상이었다.
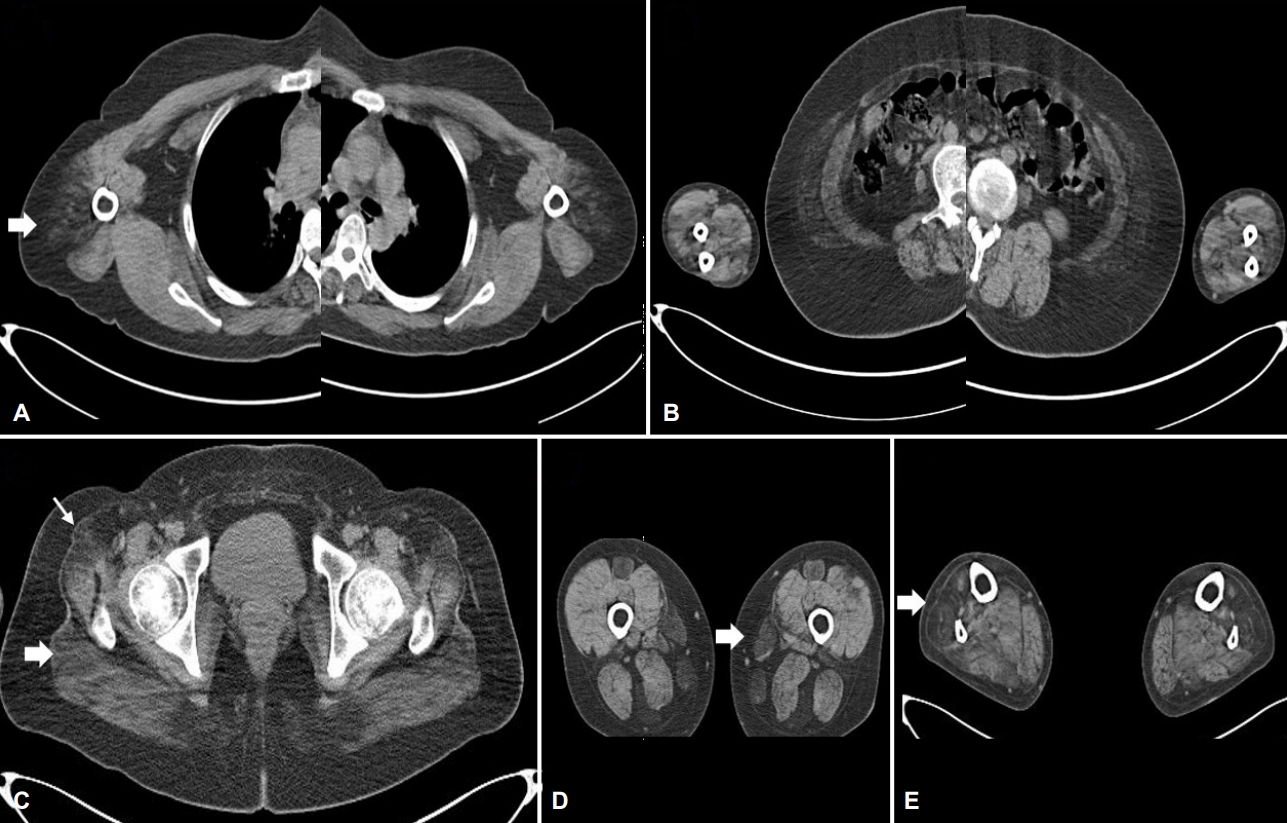
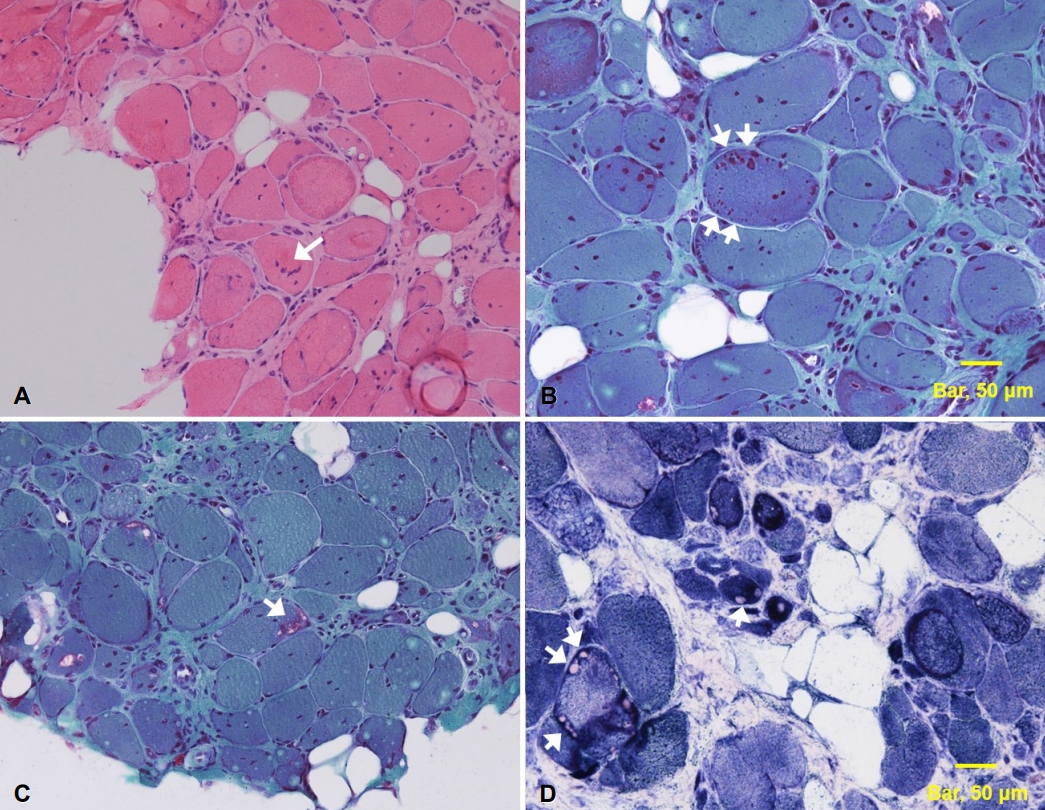
혈청 크레아틴키나아제는 507 IU/L (정상치 43-165 IU/L)로 약간 상승되어 있었으며 간기능검사와 자가면역질환 항체검사는 정상이었다. 폐기능검사에서 강제폐활량(forced vital capacity, FVC)은 2.91 L로 정상치의 72%에 해당하였다. 심전도와 가슴경유 심초음파검사는 정상이었다. 신경전도검사는 정상이었으나 우측의 어깨세모근(deltoid muscle), 장딴지근(gastrocnemius muscle), 앞정강근(tibialis anterior muscle)의 근전도검사에서 섬유자발전위, 양성예파와 근육병성 운동단위전위가 있었고 우측의 깊은손가락굽힘근(flexor digitorum profundus)과 첫째등쪽뼈사이근(first dorsal interosseous)에서 근육병성 운동단위전위가 보였다. 전신 근육 컴퓨터단층촬영에서 양측 어깨세모근, 앞정강근에서 심한 근위축이 있었고, 엉덩허리근(iliopsoas), 중간볼기근(gluteus medius), 두덩정강근(obturator)에서도 근위축이 확인되었다(Fig. 1). 좌측 어깨세모근에서 근육생검을 시행하였으나 근위축이 심하여 병리 소견을 확인하기 어려워 다시 좌측의 장딴지근에서 근육생검을 시행하였다. 헤마톡실린-에오신염색(hematoxylin and eosin stain)에서 근섬유 크기의 변이가 증가하였고 위축섬유가 다수 관찰되었으며 세포사이 질이 현저하게 증가되었다(Fig. 2-A). 트리크롬염색(trichrome stain)에서는 매우 특징적으로 다수의 세포질체(cytoplasmic body)와 가장자리공포(rimmed vacuoles)가 관찰되었다(Fig. 2-B, C). 특히, 세포질체는 근육속막아래(subsarcolemma region)에 여러 개가 관찰되며 근섬유를 원형으로 둘러싸는 형태를 보였다(Fig. 2-B, arrows). Nicotinamide adenine dinucleotide tetrazolium reductase stain (NADH-TR) 염색에서는 근원섬유사이망(intermyofibrillar network)이 붕괴되어 있었고 세포질체가 있는 자리에는 근원섬유가 소실되어 있는 것으로 나타났다(Fig. 2-D). 이에, 근생검을 바탕으로 근원섬유근육병(myofibrillar myopathy)으로 진단하였다. 근원섬유근육병의 원인 유전자를 포함한 근육병 유전자 패널 검사에서 TTN 유전자에서 이형접합 과오돌연변이인 p.C31712R(c.95134T>C, reference sequence NG_011618.3, NM_001267550.1)을 확인할 수 있었다. 이는 국외에서 HMERF의 병인으로 보고된 유전자 변이이다. 보행장애가 있는 환자의 아버지와 증상이 없는 여동생에게 동일한 유전자 변이가 확인되었고 남동생은 유전자 변이가 없었다. 따라서 환자의 돌연변이는 보통염색체 우성 유전을 보이는 것으로 판단하였다.
환자는 진단 후 4개월 경과 시에 빨리 걷거나 움직일 때 숨이 차고 밤에 자꾸 깨어 주간에 피곤함을 호소하였다. 앉은 자세에서의 폐기능검사에서 FVC가 2.51 L (62%)로 확인되었고, 누운 자세에서는 FVC가 1.87 L (46%)로 감소하여 호흡부전이 동반되었음을 진단할 수 있었다. 이후 수면 시 비침습환기를 적용하기 시작하였다.
고 찰
TTN 유전자는 364개의 엑손으로 구성된 인체에서 가장 긴 cDNA이다[2]. 이는 디스트로핀(dystrophin) 유전자로 알려진 DMD 유전자보다 8배 가량 큰 크기이다. 이로부터 발현되는 titin 단백질은 M-band부터 Z-disk까지 이르는 근육원섬유마디의 절반 가량을 차지하는 구조 단백질이다. Z-disk, I-band, A-band, M-band 부분으로 나뉘는데, 각 부분마다 서로 분리된 다양한 기능을 가지게 된다. 근육의 기계적인 기능과 수동적인 긴장에 기여하면서 안정 시의 근육원섬유마디 길이를 결정하고 이를 조절하는 기능을 한다. TTN 유전자의 변이의 위치는 대부분이 A-band이며 M-band에서도 일부 변이가 발견되었다[2]. 본 증례는 titin 단백질 중 A-band의 myosin-binding fibronectin-III에 유전자 변이가 발생하였고, 이는 2012년 스웨덴과 영국의 가족에서 처음 보고된 변이와 같은 변이로 TTN 엑손 344번에서 p.C31712R(g.274375T>C)가 확인되었다[3,4]. 일부 환자에게서는 불완전 우성 유전을 보이는 돌연변이가 발견되기도 하였는데, 프랑스 가족에서는 같은 엑손에서 p.P31709R(g.274367C>G)가 확인되었고[5], 독일과 영국 가계에서는 p.P31732L(g.274436C>T) 변이가 발견되었다[6]. 이들 서유럽 HMERF 환자군에서 가장 흔한 유전자 변이는 p.C31712R이었다[2]. 중국에서도 영국 가족과는 다른 일배체형(haplotype)을 가지는 p.C31712R 변이가 보고되었으며[7], 일본에서도 17명의 환자를 대상으로 한 연구에서 새로운 유전자 변이(p.C31712Y, p.G31791R, and p.G31791V)와 함께 C31712R 변이가 가장 흔하게 발견되었다[8]. 본 증례도 HMERF에서 가장 흔한 p.C31712R 변이가 발견되었으며, 이 변이는 동양인과 서양인 간의 차이는 없는 것으로 보인다.
본 증례는 보행장애의 정도에 비하여 호흡부전이 조기에 발생하였다. 이는 질병 초기 단계에 사지의 위약과 이에 비하여 불균형하게 호흡부전이 동반되는 TTN 유전자의 변이와 연관된 선천근육병의 특징이다. HMERF는 주로 하지의 위약부터 시작하며 목의 굽힘근과 발목의 등쪽 굽힘근 위약이 뚜렷하지만 질병의 초기에 상지는 잘 침범하지 않는 것으로 알려져 있다[2]. 본 증례에서 환자는 발목의 근력저하 외에는 호소하지 않았지만 양측 어깨세모근에 심한 근위축이 있어 질환 초기부터 상지가 침범되어 있었고, 따라서 HMERF의 근력저하는 다양한 형태로 진행할 수 있음을 보여주었다. 최근 HMERF 환자의 보고에서는 근력저하가 비대칭적으로 발생하기도 하며 양측의 등세모근(trapezius)과 앞톱니근(serratus anterior)의 위약으로 인하여 날개어깨뼈가 발생하기도 한다. 일부 환자들에서는 등세모근 위축으로 인한 머리처짐이나 비음증, 경직 척추가 나타나기도 한다. 심장 근육에도 변이가 발생하기도 하나 titin 단백질의 A-band 변이에서 심근병증이 나타나는 경우는 드물다. 삼킴곤란이 나타나기도 하고, 종아리 근육의 비대 또는 위축이 동반되기도 한다. 복부 근육의 약화로 인하여 변비가 발생하기도 한다[2,4,6]. 호흡부전은 기좌호흡이나 운동 시 호흡부전으로 나타난다. 주간 졸음, 아침 두통을 호소하기도 하는데 이는 야간 저환기의 증상들이다. 수면 시 산소포화도 모니터링이나 동맥혈검사에서 고이산화탄소혈증이 진단에 도움이 된다. 또한 본 증례와 마찬가지로 누운 자세와 일어선 자세에서의 폐기능검사를 비교하였을 때, 횡격막의 위약이 있으면 누운 자세에서 FVC가 25% 이상 감소하는 것을 확인할 수 있으므로 호흡부전 증상이 뚜렷하지 않은 환자에서 이를 시행하는 것이 조기 진단에 도움이 된다[2].
혈액검사에서 혈청 크레아틴키나아제는 정상범위이거나 조금 증가한다. 근전도검사에서는 신경원성과 근원성 패턴이 같이 나타날 수 있으나 말초신경병은 동반되지 않는다[1,2]. 근생검 검사에서는 근섬유의 크기가 다양해지고 세포질체가 확인되는 것이 특징이다. 세포질체는 대부분 근육속막(sarcolemma) 안쪽에 있고 본 증례처럼 여러 개의 세포질체가 원형을 이루어 근섬유를 둘러싸기도 한다[8]. 일부 근섬유는 근원섬유사이망이 붕괴되고 테두리공포가 관찰된다[2].
자기공명영상을 이용한 연구에서 HMERF는 특징적으로 반힘줄근(semitendinosus)과 두덩정강근을 질환 초기부터 침범하였다[9]. 이 외에도 하지 근육 중 엉덩허리근, 넙다리빗근(sartorius), 두덩정강근(gracilis), 앞정강근이 흔히 침범되며, 이와 달리 네갈래근(quadriceps), 넙다리두갈래근(biceps femoris), 장딴지근(gastrocnemius), 가자미근(soleus) 등은 비교적 보존되었다. 이러한 근육 침범 형태는 이후 여러 연구에서 유전자 변이 종류와 별개로 일정하게 나타남을 보고하여[2-4,6-8] 자기공명영상으로 침범된 근육을 관찰하는 것이 진단 민감도를 높이는 검사법으로 알려져 있다[2]. 본 증례에서도 이전의 보고와 유사하게 엉덩허리근, 두정정강근, 앞정강근에서는 심한 근위축이 있었으나 네갈래근과 넙다리두갈래근은 보존되었다.
본 증례는 청소년기 이후 양하지 원위부 근력저하로 시작하였고, 증상에 비하여 조기에 호흡부전이 동반되었으며, 근육 조직검사에서 근원섬유근육병이 관찰되었고, 유전자검사를 통하여 TTN 유전자의 변이가 확인되어 HMERF를 진단하였다. 따라서, 원위부 근력저하로 시작한 환자에서 TTN 유전자의 변이가 확인되면 진단 당시 호흡부전 증상이 동반되지 않았더라도 누운 자세와 일어선 자세에서 폐기능검사를 시행하는 등 주기적인 호흡기능 평가가 중요하다. 또한 호흡부전 증상이 동반되면 급성 호흡부전의 예방과 삶의 질 향상을 위하여 조기에 비침습환기의 사용을 고려해야 한다.



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print