| J Korean Neurol Assoc > Volume 35(1); 2017 > Article |
|
Abstract
Near-infrared spectroscopy (NIRS), a noninvasive optical method, utilizes the characteristic absorption spectra of hemoglobin in the near-infrared range to provide information on cerebral hemodynamic changes in various clinical situations. NIRS monitoring have been used mainly to detect reduced perfusion of the brain during orthostatic stress for three common forms of orthostatic intolerance (OI); orthostatic hypotension, neurally mediated syncope, and postural orthostatic tachycardia syndrome. Autonomic function testing is an important diagnostic test to assess their autonomic nervous systems for patients with symptom of OI. However, these techniques cannot measure dynamic changes in cerebral blood flow. There are many experimentations about study of NIRS to reveal the pathophysiology of patients with OI. Research using NIRS in other neurologic diseases (stroke, epilepsy and migraine) are ongoing. NIRS have been experimentally used in all stages of stroke and may complement the established diagnostic and monitoring tools. NIRS also provide pathophysiological approach during rehabilitation and secondary prevention of stroke. The hemodynamic response to seizure has long been a topic for discussion in association with the neuronal damage resulting from convulsion. One critical issue when unpredictable events are to be detected is how continuous NIRS data are analyzed. Besides, NIRS studies targeting pathophysiological aspects of migraine may contribute to a deeper understanding of mechanisms relating to aura of migraine. NIRS monitoring may play an important role to trend regional hemodynamic distribution of flow in real time and also highlights the pathophysiology and management of not only patients with OI symptoms but also those with various neurologic diseases.
자율신경계 질환 특히 기립불내증(orthostatic intolerance)은 기립 시 뇌혈류를 유지하기 위한 심혈관계 작용이 적절히 이루어지지 않아 뇌혈역학에 변화를 초래하여 어지럼이나, 심계항진, 피곤감과 같은 다양한 증상들이 나타나는 질환이다. 현재 기립불내증은 임상적인 증상들과 이에 상응하는 자율신경계 기능검사 결과들을 종합하여 진단하고 있다. 그러나 그 증상이 전형적인 것이 없고, 다양한 질환들에 의해 나타날 수 있는 증상들과 유사하여 진단이 쉽지 않다[1]. 특히 자율신경계 기능검사의 결과도 환경적인 요인이나, 기저질환에 의해 영향을 받을 수 있어 검사 결과의 신뢰도가 떨어져 진단이 용이하지 않은 실정이다. 일반적으로 기립불내증의 병리기전 중 환자에게 증상을 유발하는 주 원인은 뇌관류(cerebral perfusion)의 저하로 인해 뇌기능장애가 발생하여 일어나는 것으로 알려져 있다. 뇌관류의 변화를 측정하는 검사로 단일광자방출컴퓨터단층촬영(single photon emission computed tomography, SPECT), 기능자기공명영상(functional magnetic resonance imaging, fMRI), 양전자방출단층촬영(positron emission tomography, PET), 관류컴퓨터단층촬영(perfusion CT) 혹은 관류자기공명영상(perfusion MRI)을 포함하여 다양한 검사법들이 있으나, 이는 체위 변화나 다양한 조건에서 변화할 수 있는 뇌관류 및 뇌혈역학을 실시간으로 평가하는 데는 한계가 있다. 최근 fMRI보다는 해상도가 떨어지지만 뇌의 기능적인 변화와 뇌혈역학을 측정할 수 있는 도구로서 근적외선분광분석법(near-infrared spectroscopy, NIRS)이 소개되어 다양한 분야에 적용되고 있다. 본고는 기립불내증의 임상적 특성과 기존에 알려진 병태생리적 기전을 고려하여 NIRS의 진단적 가치에 대해 다양한 신경계질환 관련 연구 내용과 함께 논하고자 한다.
최근 신경질환의 진단과 발병원인에 대한 연구가 활발히 진행되고 있으며, 뇌의 혈역학과 부분적인 기능을 알고자 하는 연구 또한 많은 분야에서 이루어지고 있다[2]. 이에 비침습적으로 대뇌 산소 포화도 변화를 측정하기 위해 NIRS가 널리 사용되고 있다. 현재 임상에서 활용되고 있는 신경영상 장치 중 fMRI는 뇌의 깊이에 따른 신호를 측정할 수 있는 장점이 있으나 시간분해능이 떨어지고 다른 장치에 비해 높은 비용이 단점이다. PET는 많은 비용이 요구되고 낮은 시공간분해능과 긴 영상복원 시간이 단점으로 지적된다. 이러한 기존 신경영상 장치들의 단점을 보완하고 새로운 장점을 가진 광학을 이용한 신경 신호 측정 방법이 바로 NIRS이다. 특정한 임무를 수행할 때 뇌에서 나타나는 변화를 분석하는 등 의학 분야 및 뇌-컴퓨터 인터페이스(brain-computer interface, BCI) 분야에서 최근 주목을 받고 있다[3].
NIRS는 근적외선을 이용하며 두피에서 입사한 근적외선은 2 cm 정도의 깊이까지 흡수와 산란을 거쳐 도달하게 되며, 흡수되지 않은 근적외선은 바나나 모양의 경로를 그리며 광원으로부터 3-4 cm 떨어진 위치의 두피에 도달한다(Fig. 1) [4].
물은 700-900 nm 파장의 근적외선에서 매우 작은 흡수계수를 가지고 있다. 이 대역의 빛은 물에 거의 흡수되지 않고 인체의 깊숙한 곳까지 침투하므로 근적외선을 이용하여 대뇌 피질의 산소포화도 변화를 관찰할 수 있다. 반면에 산소혈색소(HbO)와 탈산소혈색소(HbR)는 700-900 nm 파장 대역에서 물에 비해 상대적으로 흡수계수가 크므로, 인체에 조사된 근적외선의 강도 변화량을 분석하면 비침습적으로 HbO와 HbR의 농도 변화량을 계산할 수 있다. 생리학적으로 신경의 활성화가 산소의 공급과 사용에 불균형을 가져와 혈액 내의 HbO의 농도를 증가시키고, HbR의 농도는 감소시킨다[5]. 그러므로 NIRS는 혈액 내의 산소포화도 변화 관찰을 통하여 뇌 활성도의 변화를 알 수 있다(Fig. 2).
실시간으로 뇌의 혈류신호를 받아서 Hbo와 HbR의 농도로 계산을 한 뒤, 기본적인 지도화(mapping)를 거쳐 실시간으로 영상화를 한다. 다양한 거리의 발광 다이오드와 수광 다이오드가 복잡한 그물(mesh)을 만들면서 전두엽의 공간적인 정보를 2D 형태로 나타내게 되며 지도화의 방식에 따라 얻는 정보를 다르게 표현할 수도 있다. 최근 연구에서는 대뇌 피질 부위별 연결성에 대한 분석을 위한 수학적 모델링 기법이 개발되면서 NIRS를 이용한 대뇌 활성도의 연구와 뇌 지도화 연구도 더 빠르게 좋은 결과들을 제시하고 있다[6]. 그렇지만, 다채널을 이용한 지도화를 위해서는 넓은 범위에 NIRS 전극을 부착하여야 하기 때문에, 머리카락이 있는 두피에 적용하기에는 제한점이 있어 주로 이마에서만 검사를 하게 되어 전두엽 평가에 그치게 된다는 단점이 있다. 최근 두피 전체에 적용이 가능한 기술적인 발전이 이루어지고 있어 향후에는 뇌파와 같이 대뇌 전체의 피질 기능을 평가할 수 있는 다채널 NIRS가 임상 및 연구 현장에 사용될 수 있을 것으로 보인다.
NIRS는 근적외선을 이용하기 때문에 안전성이 높으며 뇌의 생리적 변화를 측정하기 위해서 사용되는 다른 장비들과 비교했을 때 상대적으로 작은 크기를 가지고 있어 휴대성과 이동성이 우수하고 높은 시간해상도와 공간해상도를 가지고 있어 인체를 관찰하는데 적절하다. 그렇지만, 투과도가 높지 않아 대뇌 피질부의 평가에 국한되고, 산소포화도와 연관된 지표만을 이용하기 때문에 전기생리학적 변화가 주를 이루는 신경계 질환들의 평가에는 그 활용도가 제한적이라는 단점도 있다.
자세 변화시 심박동과 혈압의 변화는 주로 자율신경계에 의해서 이뤄지는데 사람이 누워있다가 기립하면 약 500 mL 정도의 혈액이 중력에 의해 하지의 정맥혈 저장 시스템에 머무르게 되는 혈역학적 반응을 보이게 된다. 이러한 혈액의 이동에 의해서 정맥환류(venous return) 감소, 심실 전부하(preload)의 감소가 이어지고 이에 따라 심박출량이 감소하며 뒤이어 혈압은 떨어지게 된다[7]. 이렇게 기립 시 혈압저하가 일어나면 장기의 관류압을 유지하기 위해 즉각적으로 신경조절계가 활성화되는데, 대동맥궁(aortic arch)과 경동맥동(carotid sinus)의 압력수용체에서 감지된 구심성 신경신호는 각각 미주신경과 혀인두신경을 통하여 압력반사중추(baroreflex center)로 전달되고 교감신경을 활성화시켜서 반사적인 심박동 증가와 동맥수축으로 1분 이내에 정상혈압을 회복하게 한다(Fig. 3) [8,9]. 하지만 수십 분 이상 지속적으로 기립상태를 유지하게 되면 정맥혈류의 저류 효과 외에 횡경막 하부 모세혈관의 정류압이 증가하여 수분의 이동이 일어나 중심 혈액량과 심박출양이 감소하게 되는데, 이런 경우의 혈압 보상기전으로는 혈장량을 유지하기 위하여 레닌-앤지오텐신-알도스테론계통과 같은 신경-내분비기전이 활성화되고 알도스테론 분비도 이뤄지게 된다[10]. 다양한 원인 질환에 의해 이러한 신경-체액(neuro-humoral) 보상기전이 적절히 작동하지 않는 경우 혈압이 저하되고, 이로 인한 뇌관류의 저하로 뇌실질 내 혈액공급이 감소하여 다양한 기립불내증의 증상과 심하면 의식소실까지 발생할 수 있다[11-13].
기립불내증은 기립상태에서 정상적인 자율신경계 활동을 유지한 채 일정 기간 이상 견딜 수 없는 것으로 정의하며, 다양한 정도의 자율신경계 이상에 의해 발생하는 증후군으로서 기립저혈압, 신경탓실신, 자세기립빈맥증후군(postural orthostatic tachycardia syndrome, POTS) 등의 형태로 나타날 수 있고, 기립경사검사(Head-Up tilt table test, HUTT), 발살바수기(Valsalva maneuver, VM), 심호흡심장박동수검사(heart rate response to deep breathing, HRDB) 등을 포함한 자율신경계 기능 평가 검사들을 이용하여 진단 및 기전 연구도 함께 이루어지고 있다(Table 1) [14].
기립저혈압은 기립 시 정상적으로 발생하는 정맥환류 감소에 대한 보상 기전에 이상이 있을 때 발생하며, 구조적 또는 기능적 교감신경계의 차단이나 교감신경 유출을 반사적으로 조절하는 과정에 이상이 발생하였음을 시사한다. 기립저혈압은 임상적으로 몇 가지로 분류하는데 전형적인 기립저혈압은 기립 시 30-180초 이내에 수축기 혈압이 20 mmHg, 이완기 혈압이 10 mmHg 이상 감소하는 것으로 정의하고, 고혈압 환자에서는 혈압이 30/15 mmHg 이상 감소하는 것으로 정의한다[15]. 지연기립저혈압은 기립 시 적응기전장애가 서서히 나타나는 것으로 기립 시 혈압저하가 3-45분 사이에 나타나는 것을 말한다. 초기기립저혈압은 일시적인 혈압 강하(수축기 혈압 40 mmHg, 이완기 혈압 20 mmHg 이상)가 30초 이내에 나타나는 것으로 정의한다[12]. 초기기립저혈압은 자발적으로 기립을 할 때에만 나타나고, 기립경사검사에서는 혈압저하가 가볍게 나타나거나 혈압저하가 없다.
신경탓실신은 혈관미주신경실신 또는 반사실신(reflex syncope)이라고도 불리며 동맥이나 내장 압력수용체가 압박이나 팽만으로 인해 자극되면 뇌간으로 구심 신호를 전달하고 그 후 원심 신호는 미주신경을 통해 심장결절로 전달되어 서맥이 생기거나 반사로 인해 혈관확장이 생겨 혈압을 떨어뜨리는 것이 실신의 원인이 된다. 반사는 급성통증이나 감정변화에 의해 악화되지만 다른 원인 없이, 서 있거나 걸을 때 하지 정맥으로 혈액이 몰려 반사가 생기기도 한다. 서맥과 저혈압이 생기면 뇌순환이 떨어지게 되며 실신 전에 오심, 눈이 침침함, 땀, 전신 무력, 또는 거의 의식을 잃을 것 같은 증상이 선행되고 그 후 환자는 의식을 잃고 쓰러진다. 의식을 유지하기 위해선 뇌피질과 뇌간 그물활동계가 긴밀하게 잘 작동해야 하는데 이런 조직에 뇌관류 감소로 기능이상이 생기면 결국 의식 저하 상태가 올 수 있는 것이다[16].
POTS의 혈역학적 특징은 기립 시 혈압은 유지되지만, 맥박수가 과도하게 증가하고 이와 관련된 증상이 발생하며, 이러한 증상이 누우면 호전되는 것이 특징이다. POTS는 기립 시 혈압의 변화는 없으면서, 심박동이 기립 후 5-30분 이내에 30회/분 이상 증가 혹은 기립 시의 심박동 >120회/분, 기립 시 증상이 악화되고 누웠을 때 증상이 호전, 그리고 증상이 6개월 이상 지속 되는 경우에 진단할 수 있다[17,18]. POTS는 대개 신경병증성(neuropathic) POTS와 고아드레날린성(hyperadrenergic) POTS로 분류하는 것이 일반적이며[19] 그 외에 탈조건화(deconditioning) POTS, 속발성(secondary) POTS 등을 추가 분류하기도 한다.
이 중 신경병증성 POTS는 가장 흔한 형태로서 이들 환자들은 경한 말초 자율신경병증에 의해서 말초혈관이 적당한 혈관저항을 유지하지 못하여 기립 시에 횡격막 아래쪽에 있는 혈관에 정상보다 많은 혈액저류가 일어난다. 이에 뇌관류를 일정수준으로 유지하기 위하여 보상적으로 심박동과 심근수축을 증가시키게 되며, 이로 인해 처음에는 어느 정도 보상이 가능하지만, 정맥의 혈액저류는 점차적으로 증가하고, 이러한 보상작용을 초과하게 되어 증상이 나타난다[19,20].
고아드레날린성 POTS는 증상이 갑작스럽게 나타나기보다는 점차적으로 진행하는 양상으로 나타나며 대개는 기립 시에 교감신경계 활성에 의한 진전, 불안감, 심계항진을 호소한다. 고아드레날린성 POTS 환자들은 종종 기립빈맥뿐만 아니라 기립고혈압이 같이 나타나며 기립 시 노르에피네프린이 의미 있게 증가되어 나타난다[21]. 혈중 노르에피네프린이 증가되는 현상은 부분적인 자율신경계 장애, 또는 저혈량증으로 인하여 이차적으로 발생하는 것으로 알려져 있다.
자율신경계 이상으로 인한 기립불내증에 대해 고전적으로 시행하는 검사로는 심호흡심장박동수검사, 발살바수기, 그리고 기립경사검사가 있다[22]. 심호흡심장박동수검사는 부교감신경을 평가하는 검사로 2회 시행하며 순서는 다음과 같이 시행한다 (1분간 기준값 기록→ 첫 번째 검사시행→ 2분 휴식→ 1분간 기준값 기록→ 두 번째 검사 시행→ 1분 휴식). 발살바수기는 아드레날린성 교감신경 및 부교감신경 평가 검사로 2-3회 시행한다. 검사는 다음과 같은 순서로 시행한다 (1분 기준값 기록→ 첫 번째 발살바수기 시행→ 3분 휴식→ 두 번째 발살바수기 시행→ [만일 편평정상(flat-top) 반응이 있으면 상체를 20°와 40°로 각각 올린 상태에서 시행할 수 있다]→ 2분 후에 검사 종료). 기립경사검사는 아드레날린성 교감신경 및 압반사를 평가하는 검사로 순서는 다음과 같다 (5분 동안 누운 상태에서 기준값을 기록한다→ 10분[기립저혈압, 자세기립빈맥증후군 검사의 경우] 혹은 30분[실신의 경우] 동안 기립경사검사를 시행→ 누운 상태에서 3분 기록한 후에 검사 종료) (Fig. 4) [23].
이들 검사를 시행하면서 발생하는 뇌의 혈역학적 변화를 NIRS를 이용하여 측정하고자 하는 몇몇 연구들이 최근 진행되어 왔다[24,25]. NIRS를 부착하고 기립경사검사 시행 후 미주신경성 실신을 보였던 환자들의 결과를 분석해 본 연구에서는 증상이 발생하기 전 HbO가 먼저 감소를 보였고 뒤이어 전실신(presyncope) 증상, 혈압, 심박수, 동맥혈산소분압의 감소가 순서적으로 관찰되었으며, 그 이후에 실신이 발생하는 것을 확인할 수 있었다[26]. 이는 미주신경성 실신이 말초에서의 혈압과 심박수의 조절 장애, 그리고 뇌관류의 저하로 인한 것임을 설명함과 동시에 NIRS가 뇌혈류 변화를 평가하는 데 유용하다는 것을 나타내는 연구결과였다. 정상인과 실신환자를 대상으로 뇌와 신장에서의 혈역학적 관류의 차이를 확인하기 위해 NIRS를 이마와 흉추, 요추부(T10-L1)에 부착하고 시행했던 기립경사검사에서도 실신과정에서 뇌관류 감소와 함께 역설적인 내장 혈관확장을 시사하는 내장관류의 확연한 증가 소견이 관찰되었다[27]. 경동맥 협착을 동반한 기립어지럼을 호소하는 환자들과 정상인을 대상으로 시행한 기립경사검사에서도 경동맥 협착군에서 유의한 HbO의 감소 소견을 보여 심한 경동맥협착에서 뇌의 자가조절기능의 평가에 NIRS가 유용하게 쓰일 수 있음을 보여주었다[28]. 정상인을 대상으로 발살바수기를 시행하는 동안 NIRS를 측정한 연구에서는 발살바수기로 인해 변화된 평균동맥압이 뇌혈류와 뇌산소분압에 변화를 가져온다는 것을 보여주었다[29]. 또 다른 연구에서는 두피로부터 30 mm 깊이에서 측정된 HbO와 15 mm 깊이에서 측정된 HbO값을 발살바수기시 평균동맥압과 비교 분석하였고, 이때 전체적인 혈역학적 변화가 NIRS 신호에 영향을 미칠 수 있다는 것을 나타냈다[30]. 이들 연구들은 자율신경계 기능장애 때 발생하는 뇌혈류역학 변화를 NIRS를 이용해 평가할 수 있다는 가능성을 보여준 연구들로서 그 가치들이 있다. 그렇지만, 임상적인 의미를 부여하기에는 연구에 포함된 질환별 대상군의 수가 적고, 각 NIRS 측정에 치우친 연구로 인해 임상적인 평가를 시행하는 데 한계들을 가지고 있는 연구이다. NIRS는 현재 보다 많은 채널 수를 포함해 측정 장비의 기술적인 발전을 통해 더욱 임상에 적용 가능성을 높이고 있다.
뇌 산소포화도의 변화가 발생하는 뇌혈관질환은 NIRS를 이용한 연구가 가장 많이 이루어진 분야이긴 하지만, 근적외선의 투과 영역이 깊지 않아 두피로부터 심부에 위치한 뇌혈류장애를 평가하기에 적절하지 못한 NIRS의 특성 때문에 임상 현장에서 적용도는 그리 높지 않다[31]. 급성기 뇌혈관질환이 의심되는 환자에서 가장 중요한 점은 신속한 진단과 빠른 치료적 접근이기 때문에, NIRS를 이용한 연구를 적용하는 데는 윤리적인 제한점도 있어 왔다.
아급성의 전뇌동맥 뇌경색 환자들을 대상으로 NIRS를 적용하여, 이들의 병측 뇌반구에서 건측 뇌반구에 비해 뇌내 산소포화도가 2배 이상 감소하는 현상을 발견하였다[32]. 이 연구를 통해 비록 NIRS에 많은 제한점이 있지만, 뇌혈역학과 혈류 자동조절 능력에 대한 평가 및 장기 추적 감시를 위한 도구로서 가능성을 제시하였다. 아급성 뇌경색 환자들을 대상으로 수면과 연관된 호흡장애를 평가하기 위하여 NIRS를 이마에 부착하고 밤 사이 수면 중 변화하는 전두엽의 산소포화도 변화를 측정한 연구에서는 흥미롭게도 병변측보다 건측의 뇌반구에서 폐쇄수면무호흡이 있을 때 산소포화도가 감소하는 현상을 관찰하였다[33]. 이 역시 대뇌혈류의 자동조절기능이 뇌혈관질환 이후 변화를 보이기 때문에 나타난 결과로 추정되고 있다. 이외에도 뇌혈관 질환 이후 재활 중 대뇌 산소포화도의 추적 감시를 통해 치료 효과를 극대화할 수 있다는 개념의 연구와 이차 뇌혈관질환 예방을 위한 효율적인 생활 습관의 개선을 위한 연구를 위해 NIRS가 활발히 이용되고 있어서[34], 향후 뇌혈관질환의 진단 및 치료와 재활을 위한 임상에서 NIRS의 활용도는 증가할 것으로 예상된다.
뇌전증 분야에서 NIRS는 크게 세 가지 분야에서 적용되어 왔다. 첫 번째로 경련 발작 동안 대뇌피질에 산소포화도 변화의 관찰, 두 번째로 경련 유발 병변 부위의 국소화, 세 번째는 뇌전증 치료를 위한 수술 전 기능적인 지도화의 가능성 평가이다. 경련발작에 의한 산소포화도는 국소 발작의 경우에는 산소포화도의 증가와 감소가 혼재되어 보고되고 있어 아직도 논란의 여지가 많다. 그러나 전신 발작의 경우에는 비교적 일관되게 산소포화도가 감소되는 현상이 관찰되었다[35]. 이는 아마도 전신 발작에 의해 호흡의 저하와 근육 내 혈관 압박에 의한 대뇌 혈류 유입의 일시적인 감소로 인해 발생하는 현상으로 설명되고 있다. 이와 같은 현상은 우울증 치료를 위해 전기발작치료(electroconvulsive therapy)를 하며 NIRS를 시행한 연구에서 두개경유도플러 검사에서 혈류 속도가 증가하는 것에 따라 NIRS의 산소포화도는 감소하는 소견과도 일치하는 현상이다[36]. 뇌전증은 아니지만, 쥐를 대상으로 경두개직류자극을 시행하고 NIRS를 이용하여 HbO를 측정한 검사에서는 경두개직류 자극시 양의 상관성을 보이는 HbO의 증가를 관찰할 수 있어서 대뇌 활성도를 평가하는 데 NIRS가 유용할 수 있는 근거를 제시하였다[37]. 그러나 개체별 반응 정도의 변이성이 높고 개체내 반복성이 떨어져 적절한 검사 조건 및 지표들의 기준화가 필요한 실정이다. 수면중 주기사지운동장애 환자에 적용한 연구에서도 주기사지운동장애가 있는 환자군이 그렇지 않은 군에 비해 대뇌 HbO의 변화가 컸고, 수면 주기에 따른 변화는 정상군에 비해 잘 관찰되지 않은 현상을 볼 수 있었다[38]. 이도 역시 NIRS가 대뇌 활성도를 반영하는 지표로 사용될 수 있고, 다양한 대뇌 전기 활성도와 연관된 질환들의 병태생리 연구에 활용도가 높을 것이라는 것을 제시하는 연구였다.
경련 발작 부위의 국소화를 위한 시도도 활발히 이루어지고 있다. 약물 치료에 효과가 떨어지는 전두엽발작 환자들을 대상으로 두피뇌파를 시행하고, 동시에 시행한 NIRS와 SPECT의 이상 소견 감지 여부를 비교한 연구에서는 NIRS가 SPECT에 비해 뇌파와 연동된 이상 소견을 더 잘 감지하였다[39,40]. 또한 NIRS를 통해 발작 활성도의 전파 형태를 용이하게 찾아냈고, 뇌파와 NIRS의 연관성이 아주 높다는 연구 결과나[41], 경련 발작에 의한 동작성 잡파도 혈역학적 변화들과 명확히 구별해 내었다는 연구 보고도 있어[42], 향후 임상연구에 적용도가 높아질 것으로 보인다.
뇌전증은 발작 유발 부위인 병소가 대뇌 피질인 경우가 많아 NIRS를 적용하는 데 다른 뇌심부에 발생하는 질환들에 비해 용이하다는 점이 있으나, 실제 뇌전증에서 발생하는 병소의 전기생리학적 변화를 측정하는 것이 아니라 이로 인해 이차적으로 유발되는 뇌 산소포화도의 변화를 측정하는 것이기 때문에, NIRS 측정값을 어떻게 변환하여 임상적으로 제시하는 지가 논란의 핵심이다[31]. 최근 들어 다양한 환산 모델이 제시되고 있고 점차 그 신뢰도가 높아지고 있어 향후 임상 적용의 가능성도 높아지고 있다.
편두통에 NIRS의 적용은 편두통과 연관된 뇌혈관질환의 위험성을 좀 더 부각시키는 역할을 했다[43]. 88명의 심장에 열린타원구멍이 있는 편두통 환자들을 대상으로 두개경유도플러 검사와 NIRS의 열린타원구멍 발견율을 비교한 연구에서 NIRS가 약 84%의 진단 정확도로 우월하다는 것을 보고하였다[44]. 또 다른 연구에서는 편두통 환자들에서 NIRS의 지표 값 변화를 이용하여 뇌혈관의 탄성도에 변화를 확인하고 뇌졸중의 위험성이 정상군에 비해 높다는 것을 간접적으로 제시한 연구도 있었다. 이외에도 약물 치료 이후 통증의 감소를 대뇌 산소포화도 변화를 통해 객관적으로 제시할 수 있다는 연구가 보고되었고, 이후 다양한 통증 질환에서 fMRI가 이용되었던 연구처럼 NIRS의 활용 연구가 진행되고 있다. NIRS의 편두통 연구에 활용도로 가장 가능성이 높을 범주는 피질확산억제(cortical spreading depression)이다. 아주 짧은 기간 발현되는 경향이 있는 조짐증상을 NIRS를 이용하여 비교적 의미 있는 소견들을 찾아낸 연구들이 있다. 그중 최근에 연구는 8명의 환자에서 이완기 혈류 속도의 저하가 두개경유도플러에서 관찰되고, NIRS로는 조직의 산소포화도가 감소하는 현상을 보고하면서, 피질확산억제가 비 허혈성 기전에 의해 발생한다는 것을 주장하였다[45].
비록 지금까지의 연구에서 사용되는 NIRS의 지표값이 잘 정립되어 있는 단계는 아니지만, 편두통 특히 조짐증상의 병태생리를 연구하는 데 큰 역할을 할 것으로 기대된다. 특히 편두통과 혈역학의 연관성에 대한 병태생리를 규명하는 데 뇌파와 두개경유도플러와 함께 NIRS의 활용은 중요한 발전을 이루게 할 것으로 생각된다. 임상 현장에서 치료와 관련된 NIRS의 활용도는 아직은 학술적 근거가 부족하지만, 두통 환자에서 대뇌 기질적 원인을 감별하는 목적으로는 이용될 수 있을 것이다.
NIRS는 다양한 신경계 질환의 병태생리 연구에 많이 이용되고 있으나 기술적 및 기준 정립의 문제점들 때문에 아직까지 적용 범주가 제한적인 상황이다. 자율신경계 장애의 진단 및 병태생리 연구에 NIRS의 활용도는 다른 신경계 질환 연구에 비해 부족한 상황이지만, 임상적인 증상들의 원인이 심혈관계의 혈역학적 변화에 의한 뇌관류의 변화로 인해 일어난다는 가설을 고려할 때 향후 그 활용도가 폭발적으로 증가할 수 있다. 다양한 조건 하에 실시간 측정이 가능한 도구라는 장점과 최근의 기술적 발전은 NIRS의 진단 장비로서의 임상적 가치를 보다 높일 것으로 기대한다.
Acknowledgements
This work was supported by a National Research Foundation of Korea (NRF) grant funded by the Korean Government (MSIP; no. NRF-2015R1A5A7037674).
REFERENCES
1. Benarroch EE. The clinical approach to autonomic failure in neurological disorders. Nat Rev Neurol 2014;10:396-407.


2. Misgeld T, Kerschensteiner M. In vivo imaging of the diseased nervous system. Nat Rev Neurosci 2006;7:449-463.


3. Hillman EM. Optical brain imaging in vivo: techniques and applications from animal to man. J Biomed Opt 2007;12:051402.



4. Gratton G, Brumback CR, Gordon BA, Pearson MA, Low KA, Fabiani M. Effects of measurement method, wavelength, and source-detector distance on the fast optical signal. Neuroimage 2006;32:1576-1590.


5. Jobsis FF. Noninvasive, infrared monitoring of cerebral and myocardial oxygen sufficiency and circulatory parameters. Science 1977;198:1264-1267.


6. Im CH, Jung YJ, Lee S, Koh D, Kim DW, Kim BM. Estimation of directional coupling between cortical areas using Near-Infrared Spectroscopy (NIRS). Opt Express 2010;18:5730-5739.


7. Mancia G, Grassi G, Ferrari A, Zanchetti A. Reflex cardiovascular regulation in humans. J Cardiovasc Pharmacol 1985;7 Suppl 3:S152-159.


8. Harms MP, Wesseling KH, Pott F, Jenstrup M, Van Goudoever J, Secher NH, et al. Continuous stroke volume monitoring by modelling flow from non-invasive measurement of arterial pressure in humans under orthostatic stress. Clin Sci (Lond) 1999;97:291-301.


9. Low PA, Tomalia VA. Orthostatic hypotension: mechanisms, causes, management. J Clin Neurol 2015;11:220-226.



10. Robertson D. The pathophysiology and diagnosis of orthostatic hypotension. Clin Auton Res 2008;18 Suppl 1:2-7.


11. Stewart JM. Mechanisms of sympathetic regulation in orthostatic intolerance. J Appl Physiol (1985) 2012;113:1659-1668.



12. Fedorowski A, Melander O. Syndromes of orthostatic intolerance: a hidden danger. J Intern Med 2013;273:322-335.


13. Kim JB, Kim BJ, Koh SB, Park KW. Autonomic dysfunction according to disease progression in Parkinson's disease. Parkinsonism Relat Disord 2014;20:303-307.


14. Kim JB, Hong S, Park JW, Cho DH, Park KJ, Kim BJ. Utility of corrected QT interval in orthostatic intolerance. PLoS One 2014;9:e106417.

15. Freeman R, Wieling W, Axelrod FB, Benditt DG, Benarroch E, Biaggioni I, et al. Consensus statement on the definition of orthostatic hypotension, neurally mediated syncope and the postural tachycardia syndrome. Clin Auton Res 2011;21:69-72.


17. Low PA, Opfer-Gehrking TL, Textor SC, Benarroch EE, Shen WK, Schondorf R, et al. Postural tachycardia syndrome (POTS). Neurology 1995;45:S19-25.

18. Raj SR. The Postural Tachycardia Syndrome (POTS): pathophysiology, diagnosis & management. Indian Pacing Electrophysiol J 2006;6:84-99.



20. Park KJ. Orthostatic intolerance postural tachycardia syndrome. Korean J Clin Neurophysiol 2009;11:1-8.
21. Thieben MJ, Sandroni P, Sletten DM, Benrud-Larson LM, Fealey RD, Vernino S, et al. Postural orthostatic tachycardia syndrome: the Mayo clinic experience. Mayo Clin Proc 2007;82:308-313.


22. Jones PK, Gibbons CH. Autonomic function testing: an important diagnostic test for patients with syncope. Pract Neurol 2015;15:346-351.


23. Assessment: clinical autonomic testing report of the therapeutics and technology assessment subcommittee of the American academy of neurology. Neurology 1996;46:873-880.

24. Everdell NL, Airantzis D, Kolvya C, Suzuki T, Elwell CE. A portable wireless near-infrared spatially resolved spectroscopy system for use on brain and muscle. Med Eng Phys 2013;35:1692-1697.


25. Canova D, Roatta S, Bosone D, Micieli G. Inconsistent detection of changes in cerebral blood volume by near infrared spectroscopy in standard clinical tests. J Appl Physiol (1985) 2011;110:1646-1655.


26. Szufladowicz E, Maniewski R, Kozluk E, Zbiec A, Nosek A, Walczak F. Near-infrared spectroscopy in evaluation of cerebral oxygenation during vasovagal syncope. Physiological Measurement 2004;25:823-836.


27. Rao RP, Danduran MJ, Dixon JE, Frommelt PC, Berger S, Zangwill SD. Near infrared spectroscopy: guided tilt table testing for syncope. Pediatr Cardiol 2010;31:674-679.


28. Igarashi T, Sakatani K, Fujiwara N, Murata Y, Suma T, Shibuya T, et al. Monitoring of hemodynamic change in patients with carotid artery stenosis during the tilt test using wearable near-infrared spectroscopy. Adv Exp Med Biol 2013;789:463-467.


29. Perry BG, Cotter JD, Mejuto G, Mundel T, Lucas SJ. Cerebral hemodynamics during graded Valsalva maneuvers. Front Physiol 2014;5:349.



30. Tsubaki A, Kojima S, Furusawa AA, Onishi H. Effect of valsalva maneuver-induced hemodynamic changes on brain near-infrared spectroscopy measurements. Adv Exp Med Biol 2013;789:97-103.


32. Aries MJ, Coumou AD, Elting JW, van der Harst JJ, Kremer BP, Vroomen PC. Near infrared spectroscopy for the detection of desaturations in vulnerable ischemic brain tissue: a pilot study at the stroke unit bedside. Stroke 2012;43:1134-1136.


33. Pizza F, Biallas M, Kallweit U, Wolf M, Bassetti CL. Cerebral hemodynamic changes in stroke during sleep-disordered breathing. Stroke 2012;43:1951-1953.


34. Obrig H, Steinbrink J. Non-invasive optical imaging of stroke. Philos Trans A Math Phys Eng Sci 2011;369:4470-4494.


35. Sokol DK, Markand ON, Daly EC, Luerssen TG, Malkoff MD. Near infrared spectroscopy (NIRS) distinguishes seizure types. Seizure 2000;9:323-327.


36. Saito S, Yoshikawa D, Nishihara F, Morita T, Kitani Y, Amaya T, et al. The cerebral hemodynamic response to electrically induced seizures in man. Brain Res 1995;673:93-100.


37. Han CH, Song H, Kang YG, Kim BM, Im CH. Hemodynamic responses in rat brain during transcranial direct current stimulation: a functional near-infrared spectroscopy study. Biomed Opt Express 2014;5:1812-1821.



38. Byun JI, Jung KY, Lee GT, Kim CK, Kim BM. Spontaneous low-frequency cerebral hemodynamics oscillations in restless legs syndrome with periodic limb movements during sleep: a near-infrared spectroscopy study. J Clin Neurol 2016;12:107-114.


39. Watanabe E, Nagahori Y, Mayanagi Y. Focus diagnosis of epilepsy using near-infrared spectroscopy. Epilepsia 2002;43 Suppl 9:50-55.


40. Nguyen DK, Tremblay J, Pouliot P, Vannasing P, Florea O, Carmant L, et al. Noninvasive continuous functional near-infrared spectroscopy combined with electroencephalography recording of frontal lobe seizures. Epilepsia 2013;54:331-340.


41. Lee S, Lee M, Koh D, Kim BM, Choi JH. Cerebral hemodynamic responses to seizure in the mouse brain: simultaneous near-infrared spectroscopy-electroencephalography study. J Biomed Opt 2010;15:037010.


42. Nguyen DK, Tremblay J, Pouliot P, Vannasing P, Florea O, Carmant L, et al. Non-invasive continuous EEG-fNIRS recording of temporal lobe seizures. Epilepsy Res 2012;99:112-126.


43. Liboni W, Molinari F, Chiribiri A, Allais G, Mana O, Negri E, et al. The diagnostic iter of patent foramen ovale in migraine patients: an update. Neurol Sci 2008;29 Suppl 1:S19-22.


Figure 1.
Near-infrared light paths from source reaches to detector in human brain. CSF; cerebrospinal fluid.

Figure 2.
Absorption rate of HbO, HbR, and water according to wavelength. HbO; oxyhemoglobin, HbR; deoxyhemoglobin.
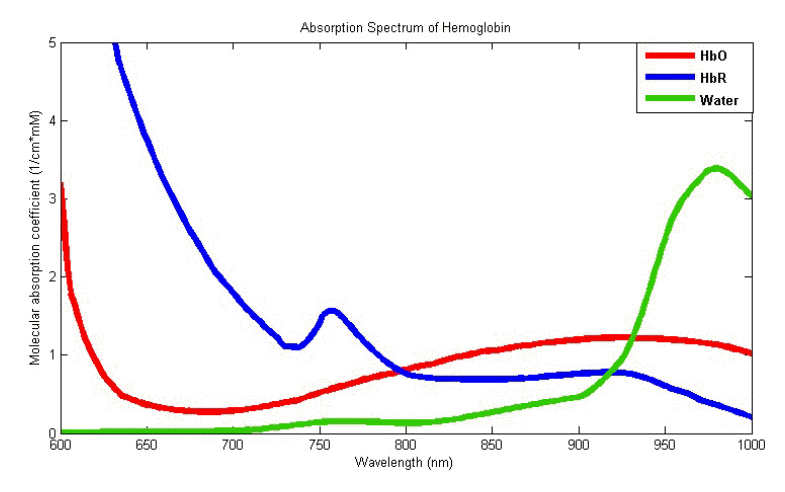
Figure 3.
Baroreflex pathways works to maintain postural normotension. Baroreceptor afferents (purple) synapse at the NTS. The vagal component of the baroreflex (sky blue) runs from the NTS to the NA and sends efferents to the SA to regulate heart rate. The adrenergic baroreflex pathway (red) runs from the NTS to the CVLM, and from there to RVLM. The adrenergic pathway continues with sympathetic efferents from the RVLM to the interomediolateral thoracic spinal cord, and from there to autonomic ganglia and to the heart, arterioles, and venules. NTS; nucleus of the tractus solitaries, NA; nucleus ambiguous, SA; sinoatrial node, CVLM; caudal ventrolateral medulla, RVLM; the rostral ventrolateral medulla.
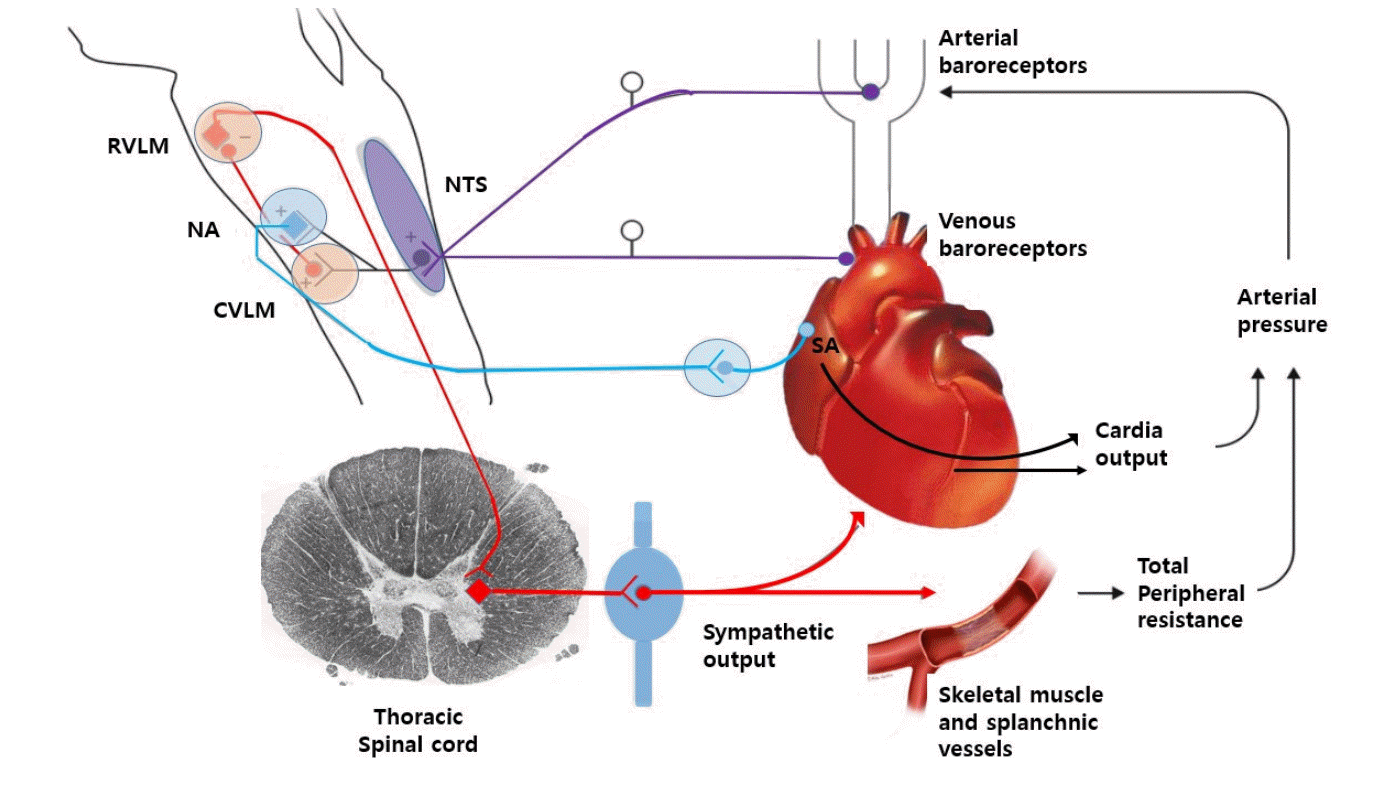
Table 1.
Blood pressure changes during Head-Up Tilt test in patients with orthostatic intolerance
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 15,313 View
- 341 Download
- Related articles
-
Clinical Applications of Heart Rate Variability in Neurological Disorders2017 February;35(1)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



