| J Korean Neurol Assoc > Volume 34(4); 2016 > Article |
|
Abstract
Until recently, neuromyelitis optica (NMO) was considered to be a clinical variant of multiple sclerosis (MS). The discovery of disease-specific anti-aquaporin-4 antibody has facilitated the differentiation of NMO from MS and led to the recognition of a broader phenotypic spectrum now referred to as neuromyelitis optica spectrum disorder (NMOSD). However, distinguishing NMOSD from MS remains challenging, as a subgroup of NMOSD patients are found to be seronegative. The ability to differentiate between NMOSD and MS is critical because these conditions have distinct treatments and prognoses, and the disease-modifying treatment for MS can actually aggravate NMOSD. This review focuses on clinically relevant guidance for diagnosing and differentiating between NMOSD and MS.
시신경척수염(neuromyelitis optica, NMO)과 다발경화증(multiple sclerosis, MS)은 중추신경계의 염증탈수초질환으로, 뇌, 시신경, 또는 척수를 반복적으로 침범하는 비슷한 임상양상으로 나타난다. 오랜 기간 동안 시신경척수염은 다발경화증의 한 아형으로 여겨졌으나, 2004년 시신경척수염 환자의 혈청에서 질병특이항체(aquaporin-4 [AQP4]-IgG)가 발견되면서 다발경화증과는 별개의 질환임이 밝혀졌고[1], 이후 시신경척수염범주질환(neuromyelitis optica spectrum disorder, NMOSD)으로 질환의 개념이 확대되었다[2,3]. 다발경화증과 시신경척수염범주질환의 감별진단은 임상적으로 흔히 경험하는 상황으로, 시신경척수염 특이적 임상양상과 영상 소견, AQP-4 항체 검사가 많은 경우에 도움이 된다. 그러나 혈청항체 음성이며, 다발경화증과 흡사한 병변을 가진 시신경척수염범주질환의 경우 그 구별은 매우 어렵다. 이에 시신경척수염범주질환과 다발경화증의 감별진단에 도움이 되는 다양한 임상양상, 영상, 검사소견 등을 정리해보고자 한다.
다발경화증은 모든 연령에서 생길 수 있으나, 평균 발병연령은 29세이며, 주로 20세에서 40세 사이에 가장 흔히 발병하고, 10세 이전이나 60세 이후에 생기는 경우는 드물다[4,5]. 또한 여성의 유병률이 남성보다 2-3배 정도 높고, 백인에 비해 아시아인과 흑인에서 상대적으로 드물다[4,6]. 유병률이 가장 높은 지역은 북미, 북유럽, 호주 등으로 인구 10만 명당 100-200명 정도이며, 아시아나 아프리카는 대체로 10만 명당 5명 이하의 낮은 유병률을 보인다[4]. 우리나라의 유병률은 2000-2005년 사이의 환자를 대상으로 한 연구에서 10만 명당 3.5-3.6명이었다[7].
다발경화증을 진단하기 위한 질병특이검사방법은 없으며, 진단은 ‘병변’이 시간과 공간 측면으로 ‘여러 번(dissemination in time, DIT)’, ‘여러 부위(dissemination in space, DIS)’에서 발생했음을 밝히는 것을 기본으로 한다. 과거에 사용되었던 ‘Poser 진단기준’은 확실히 두 번 이상의 재발이 있었을 때 다발경화증을 임상적으로 확진할 수 있으며, 그 외의 경우 뇌척수액검사와 자기공명영상검사(magnetic resonance imaging, MRI) 등을 사용하여 진단민감도를 높이도록 제시하고 있다[14]. ‘2001년에 발표된 McDonald 진단기준’은 과거의 진단기준과 달리 MRI만으로도 DIT와 DIS를 증명하여 초기에 다발경화증을 진단할 수 있도록 하였다(Table 1)[15]. 그러나 이 진단기준에서 사용한 MRI 기준은 Barkhof이 제시하고 Tintoré가 수정한 것을 사용하였는데, 너무 엄격해서 다발경화증을 초기에 진단하지 못하는 경우가 많았다[16]. 특히 척수병변을 충분히 감안하지 않은 기준으로, 이를 보완하기 위해 ‘2005년에 개정 McDonald 진단기준’을 제시하였다(Table 1). ‘척수병변’을 ‘후두개와(posterior fossa)병변’과 동일하게 보았고, 뇌병변의 개수를 측정할 때 척수병변도 동일하게 사용함으로써 DIS를 증명하기 위해 척수병변을 더 유용하게 사용할 수 있도록 하였으며, DIT를 밝히기 위해 2001년의 3개월보다 더 단축된 30일 이후 T2 강조 MRI영상에서 새로운 병변이 나온 경우를 인정함으로써 이전 진단기준보다 더 초기에 다발경화증을 진단할 수 있게 되었다[16]. 이후 첫 발병 시의 ‘임상단독증후군(clinically isolated syndrome, CIS)’의 대다수가 나중에 McDonald 진단기준에 부합된 다발경화증으로 전환되며, 인터페론(interferon)이나 글라티라머아세테이트(glatiramer acetate) 등이 이러한 전환을 줄일 수 있다는 사실이 밝혀져, 다발경화증의 조기진단의 필요성이 더욱 강조되었다[17-19]. 이에 2010년에 유럽 다발경화증 MRI 연구공동체(magnetic resonance imaging in MS, MAGNIMS)에서 임상단독증후군 환자를 한번의 MRI로 조기에 다발경화증으로 진단하기 위해 McDonald MRI 기준을 다시 한번 수정하였다(Table 1)[20]. 이 기준에서는 MRI에서 1) 뇌실주위(periventricular), 2) 피질곁(juxtacortical), 3) 후두개와, 4) 척수의 네 부위 중 두 부위 이상에서 무증상 T2 강조 MRI 병변이 관찰되면 DIS를 증명할 수 있으며, 무증상 조영증강되는 병변과 조영증강되지 않는 병변이 같이 있는 경우 또는 추적검사기간과 관계없이 시행한 MRI에서 새로운 T2 강조병변이 관찰되는 경우 DIT를 증명할 수 있다. 그러나 이러한 기준은 아시아에서 흔한 시신경척수염범주질환을 감별해야 하는 문제가 있어 적용에 더 신중할 필요가 있다.
1999년 Wingerchuk이 처음 진단기준을 제시하였다[8]. 2004년에 질병특이항체(NMO-IgG)가 발견되어 그 면역표적이 아쿠아포린-4(aquaporin-4)임이 밝혀짐에 따라[1,21], 2006년에 항체를 반영하여 좀 더 간략해진 새 진단기준이 제시되었다(Table 2)[2]. 이후 알려진 것과는 달리 뇌병변이 상당히 많은 수에서 존재하며(13-46%)[22,23], 항체검사로 확진된 시신경척수염범주질환과 다발경화증의 차이점에 대해서 좀 더 많은 새로운 내용들이 밝혀짐에 따라 2015년에 AQP-4항체 검출여부를 기준으로 분류한 새로운 진단기준이 다시 제시되었다. (Table 2)[24]. 새로운 진단기준에서는 기존의 시신경염과 급성척수염 외에도 맨아래구역(area postrema)증후군, 급성뇌간(brainstem)증후군, 기면병(narcolepsy) 또는 급성사이뇌(diencephlon)병변, 증상성대뇌병변 등을 ‘핵심임상형질’로 설정하여 이 6개 특성 가운데 1개에 해당하면서 항체양성이며 다른 질환의 배제가 이뤄지면 항체양성 시신경척수염범주질환으로 진단할 수 있게 하였다[24]. 항체가 음성인 경우는 핵심임상형질 가운데 2개가 있으면서, 시신경염, 긴척수염(longitudinally extensive transverse myelitis, LETM), 맨아래구역(area postrema)증후군 중 한 개는 반드시 포함하거나, MRI에서 시신경척수염범주질환의 특이소견 등을 제시하였다[24].
시신경척수염범주질환의 가능성이 높은 임상 특징은 척수분절 3개 이상인 긴척수염, 양측시신경염, 딸꾹질 또는 구역, 구토를 동반한 경우 맨아래구역(area postrema) 또는 고립로핵(nucleus tractus solitarius)을 침범한 연수병변이다[3,24-27]. 특히 딸꾹질이나 구토는 시신경척수염범주질환의 16-43%에서 관찰되나 다발경화증에서는 관찰되지 않아 시신경척수염범주질환을 강력히 의심하게 하는 임상증상이다[25,26,28,29]. 그러나 척수염과 시신경염은 다발경화증에서도 나타나므로 임상적으로 질환을 명확히 감별하기는 어렵지만 감별에 도움이 되는 몇 가지 특징이 있다.
‘척수분절 3개 이상의 긴척수염’으로 나타난 경우 많은 수(32-80%)에서 AQP-4 항체양성을 보이며, 다발경화증에서는 대체로 척수분절 3개보다 짧은 분절을 침범하며 병변이 척수의 일부분만을 침범하는 양상으로 나타나므로, ‘척수분절 3개 이상의 긴척수염’은 시신경척수염범주질환을 시사하는 중요한 소견으로 인정되고 있다[24,25,27,30]. 그런데 최근 AQP-4 항체양성 척수염의 일부(14%)는 ‘짧은척수염’(3개 척수분절보다 짧은 척수염)으로 처음 발현되며, 이 중 대부분(92%)이 재발 시에 LETM으로 나타남이 밝혀짐에 따라, ’짧은척수염’이라도 시신경척수염범주질환의 가능성을 여전히 고려해야 한다[31]. 이외에도 ‘T1 강조영상 저음영’의 척수 MRI 소견이 다발경화증보다 시신경척수염범주질환에서 더 흔히 관찰되며[25,30,32,33], ‘T2 강조영상에서 밝은 점의 병변(bright spotty lesion, BSL)’이 시신경척수염범주질환에서 특징적으로 관찰된다[25,30,33-35]. 척수 중심부를 침범한 척수염 또는 강직연축(tonic spasm)의 존재도 시신경척수염범주질환을 강력히 시사하는 소견이다[25,32,36,37].
시신경염이 양측, 안구 뒤, 시신경교차까지 침범되는 긴병변의 경우와 시력저하의 후유증이 심한 경우는 시신경척수염범주질환을 더 시사한다[38-40]. 시신경의 축삭 부분인 망막신경섬유층(retinal nerve fiber layer, RNFL)의 두께를 측정할 수 있는 빛간섭단층촬영(optical coherence tomography, OCT)도 두 질환의 감별에 도움을 줄 수 있다(Fig. 1)[32]. 시신경염 이후에 망막신경섬유층과 망막신경섬유의 신경세포체가 분포하는 신경절세포층(ganglion cell layer, GCL)의 두께 감소가 관찰되는데, 시신경척수염범주질환에서 다발경화증보다 감소가 더 현저하다[41]. 다발경화증의 경우 시신경염의 병력이 없는 눈에서도 망막신경섬유층과 신경절세포층의 두께가 감소되는데, 이는 시신경척수염범주질환에서는 관찰되지 않는다[41]. 시신경염이 발생했던 눈에서, 무증상 눈에 비해 망막신경섬유층이 15 micrometer 이상 감소된 경우는 다발경화증(24%)보다는 시신경척수염(75%)일 가능성이 높다[32]. 또한 시신경척수염범주질환은 전반적인 망막신경섬유의 감소를 보이나 다발경화증에서는 시신경유두황반다발(papillomacular bundle)이 분포한 측두부(temporal quadrant) 망막신경섬유층이 특징적으로 감소한다[42]. 그리고 시신경염 이후 OCT에서 망막의 내부핵층(inner nuclear layer)에 미세한 낭종이 형성되는 미세낭황반부종(microcystic macular edema) 소견이 관찰되기도 하는데, 다발경화증(5%)에 비해 시신경척수염범주질환(20-40%)에서 더 흔히 관찰된다[41].
뇌 MRI 소견이 두 질환의 감별에 도움이 될 수 있다. 과거에는 시신경척수염범주질환은 뇌병변이 없다고 알려져 있었으나, 이후 시신경척수염범주질환의 50% 이상에서 뇌병변이 관찰되며 일부(13-66%)는 다발경화증 뇌병변과 흡사하게 나타나기도 한다는 것이 밝혀졌다[30,43,44]. 1) 피질척수로를 따라 발생한 긴 병변, 2) 큰 뇌반구의 병변, 3) 측뇌실(lateral ventricle)을 둘러싼 뇌실막 주변(periependymal)의 아치형 다리모양의 병변, 4) 사이뇌(diencephalic)병변(시상하부 침범), 5) 등쪽뇌간(dorsal brainstem)병변(area postrema 침범 또는 수도관 주위), 6) 경수에서 연수까지 걸쳐 있는 병변, 7) 구름모양의 경계가 불분명한 조영증강병변 등은 시신경척수염범주질환을 더 시사하는 소견이다(Fig. 2)[19,20,22,25,34,35]. 1) U-섬유를 침범하는 피질곁병변, 2) 피질병변, 3) 측뇌실주변의 뇌정맥주행경로를 따라 수직으로 나타난 타원형 또는 손가락모양의 병변(Dawson’s finger)과 4) 무증상조영증강 또는 타원형이나 반지형의 조영증강병변은 다발경화증을 더 시사하는 소견이다(Fig. 3)[44]. 2013년에는 Matthews 등이 44명의 시신경척수염범주질환과 50명의 재발완화형 다발경화증 환자에서 뇌 MRI T2 강조병변 지도를 작성하여, 이로부터 병변확률(lesion probability)에 대한 복셀분석(voxel-wise analysis)을 시행해서, 다발경화증을 시신경척수염범주질환으로부터 감별하는 알고리듬을 만들었는데, 1) 병변이 측뇌실의 체부근처와 하부측두엽에 있을 경우 2) U-섬유침범 병변 또는 3) Dawson’s finger 병변의 세 가지 조건 중 한 가지 이상을 만족할 경우 다발경화증을 시사한다고 밝혔다[45].
새로운 뇌 MRI 기법을 이용하여 두 질환의 차이를 확인하여 감별진단에 이용하려는 연구가 최근 활발히 이루어지고 있다. 확산텐서영상(diffusion tensor imaging, DTI)에서 시신경척수염범주질환과는 달리 다발경화증에서는 정상으로 보이는 조직에도 이미 손상이 관찰된다[30]. 고해상도 MRI(3T 또는 7T)에서는 병변 내부에 중심정맥이 분포하는 것을 관찰할 수 있는데, 다발경화증의 경우 대부분(80-100%)의 병변 중심에 정맥이 분포하는 것이 특징이나 시신경척수염범주질환에는 일부 병변(9-35%)에만 정맥이 분포하여 감별에 도움이 될 수 있다[25,46,47]. 또한 수소자기공명분광법(1H-MR spectroscopy)영상에서 다발경화증에 비해 시신경척수염범주질환병변에서 별아교세포손상을 시사하는 myo-inositol/creatinine 값이 감소되어 향후 두 질환을 구별하는 영상표지자로 이용될 수도 있다[48].
REFERENCES
1. Lennon VA, Wingerchuk DM, Kryzer TJ, Pittock SJ, Lucchinetti CF, Fujihara K, et al. A serum autoantibody marker of neuromyelitis optica: distinction from multiple sclerosis. Lancet 2004;364:2106-2112.


2. Wingerchuk DM, Lennon VA, Pittock SJ, Lucchinetti CF, Weinshenker BG. Revised diagnostic criteria for neuromyelitis optica. Neurology 2006;66:1485-1489.


3. Wingerchuk DM, Lennon VA, Lucchinetti CF, Pittock SJ, Weinshenker BG. The spectrum of neuromyelitis optica. Lancet Neurol 2007;6:805-815.


4. Pugliatti M, Rosati G, Carton H, Riise T, Drulovic J, Vécsei L, et al. The epidemiology of multiple sclerosis in Europe. Eur J Neurol 2006;13:700-722.


5. Wingerchuk DM, Carter JL. Multiple sclerosis: current and emerging disease-modifying therapies and treatment strategies. Mayo Clin Proc 2014;89:225-240.


6. Compston A. Genetic epidemiology of multiple sclerosis. J Neurol Neurosurg Psychiatry 1997;62:553-561.



7. Kim NH, Kim HJ, Cheong HK, Kim BJ, Lee KH, Kim EH, et al. Prevalence of multiple sclerosis in Korea. Neurology 2010;75:1432-1438.


8. Wingerchuk DM, Hogancamp WF, O'Brien PC, Weinshenker BG. The clinical course of neuromyelitis optica (Devic's syndrome). Neurology 1999;53:1107-1114.


9. Pandit L, Asgari N, Apiwattanakul M, Palace J, Paul F, Leite MI, et al. Demographic and clinical features of neuromyelitis optica: A review. Mult Scler 2015;21:845-853.



10. Pittock SJ, Lucchinetti CF. Neuromyelitis optica and the evolving spectrum of autoimmune aquaporin-4 channelopathies: a decade later. Ann N Y Acad Sci 2016;1366:20-39.


11. Siritho S, Nakashima I, Takahashi T, Fujihara K, Prayoonwiwat N. AQP4 antibody-positive Thai cases: clinical features and diagnostic problems. Neurology 2011;77:827-834.



12. Kim SM, Waters P, Woodhall M, Yang JW, Yang H, Kim JE, et al. Characterization of the spectrum of Korean inflammatory demyelinating diseases according to the diagnostic criteria and AQP4-Ab status. BMC Neurol 2014;14:93.



13. Etemadifar M, Nasr Z, Khalili B, Taherioun M, Vosoughi R. Epidemiology of neuromyelitis optica in the world: a systematic review and meta-analysis. Mult Scler Int 2015;2015:174720.



14. Poser CM, Paty DW, Scheinberg L, McDonald WI, Davis FA, Ebers GC, et al. New diagnostic criteria for multiple sclerosis: guidelines for research protocols. Ann Neurol 1983;13:227-231.


15. McDonald WI, Compston A, Edan G, Goodkin D, Hartung HP, Lublin FD, et al. Recommended diagnostic criteria for multiple sclerosis: guidelines from the International Panel on the diagnosis of multiple sclerosis. Ann Neurol 2001;50:121-127.


16. Polman CH, Reingold SC, Edan G, Filippi M, Hartung HP, Kappos L, et al. Diagnostic criteria for multiple sclerosis: 2005 revisions to the "McDonald Criteria". Ann Neurol 2005;58:840-846.


17. Kappos L, Polman CH, Freedman MS, Edan G, Hartung HP, Miller DH, et al. Treatment with interferon beta-1b delays conversion to clinically definite and McDonald MS in patients with clinically isolated syndromes. Neurology 2006;67:1242-1249.


19. Comi G, Martinelli V, Rodegher M, Moiola L, Bajenaru O, Carra A, et al. Effect of glatiramer acetate on conversion to clinically definite multiple sclerosis in patients with clinically isolated syndrome (PreCISe study): a randomised, double-blind, placebo-controlled trial. Lancet 2009;374:1503-1511.


20. Montalban X, Tintore M, Swanton J, Barkhof F, Fazekas F, Filippi M, et al. MRI criteria for MS in patients with clinically isolated syndromes. Neurology 2010;74:427-434.


21. Lennon VA, Kryzer TJ, Pittock SJ, Verkman AS, Hinson SR. IgG marker of optic-spinal multiple sclerosis binds to the aquaporin-4 water channel. J Exp Med 2005;202:473-477.



22. Kim W, Park MS, Lee SH, Kim SH, Jung IJ, Takahashi T, et al. Characteristic brain magnetic resonance imaging abnormalities in central nervous system aquaporin-4 autoimmunity. Mult Scler 2010;16:1229-1236.


23. Kim W, Kim SH, Lee SH, Li XF, Kim HJ. Brain abnormalities as an initial manifestation of neuromyelitis optica spectrum disorder. Mult Scler 2011;17:1107-1112.


24. Wingerchuk DM, Banwell B, Bennett JL, Cabre P, Carroll W, Chitnis T, et al. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders. Neurology 2015;85:177-189.



25. Kim HJ, Paul F, Lana-Peixoto MA, Tenembaum S, Asgari N, Palace J, et al. MRI characteristics of neuromyelitis optica spectrum disorder: an international update. Neurology 2015;84:1165-1173.



26. Popescu BF, Lennon VA, Parisi JE, Howe CL, Weigand SD, Cabrera-Gómez JA, et al. Neuromyelitis optica unique area postrema lesions: nausea, vomiting, and pathogenic implications. Neurology 2011;76:1229-1237.



27. Weinshenker BG, Wingerchuk DM, Vukusic S, Linbo L, Pittock SJ, Lucchinetti CF, et al. Neuromyelitis optica IgG predicts relapse after longitudinally extensive transverse myelitis. Ann Neurol 2006;59:566-569.


28. Misu T, Fujihara K, Nakashima I, Sato S, Itoyama Y. Intractable hiccup and nausea with periaqueductal lesions in neuromyelitis optica. Neurology 2005;65:1479-1482.


29. Takahashi T, Miyazawa I, Misu T, Takano R, Nakashima I, Fujihara K, et al. Intractable hiccup and nausea in neuromyelitis optica with anti-aquaporin-4 antibody: a herald of acute exacerbations. J Neurol Neurosurg Psychiatry 2008;79:1075-1078.


30. Tackley G, Kuker W, Palace J. Magnetic resonance imaging in neuromyelitis optica. Mult Scler 2014;20:1153-1164.


31. Flanagan EP, Weinshenker BG, Krecke KN, Lennon VA, Lucchinetti CF, McKeon A, et al. Short myelitis lesions in aquaporin-4-IgG-positive neuromyelitis optica spectrum disorders. JAMA Neurol 2015;72:81-87.



32. Nakamura M, Miyazawa I, Fujihara K, Nakashima I, Misu T, Watanabe S, et al. Preferential spinal central gray matter involvement in neuromyelitis optica. An MRI study. J Neurol 2008;255:163-170.


33. Pekcevik Y, Mitchell CH, Mealy MA, Orman G, Lee IH, Newsome SD, et al. Differentiating neuromyelitis optica from other causes of longitudinally extensive transverse myelitis on spinal magnetic resonance imaging. Mult Scler 2015;22:302-311.



34. Yonezu T, Ito S, Mori M, Ogawa Y, Makino T, Uzawa A, et al. “Bright spotty lesions” on spinal magnetic resonance imaging differentiate neuromyelitis optica from multiple sclerosis. Mult Scler 2014;20:331-337.


35. Hyun JW, Kim SH, Jeong IH, Lee SH, Kim HJ. Bright spotty lesions on the spinal cord: an additional MRI indicator of neuromyelitis optica spectrum disorder? J Neurol Neurosurg Psychiatry 2015;86:1280-1282.


36. Kim SM, Go MJ, Sung JJ, Park KS, Lee KW. Painful tonic spasm in neuromyelitis optica: incidence, diagnostic utility, and clinical characteristics. Arch Neurol 2012;69:1026-1031.


37. Usmani N, Bedi G, Lam BL, Sheremata WA. Association between paroxysmal tonic spasms and neuromyelitis optica. Arch Neurol 2012;69:121-124.


38. Storoni M, Davagnanam I, Radon M, Siddiqui A, Plant GT. Distinguishing optic neuritis in neuromyelitis optica spectrum disease from multiple sclerosis: a novel magnetic resonance imaging scoring system. J Neuroophthalmol 2013;33:123-127.


39. Khanna S, Sharma A, Huecker J, Gordon M, Naismith RT, Van Stavern GP. Magnetic resonance imaging of optic neuritis in patients with neuromyelitis optica versus multiple sclerosis. J Neuroophthalmol 2012;32:216-220.


40. Fernandes DB, Ramos Rde I, Falcochio C, Apostolos-Pereira S, Callegaro D, Monteiro ML. Comparison of visual acuity and automated perimetry findings in patients with neuromyelitis optica or multiple sclerosis after single or multiple attacks of optic neuritis. J Neuroophthalmol 2012;32:102-106.


41. Kremer S, Renard F, Achard S, Lana-Peixoto MA, Palace J, Asgari N, et al. Use of Advanced Magnetic Resonance Imaging Techniques in Neuromyelitis Optica Spectrum Disorder. JAMA Neurol 2015;72:815-822.



42. Ratchford JN, Quigg ME, Conger A, Frohman T, Frohman E, Balcer LJ, et al. Optical coherence tomography helps differentiate neuromyelitis optica and MS optic neuropathies. Neurology 2009;73:302-308.



43. Kim W, Kim SH, Huh SY, Kim HJ. Brain abnormalities in neuromyelitis optica spectrum disorder. Mult Scler Int 2012;2012:735486.



44. Huh SY, Min JH, Kim W, Kim SH, Kim HJ, Kim BJ, et al. The usefulness of brain MRI at onset in the differentiation of multiple sclerosis and seropositive neuromyelitis optica spectrum disorders. Mult Scler 2014;20:695-704.


45. Matthews L, Marasco R, Jenkinson M, Küker W, Luppe S, Leite MI, et al. Distinction of seropositive NMO spectrum disorder and MS brain lesion distribution. Neurology 2013;80:1330-1337.



46. Sinnecker T, Dorr J, Pfueller CF, Harms L, Ruprecht K, Jarius S, et al. Distinct lesion morphology at 7-T MRI differentiates neuromyelitis optica from multiple sclerosis. Neurology 2012;79:708-714.


47. Quinn MP, Kremenchutzky M, Menon RS. Venocentric Lesions: An MRI Marker of MS? Front Neurol 2013;4:98.



48. Ciccarelli O, Thomas DL, De Vita E, Wheeler-Kingshott CA, Kachramanoglou C, Kapoor R, et al. Low myo-inositol indicating astrocytic damage in a case series of neuromyelitis optica. Ann Neurol 2013;74:301-305.


49. Jarius S, Paul F, Franciotta D, Ruprecht K, Ringelstein M, Bergamaschi R, et al. Cerebrospinal fluid findings in aquaporin-4 antibody positive neuromyelitis optica: results from 211 lumbar punctures. J Neurol Sci 2011;306:82-90.


Figure 1.
Optical coherence tomography finding of normal macula. Normal macula consists of multiple layers including retinal nerve fiber layer (RNFL), ganglion cell layer (GCL), inner plexiform layer (IPL), inner nuclear layer (INL), outer plexiform layer (OPL), outer nuclear layer (ONL), external limiting membrane (ELM), outer segment of photoreceptor (OS), inner segment and outer segment connecting cilia of photoreceptor (IS/OS), and retinal pigment epithelium (RPE).
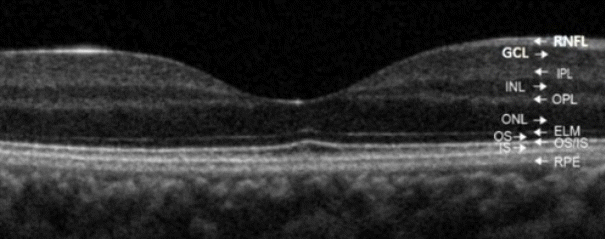
Figure 2.
Characteristic appearances of neuromyelitis optica spectrum disorder on MRI. Lesions involving longitudinal corticospinal tracts from the internal capsule to cerebral peduncle (A-C), cervicomedullary extending lesion (D), lesions involving area postrema (E), periependymal lesions surrounding lateral ventricle such as “arch-bridge sign”(F and G), extensive hemispheric lesions being tumefactive (H) or spindle like (I), and diencephalic lesion (J) were commonly presented in neuromyelitis optica spectrum disorders (some figures are revised from reference 22 and 23).
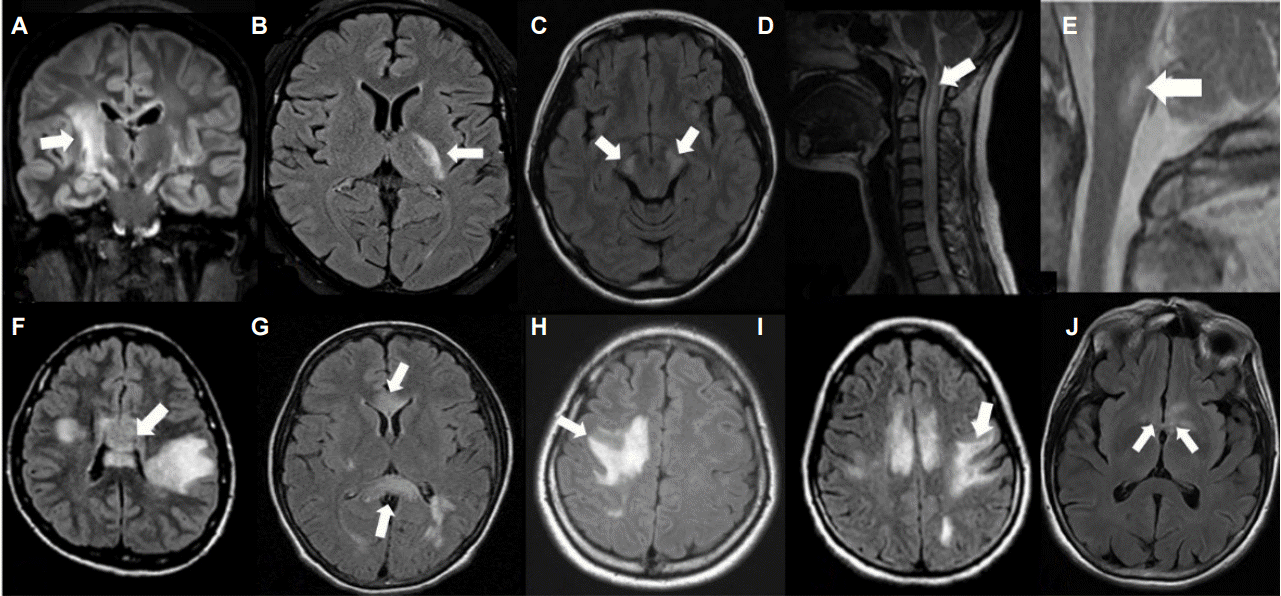
Figure 3.
Typical appearance of multiple sclerosis lesions on MRI. Lesions involving U-fibers (A), Dawson’s finger like lesion (B and D), ovoid lesion perpendicular to ventricle (C), and ovoid or ring gadolinium-enhanced lesion (E) are known as specific multiple sclerosis lesions (some figures are revised from reference 44). MRI; magnetic resonance imaging.
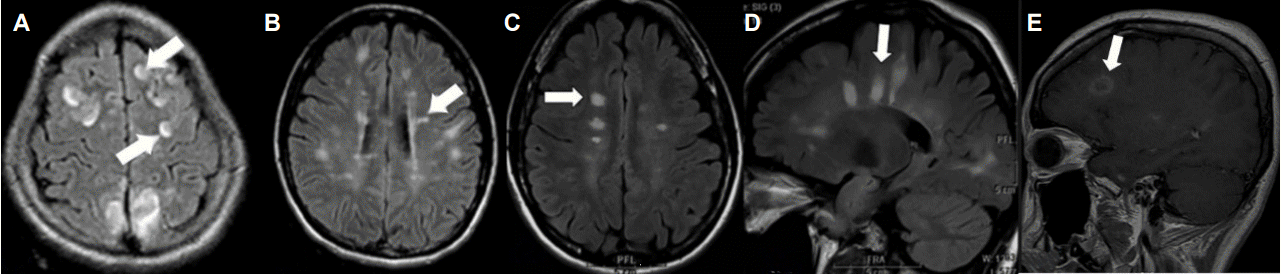
Table 1.
MRI criteria for dissemination in space and time for multiple sclerosis
Table 2.
Criteria for neuromyelitis optica or neuromyelitis optica spectrum disorders
- TOOLS
-
METRICS

-
- 3 Crossref
- 0 Scopus
- 18,701 View
- 848 Download
- Related articles
-
Advances in the Treatment of Neuromyelitis Optica Spectrum Disorder2022 February;40(1)
Diagnosis of Multiple Sclerosis: 2017 McDonald Diagnostic Criteria2018 November;36(4)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



