| J Korean Neurol Assoc > Volume 33(4); 2015 > Article |
Abstract
Background:
Patients with lacunar infarction often show neurological deterioration during the acute period of stroke. The aim of this study was to identify the predictors for early neurological deterioration (END) in patients with lacunar infarction using clinical variables and the findings of diffusion-weighted imaging (DWI).
Methods:
This study involved 104 consecutive patients with acute lacunar infarction in the lenticulostriate artery territory who were admitted within 24 hours after onset between January 2010 and October 2014. END was defined as a decrease of ≥1 point in the National Institutes of Health Stroke Scale (NIHSS) motor score or ≥2 points in the total NIHSS score during the first 7 days after stroke onset. Clinical characteristics including initial NIHSS score, vascular risk factors, laboratory parameters, and DWI findings including the size, location, and shape of the lacunar infarction were evaluated to identify predictors for END.
Results:
END occurred in 25 (24%) patients with lacunar infarction. The initial NIHSS score (odds ratio, 1.47; p=0.01), number of infarct slices (odds ratio, 1.95; p<0.01), and infarction with an irregular shape (odds ratio, 2.87; p=0.048) were independently associated with END in multivariable logistic regression analysis. In receiver operating characteristic curve analysis, the best threshold for predicting END was an NIHSS score of 4 points (sensitivity, 72%; specificity, 68%) and an infarct slice number of 3 (sensitivity, 84%; specificity, 62%).
열공뇌경색은 일반적으로 좋은 예후를 보이는 뇌경색으로 알려져 있다. 소혈관질환에 의해 발생하는 열공뇌경색은 대혈관질환이나 심장성색전증에 의해 발생하는 뇌경색보다 신경계 장애 정도가 경하고, 기능적인 예후가 좋으며, 사망률이 낮다고 보고되었다[1-3]. 그러나 여러 연구에 의하면 상당 부분(21-43%)의 열공뇌경색 환자는 급성기에 신경학적 악화를 경험하며[4-8], 신경학적 악화가 발생한 환자는 그렇지 않은 환자에 비해 심한 신경계장애가 남고 기능적 예후가 나쁘다[5-7,9].
열공뇌경색 환자에서 신경학적 악화를 예측할 수 있는 여러가지 임상 변수들이 연구되었지만 신경학적 악화와 연관된 뇌영상 소견에 대한 연구는 드물다[4,7,8,10,11]. 초기 NIH뇌졸중척도(National Institutes of Health Stroke Scale, NIHSS) 점수, 당뇨 병력, 백혈구 수, 혈장 총 콜레스테롤 수치, 병변의 위치, 크기, 모양 등이 신경학적 악화와 관련 있다고 보고되었으나 결과의 재현성이 떨어지고, 뇌영상 정보가 부족하며, 신경학적 악화를 예측하는데 효과적이지 않았다. 따라서 좀 더 다양한 뇌영상 소견을 포함하고 예측력도 높이는 연구가 필요하다.
이 연구는 후향적으로 이루어졌으며 2010년 1월부터 2014년 10월까지 단국대학교 병원에 급성뇌졸중으로 입원한 환자 중에서 증상 발생 후 24시간 이내에 magnetic resonance imaging (MRI)를 시행한 환자를 대상으로 하였다. 이 중에서 대뇌부챗살(corona radiata) 또는 기저핵(basal ganglia)과 대뇌부챗살에 국한되어 20 mm 이하의 뇌경색이 관찰되며 열공증후군을 보인 환자를 연구에 포함하였다. 심장성색전증 인자가 있거나 동측의 중대뇌동맥 또는 내경동맥에 50% 이상의 협착이 있는 환자는 제외하였다.
신경계장애는 NIHSS점수를 매일 측정하여 평가하였다. 초기 신경학적 악화는 증상 발생 후 1주일 이내에 NIHSS의 운동 항목 점수가 1점 이상 악화되거나 전체 NIHSS점수가 2점 이상 악화된 경우로 정의하였고[4,11,13], 초기 신경학적 악화 여부에 따라서 환자들을 신경학적 악화군과 비악화군으로 나누었다.
환자가 내원 시에 연령, 성별, 위험인자, NIHSS점수, 첫 증상 발견 시간을 조사하여 기록하였다. 위험인자에는 고혈압(혈압이 140/90 mmHg 이상이거나 항고혈압제 복용), 당뇨병(공복 시 혈당이 140 mg/dL 이상이거나 당뇨병약 복용), 고지질혈증(혈장 총콜레스테롤 수치가 220 mg/dL 이상이거나 항고지질혈증제 복용), 흡연(현재 흡연 여부), 심장성색전증 인자(심방세동, 판막질환, 울혈심부전, 심근경색 등)가 포함되었다. 모든 환자에서 혈액검사, 심전도, 심장초음파를 시행하였다. 뇌경색의 병인분류는 Trial of Org 10172 in Acute Stroke Treatment 분류를 사용하였고[14], 이 분류에 의하여 병인이 소혈관질환인 환자만 연구에 포함하였다. 환자가 퇴원 시에 수정Rankin척도(modified Rankin Scale, mRS)를 측정하여 단기 예후지표로 이용하였다.
모든 환자에서 MRI와 magnetic resonance angiography (MRA)를 시행하였다. MRI는 1.5-T 초전도 영상장치를 사용하였고, 확산강조영상(TR, 8,000 msec; TE, 65.8 msec; b value, 1,000 sec/mm2; field of view, 240 × 240; matrix size, 128 × 128; slice thickness, 5 mm; interslice gap, 1.5 mm)을 포함하였다.
뇌경색 크기는 확산강조영상에서 가장 큰 병변의 면적으로 측정하였다. 면적의 측정은 의료영상저장전송시스템(ViewRex, TechHeim, Seoul, Korea)에 구현된 소프트웨어를 이용하였다. 이 소프트웨어는 병변의 외곽선을 따라서 경계를 그려주면 자동으로 면적을 측정해 주는 프로그램이다. 뇌경색의 수직적인 크기는 확산강조영상에서 뇌경색이 보이는 절편의 수로 측정하였다.
뇌경색의 위치는 ‘(병변과 외측뇌실 뒷뿔 사이의 거리)/(외측 뇌실의 앞뿔과 뒷뿔 사이의 거리)’로 정의하였고 이 비율이 0.5 이하인 경우 후방형으로 정의하였다(Fig. 1).
연구에 포함된 열공뇌경색 환자들을 신경학적 악화군과 비악화군으로 분류하여 임상적인 특성을 비교 분석하였다. 연속형 변수의 비교에는 독립적 T검정(independent t-test)을 이용하였으며, 비모수검정이 필요한 경우에는 Mann-Whitney U test를 이용하였고, 범주형 변수의 비교에는 카이제곱검정(chi-square test)을 이용하였다.
단변량분석 후 신경학적 악화의 독립적인 예측인자를 분석하기 위해서 다변량회귀분석을 하였다. 단변량분석에서 p<0.2 인 변수와 임상적으로 의미가 있는 변수를 다변량회귀분석 모델에 포함하여 단계적 후향소거법(backward stepwise regression with Wald statistics)으로 상관성이 낮은 변수부터 제거한 뒤 통계적으로 유의한 변수들만으로 구성된 회귀분석모델을 구축하였다. 다변량 회귀분석 후 통계적으로 유의한 예측인자에 대해서는 Receiver operating characteristic (ROC) 곡선 분석을 시행하여 예측 민감도와 특이도를 측정하였다. 통계적 유의 수준은 p<0.05로 하였고 통계분석에는 SPSS (version 18.0, SPSS Inc., Chicago, IL, USA)를 사용하였다.
연구 기간 동안 전체 열공뇌경색 환자는 608명이었으며 이 중에서 대뇌부챗살 부위에 뇌경색을 가진 환자는 213명이었고 이 중 24시간 이내에 MRI를 시행하여 본 연구에 포함된 환자는 104명이었다. 이 중 25명(24%)의 환자에서 신경학적 악화가 발생하였다. 신경학적 악화군과 비악화군의 임상적 특성을 비교하여 Table 1에 정리하였다. 양 군 사이에 연령, 성별 등의 인구학적 특성과 뇌경색 위험인자, 혈압, 혈액인자들은 통계적으로 유의한 차이가 없었다. 내원시 NIHSS점수는 신경학적 악화군이 비악화군보다 높았으며(median, 4 vs. 3; p<0.01), 퇴원 시 mRS점수도 신경학적 악화군이 더 높았고(3.4±0.9 vs. 1.5±0.9; p<0.01), mRS점수가 2점을 초과한 환자도 더 많았다(90% vs. 16%; p<0.01).
뇌영상 변수 중 뇌경색의 위치는 양 군 사이에 차이가 없었으며, 후방형 뇌경색의 빈도도 양 군 사이에 차이가 없었다(Table 2). 뇌경색의 면적은 신경학적 악화군에서 더 컸고(98.2±40.4 vs. 75.1± 49.9 mm2; p=0.04) 병변 절편 수도 신경학적 악화군에서 더 많았다(3.6±1.1 vs. 2.5±1.1; p<0.01). 뇌경색 모양은 신경학적 악화군에서 불규칙한 모양이 더 많았다(64% vs. 35%; p=0.02). 병변측 중대뇌동맥에 50% 미만의 협착을 가진 환자의 빈도수는 양 군에서 차이가 없었다(12% vs. 11%; p=1.00).
단변량비교분석에서 p<0.2이었던 변수인 NIHSS점수, 뇌경색 면적, 병변의 절편 수, 불규칙한 모양, 고지질혈증, 혈색소, 혈당, 콜레스테롤 수치와 임상적인 의미를 고려할 수 있는 나이, 성별, 내원시 혈압, 증상 후 MRI 촬영까지 경과시간을 포함하여 시행한 다변량 분석에서는 NIHSS점수, 병변 절편 수, 불규칙한 모양만 신경학적 악화에 독립적으로 영향을 주는 변수로 남았다(Table 3). 이전의 뇌졸중으로 인한 신경계장애가 신경학적 악화의 진단에 미치는 영향을 배제하기 위하여 과거 뇌졸중의 병력을 가진 환자를 제외하고 시행한 다변량 분석에서도 유사한 결과를 보여주었다(Table 3).
다변량회귀분석에서 예측인자로 확인된 NIHSS점수와 병변 절편 수를 이용한 신경학적 악화의 예측 정도를 알아보기 위해서 ROC 분석을 하였다(Fig. 3). ROC 곡선 아래의 면적은 두 변수 모두 0.75 (95% confidence interval [CI], 0.65-0.85; p<0.01)로 유사하였다. 예측 기준은 NIHSS점수 4점 이상, 병변 절편 수는 3개 이상일 때 민감도(각각 72%, 84%)와 특이도(각각 68%, 62%)가 가장 높았다. NIHSS점수가 4점 미만인 환자의 12%에서 신경학적 악화가 발생하였고 4점 이상인 환자에서는 42%가 신경학적 악화가 발생하여 교차비는 5.6 (95% CI, 2.1-15.0; p<0.01)이었다. 병변 절편 수의 경우 3개 미만인 환자의 8%, 3개 이상인 환자의 41%가 신경학적 악화가 발생하여 교차비는 8.5 (95% CI, 2.7-27.4; p<0.01)이었다.
본 연구는 이전의 연구들보다 많은 뇌영상 변수를 포함하였고 뇌경색 크기의 경우 수평 및 수직적 크기로 나누어서 좀 더 세밀한 병변 분석을 하였다. 또한 ROC 분석을 추가하여 실제 임상에서 쉽게 사용할 수 있는 지표를 얻으려고 하였다. 분석 결과 열공뇌경색 환자에서 신경학적 악화를 예측할 수 있는 인자는 초기 NIHSS점수, 뇌경색의 수직적인 크기, 불규칙한 모양으로 확인되었다.
이전에도 초기 NIHSS점수가 신경학적 악화를 예측할 수 있다고 보고된 바 있다[7,9,17]. 본 연구에서는 추가적으로 ROC 분석을 통하여 예측력이 높은 NIHSS점수 기준(4점 이상)을 구하였다. 이와 비슷한 연구로 NIHSS점수 8점 이상을 기준으로 했을 때 신경학적 악화를 가장 잘 예측할 수 있다는 연구가 있었는데 그 연구는 열공뇌경색만이 아닌 모든 종류의 뇌경색 환자를 대상으로 한 결과였다. 본 연구의 결과는 열공뇌경색의 환자의 경우 NIHSS 4점 이상이 더욱 적합한 예측 기준이 될 수 있으며, 뇌경색의 원인에 따라서 예측 점수 기준은 달라야 한다는 것을 시사한다. 뇌경색의 원인에 따라서 그에 맞는 기준을 적용한다면 좀 더 정확한 예측을 하는데 도움이 될 것이다.
열공뇌경색의 병변 크기와 신경학적 악화와의 연관성에 대해서는 다양한 결과가 보고되었다[4,7,8,12]. 일부 연구에서는 신경학적 악화군이 비악화군보다 뇌경색 크기가 더 컸으나[4,7], 다른 연구에서는 유의한 차이가 없었다[8,12]. 연구에 따라서 확산강조영상, T2강조영상, 혹은 액체감쇠역전회복 영상을 사용하여 검사한 뇌영상의 종류가 다르고, 증상 발생 후 촬영까지 경과한 시간(평균 3시간-12.8일)도 다르며, 병변 크기의 측정 방법(직경, 면적, 부피)도 달라서 결과가 일치하지 않은 것으로 사료된다. 본 연구에서는 뇌경색의 수평적 크기와 수직적 크기 모두 신경학적 악화가 발생한 군에서 더 컸지만 다변량 분석에서는 뇌경색의 수직적인 크기만 신경학적 악화와 독립적인 연관성을 보여주었다. 병변의 수직적 크기는 관통혈관 근위부 또는 중대뇌동맥의 가기죽종질환(branch atheromatous disease)을 반영할 수 있으며 이런 경우에 모혈관의 죽종질환으로 인한 혈전증의 진행으로 그 분지 소혈관들의 뇌경색이 악화될 것이다[11,18-20]. 그러나 MRA에서 병변측 중대뇌동맥의 50% 미만의 협착이 악화군에서 더 많이 발견되지는 않았다. 이는 MRA로 중대뇌동맥의 가기죽종질환을 진단하는 것에는 한계가 있기 때문이라고 생각된다[20,21]
뇌경색의 불규칙한 모양도 신경학적 악화와 독립적인 연관 성이 있었으며 이는 이전의 연구결과와 일치한다[10,16]. 불규칙한 모양은 중대뇌동맥 줄기 부분의 폐색으로 인해 여기에서 분지 된 여러 관통혈관 부위의 경색을 시사한다[10,15] 여러 관통혈관 부위를 침범한 허혈 부위는 급성기에 경색의 진행에 취약할 수 있다.
뇌경색의 위치와 신경학적 악화와의 관계를 연구한 논문은 드물지만 최근의 한 논문에서 병변의 후방 위치가 신경학적 악화와 상관관계가 있다고 보고하였다[8]. 다른 한 논문에서는 후외측 줄무늬체(posterolateral striatum)의 병변이 신경학적 악화와 연관성을 시사하였다[22]. 그러나 본 연구에서는 뇌경색의 위치가 신경학적 악화군과 비악화군 간에 차이가 없었고, 후방에 위치한 뇌경색의 빈도도 양 군 간에 차이가 없었다. 이러한 결과의 차이는 연구들 간에 증상 발생 후 MRI 촬영까지의 시간(평균 11-40시간) 차이에 의한 확산강조영상 병변의 변화 및 측정 방법이 다르기 때문으로 추정된다[8].
뇌경색 급성기에 발생한 신경학적 악화는 예후를 나쁘게 하며 기능적 장애와 사망률을 증가시킨다[5-7,9]. 본 연구에서도 신경학적 악화를 경험한 신경학적 악화군은 퇴원시 mRS점수가 비악화군보다 높았으며 mRS 2점을 초과한 환자 수도 현저히 많았다(90% vs. 16%, p<0.01).
본 연구는 몇 가지 제한점을 가지고 있다. 연구 방식이 후향적이었고, 병변 분석의 균일성 및 편의성을 위하여 열공뇌경색의 위치를 대뇌부챗살로 제한하였다. 향후 모든 열공뇌경색의 부위를 포함하여 전향적인 연구를 한다면 본 연구결과를 좀 더 확실히 검증할 수 있을 것이다.
결론적으로 열공뇌경색 환자에서 신경학적 악화를 예측할 수 있는 임상 지표는 내원시 NIHSS점수였으며 의미 있는 뇌영상지표는 뇌경색 병변의 절편 수 및 불규칙한 모양이었다. 따라서 열공뇌경색 환자의 NIHSS점수가 4점 이상, 병변의 절편 수가 3개(수직 길이 19.5 mm) 이상 또는 불규칙한 모양인 경우 신경학적 악화의 가능성을 예상하고 대비해야 하며, 신경학적 악화를 예방하기 위한 임상시험도 이 환자군을 대상으로 하는 것이 효율적일 것이다.
REFEREBCES
1. Petty GW, Brown RD Jr, Whisnant JP, Sicks JD, O'Fallon WM, Wiebers DO. Ischemic stroke subtypes: a population-based study of functional outcome, survival, and recurrence. Stroke 2000;31:1062-1068.

2. Kolominsky-Rabas PL, Weber M, Gefeller O, Neundoerfer B, Heuschmann PU. Epidemiology of ischemic stroke subtypes according to TOAST criteria: incidence, recurrence, and long-term survival in ischemic stroke subtypes: a population-based study. Stroke 2001;32:2735-2740.

3. Grau AJ, Weimar C, Buggle F, Heinrich A, Goertler M, Neumaier S, et al. Risk factors, outcome, and treatment in subtypes of ischemic stroke: the German stroke data bank. Stroke 2001;32:2559-2566.

4. Terasawa Y, Iguchi Y, Kimura K, Kobayashi K, Aoki J, Matsumoto N, et al. Neurological deterioration in small vessel disease may be associated with increase of infarct volume. J Neurol Sci 2008;269:35-40.

5. Steinke W, Ley SC. Lacunar stroke is the major cause of progressive motor deficits. Stroke 2002;33:1510-1516.

6. Tei H, Uchiyama S, Ohara K, Kobayashi M, Uchiyama Y, Fukuzawa M. Deteriorating ischemic stroke in 4 clinical categories classified by the Oxfordshire Community Stroke Project. Stroke 2000;31:2049-2054.

7. Nakamura K, Saku Y, Ibayashi S, Fujishima M. Progressive motor deficits in lacunar infarction. Neurology 1999;52:29-33.

8. Ohara T, Yamamoto Y, Tamura A, Ishii R, Murai T. The infarct location predicts progressive motor deficits in patients with acute lacunar infarction in the lenticulostriate artery territory. J Neurol Sci 2010;293:87-91.

9. DeGraba TJ, Hallenbeck JM, Pettigrew KD, Dutka AJ, Kelly BJ. Progression in acute stroke: value of the initial NIH stroke scale score on patient stratification in future trials. Stroke 1999;30:1208-1212.

10. Ryu DW, Shon YM, Kim BS, Cho AH. Conglomerated beads shape of lacunar infarcts on diffusion-weighted MRI: what does it suggest? Neurology 2012;78:1416-1419.

11. Jeong HG, Kim BJ, Yang MH, Han MK, Bae HJ. Neuroimaging markers for early neurologic deterioration in single small subcortical infarction. Stroke 2015;46:687-691.

12. Yamada M, Yoshimura S, Kaku Y, Iwama T, Watarai H, Andoh T, et al. Prediction of neurologic deterioration in patients with lacunar infarction in the territory of the lenticulostriate artery using perfusion CT. AJNR Am J Neuroradiol 2004;25:402-408.
13. Saji N, Kimura K, Kawarai T, Shimizu H, Kita Y. Arterial stiffness and progressive neurological deficit in patients with acute deep subcortical infarction. Stroke 2012;43:3088-3090.

14. Adams HP Jr, Bendixen BH, Kappelle LJ, Biller J, Love BB, Gordon DL, et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment. Stroke 1993;24:35-41.

15. Hervé D, Mangin JF, Molko N, Bousser MG, Chabriat H. Shape and volume of lacunar infarcts: a 3D MRI study in cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy. Stroke 2005;36:2384-2388.

16. Feng C, Xu Y, Hua T, Liu XY, Fang M. Irregularly shaped lacunar infarction: risk factors and clinical significance. Arq Neuropsiquiatr 2013;71:769-773.

17. Yamamoto Y, Ohara T, Hamanaka M, Hosomi A, Tamura A, Akiguchi I, et al. Predictive factors for progressive motor deficits in penetrating artery infarctions in two different arterial territories. J Neurol Sci 2010;288:170-174.

18. Phan TG, van der Voort S, Beare R, Ma H, Clissold B, Holt M, et al. Dimensions of subcortical infarcts associated with first- to third-order branches of the basal ganglia arteries. Cerebrovasc Dis 2013;35:262-267.

19. Caplan LR. Lacunar infarction and small vessel disease: pathology and pathophysiology. J Stroke 2015;17:2-6.

20. Yamamoto Y, Ohara T, Hamanaka M, Hosomi A, Tamura A, Akiguchi I. Characteristics of intracranial branch atheromatous disease and its association with progressive motor deficits. J Neurol Sci 2011;304:78-82.

Figure 1.
The location of infarction on diffusion-weighted imaging. The lesion location is defined as the ratio of b (the distance between the lesion center and the posterior horn of the lateral ventricle)/a (the distance between the anterior and posterior horn of the lateral ventricle).
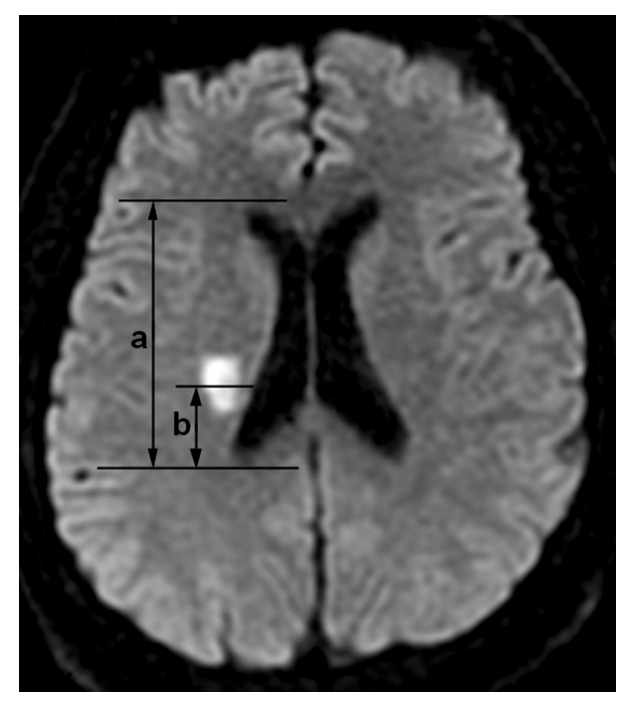
Figure 2.
The shapes of lacunar infarction on diffusion-weighted imaging. Ovoid (A) and circular shape (B) of infarctions are classified into the regular shape. Complex (C) and conglomerated beads shape (D) of infarctions are classified into the irregular shape.
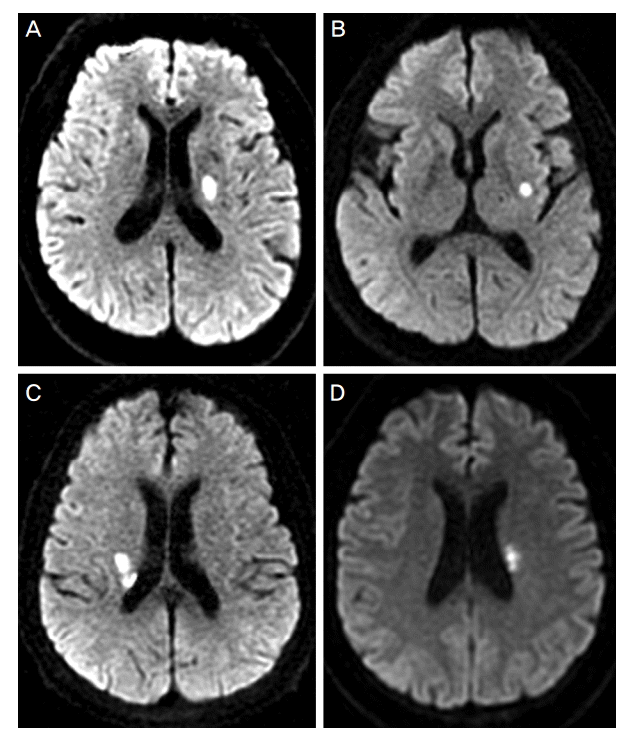
Figure 3.
Receiver operating characteristic (ROC) curves of the initial NIHSS score and infarct slice number for predicting early neurological deterioration (END). The area under the curve is 0.75(95% confidence interval, 0.65-0.85; p<0.01) for each variable. The best thresholds for predicting END are the National Institutes of Health Stroke Scale (NIHSS) score of 4 points and infarction slice number of 3.

Table 1.
Clinical characteristics in patients with END and without END
Table 2.
MRI parameters in patients with END and without END
Table 3.
Multivariable logistic regression analysis for early neurological deterioration (backward stepwise elimination with Wald statstics)
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 10,472 View
- 251 Download
- Related articles
-
Hemorrhagic Transformation in Thalamic Infarction2019 February;37(1)
Hypertensive Brainstem Encephalopathy in a Patient with Acute Lacunar Infarction2017 May;35(2)
Isolated Axial Lateropulsion in Lateral Medullary Infarction2014 ;32(4)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



