| J Korean Neurol Assoc > Volume 33(3); 2015 > Article |
Abstract
Migraine is a common cause of episodic headache disorder, and multiple factors are associated with the pathogenic mechanism underlying migraine. Recent studies suggest that genetic determinants influence migraine, most likely as part of a multifactorial mechanism. Due to the similarity in clinical features and pathophysiological mechanisms between familial hemiplegic migraine (FHM) and migraine with aura, FHM can be used as a model for migraine and aura. Mutations in the CACNA1A gene on chromosome 19p13 (FHM1), in the ATP1A2 gene at 1q23 (FHM2), and in the SCNA1A gene at 2q24 (FHM3) are responsible for most of the representative types of FHM. The recent beta version of the third edition of the International Classification of Headache Disorders contains revised diagnostic criteria for FHM, which include the above-three genetic factors. In this review we discuss the clinical and genetic features of FHM.
편두통은 유병률이 1-25%인 흔한 원발두통으로 아시아에서는 1-22%로 북미(9-16%)나 유럽(10-25%)에 비해 낮은 유병률을 보인다[1]. 한국의 편두통 유병률은 다른 아시아 국가에 비해 높다는 보고가 있었으며 최근 연구에서 전체 유병률은 6.1%로 여성에서 더 높은(여성 9.2%, 남성 2.9%) 것으로 알려져 있다[2,3]. 편두통의 발병기전에는 다양한 요인들이 복합적으로 관여하지만 편두통에 대한 가족연구와 쌍둥이를 대상으로 한 보고들을 통해 유전적인 요소가 중요한 역할을 한다고 생각되고 있다[4]. 전체적으로 편두통발병에 있어 유전적 요인의 기여도는 34-57% 정도로 생각되고 있다[4].
FHM은 일정한 정도의 운동약화를 동반하는 조짐편두통이 존재하며 1차 또는 2차 직계에서 운동약화를 동반하는 조짐편두통을 가진 가족구성원이 최소 1명 이상 있는 경우 진단할 수 있다. 1차 가족(first degree relative)은 부모, 형제, 자녀를 말하며 2차 가족(second degree relative)은 조부모, 부모의 형제, 형제의 자녀 및 자녀의 자녀를 말한다. FHM의 대부분은 보통염색체우성의 유전양상을 보이지만 일부에서는 감퇴발현(reduced penetrance)으로 인해 가족력이 확인되지 않을 수도 있다[5,8].
FHM은 전형적인 반신의 운동약화 외에도 약 15%에서 다른 신경학적 이상이 동반된다[6,9]. 반신마비 이외의 신경학적 이상으로는 운동실조와 구음장애, 안진 등을 동반한 소뇌증상이 가장 흔하다[9]. FHM 직계가족의 20%에서는 편두통 발작이나 반신마비 증상과 상관 없이 영구적인 소뇌기능 이상이 나타난다[9]. 또한 FHM 환자들은 감정적 스트레스나 경미한 두부 손상에 의해 편두통이 유발될 수 있으며 일부 환자에서는 뇌전증이 동반되기도 한다[10-12].
FHM은 일반적인 조짐편두통과 유전양상의 차이가 있지만 임상양상에서는 유사한 부분이 많다. FHM환자의 65% 이상에서는 특징적인 조짐편두통과 함께 무조짐편두통을 동반한다. 이러한 측면에서 FHM은 신경생리학적 기전을 공유하는 편두통의 한 범주에 해당한다고 볼 수 있다[6,13]. 실제로 FHM환자에서 반신마비 조짐 없이 시각조짐만을 동반한 일반적인 조짐편두통의 발병률이 정상인에 비해 7배 정도 높다고 알려져 있다[14].
FHM으로 진단된 44가계의 147명 환자를 대상으로 덴마크에서 시행한 대규모 연구에서 반신마비 증상은 환자의 약 60%에서 팔과 다리에 함께 발생하였으며 일반적인 조짐편두통 환자의 조짐에 비해 긴 시간 동안 지속되었다[6,9]. FHM환자에서 시각, 감각 및 언어 조짐 또한 지속시간이 긴 형태를 보였으나 대부분 12시간 이내였으며 24시간을 넘는 경우는 없었다. 그러나 운동조짐은 24시간 이상 지속되는 경우도 있었다.
운동조짐 이외에 가장 흔한 형태는 감각조짐으로 98%에서 나타난다. 시각조짐은 FHM환자의 89%에서 발생하며 일반적인 조짐편두통 환자(99%)에 비해 적게 나타나고 중심암점양상으로 나타나는 경우가 많다[15].
90% 이상의 FHM환자들은 한번의 편두통발작에서 4가지 조짐(운동, 시각, 감각, 언어) 중 3가지 이상이 복합적으로 나타나는 특징을 가지며 거의 모든 환자가 최소 2가지 이상의 조짐을 경험하게 된다(Fig. 1). FHM환자에서 조짐의 가장 전형적인 시간적 전개 양상은 시각조짐이 동반된 경우 시각조짐이 가장 먼저 발생하고 이어서 감각, 언어, 운동조짐이 발생하며 최종적으로 뇌간조짐증상이 발생하는 것이다. 이에 비해 일반적인 조짐편두통 환자의 2/3 이하에서만 두 가지 이상의 조짐이 복합적으로 나타나며 한 가지 조짐만 나타나는 경우가 흔하다[15].
FHM환자의 93% 이상은 조짐 이후 두통이 나타나게 되는데 이는 전형조짐편두통에서 조짐 후 두통의 병발이 58%에서 일어난다는 점과 차이를 보인다[15]. 그러므로 FHM에서 반신마비 조짐이 발생한 후 두통이 연달아 발생하지 않는 경우에는 진단에 주의가 필요할 수 있다.
최근의 연구에서 FHM의 두통발작에 대한 병태생리학적 발생기전이 일반적인 편두통과는 다를 것이라는 가능성이 제기되고 있다. 일반적인 편두통 환자들은 칼시토닌유전자관련펩티드(calcitonin gene related peptide, CGRP)나 산화질소(nitric oxide)에 민감성을 보여 이러한 물질을 투여하면 많은 수에서 편두통 발작이 발생하지만 FHM환자에서는 CGRP나 산화질소에 의한 편두통발작이 일반적인 편두통 환자에 비해 유의하게 적게 나타난다[16-18].
FHM은 다양한 유전형을 보이며 FHM 1형에서는 염색체 19p13의 CACNA1A 유전자변이가 알려져 있고 FHM 2형에서는 염색체 1q23의 ATP1A2 유전자변이가 FHM 3형에서는 염색체 2q24의 SCNA1A 유전자변이가 알려져 있다[19]. FHM의 진단기준에 합당하나 앞의 세 가지 유전자변이에 해당하지 않는 경우 FHM의 기타 유전자형으로 분류하며 염색체 1q31의 변이와 염색체 16p11의 PRRT2변이 그리고 염색체 4q13의 SLC4A4변이가 알려져 있다(Table).
국내에서도 FHM의 보고가 있었다. 한 증례에서 아들과 어머니에서 반신마비를 동반한 두통이 있는 경우를 보고하였으나 환자의 자기공명영상에서 뇌경색 소견이 보이고 환자 어머니의 반신마비 발생 당시 감별진단에 대하여 명확히 기술되지 않았다[20]. 또한 개정된 국제두통질환분류의 진단기준에 따라 반신마비를 동반한 두통이 2차례 이상 있어야 하지만 환자와 어머니 모두 한 번의 반신마비가 있던 점, 유전자 검사를 진행하지 않은 점에서 불충분한 부분이 있다.
또 다른 증례에서 반신마비와 의식변화로 내원하여 영상검사에서 소뇌위축이 관찰된 경우를 보고하였다[21]. 환자는 반신마비 편두통이 없는 기간에도 경미한 구음장애와 보행장애가 있었으며 본인과 어머니에서 반복적인 반신마비편두통발작이 있었다. 환자와 환자의 어머니 모두 FHM의 진단기준을 만족하며 유전자검사로 CACNA1A의 T666M변이를 확인하였고 FHM 1형의 T666M변이에 합당한 지속되는 소뇌증상, 의식변화를 동반한 반신마비 편두통의 임상증상을 보였다.
FHM1은 염색체 19p13과 연관되어 있으며 CACNA1A 유전자의 변이가 확인되었다[10,12]. CACNA1A 유전자는 편두통의 발병기전과 관련된 뇌신경부위인 대뇌피질, 삼차신경핵, 뇌간에 광범위하게 분포하는 CaV2.1 (P/Q-type) 전압개폐칼슘채널의 α1소단위를 부호화(encoding)한다[22]. FHM1에서의 유전자변이는 CaV2.1 (P/Q-type) 전압개폐칼슘채널의 구멍을 둘러싸고 있는 아미노산(pore lining amino acid)과 전압 센서 역할을 하는 아미노산의 구조적 변화를 초래하게 되어 결과적으로 칼슘이온의 신경세포 내로의 과도한 이동을 촉진한다. 그 결과 시냅스전 부위의 글루타메이트 등의 신경전달물질이 과도하게 방출됨으로써 피질의 과흥분이 일어난다[23]. 따라서 변형된 CaV2.1 채널은 낮은 전압역치를 가지게 되어 상대적으로 적은 양의 글루타메이트의 방출에서도 양성되먹임기전을 통해 피질확산억제(cortical spreading depression)를 발생할 수 있게 한다[23]. FHM1에서 관찰되는 유전자변이는 소뇌실조증 2형, 6형과 운동장애가 동반되는 경련 및 편두통 환자에서도 발견된다(Fig. 2).
FHM1에서 편두통의 증상은 조짐편두통과 유사하며 60분 정도의 신경학적 증상이 발생한 후 30분에서 5일정도의 두통이 연이어 발생하는 양상을 보이게 된다[11]. 어떤 환자에서는 조짐이 5일이상 지속되기도 하며 반신마비증상과 감각, 언어 및 시각증상이 동반되기도 한다. FHM1 환자의 약 1/4에서 시각조짐이 동반되지 않는 점은 일반적인 조짐편두통과 구별되는 특징이라고 할 수 있다.
FHM1의 유전자변이는 반신마비편두통 외에 다양한 범주의 임상적인 특징을 나타낼 수 있다[11]. 소뇌실조증이나 심한 두통발작 중 의식변화가 동반되는 미만성뇌병증이 편두통발작 중 나타날 수 있으며 일부에서는 이러한 신경학적 증상이 편두통발작과 상관없이 나타나기도 한다[24-26].
CACNA1A변이가 확인된 20개 가계의 117명의 환자를 대상으로 한 대단위 연구에서 72%의 환자가 반신마비편두통의 증상과 소뇌이상이 동반되었으며 이 중 60%에서는 비가역적이고 지속적인 소뇌증상이 관찰되었다[11]. 가장 흔한 소뇌증상은 안진이었으며 그 다음으로 보행실조(gait ataxia)와 상하지 실조(limb ataxia)가 동반된다. 소뇌증상은 나이가 들면서 점차 악화되지만 독립보행을 못할 정도에 이르지는 않는다. 소뇌증상이 동반된 환자에서 뇌병증이나 지속조짐 같은 비전형적인 증상들이 더 흔하게 발생한다.
FHM1에서는 지금까지 70가지 이상의 CACNA1A변이가 보고되었다[5,6,11,27]. 그중 T666M의 변이가 가장 흔하고 다음으로 R583Q변이가 흔하다[6]. FHM1에서는 유전자변이의 형태에 따라 특징적인 임상양상을 보인다. R583Q, T666M, D715E, Y1385C, R1668W, 그리고 W1684R의 변이가 있는 경우 전형적인 FHM의 반신마비증상과 함께 소뇌증상이 동반된다[11]. R583Q변이는 80% 이상에서 실조증상을 보이며 T666M변이의 72%에서 지속적인 소뇌증상이 동반된다. FHM1 환자의 20%에서 혼동, 수면 과다 같은 뇌병증의 증상이 관찰되며, 의식변화나 발열 및 경련으로 인해 중환자실에 입원하는 경우가 흔하다. 특히 T666M변이가 있는 환자의 50%는 혼수를 동반하는 심한 두통발작을 경험하게 된다. R192Q변이는 대부분 다른 증상 없이 가장 전형적인 FHM증상만 관찰된다.
FHM1에서는 가벼운 두부외상에 의해 의식소실을 동반한 두통발작이 유발될 수 있다[28]. 이는 두부외상이 피질확산억제의 역치가 낮아진 환자에서 편두통발작을 촉진하는 기전으로 설명되고 있다. 이러한 증상을 보였던 FHM1환자의 부검 소견에서 조롱박세포(purkinje cell)의 소실이 관찰되었고 상대적으로 과립세포(granular cell), 치아핵(dentate nucleus)과 아래올리브핵(inferior olivary nucleus)은 비교적 보존되는 소견이 보였다[28]. S218L, V714A, I1811L, T666M, Y138C 그리고 R583Q변이가 있는 경우에 가벼운 두부외상 이후 혼수를 동반한 두통발작의 보고가 있었다[28]. 특히 S218L변이가 있는 경우 깊은 혼수상태나 발열, 심한 뇌부종이 동반된 두통발작이 발생할 수 있다[28,29]. 또한 S218L변이가 있는 산발반신마비편두통에서도 경미한 두부외상 후 혼수가 동반된 편두통발작이 보고된 바 있다[29]. 따라서 S218L변이는 CaV2.1채널의 기능과 활성화에 가장 큰 영향을 끼치는 변이라고 생각된다[5].
FHM1에서 편두통발작의 빈도 또한 CACNA1A 변이의 종류에 따라 영향을 받는다. T666M변이가 있는 환자는 두통발작의 빈도가 많고 D715E변이가 있는 환자에서는 두통발작 빈도가 적다[11].
FHM2는 프랑스에서 진행된 대단위 가계연구를 통해 처음으로 염색체 1q21-q23에 위치한 유전자 ATP1A2의 변이가 있음이 밝혀졌다[30]. ATP1A2 유전자는 신경세포막전위를 유지하는 Na+/K+-ATPase의 α2소단위를 부호화한다[31]. Na+/K+-ATPase는 촉매기능(catalytic function)을 가지고 있는 α소단위, 조절기능(regulatory function)을 가지고 있는 β소단위 그리고 정확한 기능이 밝혀져 있지 않은 γ소단위로 구성되어 있다. α2소단위의 동형단백질(isoform)은 임신후기에서 초기 신생아기의 신경세포에서 발현되나 일반적으로 성인에서는 별아교세포에서 발현된다. 별아교세포나 신경세포의 Na+/K+-ATPase는 신경시냅스에서 글루타메이트가 분비되거나 신경흥분이 발생할 때 세포외 칼륨을 재흡수함으로써 세포막전위를 유지하는 데 중요한 역할을 한다[32]. 그러므로 ATP1A2 유전자변이가 있는 경우 신경흥분 후 안정막전위를 유지하는 기능이 감소하게 되어 결과적으로 신경의 과흥분성을 유발하여 피질확산억제를 쉽게 발생할 수 있게 한다.
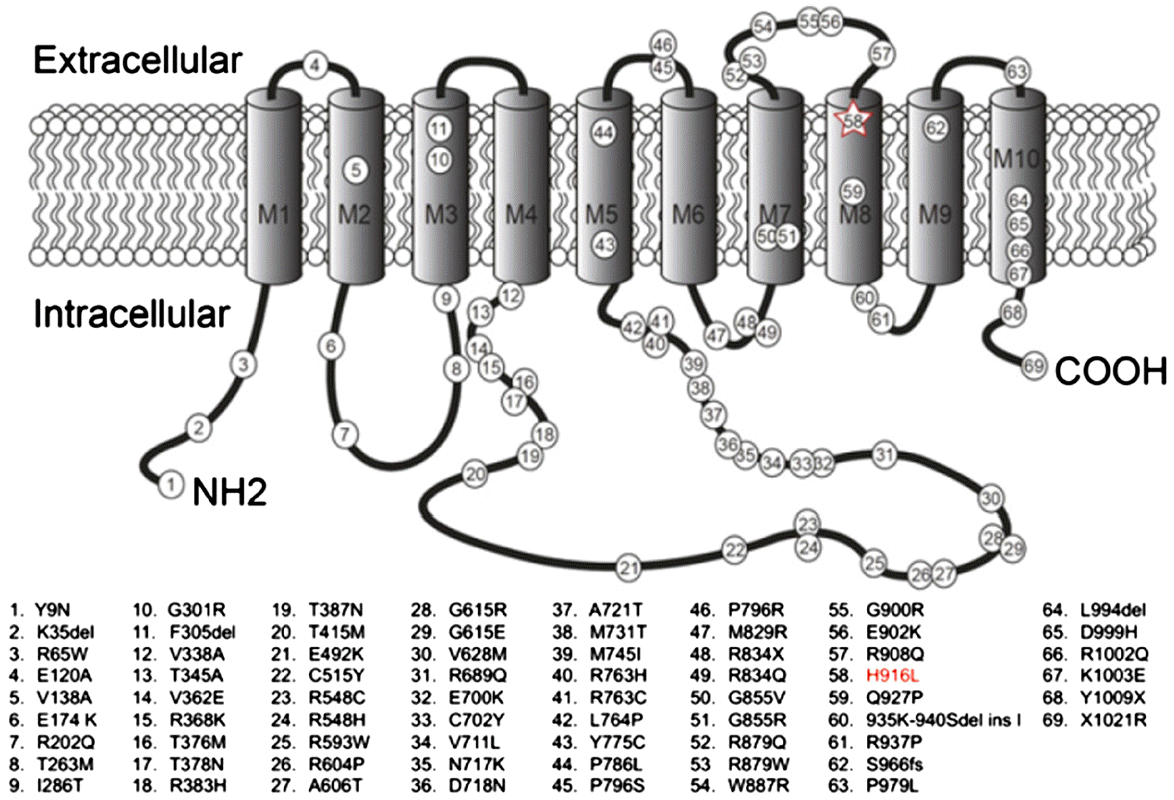
지금까지 FHM 외에 소뇌실조, 뇌전증, 발달지연과 같은 다양한 질환에서 70여 가지 이상의 ATP1A2 유전자변이가 보고되었다[33,34]. ATP1A2 유전자변이에 의한 FHM2는 FHM의 20% 정도에 해당한다[35]. FHM2유전자 변이의 절반 정도는 4,5번째 막관통영역(transmembrane segment)을 연결하는 세포 내 고리부분에 위치한다(Fig. 3)[33].
FHM2은 FHM1에 비해 유전침투도가 낮으며 편두통발작이 있는 동안 경련이 동반되는 경우가 많다. 대부분의 ATP1A2 유전자변이를 가진 환자들은 다른 신경학적 동반증상이 없이 FHM증상만 발생한다[34,36]. 그러나 FHM2의 20%는 양성가족영아경련(benign familial infantile convulsion)을 포함한 뇌전증과 연관되어 있다[31,34,37]. 또한 일부 연구에서 소아기의 교차반신마비나 지능저하 및 소뇌증상과의 관련성도 제시되었다[38-40].
발열과 함께 장시간 증상이 지속되며 우측 반신마비, 실어증 및 혼수가 동반된 FHM2형 환자의 자기공명영상에서 왼쪽 대뇌피질에 국한된 혈액뇌장벽의 변화와 대뇌피질의 부종이 발생한 증례가 보고되었다[41]. 또한 3명의 FHM2 환자에서 조짐이 있는 동안 증상에 해당하는 편측의 과관류와 중대뇌동맥의 혈관 확장이 보고되었다[33]. 이러한 결과들은 FHM2에서 피질확산억제는 혈액뇌장벽의 변화와 혈관확장을 초래함으로써 혈관탓부종(vasogenic edema)을 일으킬 수 있음을 의미한다.
뇌간조짐편두통은 반신마비증상이 동반되지 않으나 다른 임상적인 측면에서 FHM2와 공유되는 부분이 많다. 특히 가족력이 있는 뇌간조짐편두통에서 ATP1A2 유전자변이(R548H)가 발견되어 FHM2와 유전적 특성을 공유할 가능성이 제기되었다[42].
FHM3는 독일에서 3개의 가계를 대상으로 한 연구를 통해 처음으로 염색체 2q24에 위치한 SCN1A유전자 변이와 연관되어 있음이 보고되었다[43]. SCN1A유전자는 전압개폐소디움채널(voltage-gated Na+ channel) NaV1.1의 α1소단위를 부호화 한다[43]. SCN1A유전자변이는 NaV1.1채널의 빠른 불활성화(fast inactivity)의 회복을 촉진함으로써 신경세포의 흥분성을 높이게 된다[43]. 현재까지 SCN1A유전자는 100가지 이상의 절삭돌연변이(truncating mutation) 또는 과오돌연변이(missense mutation)가 밝혀져 있으며 중증영아형근간대경련(severe myoclonic epilepsy in infancy)이나 열성발작을 동반한 전신경련 같은 뇌전증과 관련이 있는 것으로 알려져 있다[44].
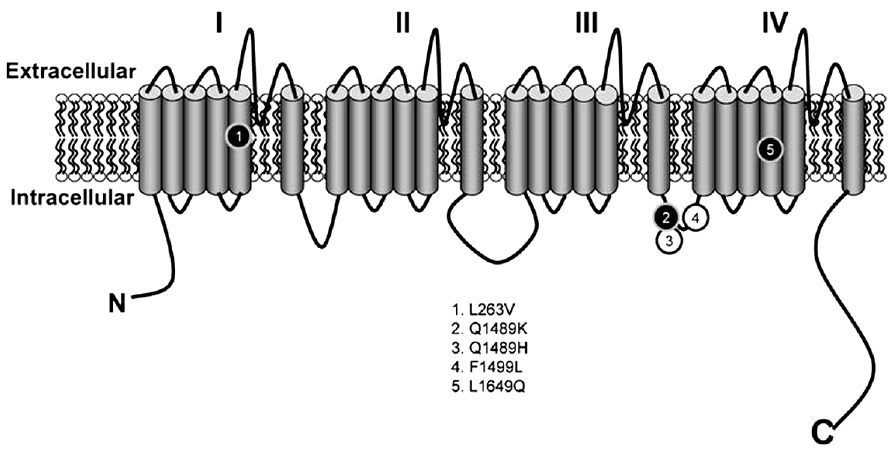
최근까지 약 5가지의 FHM3와 연관된 SCN1A 유전자변이가 보고되었다(Fig. 4)[27]. Q1489K과 L1649Q의 변이는 다른 신경학적 증상 없이 순수한 FHM증상만 나타나며 시각조짐으로 시작하여 반신감각이상과 마비증상이 구음장애와 함께 나타나 수분 이상 증상이 지속되는 양상을 보인다[43,45]. L263V변이가 있는 FHM3 환자에서는 편두통발작과 상관없이 전신강직간대발작이 나타날 수 있다[46]. Q1489H변이가 있는 FHM3 환자에서는 한쪽 또는 양쪽 눈의 시력소실이 하루에도 수차례 발생하였다 호전되는 ‘elicited repetitive transient daily blindness (ERDB)’ 증상이 두통과 상관 없이 발생하기도 한다[47].
가족반신마비편두통의 진단기준을 충족하지만 앞에 소개된 CACNA1A, ATP1A2, SCN1A의 유전자 돌연변이가 확인되지 않은 경우 FHM 기타 유전자형으로 분류하며 대표적으로 염색체 1q31변이, 염색체 14q32변이, 염색체 16p11의 PRRT2유전자 변이와 염색체 4q13의 SLC4A4유전자 변이가 알려져 있다. 미국에서 진행된 염색체 19p13의 변이가 없는 FHM 가계연구에서 염색체 1q31변이가 있음을 보고하였다[48,49]. 염색체 1q31 및 14q32변이가 있는 환자들은 전형적인 FHM에 비해 비교적 증상이 경미하며 편두통발작 사이에 소뇌증상을 비롯한 신경학적 증상이 관찰되지 않는 특징을 보인다[48-50]. 염색체 16p11의 PRRT2 유전자변이는 양성가족영아경련(benign familial infantile epilepsy)이나 돌발운동유발이상운동(paroxysmal kinesigenic dyskinesia), 돌발운동근육긴장이상(paroxysmal exertional dystonia), 돌발비운동유발이상운동(paroxysmal non-kinesigenic dyskinesia)과 같은 돌발운동질환(paroxysmal movement disorder)과 연관되어 있다[51,52]. Proline rich transmembrane protein 2 (PRRT2)는 CaV2.1을 포함한 전압개폐칼슘채널을 조절하는 기능을 가진 synaptosomal associated protein 25kDA (SNAP25)와 상호작용함으로써 증상을 일으킬 것으로 추정되고 있다[51,53,54]. 염색체 4q13의 SLC4A4는 세포막 운반단백(membrane transport protein) 중 하나인 전기발생 소디움중탄산염 협동운반체(electrogenic sodium-bicarbonate cotransporter, NBCe1)를 부호화한다[55]. NCBe1은 중탄산염의 흡수와 분비에 관여하여 세포내 pH와 뇌의 국소 pH를 변화시키며 이러한 pH변화는 신경흥분성(neuronal excitability)을 변화시킨다[56,57]. 또한 SLC4A4 변이는 근위 콩팥세뇨관산증(proximal renal tubular acidosis)과 녹내장(glaucoma)의 발생과 관련이 있다[58]. SLC4A4 변이와 연관된 반신마비편두통에서는 발작기에 의식변화를 동반한 중첩경련이나 의식혼미가 동반될 수 있다[57].
FHM의 유전자변이가 밝혀지면서 이를 유사한 임상증상을 공유하는 조짐편두통의 발병기전을 규명하기 위한 실험모델로 이용하려는 노력이 계속되었다. FHM의 유전자변이를 이용한 유전자변형마우스(transgenic mice)를 통해 발병기전과 치료에 대한 연구가 활발히 진행되고 있다.
FHM1형인 R192Q와 S218L 유전자변형을 가진 FHM1 동물모델에서는 염화칼륨(potassium chloride)이나 전기적인 자극을 뇌피질에 주었을 때 피질확산억제의 역치가 감소하거나 피질확산억제의 빈도가 증가됨이 확인되었다[23,59]. R192Q 유전자변형 모델에서는 소뇌 과립세포의 CaV2.1 칼슘채널의 전류밀도(current density)의 증가로 인한 신경흥분도의 증가 및 피질확산억제 민감도의 증가가 FHM1의 발병기전에 중요한 역할을 하는 것으로 생각되었다[23]. 특히 이러한 피질확산억제의 민감도는 S218L변이에서 더 심하게 관찰되며 대립유전자량(allele dosage)에 비례하였다[59]. FHM2형의 경우 W887R변이에 해당하는 유전자변형모델에서는 이형접합체(heterozygous)에서 피질확산억제의 역치 감소와 전파속도의 증가가 확인되었다[60].
이러한 FHM동물모델들은 대부분 편두통의 피질확산억제의 기전의 중요성을 보여주지만 실제로 조짐편두통의 발병기전을 피질확산억제만으로 설명할 수 없다. 특히 CGRP의 경우 편두통의 발병기전에 중요한 역할을 하고 있는데 R192Q변이가 있는 FHM1 유전변형모델에서는 오히려 삼차신경복합체의 CGRP 감소가 보고되었으며, FHM 1형과 2형 환자에서는 산화질소나 CGRP를 투여하였을 때 일반적인 조짐편두통 환자와 달리 두통발작이나 조짐이 유발되지 않는 결과를 제시하고 있다[16-18]. 이러한 결과는 FHM에서 피질확산억제를 통한 조짐의 발생과 CGRP를 통한 두통발생의 기전에서 일반적인 조짐편두통과 다른 형태의 기여를 하고 있음을 시사하며 앞으로 지속적인 연구가 필요한 부분이라고 생각한다.
비록 지금까지 밝혀진 FHM과 연관된 유전적 변이가 일반적인 편두통 환자에서 발견되는 것은 아니지만 FHM에 대한 연구들을 통해 편두통 환자에서 발생하는 피질확산억제와 뇌기능 조절의 이상에 대한 병태생리학적 기전에 대한 정보를 얻음으로써 편두통과 조짐의 발생기전에 대한 이해에 많은 발전이 있었다. 또한 FHM에서 관찰되는 유전적 변이가 대뇌피질의 조절기전과 흥분억제 균형의 변화를 초래할 뿐만 아니라 피질확산억제의 발생과 진행에 관여하여 편두통발작을 촉진할 수 있음을 알 수 있다.
이러한 FHM을 통한 편두통의 병태생리학적 기전의 이해를 통해 편두통 환자의 치료계획의 수립과 예방 치료에 있어 피질과흥분성과 피질확산억제에 주된 목표를 두어야 할 타당성을 생각해 볼 수 있겠다. 또한 FHM과 조짐편두통의 CGRP에 대한 반응의 차이는 두 질환의 발생기전의 차이점에 대한 추가적인 연구가 필요함을 시사한다.
REFERENCES
1. Stovner L, Hagen K, Jensen R, Katsarava Z, Lipton R, Scher A, et al. The global burden of headache: a documentation of headache prevalence and disability worldwide. Cephalalgia 2007;27:193-210.


2. Roh JK, Kim JS, Ahn YO. Epidemiologic and clinical characteristics of migraine and tension-type headache in Korea. Headache 1998;38:356-365.


3. Kim BK, Chu MK, Lee TG, Kim JM, Chung CS, Lee KS. Prevalence and impact of migraine and tension-type headache in Korea. J Clin Neurol 2012;8:204-211.



4. Mulder EJ, Van Baal C, Gaist D, Kallela M, Kaprio J, Svensson DA, et al. Genetic and environmental influences on migraine: a twin study across six countries. Twin Res 2003;6:422-431.


6. Thomsen LL, Kirchmann M, Bjornsson A, Stefansson H, Jensen RM, Fasquel AC, et al. The genetic spectrum of a population-based sample of familial hemiplegic migraine. Brain 2007;130:346-356.


7. Headache Classification Committee of the International Headache S. The International Classification of Headache Disorders, 3rd edition (beta version). Cephalalgia 2013;33:629-808.

8. de Vries B, Frants RR, Ferrari MD, van den Maagdenberg AM. Molecular genetics of migraine. Hum Genet 2009;126:115-132.


9. Thomsen LL, Eriksen MK, Roemer SF, Andersen I, Olesen J, Russell MB. A population-based study of familial hemiplegic migraine suggests revised diagnostic criteria. Brain 2002;125:1379-1391.


10. Joutel A, Bousser MG, Biousse V, Labauge P, Chabriat H, Nibbio A, et al. A gene for familial hemiplegic migraine maps to chromosome 19. Nat Genet 1993;5:40-45.


11. Ducros A, Denier C, Joutel A, Cecillon M, Lescoat C, Vahedi K, et al. The clinical spectrum of familial hemiplegic migraine associated with mutations in a neuronal calcium channel. N Engl J Med 2001;345:17-24.

12. Ophoff RA, Terwindt GM, Vergouwe MN, van Eijk R, Oefner PJ, Hoffman SM, et al. Familial hemiplegic migraine and episodic ataxia type-2 are caused by mutations in the Ca2+ channel gene CACNL1A4. Cell 1996;87:543-552.


13. de Vries B, Freilinger T, Vanmolkot KR, Koenderink JB, Stam AH, Terwindt GM, et al. Systematic analysis of three FHM genes in 39 sporadic patients with hemiplegic migraine. Neurology 2007;69:2170-2176.


14. Thomsen LL, Olesen J, Russell MB. Increased risk of migraine with typical aura in probands with familial hemiplegic migraine and their relatives. Eur J Neurol 2003;10:421-427.


15. Eriksen MK, Thomsen LL, Olesen J. Implications of clinical subtypes of migraine with aura. Headache 2006;46:286-297.


16. Hansen JM, Thomsen LL, Marconi R, Casari G, Olesen J, Ashina M. Familial hemiplegic migraine type 2 does not share hypersensitivity to nitric oxide with common types of migraine. Cephalalgia 2008;28:367-375.


17. Hansen JM, Thomsen LL, Olesen J, Ashina M. Calcitonin gene-related peptide does not cause the familial hemiplegic migraine phenotype. Neurology 2008;71:841-847.


18. Hansen JM, Thomsen LL, Olesen J, Ashina M. Familial hemiplegic migraine type 1 shows no hypersensitivity to nitric oxide. Cephalalgia 2008;28:496-505.


19. Ducros A. Familial hemiplegic migraine: a model for the genetic studies of migraine. Cephalalgia 2014;34:1035-1037.


20. Sa-Kong Y, Lee BH, Bae SM, Lee KW, Nam SW. A Case of Familial Hemiplegic Migraine. J Korean Child Neurol Soc 2003;11:367-371.
21. Choi KH, Kim JS, Lee SY, Ryu SW, Kim SS, Lee SH, et al. Familial hemiplegic migraine with prolonged coma and cerebellar atrophy: CACNA1A T666M mutation in a Korean family. J Korean Med Sci 2012;27:1124-1127.



22. Goadsby PJ, Charbit AR, Andreou AP, Akerman S, Holland PR. Neurobiology of migraine. Neuroscience 2009;161:327-341.


23. van den Maagdenberg AM, Pietrobon D, Pizzorusso T, Kaja S, Broos LA, Cesetti T, et al. A Cacna1a knockin migraine mouse model with increased susceptibility to cortical spreading depression. Neuron 2004;41:701-710.


24. Alonso I, Barros J, Tuna A, Seixas A, Coutinho P, Sequeiros J, et al. A novel R1347Q mutation in the predicted voltage sensor segment of the P/Q-type calcium-channel alpha-subunit in a family with progressive cerebellar ataxia and hemiplegic migraine. Clin Genet 2004;65:70-72.


25. Ducros A, Denier C, Joutel A, Vahedi K, Michel A, Darcel F, et al. Recurrence of the T666M calcium channel CACNA1A gene mutation in familial hemiplegic migraine with progressive cerebellar ataxia. Am J Hum Genet 1999;64:89-98.



26. Vahedi K, Denier C, Ducros A, Bousson V, Levy C, Chabriat H, et al. CACNA1A gene de novo mutation causing hemiplegic migraine, coma, and cerebellar atrophy. Neurology 2000;55:1040-1042.


27. Di Lorenzo C, Grieco GS, Santorelli FM. Migraine headache: a review of the molecular genetics of a common disorder. J Headache Pain 2012;13:571-580.



28. Kors EE, Terwindt GM, Vermeulen FL, Fitzsimons RB, Jardine PE, Heywood P, et al. Delayed cerebral edema and fatal coma after minor head trauma: role of the CACNA1A calcium channel subunit gene and relationship with familial hemiplegic migraine. Ann Neurol 2001;49:753-760.


29. Curtain RP, Smith RL, Ovcaric M, Griffiths LR. Minor head trauma-induced sporadic hemiplegic migraine coma. Pediatr Neurol 2006;34:329-332.


30. Ducros A, Joutel A, Vahedi K, Cecillon M, Ferreira A, Bernard E, et al. Mapping of a second locus for familial hemiplegic migraine to 1q21- q23 and evidence of further heterogeneity. Ann Neurol 1997;42:885-890.


31. De Fusco M, Marconi R, Silvestri L, Atorino L, Rampoldi L, Morgante L, et al. Haploinsufficiency of ATP1A2 encoding the Na+/K+ pump alpha2 subunit associated with familial hemiplegic migraine type 2. Nat Genet 2003;33:192-196.


32. Ikeda K, Onaka T, Yamakado M, Nakai J, Ishikawa TO, Taketo MM, et al. Degeneration of the amygdala/piriform cortex and enhanced fear/anxiety behaviors in sodium pump alpha2 subunit (Atp1a2)-deficient mice. J Neurosci 2003;23:4667-4676.

33. Iizuka T, Takahashi Y, Sato M, Yonekura J, Miyakawa S, Endo M, et al. Neurovascular changes in prolonged migraine aura in FHM with a novel ATP1A2 gene mutation. J Neurol Neurosurg Psychiatry 2012;83:205-212.


34. Jurkat-Rott K, Freilinger T, Dreier JP, Herzog J, Gobel H, Petzold GC, et al. Variability of familial hemiplegic migraine with novel A1A2 Na+/K+-ATPase variants. Neurology 2004;62:1857-1861.


35. Gritz SM, Radcliffe RA. Genetic effects of ATP1A2 in familial hemiplegic migraine type II and animal models. Hum Genomics 2013;7:8.



36. Santoro L, Manganelli F, Fortunato MR, Soldovieri MV, Ambrosino P, Iodice R, et al. A new Italian FHM2 family: clinical aspects and functional analysis of the disease-associated mutation. Cephalalgia 2011;31:808-819.


37. Vanmolkot KR, Kors EE, Hottenga JJ, Terwindt GM, Haan J, Hoefnagels WA, et al. Novel mutations in the Na+, K+-ATPase pump gene ATP1A2 associated with familial hemiplegic migraine and benign familial infantile convulsions. Ann Neurol 2003;54:360-366.


38. Spadaro M, Ursu S, Lehmann-Horn F, Veneziano L, Antonini G, Giunti P, et al. A G301R Na+/K+-ATPase mutation causes familial hemiplegic migraine type 2 with cerebellar signs. Neurogenetics 2004;5:177-185.


39. Swoboda KJ, Kanavakis E, Xaidara A, Johnson JE, Leppert MF, Schlesinger-Massart MB, et al. Alternating hemiplegia of childhood or familial hemiplegic migraine? A novel ATP1A2 mutation. Ann Neurol 2004;55:884-887.


40. Vanmolkot KR, Stroink H, Koenderink JB, Kors EE, van den Heuvel JJ, van den Boogerd EH, et al. Severe episodic neurological deficits and permanent mental retardation in a child with a novel FHM2 ATP1A2 mutation. Ann Neurol 2006;59:310-314.


41. Dreier JP, Jurkat-Rott K, Petzold GC, Tomkins O, Klingebiel R, Kopp UA, et al. Opening of the blood-brain barrier preceding cortical edema in a severe attack of FHM type II. Neurology 2005;64:2145-2147.


42. Ambrosini A, D'Onofrio M, Grieco GS, Di Mambro A, Montagna G, Fortini D, et al. Familial basilar migraine associated with a new mutation in the ATP1A2 gene. Neurology 2005;65:1826-1828.


43. Dichgans M, Freilinger T, Eckstein G, Babini E, Lorenz-Depiereux B, Biskup S, et al. Mutation in the neuronal voltage-gated sodium channel SCN1A in familial hemiplegic migraine. Lancet 2005;366:371-377.

44. Meisler MH, Kearney JA. Sodium channel mutations in epilepsy and other neurological disorders. J Clin Invest 2005;115:2010-2017.



45. Vanmolkot KR, Babini E, de Vries B, Stam AH, Freilinger T, Terwindt GM, et al. The novel p.L1649Q mutation in the SCN1A epilepsy gene is associated with familial hemiplegic migraine: genetic and functional studies. Mutation in brief #957. Online. Hum Mutat 2007;28:522.

46. Castro MJ, Stam AH, Lemos C, de Vries B, Vanmolkot KR, Barros J, et al. First mutation in the voltage-gated Nav1.1 subunit gene SCN1A with co-occurring familial hemiplegic migraine and epilepsy. Cephalalgia 2009;29:308-313.


47. Le Fort D, Safran AB, Picard F, Bouchardy I, Morris MA. Elicited repetitive daily blindness: a new familial disorder related to migraine and epilepsy. Neurology 2004;63:348-350.


48. Gardner K, Barmada MM, Ptacek LJ, Hoffman EP. A new locus for hemiplegic migraine maps to chromosome 1q31. Neurology 1997;49:1231-1238.


49. Lea RA, Shepherd AG, Curtain RP, Nyholt DR, Quinlan S, Brimage PJ, et al. A typical migraine susceptibility region localizes to chromosome 1q31. Neurogenetics 2002;4:17-22.


50. Cuenca-Leon E, Corominas R, Montfort M, Artigas J, Roig M, Bayes M, et al. Familial hemiplegic migraine: linkage to chromosome 14q32 in a Spanish kindred. Neurogenetics 2009;10:191-198.


51. Heron SE, Grinton BE, Kivity S, Afawi Z, Zuberi SM, Hughes JN, et al. PRRT2 mutations cause benign familial infantile epilepsy and infantile convulsions with choreoathetosis syndrome. Am J Hum Genet 2012;90:152-160.



52. Meneret A, Gaudebout C, Riant F, Vidailhet M, Depienne C, Roze E. PRRT2 mutations and paroxysmal disorders. Eur J Neurol 2013;20:872-878.


53. Cohen-Kutner M, Nachmanni D, Atlas D. CaV2.1 (P/Q channel) interaction with synaptic proteins is essential for depolarization-evoked release. Channels (Austin) 2010;4:266-277.


54. Riant F, Roze E, Barbance C, Meneret A, Guyant-Marechal L, Lucas C, et al. PRRT2 mutations cause hemiplegic migraine. Neurology 2012;79:2122-2124.


55. Burnham CE, Amlal H, Wang Z, Shull GE, Soleimani M. Cloning and functional expression of a human kidney Na+:HCO3- cotransporter. J Biol Chem 1997;272:19111-19114.

57. Suzuki M, Van Paesschen W, Stalmans I, Horita S, Yamada H, Bergmans BA, et al. Defective membrane expression of the Na(+)-HCO(3)(-) cotransporter NBCe1 is associated with familial migraine. Proc Natl Acad Sci U S A 2010;107:15963-15968.



58. Igarashi T, Inatomi J, Sekine T, Seki G, Shimadzu M, Tozawa F, et al. Novel nonsense mutation in the Na+/HCO3- cotransporter gene (SLC4A4) in a patient with permanent isolated proximal renal tubular acidosis and bilateral glaucoma. J Am Soc Nephrol 2001;12:713-718.

Figure 1.
The distribution of the various aura symptoms during familial hemiplegic migraine attack [14].
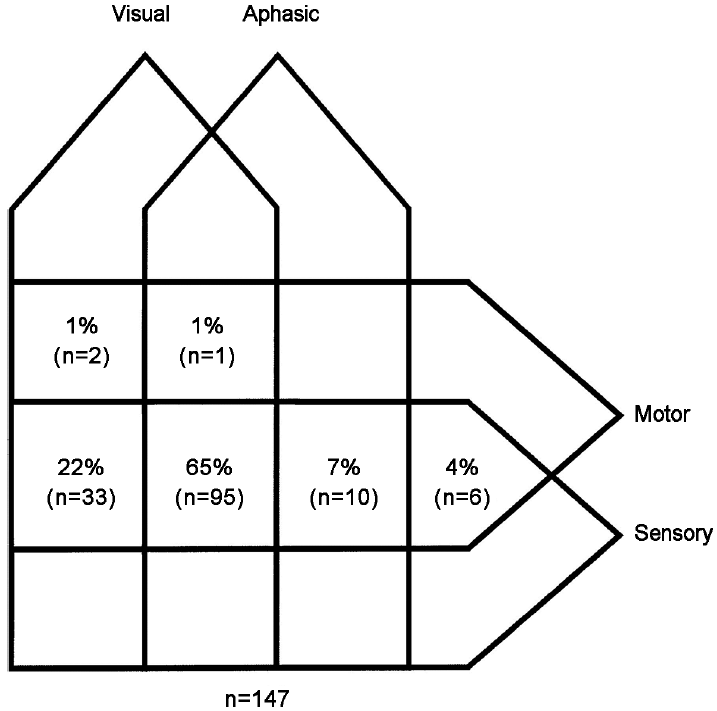
Figure 2.
Localization of mutation in the α1A subunit of the CaV2.1 voltage gated calcium channel causing delayed cerebral edema and coma after a minor head trauma (arrow) and other associated clinical phenotypes including ataxia. FHM; familial hemiplegic migraine type 1, EA-2; episodic ataxia type 2, SCA-6; spinocerebellar ataxia type 6 [28].
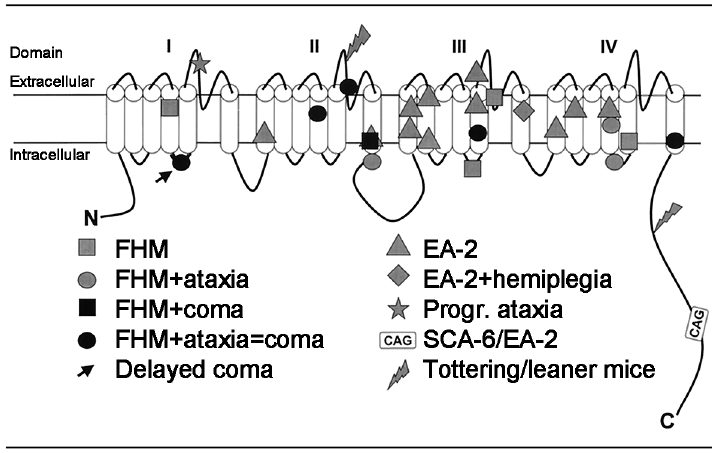
Table.
Genetic and clinical features of FHM
- TOOLS
-
METRICS

-
- 1 Crossref
- 0 Scopus
- 10,610 View
- 225 Download
- Related articles
-
Clinical and Pathological Features of Clevudine Induced Myopathy2013 ;31(1)
Clinical Features of Brachial Amyotrophic Diplegia2006 ;24(1)
Genetics of Channelopathy: Familial Periodic Paralysis2005 ;23(6)
Clinical and EMG Characteristics of Pretarsal Motor Persistence2005 ;23(1)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



