Clinico-Radiological Discordance in a Recurrent Elderly-onset NMOSD Case
- Jiwon Yang, MD, Hyeon-Mi Park, MD, Yeong-Bae Lee, MD
кі л № л°ңлі‘ NMOSDм—җм„ң мһ¬л°ң мӢң кҙҖм°°лҗң мһ„мғҒ-мҳҒмғҒ л¶Ҳмқјм№ҳ
- м–‘м§Җмӣҗ, л°•нҳ„лҜё, мқҙмҳҒл°°
- Received July 31, 2025; В В В Revised August 24, 2025; В В В Accepted August 26, 2025;
мӢңмӢ кІҪмІҷмҲҳм—јлІ”мЈјм§Ҳнҷҳ(neuromyelitis optica spectrum disorder, NMOSD)мқҳ н•өмӢ¬ м–‘мғҒ(core feature) мӨ‘ н•ҳлӮҳмқё мІҷмҲҳм—јмқҖ мһҗкё°кіөлӘ…мҳҒмғҒ(magnetic resonance imaging, MRI) мӢңмғҒл©ҙм—җм„ңлҠ” мІҷ추мІҙ 3분м Ҳ мқҙмғҒмқ„ м№ЁлІ”н•ҳлҠ” м„ёлЎңкҙ‘лІ”мң„нҡЎлӢЁмІҷмҲҳм—ј(longitudinally extensive transverse myelitis, LETM)кіј нҡЎлӢЁл©ҙм—җм„ңлҠ” мӨ‘мӢ¬л¶ҖлҘј нҸ¬н•Ён•ң 3분мқҳ 2 мқҙмғҒ лӢЁл©ҙмқ„ м№ЁлІ”н•ҳкі мІҷмҲҳл¶Җмў…мқ„ лҸҷл°ҳн•ҳлҠ” мҳҒмғҒ нҠ№м§•мқ„ ліҙмқёлӢӨ[1,2]. к·ёлҹ¬н•ң мҳҒмғҒ нҠ№м§•мқ„ л°ҳмҳҒн•ҳм—¬ мһ„мғҒм ҒмңјлЎңлҸ„ мӨ‘мҰқлҸ„к°Җ лҶ’м•„м„ң лӢӨл°ңкІҪнҷ”мҰқ(multiple sclerosis, MS)мқҙлӮҳ мҲҳмҙҲнқ¬мҶҢлҸҢкё°м•„м„ёнҸ¬лӢ№лӢЁл°ұм§Ҳн•ӯмІҙкҙҖл Ём§Ҳнҷҳ(myelin oligodendrocyte glycoprotein-associated disease, MOGAD)м—җ 비н•ҳм—¬ мҡҙлҸҷ кІ°мҶҗкіј мқҙлЎң мқён•ң ліҙн–үмһҘм• к°Җ мӢ¬н•ҳкі мҳҒкө¬м Ғмқё нӣ„мң мһҘм• лҘј лӮЁкёё к°ҖлҠҘм„ұмқҙ лҶ’лӢӨ[3,4].
м Җмһҗл“ӨмқҖ мІ« л°ңлі‘ мӢң кёүм„ұ мӢ кІҪлі‘нҶөмҰқмңјлЎң л°ңнҳ„н•ң л№„м •нҳ• NMOSD нҷҳмһҗ 1мҳҲлҘј ліҙкі н•ң л°” мһҲлҠ”лҚ°[5] лҸҷмқјн•ң кі л №мқҳ нҷҳмһҗк°Җ мІ« л°ңлі‘ нӣ„ 4л…„м§ё лҗҳлҚҳ н•ҙм—җ мһ„мғҒ-мҳҒмғҒ мӨ‘мҰқлҸ„ л¶Ҳмқјм№ҳлҘј ліҙмқҙл©° мһ¬л°ңн•ҳм—¬ мқҙм—җ лҢҖн•ҙ 추к°ҖлЎң ліҙкі н•ҳкі мһҗ н•ңлӢӨ.
- мҰқ лЎҖ
- мҰқ лЎҖ
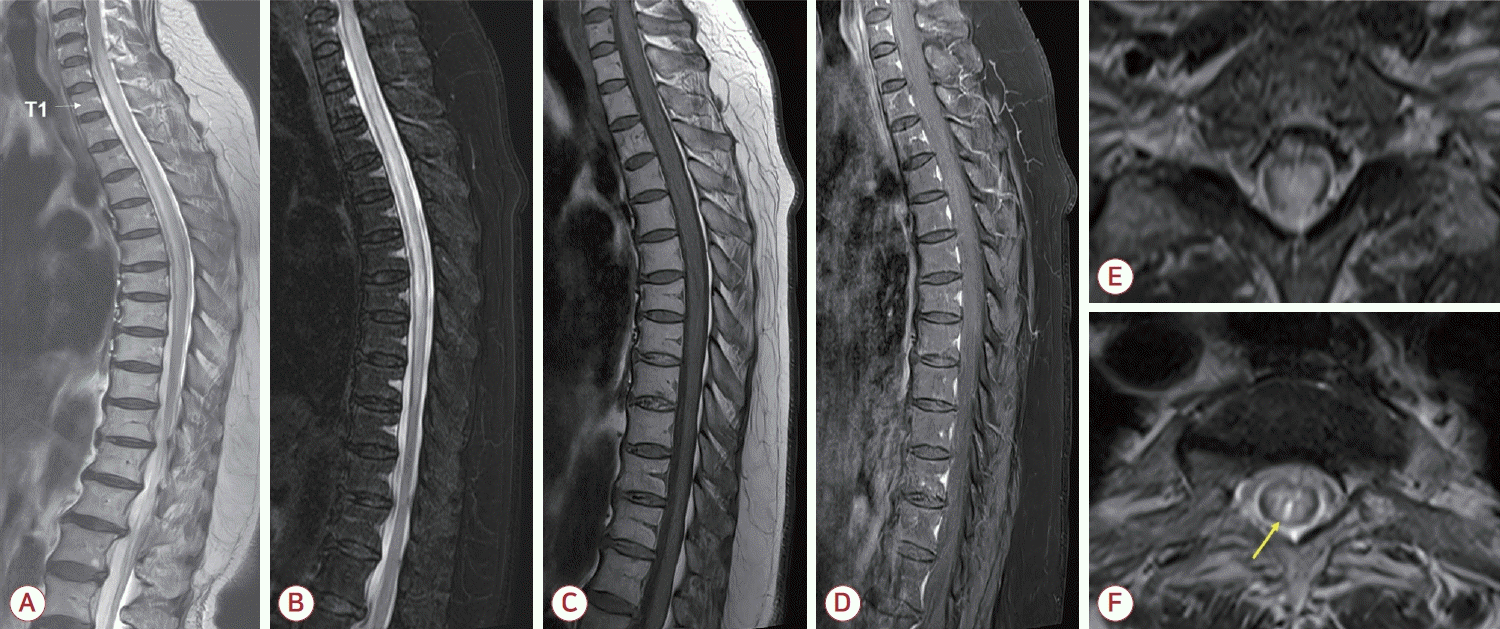
71м„ё м—¬мһҗк°Җ 1мЈјмқј м „л¶Җн„° м§ҖмҶҚлҗҳлҠ” м–‘н•ҳм§Җмқҳ мқҙмғҒк°җк°Ғкіј мқҙлЎң мқён•ң л¶Ҳм•Ҳм • ліҙн–үмңјлЎң лі‘мӣҗм—җ мҷ”лӢӨ. нҷҳмһҗлҠ” 64м„ём—җ мӢ¬мһҘ-кҙҖмғҒлҸҷл§Ҙм§Ҳнҷҳмқ„ 진лӢЁл°ӣкі мҠӨн…җнҠё мӮҪмһ… нӣ„ нҒҙлЎңн”јлҸ„к·ёл җкіј мҠӨнғҖнӢҙмқ„ ліөмҡ©н•ҳкі мһҲм—Ҳкі 67м„ём—җ кёүм„ұ мӮ¬м§ҖнҶөмҰқмңјлЎң мІҳмқҢ мӢ кІҪкіј 진лЈҢлҘј л°ӣм•„ кІҪ추 2лІҲ분м Ҳм—җ л¶Җ분м Ғ T2 кі мӢ нҳёк°•лҸ„мҷҖ нҳҲмІӯ н•ӯм•„мҝ м•„нҸ¬лҰ°4н•ӯмІҙ м–‘м„ұ(positive [1+] in 1:10 by cell-based indirect immunofluorescence assay, Euroimmun, LГјbeck, Germany)мқ„ нҶөн•ҙ NMOSDлҘј 진лӢЁл°ӣкі мҷёлһҳ 추м Ғ мӨ‘мқҙм—ҲлӢӨ. мӢ кІҪлі‘нҶөмҰқмқҖ л°ңлі‘ нӣ„ 18к°ңмӣ” лҸҷм•Ҳ м җм°Ё мҷ„м „нһҲ нҳём „лҗҳм–ҙ м№ҙл°”л§Ҳм ңн•Җкіј н”„л Ҳк°Җл°ңлҰ°мқ„ лӘЁл‘җ мӨ‘лӢЁн•ҳмҳҖлӢӨ. кІҪкө¬ мҠӨн…ҢлЎңмқҙл“ңмҷҖ л©ҙм—ӯм–өм ңм ң м№ҳлЈҢм—җ лҢҖн•ҙм„ңлҠ” л¶Җмһ‘мҡ©м—җ лҢҖн•ҳм—¬ нҷҳмһҗмқҳ мҡ°л Өк°Җ л§Өмҡ° м»Өм„ң мғҒмқҳ нӣ„ кІҪкө¬ мҠӨн…ҢлЎңмқҙл“ңл§Ң 1мқј 5 mg мҡ©лҹүк№Ңм§Җ к°җлҹүн•ҳм—¬ мң м§Җн•ҳмҳҖлӢӨ. л°ңлі‘ 12к°ңмӣ” нӣ„ 추м Ғн•ң н•ӯм•„мҝ м•„нҸ¬лҰ° 4н•ӯмІҙлҠ” л‘җ к°Җм§Җ кІҖмӮ¬лІ•м—җм„ң лӘЁл‘җ м–‘м„ұ(positive [1+] in 1:10; mean fluorescence intensity ratio [MFIr], 5.76; positive cut-off >1.32 by cell-based flow cytometry; EONE Laboratories, Incheon, Korea)мқҙм—ҲлӢӨ.мқҙнӣ„ нҷҳмһҗлҠ” 3л…„к°„ м•Ҳм •м ҒмңјлЎң м§ҖлӮҙлҚҳ мӨ‘ 1мЈјмқј м „л¶Җн„° мІҙк°„кіј м–‘н•ҳм§Җмқҳ л¬ҙл””кі м ҖлҰ° мқҙмғҒк°җк°Ғмқҙ мғқкІјкі мқҙлЎң мқён•ҳм—¬ ліҙн–үмқҙ л¶Ҳм•Ҳм •н•ҙм ём„ң мқ‘кёүмӢӨмқ„ нҶөн•ҙ мһ…мӣҗн•ҳмҳҖлӢӨ. мӢ кІҪкі„ 진찰м—җм„ң мӮ¬м§Җ к·јл ҘмқҖ м •мғҒмқҙм—ҲлӢӨ. к°җк°Ғ мҲҳмӨҖмқҖ нқү추 5лІҲ분м Ҳ мқҙн•ҳмҳҖмңјл©° к°ҖлІјмҡҙ мҙүк°Ғ, мҳЁлҸ„к°Ғ, нҶөк°Ғ, 진лҸҷк°җк°Ғмқҳ м Җн•ҳк°Җ лҢҖм№ӯм ҒмңјлЎң кҙҖм°°лҗҳм—Ҳкі мң„м№ҳк°җк°ҒмқҖ ліҙмЎҙлҗҳм–ҙ мһҲм—ҲлӢӨ. к№ҠмқҖнһҳмӨ„л°ҳмӮ¬лҠ” лҢҖм№ӯм ҒмңјлЎң м •мғҒліҙлӢӨ м•Ҫк°„ н•ӯ진лҗң м •лҸ„мҳҖмңјл©° л°”лұ…мҠӨнӮӨл°ҳмӮ¬лҠ” м–‘мёЎм—җм„ң м–‘м„ұмқҙм—ҲлӢӨ. кІҪлҜён•ң л°°лҮЁ л¶ҲнҺёк°җмқҙ мһҲм—Ҳм§Җл§Ң лҸ„лҮЁкҙҖ кұ°м№ҳ м—Ҷмқҙ мһҗк°Җ л°°лҮЁк°Җ к°ҖлҠҘн•ҳмҳҖлӢӨ. нҷ•мһҘмһҘм• мғҒнғңмІҷлҸ„(extended disability status scale, EDSS)лҠ” 2м җм—җ н•ҙлӢ№н•ҳмҳҖлӢӨ.мІҷмҲҳMRI кІҖмӮ¬лҘј нҶөн•ҳм—¬ мІҷмҲҳ нҡЎлӢЁл©ҙмқ„ кұ°мқҳ лӢӨ м№ЁлІ”н•ҳлҠ” кІҪ추 6лІҲ분м Ҳл¶Җн„° нқү추 9лІҲ분м Ҳм—җ мқҙлҘҙлҠ” м„ёлЎңлЎң л§Өмҡ° кёҙ T2 кі мӢ нҳёк°•лҸ„мҷҖ T1 м ҖмӢ нҳёк°•лҸ„, мІҷмҲҳл¶Җмў…мқ„ нҷ•мқён•ҳмҳҖлӢӨ(Fig.). NMOSDм—җм„ң нҠ№м§•м Ғмқё brighter spotty lesion (BSL)лҸ„ кҙҖм°°лҗҳм—ҲмңјлӮҳ мЎ°мҳҒмҰқк°•мқҖ м—Ҷм—ҲлӢӨ. лҮҢмІҷмҲҳм•Ў 분м„қм—җм„ңлҠ” л°ұнҳҲкө¬ 19/mm3, м ҒнҳҲкө¬ 211/mm3, лӢЁл°ұм§Ҳ 26.1 mg/dL, нҸ¬лҸ„лӢ№ 79 mg/dL (нҳҲмІӯ нҸ¬лҸ„лӢ№ 193 mg/dL)мҳҖлӢӨ. л©ҙм—ӯкёҖлЎңл¶ҲлҰ°-Gм§ҖмҲҳлҠ” 0.6мқҙм—Ҳкі мҳ¬лҰ¬кі нҒҙлЎ лқ лҠ” мқҢм„ұмқҙм—ҲлӢӨ. н•ӯмҲҳмҙҲнқ¬мҶҢлҸҢкё°м•„м„ёнҸ¬лӢ№лӢЁл°ұм§Ҳн•ӯмІҙ(н•ӯmyelin oligodendrocyte glycoprotein [MOG]н•ӯмІҙ)лҠ” мқҢм„ұмқҙм—ҲлӢӨ. н•ӯм•„мҝ м•„нҸ¬лҰ°4н•ӯмІҙ кІҖмӮ¬лҠ” м§ҖмҶҚм ҒмңјлЎң лӘЁл‘җ м–‘м„ұ(positive [1+] in 1:10; MFIr, 7.65; positive cut-off >1.40)мқҙм—ҲлӢӨ. мІҷмҲҳм—ј мһ¬л°ңлЎң 진лӢЁн•ҳмҳҖкі 5мқјк°„ кі мҡ©лҹү(1 g/day) л©”нӢён”„л Ҳл“ңлӢҲмҶ”лЎ м •л§Ҙ мЈјмӮ¬ нҲ¬м—¬ нӣ„ кІҪкө¬ мҠӨн…ҢлЎңмқҙл“ңлЎң м „нҷҳн•ҳл©ҙм„ң нҷҳмһҗлҠ” мһ¬нҷң лі‘мӣҗмңјлЎң нҮҙмӣҗн•ҳмҳҖлӢӨ. нҮҙмӣҗ 2мЈј нӣ„ мҷёлһҳ 진찰 мӢң EDSS 1.5м җмңјлЎң м•Ҫк°„ нҳём „лҗң мғҒнғңмҳҖлӢӨ. мқҙм—җ кІҪкө¬ мҠӨн…ҢлЎңмқҙл“ң 10 mg/dayлЎң мң м§Җн•ҳл©ҙм„ң м•„мһҗмӢёмқҙмҳӨн”„лҰ°мқ„ 50 mg/day мҡ©лҹүмңјлЎң 추к°Җн•ҳмҳҖкі м җм°Ё мҰқлҹүн•ҳкё°лЎң кі„нҡҚн•ҳмҳҖлӢӨ.
- кі м°°
- кі м°°
NMOSDк°Җ нҸүк· м ҒмңјлЎң нҳёл°ңн•ҳлҠ” л°ңлі‘ м—°л №мқҖ 3-40лҢҖм§Җл§Ң 50м„ё мқҙмғҒ нҳ№мқҖ 70м„ё мқҙмғҒмқҳ м—°л №м—җм„ңлҸ„ мІ« л°ңлі‘мқ„ ліҙмқј мҲҳ мһҲмңјл©° л°ңлі‘ м—°л №м—җ л”°лқј лі‘н„° мң„м№ҳ, мһ¬л°ң л№ҲлҸ„, мҳҲнӣ„к°Җ лӢ¬лқјм§Ҳ мҲҳ мһҲлӢӨлҠ” м—°кө¬л“Өмқҙ м җм°Ё ліҙкі лҗҳкі мһҲлӢӨ[6-9]. л°ңлі‘ м—°л №мқ„ лӮҳлҲ„лҠ” кё°мӨҖмқҖ м—°кө¬л§ҲлӢӨ мһ„мқҳм Ғмқҙм§Җл§Ң 50м„ё мқҙм „ л°ңлі‘мқ„ мқҙлҘё л°ңлі‘(early-onset), 50-70м„ё л°ңлі‘мқ„ лҠҰмқҖ л°ңлі‘(late-onset), 70м„ё мқҙнӣ„ л°ңлі‘мқ„ л§Өмҡ° лҠҰмқҖ л°ңлі‘(very late-onset)мңјлЎң м–ёкёүн•ҳкі мһҲмңјл©° л°ңлі‘ м—°л №мқҙ лҶ’мқ„мҲҳлЎқ мІҷмҲҳм—ј л°ңнҳ„мқҙ л§Һкі кёүм„ұкё° мқҙнӣ„ нҡҢліө м •лҸ„к°Җ лӮҳмҒҳл©° EDSSк°Җ лҶ’м•ҳлӢӨ. мқјліёкіј мӨ‘көӯм—җм„ң к°Ғк°Ғ 진н–үлҗң нӣ„н–Ҙ кҙҖм°° м—°кө¬м—җм„ңлҠ” 추м Ғ кҙҖм°° кё°к°„ лӮҙлӮҙ кі л №мқҳ нҷҳмһҗк°Җ лҶ’мқҖ EDSSлҘј ліҙмҳҖкұ°лӮҳ[7] лҚ” лҶ’мқҖ н•ӯм•„мҝ м•„нҸ¬лҰ°4н•ӯмІҙ м–‘м„ұлҘ кіј м—ӯк°Җ(titer)лҘј ліҙмқҙкё°лҸ„ н•ҳмҳҖлӢӨ[6].ліё мҰқлЎҖмқҳ нҷҳмһҗлҠ” 67м„ём—җ л№„м •нҳ• мҰқмғҒкіј 짧мқҖ кёёмқҙмқҳ мІҷмҲҳм—ј лі‘н„°, н•ӯмІҙ м–‘м„ұмқ„ нҶөн•ҙ NMOSDмқҙ мІҳмқҢ 진лӢЁлҗң лҠҰмқҖ л°ңлі‘(late-onset) нҷҳмһҗм—җ мҶҚн•ңлӢӨ. мһ¬л°ң м—ӯмӢң мІҷмҲҳм—јмқҙм—ҲмңјлӮҳ мІҳмқҢмқҳ мІҷмҲҳм—јкіјлҠ” м „нҳҖ лӢӨлҘё мҳҒмғҒ нҠ№м§•мқ„ ліҙмҳҖлҠ”лҚ° 10к°ңмқҳ мІҷ추분м Ҳм—җ лӢ¬н•ҳлҠ” м„ёлЎңлЎң л§Өмҡ° кёҙ лі‘ліҖкіј мӨ‘мӢ¬нҡҢмғүм§Ҳмқ„ м№ЁлІ”н•ҳлҠ” л„“мқҖ нҡЎлӢЁл©ҙ лі‘ліҖ, мІҷмҲҳл¶Җмў…, BSL л“ұмқҖ NMOSDм—җ л¶Җн•©н•ҳлҠ” л°ҳл©ҙ мЎ°мҳҒмҰқк°•мқҖ кҙҖм°°лҗҳм§Җ м•Ҡм•ҳлӢӨ. мһ„мғҒ мҰқмғҒлҸ„ MRI лі‘н„°м—җм„ң мҳҲмғҒлҗҳлҠ” мӢ¬н•ң мҡҙлҸҷмһҘм• лӮҳ л°©кҙ‘кё°лҠҘмһҘм• лҘј ліҙмқҙм§Җ м•Ҡкі н•ҳм§Җ мқҙмғҒ к°җк°ҒмңјлЎң мқён•ң ліҙн–ү л¶Ҳм•Ҳм •м„ұ м •лҸ„л§Ң нҳёмҶҢн•ҳмҳҖмңјл©° мІңмІңнһҲ лҸ…лҰҪ ліҙн–үмқҙ к°ҖлҠҘн•ң мҲҳмӨҖмңјлЎң 비көҗм Ғ лӮ®мқҖ EDSSлҘј ліҙм—¬ мҳҒмғҒкіј мһ„мғҒ мҶҢкІ¬мқҙ мқјм№ҳн•ҳм§Җ м•Ҡм•ҳлӢӨ.мҳҒмғҒкіј мһ„мғҒ к°„ л¶Ҳмқјм№ҳлҠ” MSм—җм„ңлҠ” л“ңл¬јм§Җ м•ҠмңјлӮҳ NMOSDм—җм„ңлҠ” нқ”н•ҳм§ҖлҠ” м•ҠлӢӨ. NMOSDм—җм„ңлҠ” MSм—җ 비н•ҙ л¬ҙмҰқмғҒ лі‘ліҖмқҙ л“ңл¬јкі мЎҙмһ¬н•ҳлҚ”лқјлҸ„ 짧мқҖ 분м Ҳмқҳ мІҷмҲҳ лі‘н„°лӮҳ мӢңмӢ кІҪ лі‘н„°к°Җ мЈјлЎң ліҙкі лҗҳм—Ҳмңјл©° лӢӨмқҢ мһ¬л°ңк№Ңм§Җмқҳ мӢңк°„ лӢЁм¶•кіјлҠ” л¬ҙкҙҖн•ҳкұ°лӮҳ мһ„л°•н•ң мһ¬л°ңмқҳ м „мЈјмқј мҲҳ мһҲлӢӨлҠ” мғҒл°ҳлҗң ліҙкі к°Җ мһҲлӢӨ[10,11]. ліё нҷҳмһҗмҷҖ к°ҷмқҙ LETM лі‘н„°к°Җ кІҪлҜён•ң мһ„мғҒ кІҪкіјлҘј ліҙмқё мҳҲлҠ” л§Өмҡ° л“ңл¬јм—Ҳмңјл©° м•„м§Ғ лӘ…нҷ•н•ң кё°м „мқ„ м„ӨлӘ…н•ҳкё°лҠ” м–ҙл өлӢӨ. лӢӨл§Ң T2 кі мӢ нҳёк°•лҸ„м—җ 비н•ҙ мҡҙлҸҷмӢ кІҪмқ„ лӢҙлӢ№н•ҳлҠ” н”јм§ҲмІҷмҲҳлЎңмқҳ кө¬мЎ° л°Ҹ кё°лҠҘ м—°кІ°кіј нҶөн•©мқҙ ліҙмЎҙлҗҳм–ҙ мһҲлҠ” мғҒнҷ©мқј кІғмңјлЎң м Җмһҗл“ӨмқҖ м¶”м •н•ҳмҳҖлӢӨ[12].мІҷмҲҳм—јм—җм„ң MRI нҠ№м§•мқҖ нҠ№м • м§Ҳнҷҳм—җ лҢҖн•ң к°җлі„ 진лӢЁкіј мһ„мғҒ мҳҲнӣ„ мҳҲмёЎмқ„ лҸ„мҷҖмЈјлҠ” мӨ‘мҡ”н•ң мҡ”мҶҢмқҙлӢӨ. нҠ№нһҲ кёүм„ұкё°м—җ мҙ¬мҳҒн•ң MRIмқҳ лі‘н„° мң„м№ҳ(кІҪ추лӮҳ нқү추, мӨ‘мӢ¬нҡҢмғүм§ҲмқҙлӮҳ л°ұмғүм§Ҳ), лі‘н„° м„ёлЎң кёёмқҙ(3분м Ҳ мқҙмғҒ лҳҗлҠ” лҜёл§Ң), мІҷмҲҳл¶Җмў…, мЎ°мҳҒмҰқк°• мң л¬ҙмҷҖ м–‘мғҒ(кі лҰ¬ нҳ•нғң, м—°мҲҳл§ү мЎ°мҳҒмҰқк°•, мӮјм§Җм°Ҫ징нӣ„[trident sign]), нҠ№м§•м Ғмқё лі‘н„° лӘЁм–‘(H-sign, BSL, лІ мқҙкёҖ징нӣ„[bagel sign]) л“ұм—җ л”°лқј NMOSD, MS, MOGAD, мӮ¬мҪ”мқҙл“ңмҰқ, лІ мІҙнҠёлі‘, лҘҳл§ҲнӢ°мҠӨм§ҲнҷҳкҙҖл ЁмІҷмҲҳм—ј, нҳҲкҙҖмІҷмҲҳлі‘, м••л°•мІҷмҲҳлі‘ л“ұмқ„ кө¬л¶„н•ҳкі нҷ•м§„мқ„ мң„н•ң 추к°Җ кІҖмӮ¬лҘј кі л Өн• мҲҳ мһҲлӢӨ[3,14].мІҷмҲҳм—ј лі‘н„°мқҳ мЎ°мҳҒмҰқк°•мқҖ нҳҲм•ЎлҮҢмһҘлІҪ(blood-brain barrier) мҶҗмғҒмқ„ л°ҳмҳҒн•ҳл©° нҷңлҸҷм„ұ м—јмҰқмқҳ мӨ‘мҡ”н•ң м§Җн‘ңлЎң 여겨진лӢӨ. NMOSD мІҷмҲҳм—јм—җм„ңлҠ” 90% к°Җк№Ңмқҙм—җм„ң л¶Ҳк·ңм№ҷн•ң л°ҳм җ(patchy) мЎ°мҳҒмҰқк°•мқҙлӮҳ кі лҰ¬ нҳ•нғң мЎ°мҳҒмҰқк°•мқҙ лӮҳнғҖлӮңлӢӨкі ліҙкі лҗңлӢӨ[14]. н•ҳм§Җл§Ң MOGADмҷҖ мӮ¬мҪ”мқҙл“ңмҰқ мІҷмҲҳм—јм—җм„ң ліё мҰқлЎҖмҷҖ мң мӮ¬н•ҳкІҢ LETM, мӨ‘мӢ¬нҡҢмғүм§Ҳ м№ЁлІ”, мІҷмҲҳл¶Җмў…мқ„ ліҙмқҙл©ҙм„ң мЎ°мҳҒмҰқк°•мқ„ лҸҷл°ҳн•ҳм§Җ м•Ҡмқ„ мҲҳ мһҲм–ҙ NMOSD 진лӢЁ мӢң мЈјмқҳн•ҙм•ј н•ңлӢӨ[14,15]. MOGADмІҷмҲҳм—јмқҖ нҠ№мқҙ н•ӯмІҙ мң л¬ҙк°Җ 진лӢЁм—җ мӨ‘мҡ”н•ҳкі мӮ¬мҪ”мқҙл“ңмҰқмІҷмҲҳм—јмқҖ л°°мӘҪкіј л“ұмӘҪ м—°м§Ҳл§үл°‘(subpial) лҳҗлҠ” м—°мҲҳл§ү(leptomeningeal) мЎ°мҳҒмҰқк°•мқҙ нқ”н•ҳкІҢ кҙҖм°°лҗҳлҠ” м җмқҙ лӢӨлҘҙлӢӨ[15]. м Җмһҗл“ӨмқҖ нҷҳмһҗмқҳ н•ӯм•„мҝ м•„нҸ¬лҰ°4н•ӯмІҙ м–‘м„ұ, н•ӯMOGн•ӯмІҙ мқҢм„ұ, мІҷмҲҳ лі‘н„° лӮҙ BSLмқҙ мЎҙмһ¬н•ҳлҠ” м җмңјлЎң лҜёлЈЁм–ҙ NMOSDмІҷмҲҳм—ј мһ¬л°ңмқҙлқјкі нҢҗлӢЁн•ҳмҳҖлӢӨ.NMOSDм—җм„ң мһҘкё°м Ғмқё л©ҙм—ӯм–өм ң м№ҳлЈҢмқҳ н•„мҡ”м„ұмқҖ мқҙлҜё нҷ•лҰҪлҗҳм–ҙ мһҲлӢӨ. нҠ№нһҲ кі л №мқҙлҚ”лқјлҸ„ мІ« л°ңмһ‘ нӣ„ кёүм„ұкё° м№ҳлЈҢлҘј мӢңн–үн•ң л’Ө мҲҳк°ңмӣ”к°„ кІҪкө¬ мҠӨн…ҢлЎңмқҙл“ң мҡ”лІ•мқ„ мң м§Җн•ҳл©ҙм„ң мһҘкё°м Ғмқё л©ҙм—ӯм–өм ңм ңлҘј лі‘мҡ©н• кІғмқ„ мөңк·ј к¶Ңкі м•Ҳм—җм„ң м ңмӢңн•ҳкі мһҲмңјл©°[16] көӯлӮҙ лӢӨкё°кҙҖ м—°кө¬м—җм„ңлҸ„ 65м„ё мқҙмғҒ NMOSD нҷҳмһҗм—җм„ң м•„мһҗмӢёмқҙмҳӨн”„лҰ°, лҜёмҪ”нҺҳлҶҖл ҲмқҙнҠёлӘЁнҺҳнӢё, лҰ¬нҲӯмӢңл§ҷ к°ҷмқҖ м•Ҫм ңк°Җ м§Ҳлі‘ нҷңм„ұ м–өм ңмҷҖ мһҘм• м•Ҳм •нҷ”м—җ кё°м—¬н•Ёмқ„ ліҙкі н•ң л°” мһҲлӢӨ[17].м Җмһҗл“ӨмқҖ ліё мҰқлЎҖлҘј нҶөн•ҙ кёүм„ұ мӢ кІҪлі‘м„ұ нҶөмҰқмңјлЎң л°ңнҳ„н•ҳмҳҖлҚҳ кі л № NMOSD нҷҳмһҗмқҳ мһҘкё°м Ғмқё 추м Ғ кҙҖм°° кІ°кіј(мҷ„м „ нҡҢліө)мҷҖ мһ„мғҒ-мҳҒмғҒ л¶Ҳмқјм№ҳлҘј ліҙмқҙлҠ” мІҷмҲҳм—ј мһ¬л°ңм—җ лҢҖн•ҙ ліҙкі н•ҳмҳҖлӢӨ. ліё мҰқлЎҖлҠ” м—¬м „нһҲ NMOSDм—җм„ң лӢӨм–‘н•ң нҳ•нғңмқҳ мһ¬л°ңмқҙ кҙҖм°°лҗ мҲҳ мһҲмңјл©° кі л № NMOSD нҷҳмһҗлқј н•ҳлҚ”лқјлҸ„ м§ҖмҶҚм Ғмқё л©ҙм—ӯм–өм ң м№ҳлЈҢмҷҖ 추м Ғ кҙҖм°°мқҳ мӨ‘мҡ”м„ұмқ„ мӢңмӮ¬н•ңлӢӨ.
Figure.
Spine magnetic resonance imaging (MRI) findings of the case patient. (A) Sagittal T2-weighted image of the whole spine demonstrated a longitudinally extensive lesion extending from C6 to T9 (white arrow indicating the level of T1 vertebral body). (B) Fat-suppressed T2-weighted image showed mild cord swelling, and (C) corresponding T1-weighted image revealed subtle hypointensity in the same region. (D) Post-gadolinium T1-weighted image did not demonstrate abnormal enhancement. (E) Axial T2-weighted image at the C7 level and (F) at the T3 level showed extensive hyperintense lesion involving the central gray matter with a focal hyperintense area. In panel (F), a brighter spotty lesion is indicated by a yellow arrow.
- REFERENCES
- REFERENCES
- 1. Wingerchuk DM, Banwell B, Bennett JL, Cabre P, Carroll W, Chitnis T, et al. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders. Neurology 2015;85:177-189.
[Article] [PubMed] [PMC]2. Clarke L, Arnett S, Lilley K, Liao J, Bhuta S, Broadley SA. Magnetic resonance imaging in neuromyelitis optica spectrum disorder. Clin Exp Immunol 2021;206:251-265.
[Article] [PubMed] [PMC]3. Akaishi T, Takahashi T, Misu T, Abe M, Ishii T, Fujimori J, et al. Progressive patterns of neurological disability in multiple sclerosis and neuromyelitis optica spectrum disorders. Sci Rep 2020;10:13890.
[Article] [PubMed] [PMC]4. Contentti EC, Lopez PA, Criniti J, Pettinicchi JP, Cristiano E, Patrucco L, et al. Clinical outcomes and prognostic factors in patients with optic neuritis related to NMOSD and MOGAD in distinct ethnic groups from Latin America. Mult Scler Relat Disord 2023;72:104611.
[Article] [PubMed]5. Kim YJ, Jo KJ, Park HM, Yang J. Neuromyelitis optica spectrum disorder presenting acute paroxysmal neuropathic pain in four extremities. J Korean Neurol Assoc 2022;40:363-366.
[Article]6. Min W, Zhang L, Wang S, Xue M, Guo C, Zhu M. Clinical characteristics of late-onset neuromyelitis optica spectrum disorder. Mult Scler Relat Disord 2023;70:104517.
[Article] [PubMed]7. Yu J, Yan S, Niu P, Teng J. Relatively early and late-onset neuromyelitis optica spectrum disorder in Central China: clinical characteristics and prognostic features. Front Neurol 2022;13:859276.
[Article] [PubMed] [PMC]8. Nakahara K, Nakane S, Nagaishi A, Narita T, Matsuo H, Ando Y. Very late onset neuromyelitis optica spectrum disorders. Eur J Neurol 2021;28:2574-2581.
[Article] [PubMed]9. Seok JM, Cho HJ, Ahn SW, Cho EB, Park MS, Joo IS, et al. Clinical characteristics of late-onset neuromyelitis optica spectrum disorder: a multicenter retrospective study in Korea. Mult Scler 2017;23:1748-1756.
[Article] [PubMed]10. Contentti EC, Lopez PA, Tkachuk V, Vrech C, Zarate MA, Correale J, et al. Frequency of new asymptomatic MRI lesions during attacks and follow-up of patients with NMOSD in a real-world setting. Mult Scler 2023;29:1240-1249.
[Article] [PubMed]11. Camera V, Holm-Mercer L, Ali AAH, Messina S, Horvat T, Kuker W, et al. Frequency of new silent MRI lesions in myelin oligodendrocyte glycoprotein antibody disease and aquaporin-4 antibody neuromyelitis optica spectrum disorder. JAMA Netw Open 2021;4:e2137833.
[Article] [PubMed] [PMC]12. Ma H, Zhu Y, Liang X, Wu L, Wang Y, Li X, et al. In patients with mild disability NMOSD: is the alteration in the cortical morphological or functional network topological properties more significant. Front Immunol 2024;15:1345843.
[Article] [PubMed] [PMC]13. Cacciaguerra L, Sechi E, Rocca MA, Filippi M, Pittock SJ, Flanagan EP. Neuroimaging features in inflammatory myelopathies: a review. Front Neurol 2022;13:993645.
[Article] [PubMed] [PMC]14. Fadda G, Flanagan EP, Cacciaguerra L, Jitprapaikulsan J, Solla P, Zara P, et al. Myelitis features and outcomes in CNS demyelinating disorders: comparison between multiple sclerosis, MOGAD, and AQP4-IgG-positive NMOSD. Front Neurol 2022;13:1011579.
[Article] [PubMed] [PMC]15. Flanagan EP, Kaufmann TJ, Krecke KN, Aksamit AJ, Pittock SJ, Keegan BM, et al. Discriminating long myelitis of neuromyelitis optica from sarcoidosis. Ann Neurol 2016;79:437-447.
[Article] [PubMed]16. Kumpfel T, Giglhuber K, Aktas O, Ayzenberg I, Bellmann-Strobl J, Haussler V, et al. Update on the diagnosis and treatment of neuromyelitis optica spectrum disorders (NMOSD) - revised recommendations of the Neuromyelitis Optica Study Group (NEMOS). Part II: attack therapy and long-term management. J Neurol 2024;271:141-176.
[PubMed]
