Reversible Encephalopathy with Cerebral Microbleeds in Hepatocellular Carcinoma: Diagnostic Challenges in the Context of Atezolizumab-Bevacizumab Therapy
- Jong Hyun Jeon, MD, Jinseok Park, MD, PhD
м•„н…ҢмЎёлҰ¬мЈјл§ҷ-лІ л°”мӢңмЈјл§ҷ м№ҳлЈҢлҘј л°ӣмқҖ к°„м„ёнҸ¬м•” нҷҳмһҗм—җм„ңмқҳ лҮҢ лҜём„ём¶ңнҳҲмқ„ лҸҷл°ҳн•ң к°Җм—ӯ лҮҢлі‘мҰқ: 진лӢЁм Ғ лҸ„м „
- м „мў…нҳ„, 박진м„қ
- Received August 18, 2025; В В В Revised August 19, 2025; В В В Accepted August 22, 2025;
л©ҙм—ӯкҙҖл¬ём–өм ңм ң(immune checkpoint inhibitor, ICI)лҠ” лӢӨм–‘н•ң кі нҳ•м•”м—җм„ң мҡ°мҲҳн•ң м№ҳлЈҢ нҡЁкіјлҘј ліҙм—¬ н‘ңмӨҖ м№ҳлЈҢлЎң мһҗлҰ¬ мһЎм•ҳлӢӨ. нҠ№нһҲ мҳҲм •мӮ¬лӢЁл°ұм§Ҳ-1лҰ¬к°„л“ң(programmed cell death ligand-1, PD-L1) м–өм ңм ңмқё м•„н…ҢмЎёлҰ¬мЈјл§ҷ(atezolizumab)мқҖ лІ л°”мӢңмЈјл§ҷкіјмқҳ лі‘н•© мҡ”лІ•мңјлЎң м Ҳм ң л¶Ҳк°ҖлҠҘн•ң к°„м„ёнҸ¬м•”м—җм„ң л„җлҰ¬ мӮ¬мҡ©лҗҳкі мһҲлӢӨ[1]. к·ёлҹ¬лӮҳ ICI мӮ¬мҡ©мқҙ мҰқк°Җн•Ём—җ л”°лқј лӢӨм–‘н•ң л©ҙм—ӯ кҙҖл Ё мқҙмғҒ л°ҳмқ‘(immune-related adverse event, irAE)мқҙ ліҙкі лҗҳкі мһҲмңјл©° к·ёмӨ‘ мӢ кІҪкі„ мқҙмғҒ л°ҳмқ‘м—җлҠ” к·јл¬ҙл ҘмҰқнӣ„кө°, к·јм—ј, кё°м•ө-л°”л ҲмҰқнӣ„кө°, лҮҢмӢ кІҪлі‘мҰқ, мҲҳл§үм—ј, лҮҢм—ј л“ұмқҙ нҸ¬н•ЁлҗңлӢӨ[2]. м Җмһҗл“ӨмқҖ мһҘкё°к°„ м•„н…ҢмЎёлҰ¬мЈјл§ҷкіј лІ л°”мӢңмЈјл§ҷ лі‘н•© мҡ”лІ•мқ„ мӢңн–үн•ң нҷҳмһҗм—җм„ң кҙ‘лІ”мң„н•ң лҜём„ём¶ңнҳҲкіј к°Җм—ӯ лҮҢлі‘мҰқмқҙ мһҗкё°кіөлӘ…мҳҒмғҒ(magnetic resonance imaging, MRI)м—җм„ң кҙҖм°°лҗң л“ңл¬ё мӮ¬лЎҖлҘј ліҙкі н•ҳкі мһҗ н•ңлӢӨ.
- мҰқ лЎҖ
- мҰқ лЎҖ
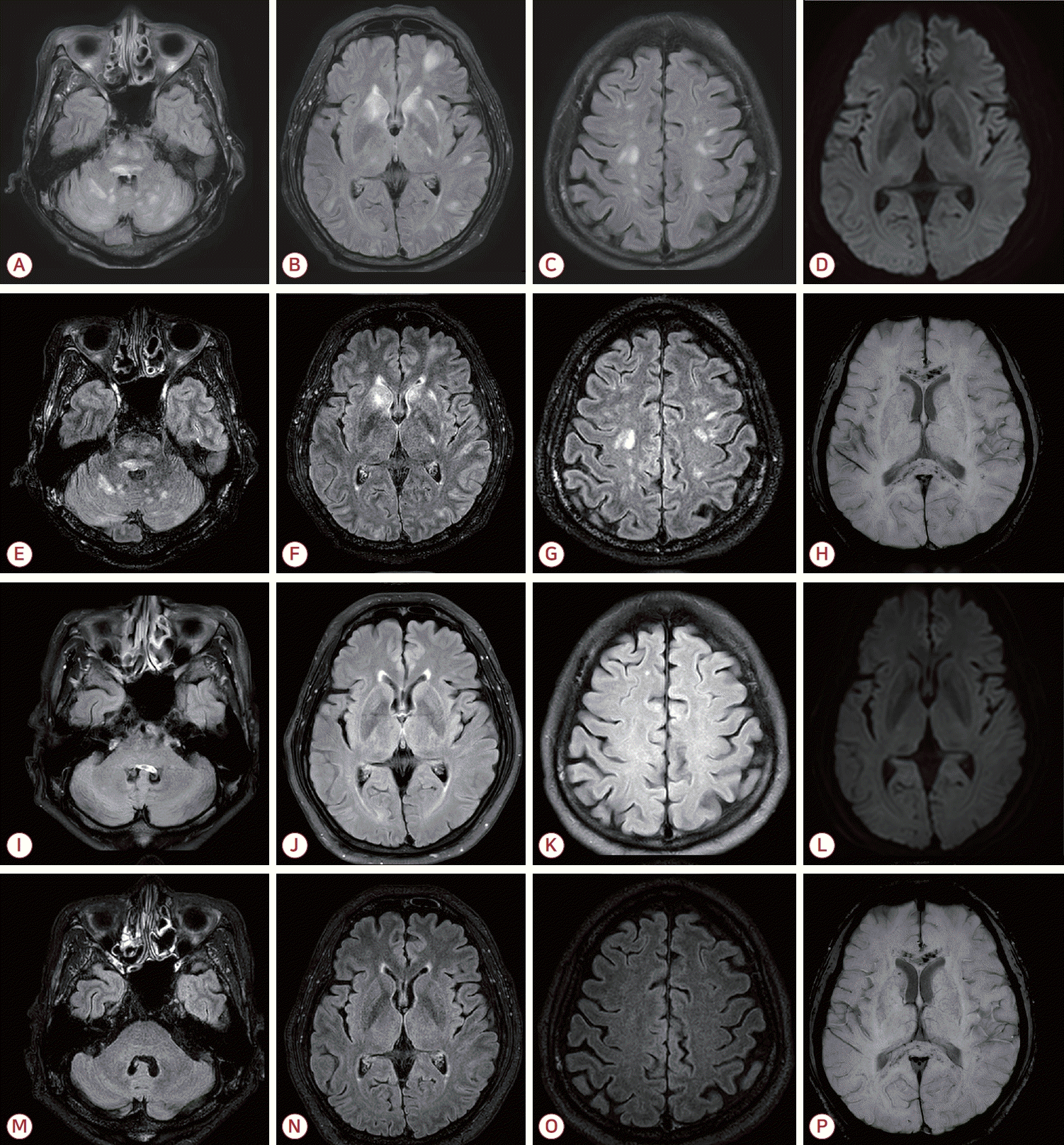
77м„ё лӮЁм„ұмқҙ н•ҳлЈЁ м „л¶Җн„° мӢңмһ‘лҗң м „мӢ мҮ м•Ҫк°җкіј лӢ№мқј л°ңмғқн•ң мқҳмӢқ нҳјлҸҷмқ„ мЈјмҶҢлЎң мқ‘кёүмӢӨм—җ лӮҙмӣҗн•ҳмҳҖлӢӨ. нҷҳмһҗлҠ” 5л…„ м „ к°„м„ёнҸ¬м•”мңјлЎң мҡ°к°„ м Ҳм ңмҲ мқ„ л°ӣм•ҳмңјл©° мқҙнӣ„ мҡ°мёЎ л¶ҖмӢ м „мқҙк°Җ нҷ•мқёлҗҳм–ҙ м•Ҫ 1л…„ м „л¶Җн„° 3мЈј к°„кІ©мңјлЎң мҙқ 17нҡҢм—җ кұёміҗ м•„н…ҢмЎёлҰ¬мЈјл§ҷкіј лІ л°”мӢңмЈјл§ҷ лі‘н•© мҡ”лІ•мқ„ л°ӣм•ҳкі л§Ҳм§Җл§ү нҲ¬м•ҪмқҖ лӮҙмӣҗ 1к°ңмӣ” м „мқҙм—ҲлӢӨ. м№ҳлЈҢ кё°к°„ лҸҷм•Ҳ нҠ№мқҙ л¶Җмһ‘мҡ©мқҖ м—Ҷм—ҲмңјлӮҳ мқҙнӣ„ 추м Ғ мҳҒмғҒм—җм„ң н•ҳлҢҖм •л§Ҙ м№ЁлІ”мқ„ лҸҷл°ҳн•ң мһ¬л°ңкіј лӢӨл°ң м „мқҙк°Җ кҙҖм°°лҗҳм—ҲлӢӨ. лӮҙмӣҗ лӢ№мӢң лҸҷкіөл°ҳмӮ¬лҠ” м •мғҒмқҙм—Ҳкі м•Ҳкө¬нҺёмң„лҠ” ліҙмқҙм§Җ м•Ҡм•ҳмңјл©° к·јл ҘмқҖ м •мғҒмқҙм—ҲлӢӨ. мҲҳл§үмһҗ극징нӣ„лҸ„ ліҙмқҙм§Җ м•Ҡм•ҳлӢӨ. нҳҲм••мқҖ мҲҳ축기 нҳҲм••мқҙ 170 mmHg лӮҙмҷёлЎң мң м§Җлҗҳм—ҲлӢӨ. л§җмҙҲнҳҲм•Ў кІҖмӮ¬м—җм„ң л°ұнҳҲкө¬ 3,700/mm3, нҳҲмғүмҶҢ 10.4 g/dL, нҳҲмҶҢнҢҗ 97,000/mm3лЎң кІҪлҸ„мқҳ лІ”нҳҲкө¬к°җмҶҢмҰқмқҙ мһҲм—Ҳмңјл©° нҳҲмӨ‘ м•”лӘЁлӢҲм•„лҠ” 135 Ојg/dLлЎң мғҒмҠ№лҗҳм–ҙ мһҲм—ҲлӢӨ. к·ё мҷё м –мӮ°, мҶҢл“җ, C-л°ҳмқ‘лӢЁл°ұ л“ұмқҖ м •мғҒ лІ”мң„мҳҖкі лҮҢ computed tomography (CT)м—җм„ңлҠ” нҠ№мқҙ мҶҢкІ¬мқҙ м—Ҷм—ҲлӢӨ. к°„м„ұ нҳјмҲҳлҘј мқҳмӢ¬н•ҳм—¬ кҙҖмһҘ м№ҳлЈҢлҘј мӢңн–үн•ҳмҳҖмңјлӮҳ мқҳмӢқ нҳём „мқҙ м—Ҷм–ҙ лҮҢMRIлҘј мӢңн–үн•ҳмҳҖлӢӨ. MRIм—җм„ң лҮҢк°„, мҶҢлҮҢ, мӢ¬л¶ҖнҡҢл°ұм§Ҳ, лҢҖлҮҢн”јм§Ҳ л°Ҹ н”јм§Ҳн•ҳл°ұм§Ҳм—җ лӢӨл°ңм„ұ T2кі мӢ нҳёк°•лҸ„ лі‘ліҖмқҙ кҙҖм°°лҗҳм—Ҳкі мЎ°мҳҒмҰқк°•м•ЎмІҙк°җмҮ м—ӯм „нҡҢліө(fluid attenuated inversion recovery, FLAIR)мҳҒмғҒм—җм„ңлҠ” мЈјлЎң лҮҢк°„кіј мҶҢлҮҢ, мқјл¶Җ лҢҖлҮҢ л°ҳкө¬м—җ мһ‘мқҖ мЎ°мҳҒмҰқк°• кІ°м Ҳмқҙ нҷ•мқёлҗҳм—ҲлӢӨ. мһҗнҷ”мңЁк°•мЎ°мҳҒмғҒ(susceptibility weighted image, SWI)м—җм„ң лҮҢлҹүкіј м–‘мёЎ н”јм§Ҳн•ҳл°ұм§Ҳм—җ кҙ‘лІ”мң„ лҜём„ём¶ңнҳҲмқҙ нҷ•мқёлҗҳм—ҲлӢӨ(Fig. A-H). лҮҢ м „мқҙ м—°кҙҖ нғҲмҲҳмҙҲм§ҲнҷҳмқҙлӮҳ нҳҲкҙҖм—ј к°ҖлҠҘм„ұмқ„ л°°м ңн•ҳкё° мң„н•ҳм—¬ лҮҢмІҷмҲҳм•Ў кІҖмӮ¬мҷҖ лҮҢнҢҢ кІҖмӮ¬лҘј мӢңн–үн•ҳмҳҖмңјл©° лҮҢмІҷмҲҳм•Ўм—җм„ң м„ёнҸ¬ мҲҳ 2/mm3, лӢЁл°ұм§Ҳ 92 mg/dL, нҸ¬лҸ„лӢ№ 60 mg/dLлЎң кІҪлҜён•ң лӢЁл°ұ мғҒмҠ№ мҶҢкІ¬мқҙ мһҲм—Ҳкі м„ёнҸ¬ кІҖмӮ¬м—җм„ңлҠ” м•…м„ұм„ёнҸ¬к°Җ кҙҖм°°лҗҳм§Җ м•Ҡм•ҳлӢӨ. н•ӯм•„мҝ м•„нҸ¬лҰ°-4н•ӯмІҙ, мһҗк°Җл©ҙм—ӯн•ӯмІҙ л°Ҹ мӢ мғқл¬јл”ёлҰјн•ӯмІҙлҠ” лӘЁл‘җ мқҢм„ұмқҙм—ҲлӢӨ. лҮҢнҢҢ кІҖмӮ¬м—җм„ңлҠ” м „л°ҳм Ғмқё м„ёнғҖнҢҢ л°Ҹ лҚёнғҖнҢҢк°Җ кҙҖм°°лҗҳм—ҲмңјлӮҳ лҮҢм „мҰқнҢҢлҠ” м—Ҷм—ҲлӢӨ. мһ…мӣҗ 4мқјм§ё, мҡ°мёЎ л°ҳмӢ л§Ҳ비мҷҖ л°ңм—ҙ(38в„ғ)мқҙ л°ңмғқн•ҳм—¬ кІҪн—ҳм Ғ н•ӯмғқм ң м№ҳлЈҢлҘј мӢңмһ‘н•ҳмҳҖлӢӨ. мҠӨн…ҢлЎңмқҙл“ң м№ҳлЈҢлҸ„ кі л Өлҗҳм—ҲмңјлӮҳ лӢӨмқҢлӮ мқҳмӢқ мҲҳмӨҖмқҙ нҳём „лҗҳм—Ҳкі мҡ°мёЎ л§Ҳ비лҸ„ мҷ„м „нһҲ нҡҢліөлҗҳм—ҲлӢӨ. мқҙнӣ„ мһ¬нҸүк°Җм—җм„ң кІҪлҜён•ң кө¬мқҢмһҘм• к°Җ мһҲм—ҲмңјлӮҳ м–ём–ҙ кё°лҠҘмқҖ кұ°мқҳ м •мғҒмқҙм—Ҳмңјл©° мһ…мӣҗ кё°к°„ лҸҷм•Ҳмқҳ мӮ¬кұҙм „кё°м–өмғҒмӢӨ(retrograde amnesia)мқ„ ліҙмҳҖлӢӨ. 추м Ғ лҮҢнҢҢм—җм„ңлҠ” м •мғҒ л°°кІҪнҢҢлҘј ліҙмҳҖлӢӨ. нҷҳмһҗлҠ” мһ¬нҷң м№ҳлЈҢ нӣ„ мӢ кІҪкі„ нӣ„мң мҰқ м—Ҷмқҙ нҮҙмӣҗн•ҳмҳҖлӢӨ. нҮҙмӣҗ 4к°ңмӣ” нӣ„ мӢңн–үн•ң 추м Ғ MRIм—җм„ң лҢҖлҮҢ, лҮҢк°„, мҶҢлҮҢмқҳ лӢӨл°ңм„ұ кі мӢ нҳёк°•лҸ„ лі‘ліҖмқҖ кұ°мқҳ мҶҢмӢӨлҗҳм—ҲмңјлӮҳ кҙ‘лІ”мң„ лҜём„ём¶ңнҳҲмқҖ м§ҖмҶҚлҗҳм—ҲлӢӨ(Fig. I-P).
- кі м°°
- кі м°°
м•„н…ҢмЎёлҰ¬мЈјл§ҷмқҖ PD-L1м—җ м„ нғқм ҒмңјлЎң кІ°н•©н•ҳм—¬ programmed death-1 (PD-1)/PD-L1 мӢ нҳём „лӢ¬кІҪлЎңлҘј м°ЁлӢЁн•ЁмңјлЎңмҚЁ мў…м–‘м„ёнҸ¬м—җ лҢҖн•ң нҡЁкіјкё° Tм„ёнҸ¬ л§Өк°ң мӮҙмғҒмқ„ мң лҸ„н•ңлӢӨ. к·ёлҹ¬лӮҳ PD-L1 м–өм ңлЎң мқён•ң л©ҙм—ӯ мЎ°м Ҳ кё°лҠҘ м Җн•ҳлҠ” м„ёнҸ¬лҸ…м„ұ TлҰјн”„кө¬мқҳ кіјлҸ„н•ң нҷңм„ұкіј м—јмҰқ л°ҳмқ‘мқ„ мң л°ңн•ҳм—¬ мҳҲкё°м№ҳ м•ҠмқҖ irAEлҘј мҙҲлһҳн• мҲҳ мһҲлӢӨ. мқҙлҹ¬н•ң нҡЁкіјлҠ” нҳҲкҙҖлӮҙн”јм„ұмһҘмқёмһҗ(vascular endothelial growth factor)м—җ кІ°н•©н•ҳм—¬ нҳҲкҙҖ мӢ мғқмқ„ м–өм ңн•ҳкі ICIмқҳ мў…м–‘ лӮҙ м•Ҫл¬ј м „лӢ¬мқ„ к°ңм„ н•ҳлҠ” лІ л°”мӢңмЈјл§ҷ лі‘мҡ© нҲ¬м—¬м—җ мқҳн•ҳм—¬ лҚ”мҡұ мҰқнҸӯлҗ мҲҳ мһҲлӢӨ[1]. мӢӨм ңлЎң м•„н…ҢмЎёлҰ¬мЈјл§ҷкіј лІ л°”мӢңмЈјл§ҷ лі‘мҡ© мҡ”лІ•мқ„ мӢңн–үн•ң к°„м„ёнҸ¬м•” нҷҳмһҗм—җм„ң лҮҢм—јмқҙ лӢӨмҲҳ ліҙкі лҗҳм—Ҳмңјл©°[3] лҢҖл¶Җ분мқҳ кІҪмҡ° лҮҢMRIм—җм„ң м–‘мёЎм„ұ T2к°•мЎ°мҳҒмғҒ лҳҗлҠ” FLAIR кі мӢ нҳёмҷҖ мЎ°мҳҒмҰқк°• мҶҢкІ¬мқ„ ліҙмҳҖлӢӨ.кё°мЎҙ ліҙкі м—җ л”°лҘҙл©ҙ м•„н…ҢмЎёлҰ¬мЈјл§ҷкіј лІ л°”мӢңмЈјл§ҷ лі‘мҡ© мҡ”лІ• мқҙнӣ„ л°ңмғқн•ҳлҠ” лҮҢм—јмқҖ лҢҖк°ң м№ҳлЈҢ мҙҲкё° мҲҳк°ңмӣ” лӮҙ л°ңлі‘н•ҳл©° л©ҙм—ӯм–өм ң м№ҳлЈҢк°Җ н•„мҡ”н•ң кІҪмҡ°к°Җ л§ҺлӢӨ[3]. к·ёлҹ¬лӮҳ ліё нҷҳмһҗлҠ” м№ҳлЈҢ 11к°ңмӣ”м§ём—җ мҰқмғҒмқҙ л°ңмғқн•ҳмҳҖкі л©ҙм—ӯм–өм ңм ң нҲ¬м—¬ м—Ҷмқҙ мһҗл°ңм ҒмңјлЎң нҡҢліөлҗҳм—ҲлӢӨлҠ” м җм—җм„ң м „нҳ•м Ғмқё ICI мң л°ң лҮҢм—јкіј м°ЁмқҙлҘј ліҙмқёлӢӨ. лҳҗн•ң к°Җм—ӯ лҮҢлі‘мҰқкіј н•Ёк»ҳ SWIм—җм„ң кҙ‘лІ”мң„н•ң лҜём„ём¶ңнҳҲмқ„ нҷ•мқён•ң ліҙкі лҠ” кё°мЎҙ ICI мң л°ң лҮҢм—ј кҙҖл Ё л¬ён—Ңм—җм„ңлҠ” нҷ•мқёлҗҳм§Җ м•Ҡм•ҳлӢӨ.лҮҢ лҜём„ём¶ңнҳҲ(cerebral microbleeds)мқҖ л…ёнҷ”м—җм„ңлҸ„ кҙҖм°°лҗҳм§Җл§Ң лҮҢм•„л°ҖлЎңмқҙл“ңнҳҲкҙҖлі‘мҰқ, лҮҢмЎёмӨ‘, мҷёмғҒ лҮҢмҶҗмғҒ л“ұм—җм„ң лҚ” нқ”нһҲ л°ңкІ¬лҗңлӢӨ. нҠ№нһҲ мҷёмғҒм—җ мқҳн•ң кҙ‘лІ”мң„ 축мӮӯ мҶҗмғҒ(diffuse axonal injury)м—җ лҸҷл°ҳлҗҳлҠ” м¶ңнҳҲ лі‘ліҖмқҖ мЈјлЎң лҮҢлҹүкіј нҡҢл°ұм§Ҳ-л°ұм§Ҳ кІҪкі„ л¶Җмң„м—җ мң„м№ҳн•ҳл©° нҳҲкҙҖмЈјмң„кіөк°„мқ„ л”°лқј л°©мӮ¬мғҒмңјлЎң 분нҸ¬н•ҳлҠ”лҚ° мқҙлҹ¬н•ң 분нҸ¬лҠ” ліё мҰқлЎҖмқҳ мҶҢкІ¬кіј мң мӮ¬н•ҳлӢӨ. мҷёмғҒ лҮҢмҶҗмғҒм—җм„ңмқҳ лҜём„ём¶ңнҳҲмқҖ нҳҲм•Ў лҮҢмһҘлІҪ(blood brain barrier, BBB) мҶҗмғҒмқҳ мҳҒмғҒ н‘ңм§ҖлЎң к°„мЈјлҗҳл©°4 BBBмқҳ мЈјмҡ” кө¬м„ұ мҡ”мҶҢмқё лі„м•„көҗм„ёнҸ¬(astrocyte)лҠ” лҮҢ н•ӯмғҒм„ұ мң м§ҖмҷҖ мӢ кІҪм„ёнҸ¬ лҢҖмӮ¬ м§Җмӣҗм—җ мӨ‘мҡ”н•ң м—ӯн• мқ„ н•ңлӢӨ[5]. м„ұмғҒкөҗм„ёнҸ¬ мӨ‘ мқјл¶ҖлҠ” PD-L1мқ„ л°ңнҳ„н•ҳм—¬ PD-1 м–‘м„ұ л©ҙм—ӯм„ёнҸ¬мқҳ нҷңм„ұмқ„ м–өм ңн•ҳкі м„ёнҸ¬ лӮҙ мӢ нҳёлҘј мЎ°м Ҳн•ЁмңјлЎңмҚЁ кіјлҸ„н•ң мӢ кІҪл©ҙм—ӯ л°Ҹ мӢ кІҪм—јмҰқ л°ҳмқ‘мқ„ мҷ„нҷ”н•ңлӢӨ. PD-L1 мӢ нҳёлҘј м°ЁлӢЁн•ҳл©ҙ мӢ кІҪм—јмҰқмқҙ м§ҖмҶҚлҗҳкі лҢҖмӢқм„ёнҸ¬лҘј нҸ¬н•Ён•ң м—јмҰқм„ёнҸ¬ м№ЁмңӨмқҙ мҰқк°Җн•ҳм—¬ мҷёмғҒ лҮҢмҶҗмғҒ лі‘ліҖмқҙ м•…нҷ”лҗҳлҠ” кІғмңјлЎң ліҙкі лҗҳм—ҲлӢӨ[6]. лҳҗн•ң PD-L1 м–‘м„ұ лі„м•„көҗм„ёнҸ¬лҠ” мһҗк°Җл©ҙм—ӯ мӢ кІҪм—јмҰқ лӘЁлҚём—җм„ң PD-1 м–‘м„ұ лҜём„ём•„көҗм„ёнҸ¬мқҳ м—јмҰқ кё°лҠҘмқ„ м–өм ңн•ҳлҠ” кІғмңјлЎң м•Ңл Өм ё мһҲлӢӨ[7].л”°лқјм„ң ліё мҰқлЎҖм—җм„ң кҙҖм°°лҗң лҜёл§Ңм„ұ лҜём„ём¶ңнҳҲкіј к°Җм—ӯ лҮҢлі‘мҰқмқҖ PD-L1 м–өм ңм—җ л”°лҘё лі„м•„көҗм„ёнҸ¬мқҳ мӢ кІҪл©ҙм—ӯ мЎ°м Ҳ кё°лҠҘ м Җн•ҳмҷҖ лІ л°”мӢңмЈјл§ҷм—җ мқҳн•ң лӮҙн”јм„ёнҸ¬ кё°лҠҘмһҘм• к°Җ ліөн•©м ҒмңјлЎң мһ‘мҡ©н•ҳм—¬ BBB мҶҗмғҒкіј лҜём„ёнҳҲкҙҖ мҶҗмғҒмқҙ мӢ¬нҷ”лҗң кІ°кіјмқј к°ҖлҠҘм„ұмқҙ мһҲлӢӨ. м•„н…ҢмЎёлҰ¬мЈјл§ҷкіј лІ л°”мӢңмЈјл§ҷмқҖ к°Ғк°Ғ ICI мң л°ң лҮҢм—јкіј BBB л°Ҹ лӮҙн”јм„ёнҸ¬ мҶҗмғҒм—җ мқҳн•ң к°Җм—ӯнӣ„лҮҢлі‘мҰқ(posterior reversible encephalopathy syndrome)мқ„ мқјмңјнӮ¬ мҲҳ мһҲлҠ” м•Ҫм ңмқҙлҜҖлЎң л‘җ м•Ҫм ңлҘј лі‘мҡ©н•ҳлҠ” нҷҳмһҗм—җм„ң лҮҢлі‘мҰқмқҙ л°ңмғқн•ң кІҪмҡ° л‘җ к°Җм§Җ лі‘нғңлҘј лӘЁл‘җ к°җлі„н•ҳлҠ” кІғмқҙ мӨ‘мҡ”н•ҳлӢӨ. нҠ№нһҲ л‘җ м•Ҫм ңк°Җ BBB мҶҗмғҒмқ„ мғҒнҳё мҰқнҸӯмӢңнӮ¬ к°ҖлҠҘм„ұмқ„ кі л Өн•ҳм—¬м•ј н•ҳл©° SWI мҙ¬мҳҒмқҖ лҜём„ём¶ңнҳҲмқ„ нҸ¬н•Ён•ң л№„м „нҳ•м Ғ лі‘нғңлҘј мЎ°кё° л°ңкІ¬н•ҳкі лі‘нғңмғқлҰ¬лҘј мқҙн•ҙн•ҳлҠ” лҚ° мң мҡ©н•ҳлӢӨ. ліё мҰқлЎҖлҠ” кё°мЎҙ ICI мң л°ң лҮҢм—јкіјлҠ” лӢӨлҘё м–‘мғҒмқҳ лҮҢлі‘мҰқ к°ҖлҠҘм„ұмқ„ мӢңмӮ¬н•ҳл©° м•„н…ҢмЎёлҰ¬мЈјл§ҷ-лІ л°”мӢңмЈјл§ҷ лі‘мҡ© нҷҳмһҗм—җм„ңмқҳ 진лӢЁ л°Ҹ м№ҳлЈҢ м „лһө мҲҳлҰҪм—җ м°ёкі к°Җ лҗ мҲҳ мһҲлӢӨ.к·ёлҹ¬лӮҳ ліё мҰқлЎҖм—җм„ңлҠ” л§җмқҙ집нқ¬мҶҢлҸҢкё°м•„көҗм„ёнҸ¬лӢ№лӢЁл°ұ(myelin oligodendrocyte glycoprotein, MOG)н•ӯмІҙ кІҖмӮ¬лҘј нҷ•мқён•ҳм§Җ лӘ»н•ҳм—¬ н•ӯMOGн•ӯмІҙм—°кҙҖм§Ҳнҷҳ(MOG associated disease)лҘј нҸ¬н•Ён•ң нғҲмҲҳмҙҲ м§Ҳнҷҳмқ„ мҷ„м „нһҲ л°°м ңн• мҲҳ м—ҶлӢӨлҠ” м җмқҙ мӨ‘мҡ”н•ң н•ңкі„лЎң лӮЁлҠ”лӢӨ. н–Ҙнӣ„ мң мӮ¬н•ң мӮ¬лЎҖм—җм„ңлҠ” MOGн•ӯмІҙ кІҖмӮ¬лҘј нҸ¬н•Ён•ң л©ҙм—ӯ кІҖмӮ¬к°Җ н•„мҲҳм ҒмңјлЎң кі л Өлҗҳм–ҙм•ј н•ңлӢӨ.
Figure.
Initial brain MRI demonstrated multiple T2/FLAIR hyperintense lesions involving the brainstem, cerebellum, deep gray matter, cerebral cortex, and subcortical white matter (A-C). Diffusion-weighted imaging (D) showed no diffusion restriction. Contrast-enhanced FLAIR images revealed multiple tiny enhancing nodules, predominantly in the brainstem and cerebellum, and to a lesser extent in the cerebral hemispheres (E-G). SWI showed diffuse microbleeds in the corpus callosum and subcortical white matter (H). On follow-up MRI after 4 months, most hyperintense lesions had resolved (I-K, M-O). Diffusion-weighted imaging again showed no diffusion restriction (L). Contrast- enhanced FLAIR demonstrated interval disappearance of the previously noted tiny enhancing nodules (M-O). However, diffuse microbleeds persisted in the corpus callosum and subcortical regions (P). MRI; magnetic resonance imaging, FLAIR; fluid-attenuated inversion recovery, SWI; susceptibility-weighted imaging.
- REFERENCES
- REFERENCES
- 1. Cheng AL, Qin S, Ikeda M, Galle PR, Ducreux M, Kim TY, et al. Updated efficacy and safety data from IMbrave150: atezolizumab plus bevacizumab vs. sorafenib for unresectable hepatocellular carcinoma. J Hepatol 2022;76:862-873.
[Article] [PubMed]2. Marini A, Bernardini A, Gigli GL, Valente M, MuГұiz-Castrillo S, Honnorat J, et al. Neurologic adverse events of immune checkpoint inhibitors: a systematic review. Neurology 2021;96:754-766.
[Article] [PubMed]3. Velasco R, VillagrГЎn M, JovГ© M, SimГі M, VilariГұo N, Alemany M, et al. Encephalitis induced by immune checkpoint inhibitors: a systematic review. JAMA Neurol 2021;78:864-873.
[Article] [PubMed]4. Li Y, Li M, Zuo L, Li X, Hou Y, Hu W. Cerebral microbleeds are associated with widespread blood-brain barrier leakage. Eur Neurol 2023;86:395-403.
[Article] [PubMed]5. Burda JE, Bernstein AM, Sofroniew MV. Astrocyte roles in traumatic brain injury. Exp Neurol 2016;275:305-315.
[Article] [PubMed] [PMC]
