Shifting the Paradigm of Dementia Management in Korea with the Role of Lecanemab
- Yeo Jin Kim, MD, PhD
л Ҳм№ҙл„Өл§ҷ лҸ„мһ…мқ„ нҶөн•ң н•ңкөӯ м№ҳл§Ө кҙҖлҰ¬ нҢЁлҹ¬лӢӨмһ„мқҳ м „нҷҳ
- к№Җ여진
- Received September 1, 2025; В В В Revised September 26, 2025; В В В Accepted September 26, 2025;
- м„ң лЎ
- м„ң лЎ
м№ҳл§ӨлҠ” м „ м„ёкі„м ҒмңјлЎң кі л №нҷ” мӮ¬нҡҢк°Җ мӢ¬нҷ”лҗҳл©ҙм„ң к°ҖмһҘ нҒ° ліҙкұҙн•ҷм Ғ кҙҖмӢ¬ м§Ҳнҷҳ мӨ‘ н•ҳлӮҳлЎң л¶ҖмғҒн•ҳкі мһҲлӢӨ. нҷҳмһҗмқҳ мқјмғҒнҷңлҸҷ мң м§Җ лҠҘл Ҙ мғҒмӢӨмқҖ мӮ¶мқҳ м§Ҳмқ„ нҒ¬кІҢ м Җн•ҳмӢңнӮ¬ лҝҗ м•„лӢҲлқј к°ҖмЎұм—җкІҢ мғҒлӢ№н•ң м •м„ңм Ғ, кІҪм ңм Ғ л¶ҖлӢҙмқ„ м•ҲкёҙлӢӨ[1,2]. лҳҗн•ң мһҘкё° мҡ”м–‘, мқҳлЈҢ м„ң비мҠӨ, мӮ¬нҡҢ ліөм§Җ м§Җм¶ңмқҳ мҰқк°ҖлЎң мқён•ҳм—¬ көӯк°Җм Ғ м°Ёмӣҗм—җм„ңлҸ„ л§үлҢҖн•ң мӮ¬нҡҢ кІҪм ңм Ғ 비мҡ©мқҙ мҡ”кө¬лҗңлӢӨ[3]. нҠ№нһҲ лҢҖн•ңлҜјкөӯмқҖ м„ёкі„м—җм„ң к°ҖмһҘ л№ лҘҙкІҢ кі л №нҷ”к°Җ 진н–үлҗҳкі мһҲлҠ” көӯк°Җ мӨ‘ н•ҳлӮҳлЎң н–Ҙнӣ„ 10л…„ лӮҙ 65м„ё мқҙмғҒ мқёкө¬к°Җ м „мІҙ мқёкө¬мқҳ 35%лҘј мҙҲкіјн• кІғмңјлЎң м „л§қлҗңлӢӨ[4]. мқҙм—җ л”°лқј н–Ҙнӣ„ м№ҳл§Ө нҷҳмһҗ мҲҳлҠ” кёүкІ©нһҲ мҰқк°Җн•ҳкі м№ҳл§Ө кҙҖл Ё мӮ¬нҡҢ, кІҪм ңм Ғ 비мҡ© м—ӯмӢң кё°н•ҳкёүмҲҳм ҒмңјлЎң мғҒмҠ№н• кІғмңјлЎң мҳҲмғҒлҗңлӢӨ[5]. мқҙлҹ¬н•ң мғҒнҷ©м—җм„ң м§Ҳлі‘мқҳ к·јліём Ғмқё 진н–үмқ„ м–өм ңн• мҲҳ мһҲлҠ” мӢ м•Ҫ к°ңл°ң л°Ҹ лҸ„мһ…мқҖ мқҳн•ҷм Ғ 분야лҝҗл§Ң м•„лӢҲлқј көӯк°Җ ліҙкұҙ м •мұ… м°Ёмӣҗм—җм„ң мҡ”кө¬лҗҳкі мһҲлӢӨ.нҳ„мһ¬к№Ңм§Җ мӮ¬мҡ©лҗҳм–ҙ мҷ”лҚҳ м№ҳл§Ө м№ҳлЈҢм ңлҠ” мЈјлЎң мҰқмғҒ мЎ°м Ҳм—җ лЁёл¬ҙлҘҙкі мһҲм–ҙ м§Ҳлі‘мқҳ лі‘нғңмғқлҰ¬м Ғ 진н–үмқ„ к·јліём ҒмңјлЎң лҠҰ추м§Җ лӘ»н–ҲлӢӨ[6]. л”°лқјм„ң мғҲлЎңмҡҙ кё°м „м—җ кё°л°ҳн•ң м№ҳлЈҢм ң, нҠ№нһҲ м•„л°ҖлЎңмқҙл“ң лІ нғҖлҘј м§Ғм ‘ н‘ңм Ғн•ҳлҠ” н•ӯмІҙ м№ҳлЈҢм ңмқҳ лҸ„мһ…мқҖ м№ҳл§Ө кҙҖлҰ¬ нҢЁлҹ¬лӢӨмһ„м—җ нҒ° ліҖнҷ”лҘј к°Җм ёмҳ¬ мҲҳ мһҲлӢӨ. лҚ” лӮҳм•„к°Җ м№ҳл§Ө мҳҲл°©, мЎ°кё° 진лӢЁ, мһҘкё°м Ғмқё лҸҢлҙ„ мІҙкі„мҷҖ м—°кі„лҗң нҶөн•©м Ғ кҙҖлҰ¬ м „лһөмқҳ мқјнҷҳмңјлЎңмҚЁ л Ҳм№ҙл„Өл§ҷкіј к°ҷмқҖ м•Ҫм ңмқҳ лҸ„мһ…мқҖ н•„мҲҳм ҒмқҙлӢӨ. мқҙм—җ ліё л…јл¬ём—җм„ңлҠ” л Ҳм№ҙл„Өл§ҷ лҸ„мһ…мқ„ кі„кё°лЎң көӯлӮҙ м№ҳл§Ө кҙҖлҰ¬ м •мұ…мқҳ ліҖнҷ” н•„мҡ”м„ұмқ„ к°•мЎ°н•ҳкі к·ё м •мұ…м Ғ л°©н–Ҙмқ„ лӘЁмғүн•ҳкі мһҗ н•ңлӢӨ.
- ліё лЎ
- ліё лЎ
- 1. мқём§ҖмһҘм• мҷҖ м•Ңмё н•ҳмқҙлЁёмқҳ к°ңмҡ”
- 1. мқём§ҖмһҘм• мҷҖ м•Ңмё н•ҳмқҙлЁёмқҳ к°ңмҡ”
1) мқём§ҖмһҘм• мқҳ 분лҘҳ
1) мқём§ҖмһҘм• мқҳ 분лҘҳ
мқём§Җкё°лҠҘмқҖ м •ліҙлҘј нҡҚл“қн•ҳкі мІҳлҰ¬н•ҳкі м ҖмһҘн•ҳкі нҷңмҡ©н•ҳлҠ” лӘЁл“ м •мӢ м Ғ кіјм •мқ„ мқјм»«лҠ” л§җлЎң мЈјмқҳл Ҙ, кё°м–өл Ҙ, м–ём–ҙлҠҘл Ҙ, мӢңкіөк°„кё°лҠҘ, 집н–үлҠҘл Ҙ, мӮ¬нҡҢмқём§Җмқҳ мҳҒм—ӯмңјлЎң кө¬м„ұлҗҳм–ҙ мһҲлӢӨ[7]. мқём§ҖмһҘм• лҠ” м—°мҶҚм Ғ мҠӨнҺҷнҠёлҹјмғҒм—җм„ң мЈјкҙҖкё°м–өмһҘм• , кІҪлҸ„мқём§ҖмһҘм• , м№ҳл§ӨлЎң кө¬л¶„лҗңлӢӨ. мЈјкҙҖкё°м–өмһҘм• м—җм„ңлҠ” нҷҳмһҗк°Җ мЈјкҙҖм ҒмңјлЎң кё°м–өмһҘм• лҘј нҳёмҶҢн•ҳм§Җл§Ң к°қкҙҖм Ғмқё мӢ кІҪмӢ¬лҰ¬ кІҖмӮ¬м—җм„ң лҡңл ·н•ң мқҙмғҒмқҖ нҷ•мқёлҗҳм§Җ м•ҠлҠ”лӢӨ[8]. кІҪлҸ„мқём§ҖмһҘм• м—җм„ңлҠ” к°қкҙҖм Ғ мӢ кІҪмӢ¬лҰ¬ кІҖмӮ¬м—җм„ң мқҙмғҒмқ„ ліҙмқҙм§Җл§Ң мқјмғҒнҷңлҸҷ мң м§Җ лҠҘл ҘмқҖ ліҙмЎҙлҗңлӢӨ[9]. м№ҳл§ӨлҠ” мқём§ҖмһҘм• лЎң мқён•ҳм—¬ мқјмғҒнҷңлҸҷ мң м§Җ лҠҘл Ҙм—җлҸ„ мҶҗмғҒмқҙ мғқкІЁ лҸ…лҰҪм Ғмқё мғқнҷң мң м§Җк°Җ м–ҙл өлӢӨ[10]. мқҙмҷҖ к°ҷмқҖ лӢЁкі„м Ғ кө¬л¶„мқҖ мқём§ҖмһҘм• мқҳ мЎ°кё° л°ңкІ¬кіј к°ңмһ…мқҳ мӨ‘мҡ”м„ұмқ„ к°•мЎ°н•ҳл©° мЈјкҙҖкё°м–өмһҘм• лӢЁкі„м—җм„ңл¶Җн„° м Ғк·№м Ғмқё лӘЁлӢҲн„°л§Ғмқҙ к¶ҢмһҘлҗҳкі мһҲлӢӨ[11].2) мқём§ҖмһҘм• мқҳ мӣҗмқё
2) мқём§ҖмһҘм• мқҳ мӣҗмқё
мқём§ҖмһҘм• мқҳ мӣҗмқёмқҖ нҒ¬кІҢ мқјм°Ём„ұкіј мқҙм°Ём„ұмңјлЎң кө¬л¶„лҗңлӢӨ. мқјм°Ё м№ҳл§ӨлҠ” м•Ңмё н•ҳмқҙлЁёлі‘кіј к°ҷмқҖ нҮҙн–үм„ұ лҮҢм§ҲнҷҳмңјлЎң мқён•ҳм—¬ л°ңмғқн•ҳл©° мқҙм°Ё м№ҳл§ӨлҠ” мҷёмғҒ, к°җм—ј, лҢҖмӮ¬м§Ҳнҷҳ, нҳҲкҙҖм„ұ м§Ҳнҷҳ л“ұ нҠ№м • мӣҗмқём—җ мқҳн•ҳм—¬ мң л°ңлҗңлӢӨ. м•Ңмё н•ҳмқҙлЁёлі‘мқҖ м„ёкі„м ҒмңјлЎң м „мІҙ м№ҳл§Ө мӣҗмқёмқҳ м•Ҫ 60-80%лҘј м°Ём§Җн•ҳкі [12] көӯлӮҙ ліҙкі м—җм„ңлҸ„ 80% мқҙмғҒмқ„ м°Ём§Җн•ҳлҠ”[13] к°ҖмһҘ нқ”н•ң мӣҗмқёмңјлЎң м•Ңл Өм ё мһҲмңјл©° мқҙм°Ё м№ҳл§ӨлЎң к°ҖмһҘ лҢҖн‘ңм Ғмқё нҳҲкҙҖм№ҳл§Өмқҳ кІҪмҡ°м—җлҸ„ 30%м—җм„ң м•„л°ҖлЎңмқҙл“ң лі‘лҰ¬к°Җ лҸҷл°ҳлҗҳм–ҙ мһҲлҠ” кІғмңјлЎң м•Ңл Өм ё мһҲлӢӨ[14]. нҠ№нһҲ нҳҲкҙҖм№ҳл§Өм—җм„ңлҸ„ м•„л°ҖлЎңмқҙл“ң лі‘лҰ¬мҷҖ лҸҷл°ҳлҗ кІҪмҡ° м•„л°ҖлЎңмқҙл“ң лі‘лҰ¬к°Җ лҸҷл°ҳлҗҳм§Җ м•ҠмқҖ кІҪмҡ°ліҙлӢӨ мқём§Җ м Җн•ҳк°Җ лҚ” л№ лҘҙкІҢ 진н–үн•ңлӢӨлҠ” ліҙкі к°Җ мһҲлӢӨ[15]. мқҙмІҳлҹј мқём§ҖмһҘм• мқҳ мӣҗмқёлі„ нҠ№м„ұмқ„ мқҙн•ҙн•ҳлҠ” кІғмқҖ нҷҳмһҗ л§һм¶Өнҳ• м№ҳлЈҢ м „лһө мҲҳлҰҪм—җ н•„мҲҳм ҒмқҙлӢӨ.3) м•Ңмё н•ҳмқҙлЁёлі‘мқҳ лі‘нғңмғқлҰ¬
3) м•Ңмё н•ҳмқҙлЁёлі‘мқҳ лі‘нғңмғқлҰ¬
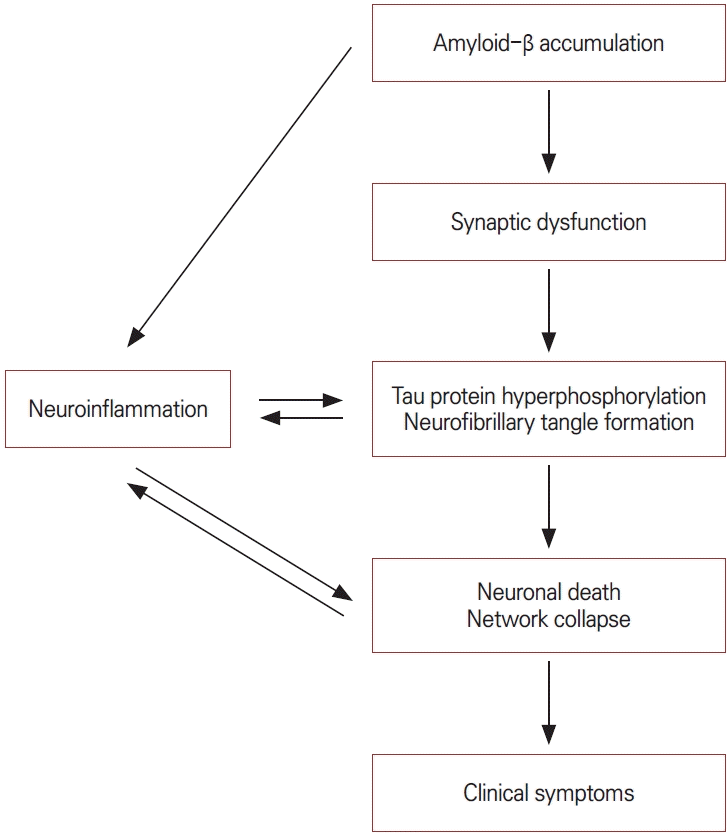
м•Ңмё н•ҳмқҙлЁёлі‘мқҳ лі‘нғңмғқлҰ¬(Fig.)м—җ лҢҖн•ҙ к°ҖмһҘ л„җлҰ¬ л°ӣм•„л“Өм—¬м§ҖлҠ” к°Җм„ӨмқҖ м•„л°ҖлЎңмқҙл“ң м—°мҮ„ к°Җм„Ө(amyloid cascade hypothesis)мқҙлӢӨ[16]. м•„л°ҖлЎңмқҙл“ң лІ нғҖ лӢЁл°ұм§Ҳмқҙ лҮҢм—җ 축м Ғлҗҳл©ҙ мӢңлғ…мҠӨ кё°лҠҘмһҘм• к°Җ л°ңмғқн•ҳкі мқҙм–ҙм„ң нғҖмҡ° лӢЁл°ұмқҳ кіјмқёмӮ°нҷ” л°Ҹ мӢ кІҪ섬мң лӢӨл°ң нҳ•м„ұмқҙ мҙү진лҗңлӢӨ. мқҙлҹ¬н•ң ліҖнҷ”лҠ” мӢ кІҪм„ёнҸ¬ мӮ¬л©ёкіј л„ӨнҠёмӣҢнҒ¬ 붕кҙҙлЎң мқҙм–ҙм ё мһ„мғҒм ҒмңјлЎң кё°м–өл Ҙ м Җн•ҳ, мӢӨн–үкё°лҠҘ м Җн•ҳ л“ұ лӢӨм–‘н•ң мқём§Җкё°лҠҘмһҘм• лЎң лӮҳнғҖлӮңлӢӨ. лҳҗн•ң мӢ кІҪм—јмҰқл°ҳмқ‘, мӮ°нҷ” мҠӨнҠёл ҲмҠӨ, нҳҲкҙҖкё°лҠҘ м Җн•ҳ л“ұмқҙ лі‘мқҳ 진н–үмқ„ мҙү진н•ҳлҠ” мҡ”мқёмңјлЎң мһ‘мҡ©н•ңлӢӨ[17-19]. мөңк·ј м—°кө¬л“ӨмқҖ м•„л°ҖлЎңмқҙл“ң лІ нғҖмҷҖ нғҖмҡ° лі‘лҰ¬мқҳ мғҒнҳёмһ‘мҡ© л°Ҹ лҮҢнҳҲкҙҖ м§Ҳнҷҳкіј л©ҙм—ӯ л°ҳмқ‘мқҳ м—ӯн• м—җ мЈјлӘ©н•ҳкі мһҲлӢӨ.
- 2. кё°мЎҙ м№ҳлЈҢм ңмқҳ н•ңкі„
- 2. кё°мЎҙ м№ҳлЈҢм ңмқҳ н•ңкі„
1) кё°мЎҙ м•Ҫл¬ј м№ҳлЈҢ: мҪңлҰ° к°Җм„Өм—җ кё°л°ҳн•ң м№ҳлЈҢ
1) кё°мЎҙ м•Ҫл¬ј м№ҳлЈҢ: мҪңлҰ° к°Җм„Өм—җ кё°л°ҳн•ң м№ҳлЈҢ
нҳ„мһ¬ мӮ¬мҡ©лҗҳлҠ” м•Ҫл¬јмқҖ м•„л°ҖлЎңмқҙл“ң м—°мҮ„ к°Җм„Ө мқҙм „мқҳ к°Җм„Өмқҙм—ҲлҚҳ мҪңлҰ° к°Җм„Өм—җ кё°л°ҳн•ң м№ҳлЈҢм ңлЎң м•„м„ёнӢёмҪңлҰ°л¶„н•ҙнҡЁмҶҢм–өм ңм ңмҷҖ N-methyl-D-aspartate glutamate (NMDA)мҲҳмҡ©мІҙ кёён•ӯм ңмқҙлӢӨ[20]. м•„м„ёнӢёмҪңлҰ°л¶„н•ҙнҡЁмҶҢм–өм ңм ңлҠ” кё°м–өл Ҙмқ„ мң м§Җн•ҳлҠ” лҚ° мӨ‘мҡ”н•ң м—ӯн• мқ„ н•ҳлҠ” мҪңлҰ°мӢ кІҪм„ёнҸ¬мқҳ кё°лҠҘмқ„ мң м§Җн•ҳлҸ„лЎқ н•ҳкё° мң„н•ҳм—¬ мҪңлҰ°мӢ кІҪм„ёнҸ¬мқҳ мӢ кІҪм „лӢ¬л¬јм§Ҳмқё м•„м„ёнӢёмҪңлҰ°мқҳ 분н•ҙлҘј м–өм ңн•ҳм—¬ мӢңлғ…мҠӨ лӮҙ мІҙлҘҳ мӢңк°„мқ„ лҠҳлҰјмңјлЎңмҚЁ мӢ кІҪм „лӢ¬мқ„ к°•нҷ”н•ңлӢӨ. NMDAмҲҳмҡ©мІҙкёён•ӯм ңлҠ” кіјлҸ„н•ң нқҘ분м„ұ мӢ кІҪм „лӢ¬мқ„ м–өм ңн•ҳм—¬ мӢңлғ…мҠӨ к°ҖмҶҢм„ұмқ„ мң м§Җн•ҳкі мӢ кІҪм „лӢ¬ нҡЁмңЁмқ„ к°ңм„ н•ҳл©° кіјлҸ„н•ң нқҘ분мңјлЎң мқён•ң лҸ…м„ұмқ„ м–өм ңн•ҳм—¬ мӢ кІҪм„ёнҸ¬ мҶҗмғҒмқ„ мӨ„мқёлӢӨ. мқҙлҹ¬н•ң м•Ҫл¬јмқҖ мқјмӢңм ҒмңјлЎң мқём§Җкё°лҠҘмқ„ мң м§Җн•ҳкұ°лӮҳ н–үлҸҷ мҰқмғҒмқ„ мЎ°м Ҳн•ҳлҠ” лҚ° лҸ„мӣҖмқ„ мӨ„ мҲҳ мһҲлӢӨ.2) кё°мЎҙ м•Ҫл¬ј м№ҳлЈҢмқҳ н•ңкі„м җ
2) кё°мЎҙ м•Ҫл¬ј м№ҳлЈҢмқҳ н•ңкі„м җ
кё°мЎҙм—җ мӮ¬мҡ©лҗҳлҠ” м•„м„ёнӢёмҪңлҰ°л¶„н•ҙнҡЁмҶҢм–өм ңм ң л°Ҹ NMDAмҲҳмҡ©мІҙкёён•ӯм ңлҠ” м•Ңмё н•ҳмқҙлЁёлі‘мқҳ к·јліём Ғмқё лі‘нғң мғқлҰ¬мқё м•„л°ҖлЎңмқҙл“ңлІ нғҖмҷҖ нғҖмҡ° лӢЁл°ұ 축м Ғмқ„ м°ЁлӢЁн•ҳм§Җ лӘ»н•ңлӢӨ. л”°лқјм„ң мқҙлҜё мӢ кІҪм„ёнҸ¬ мҶҗмғҒмқҙ мғҒлӢ№нһҲ 진н–үлҗң кІҪмҡ°м—җлҠ” нҡЁкіјк°Җ м ңн•ңм Ғмқҙл©° мһҘкё°м Ғмқё м§Ҳлі‘ м–өм ңм—җлҠ” кё°м—¬н•ҳм§Җ лӘ»н•ңлӢӨ. лҳҗн•ң нҡЁкіјк°Җ м ңн•ңм Ғмқё л°ҳл©ҙ мң„мһҘкҙҖмһҘм• , м–ҙм§ҖлҹјмҰқ л“ұмқҳ л¶Җмһ‘мҡ©мқҙ л°ңмғқн• мҲҳ мһҲм–ҙ мһҘкё° ліөмҡ©мқҳ мҲңмқ‘лҸ„лҸ„ л¬ём ңлЎң м§Җм ҒлҗңлӢӨ[21]. мқҙ л•Ңл¬ём—җ к·јліём Ғмқё м№ҳлЈҢм ңлЎңм„ңмқҳ м—ӯн• мқҖ м ңн•ңм ҒмқҙлӢӨ.
- 3. л Ҳм№ҙл„Өл§ҷкіј мғҲлЎңмҡҙ м№ҳлЈҢ нҢЁлҹ¬лӢӨмһ„
- 3. л Ҳм№ҙл„Өл§ҷкіј мғҲлЎңмҡҙ м№ҳлЈҢ нҢЁлҹ¬лӢӨмһ„
1) м•„л°ҖлЎңмқҙл“ң кё°л°ҳ м№ҳлЈҢмқҳ л“ұмһҘ
1) м•„л°ҖлЎңмқҙл“ң кё°л°ҳ м№ҳлЈҢмқҳ л“ұмһҘ
2000л…„лҢҖл¶Җн„° м•„л°ҖлЎңмқҙл“ң лІ нғҖ 축м Ғмқ„ м§Ғм ‘ м ңкұ°н•ҳкұ°лӮҳ м–өм ңн•ҳлҠ” н•ӯмІҙ кё°л°ҳ м№ҳлЈҢм ң к°ңл°ңмқҙ нҷңл°ңнһҲ 진н–үлҗҳм—ҲлӢӨ[22]. л Ҳм№ҙл„Өл§ҷмқҖ л©ҙм—ӯкёҖлЎңл¶ҲлҰ°(immunoglobulin) G1 н•ӯм•„л°ҖлЎңмқҙл“ң лӢЁнҒҙлЎ н•ӯмІҙлЎң кІҪлҸ„мқём§ҖмһҘм• л°Ҹ мҙҲкё° м•Ңмё н•ҳмқҙлЁёлі‘ м№ҳл§Ө нҷҳмһҗм—җм„ң м•„л°ҖлЎңмқҙл“ң н”ҢлқјнҒ¬мқҳ к°җмҶҢмҷҖ мһ„мғҒ нҡЁкіјлҘј мһ…мҰқн•ҳм—¬ м§Ҳлі‘ мЎ°м Ҳм№ҳлЈҢм ң(disease-modifying therapy, DMT)лЎңлҠ” лҜёкөӯм—җм„ң мІҳмқҢ м •мӢқ мҠ№мқёмқ„ л°ӣм•ҳлӢӨ[23]. м•Ҫл¬ј к°ңл°ңкіј лҸҷмӢңм—җ мғқл¬јн‘ңм§Җмһҗ м—°кө¬мқҳ л°ңм „мқҖ м•Ңмё н•ҳмқҙлЁёлі‘ 진лӢЁмқҳ нҢЁлҹ¬лӢӨмһ„мқ„ ліҖнҷ”мӢңмј°лӢӨ. кіјкұ°м—җлҠ” л¶ҖкІҖмқ„ нҶөн•ҙм„ңл§Ң м•Ңмё н•ҳмқҙлЁёлі‘ нҷ•м§„мқҙ к°ҖлҠҘн•ҳмҳҖмңјлӮҳ мқҙм ңлҠ” мғқл¬јн‘ңм§ҖмһҗлҘј нҶөн•ҙ мӮ¬л§қ мқҙм „м—җлҸ„ м•„л°ҖлЎңмқҙл“ң лІ нғҖ л°Ҹ нғҖмҡ° лӢЁл°ұмқҳ лі‘лҰ¬м Ғ ліҖнҷ”лҘј м§Ғм ‘ нҷ•мқён• мҲҳ мһҲкІҢ лҗҳм—ҲлӢӨ. мқҙлҹ¬н•ң кё°мҲ мқҳ 진ліҙлЎң мқён•ҳм—¬ мһ„мғҒ мҰқмғҒмқҙ л°ңнҳ„лҗҳкё° м „ лӢЁкі„м—җм„ңлҸ„ м•Ңмё н•ҳмқҙлЁёлі‘мқ„ 진лӢЁн•ҳкі мЎ°кё° к°ңмһ…мқ„ мӢңлҸ„н• мҲҳ мһҲлҠ” кёёмқҙ м—ҙл ёлӢӨ[24]. мғқл¬јн‘ңм§Җмһҗ м—°кө¬ кІ°кіјм—җ л”°лҘҙл©ҙ м•„л°ҖлЎңмқҙл“ң лІ нғҖмқҳ 축м ҒмқҖ мһ„мғҒ мҰқмғҒ м¶ңнҳ„ мҲҳл…„ м „л¶Җн„° мқҙлҜё 진н–үлҗҳл©°[25] л”°лқјм„ң мЎ°кё° м№ҳлЈҢ к°ңмһ…мқҙ нҡЁкіјм ҒмқҙлқјлҠ” м җмқҙ нҷ•мқёлҗҳм—ҲлӢӨ[26]. мҙҲкё° мһ„мғҒмӢңн—ҳмқҖ мЈјлЎң мӨ‘л“ұлҸ„ м№ҳл§Ө нҷҳмһҗлҘј лҢҖмғҒмңјлЎң мқҙлЈЁм–ҙмЎҢмңјлӮҳ мқҙнӣ„ мғқл¬јн‘ңм§Җмһҗ кё°мҲ мқҙ л°ңм „н•ҳл©ҙм„ң кІҪлҸ„мқём§ҖмһҘм• л°Ҹ мҙҲкё° м•Ңмё н•ҳмқҙлЁёлі‘ м№ҳл§Ө нҷҳмһҗм—җм„ң м№ҳлЈҢ нҡЁкіјк°Җ лҚ” нҒ¬лӢӨлҠ” к·јкұ°к°Җ 축м Ғлҗҳм—ҲлӢӨ[27]. лҳҗн•ң лҸ„лӮҳл„Өл§ҷ(donanemab) мһ„мғҒ мӢңн—ҳм—җм„ңлҠ” нғҖмҡ° м№Ём°© м •лҸ„м—җ л”°лқј м•ҪнҡЁ м°Ёмқҙк°Җ лӮҳнғҖлӮ¬мңјл©° нғҖмҡ° м№Ём°©мқҙ кҙ‘лІ”мң„н•ҳкІҢ 진н–үлҗң нҷҳмһҗліҙлӢӨ к·ёл Үм§Җ м•ҠмқҖ нҷҳмһҗм—җм„ң нӣЁм”¬ лҚ” к°•л Ҙн•ң м№ҳлЈҢ нҡЁкіјк°Җ кҙҖм°°лҗҳм—ҲлӢӨ[28]. мқҙлҹ¬н•ң кІ°кіјлҠ” м•Ңмё н•ҳмқҙлЁёлі‘мқҳ мЎ°кё° м№ҳлЈҢк°Җ м§Ҳлі‘ 진н–үмқ„ м–өм ңн•ҳлҠ” лҚ° к°ҖмһҘ нҡЁкіјм Ғмһ„мқ„ к°•л ҘнһҲ л’·л°ӣм№Ён•ҳлҠ” к·јкұ°к°Җ лҗңлӢӨ.2) л Ҳм№ҙл„Өл§ҷ мӮ¬мҡ© мЎ°кұҙ
2) л Ҳм№ҙл„Өл§ҷ мӮ¬мҡ© мЎ°кұҙ
л Ҳм№ҙл„Өл§ҷмқҖ м•„л°ҖлЎңмқҙл“ң лі‘лҰ¬к°Җ нҷ•мқёлҗң кІҪлҸ„мқём§ҖмһҘм• л°Ҹ мҙҲкё° м•Ңмё н•ҳмқҙлЁёлі‘ м№ҳл§Ө нҷҳмһҗм—җм„ң мӮ¬мҡ©лҗңлӢӨ. мӮ¬мҡ© м „ м•„л°ҖлЎңмқҙл“ң м–‘м „мһҗл°©м¶ңмҙ¬мҳҒ(positron emission topography, PET) нҳ№мқҖ лҮҢмІҷмҲҳм•Ў кІҖмӮ¬лҘј нҶөн•ҙ м•Ңмё н•ҳмқҙлЁёлі‘ лі‘лҰ¬лҘј нҷ•мқён•ҙм•ј н•ҳл©° м•„нҸ¬м§ҖлӢЁл°ұE (apolipoprotein E, APOE) мң м „мһҗнҳ• 분м„қкіј мһҗкё°кіөлӘ…мҳҒмғҒ(magnetic resonance imaging, MRI)мқ„ нҶөн•ң мң„н—ҳ нҸүк°Җк°Җ н•„мҡ”н•ҳлӢӨ[29]. мқҙмҷҖ к°ҷмқҖ мЎ°кұҙмқҖ нҷҳмһҗ м•Ҳм „м„ұмқ„ нҷ•ліҙн•ҳкё° мң„н•ң н•„мҲҳм Ғ м Ҳм°ЁлЎң мһ„мғҒ нҳ„мһҘм—җм„ң мқјм • мҲҳмӨҖмқҳ мқён”„лқјмҷҖ кІҖмӮ¬ 비мҡ© м§Җмӣҗмқҙ мҡ”кө¬лҗңлӢӨ.3) л Ҳм№ҙл„Өл§ҷ л¶Җмһ‘мҡ©
3) л Ҳм№ҙл„Өл§ҷ л¶Җмһ‘мҡ©
л Ҳм№ҙл„Өл§ҷ мӮ¬мҡ© мӢң к°ҖмһҘ мЈјмқҳн•ҙм•ј н• л¶Җмһ‘мҡ©мқҖ м•„л°ҖлЎңмқҙл“ң кҙҖл Ё мҳҒмғҒ мқҙмғҒ(amyloid-related imaging abnormalities, ARIA)мқҙлӢӨ[30]. мқҙлҠ” лҮҢнҳҲкҙҖлІҪм—җ м№Ём°©лҗң м•„л°ҖлЎңмқҙл“ң лІ нғҖк°Җ м ңкұ°лҗҳл©ҙм„ң нҲ¬кіјм„ұмқҙ мҰқк°Җн•ҳм—¬ лҮҢл¶Җмў…мқҙлӮҳ лҮҢм¶ңнҳҲмқ„ мң л°ңн•ҳлҠ” нҳ„мғҒмқҙлӢӨ. л¶Җмһ‘мҡ©мқҖ мЈјлЎң нҲ¬м—¬ мҙҲкё° 3к°ңмӣ” лӮҙм—җ 집мӨ‘м ҒмңјлЎң л°ңмғқн•ҳм§Җл§Ң мқҙнӣ„ м•Ҳм •нҷ”лҗҳлҠ” кІҪн–Ҙмқ„ ліҙмқёлӢӨ. ARIAлҠ” нҠ№нһҲ APOE Оө4 ліҙмң мһҗм—җкІҢ лҚ” л№ҲлІҲнһҲ лӮҳнғҖлӮҳлҠ” кІғмңјлЎң м•Ңл Өм ё мһҲлӢӨ. мһ„мғҒмӢңн—ҳм—җм„ңлҠ” мЈјмһ… кҙҖл Ё мқҙмғҒ л°ҳмқ‘лҸ„ ліҙкі лҗҳм—ҲмңјлӮҳ лҢҖл¶Җ분 кІҪмҰқм—җм„ң мӨ‘л“ұлҸ„ мҲҳмӨҖмқҙм—ҲлӢӨ. мқҙмҷҖ к°ҷмқҖ м•Ҳм „м„ұ л¬ём ңлҠ” мӢӨм ң мһ„мғҒ нҳ„мһҘм—җм„ң м№ҳлЈҢ м§ҖмҶҚ м—¬л¶ҖлҘј кІ°м •н•ҳлҠ” н•өмӢ¬ мҡ”мҶҢк°Җ лҗ кІғмқҙлӢӨ.4) лҸҷмқј кё°м „ м•Ҫм ң
4) лҸҷмқј кё°м „ м•Ҫм ң
л Ҳм№ҙл„Өл§ҷ мҷём—җлҸ„ м•„л‘җм№ҙлҲ„л§ҷ, лҸ„лӮҳл„Өл§ҷ л“ұ м•„л°ҖлЎңмқҙл“ң н‘ңм Ғ м•Ҫм ңк°Җ к°ңл°ңлҗҳм—ҲлӢӨ. м•„л‘җм№ҙлҲ„л§ҷмқҖ л Ҳм№ҙл„Өл§ҷ мқҙм „м—җ к°ңл°ңлҗҳм–ҙ лҜёкөӯмӢқн’Ҳмқҳм•Ҫкөӯ(Food and Drug Administration, FDA) к°ҖмҶҚ мҠ№мқёмқ„ л°ӣм•ҳмңјлӮҳ мһ„мғҒм Ғ мқҙл“қмқҙ лҶ’м§Җ м•Ҡм•„ кІ°көӯ м •мӢқмңјлЎң мҠ№мқёлҗҳм§Җ лӘ»н•ҳмҳҖлӢӨ. лҸ„лӮҳл„Өл§ҷмқҖ мқјл¶Җ көӯк°Җм—җм„ң мҠ№мқёлҗҳм—ҲмңјлӮҳ ARIA л°ңмғқлҘ мқҙ мғҒлҢҖм ҒмңјлЎң лҶ’м•„ көӯлӮҙм—җм„ңлҠ” мҠ№мқёмқ„ л°ӣм§Җ лӘ»н•ҳмҳҖлӢӨ. мқҙлҹ¬н•ң мӮ¬лЎҖлҠ” лҸҷмқј кё°м „ м•Ҫм ңлқј н•ҳлҚ”лқјлҸ„ мң нҡЁм„ұ л°Ҹ м•Ҳм „м„ұ н”„лЎңнҢҢмқјмқҳ м°Ёмқҙк°Җ м№ҳлЈҢм ң мҠ№мқё м—¬л¶Җм—җ нҒ° мҳҒн–Ҙмқ„ лҜём№ңлӢӨлҠ” м җмқ„ ліҙм—¬мӨҖлӢӨ.
- 4. н•ҙмҷё л Ҳм№ҙл„Өл§ҷ лҸ„мһ… л°Ҹ к·ңм ң, кёүм—¬ нҳ„нҷ©
- 4. н•ҙмҷё л Ҳм№ҙл„Өл§ҷ лҸ„мһ… л°Ҹ к·ңм ң, кёүм—¬ нҳ„нҷ©
1) лҜёкөӯ
1) лҜёкөӯ
лҜёкөӯ FDAлҠ” 2023л…„ 1мӣ” л Ҳм№ҙл„Өл§ҷмқ„ к°ҖмҶҚ мҠ№мқён•ң л’Ө 7мӣ” CLARITY AD 3мғҒ мһ„мғҒмӢңн—ҳ кІ°кіјлҘј к·јкұ°лЎң м •мӢқ мҠ№мқёмқ„ л¶Җм—¬н•ҳмҳҖлӢӨ[31]. мқҙм „м—җ к°ңл°ңлҗҳм—ҲлҚҳ к°ҷмқҖ кё°м „мқҳ м•Ҫм ңмқё м•„л‘җм№ҙлҲ„л§ҷмқҳ кІҪмҡ° мһ„мғҒмӢңн—ҳ EMERGE/ENGAGEлҘј 진н–үн•ҳмҳҖкі EMERGEмқҳ кі мҡ©лҹү кө°м—җм„ң мһ„мғҒм Ғ мң мҡ©м„ұмқ„ ліҙмҳҖмңјлӮҳ ENGAGEм—җм„ңлҠ” мһ„мғҒм Ғ мң мҡ©м„ұмқ„ ліҙмқҙм§Җ м•ҠлҠ” мғҒл°ҳлҗң кІ°кіјк°Җ лӮҳмҷ”лӢӨ[32]. н•ҳм§Җл§Ң лҮҢ лӮҙ м•„л°ҖлЎңмқҙл“ң н”ҢлқјнҒ¬ к°җмҶҢлҘј ліҙм—¬ мқҙлҘј к·јкұ°лЎң к°ҖмҶҚ мҠ№мқёмқ„ л°ӣм•ҳкі мһ„мғҒм Ғ мқҙл“қ кІҖмҰқмқ„ мң„н•ң мӮ¬нӣ„ нҷ•мҰқ мӢңн—ҳмқ„ мЎ°кұҙмңјлЎң л¶ҷм—ҲлӢӨ. н•ҳм§Җл§Ң 2024л…„ 1мӣ” к°ңл°ңмӮ¬м—җм„ң к°ңл°ң л°Ҹ нҢҗл§Ө мӨ‘лӢЁмқ„ л°ңн‘ңн•ҳм—¬ нҳ„мһ¬лҠ” мӮ¬мҡ©лҗҳм§Җ м•Ҡкі мһҲлӢӨ. м•„л‘җм№ҙлҲ„л§ҷ мӮ¬лЎҖмҷҖ лӢ¬лҰ¬ л Ҳм№ҙл„Өл§ҷмқҖ 18к°ңмӣ” мӮ¬мҡ© нӣ„ мһ„мғҒ м§Җн‘ңм—җм„ң мң„м•Ҫ лҢҖ비 27% 진н–ү м§Җм—° нҡЁкіјлҘј ліҙм—¬ мһ„мғҒм Ғ мң нҡЁм„ұмқ„ мһ…мҰқн•ҳмҳҖлӢӨлҠ” м җм—җм„ң м°Ёлі„нҷ”лҗңлӢӨ. м•Ҫк°ҖлҠ” м—°к°„ 26,500лӢ¬лҹ¬лЎң мұ…м •лҗҳм—Ҳмңјл©° л©”л””мјҖм–ҙ нҢҢнҠё Bм—җ м Ғмҡ©лҗҳм–ҙ нҷҳмһҗлҠ” м•Ҫ 20%мқё 5,300лӢ¬лҹ¬лҘј л¶ҖлӢҙн•ңлӢӨ. мқҙлҠ” кі л № нҷҳмһҗмқҳ м ‘к·јм„ұмқ„ мқјм • л¶Җ분 ліҙмһҘн•ҳмҳҖмңјлӮҳ м—¬м „нһҲ мғҒлӢ№н•ң кІҪм ңм Ғ л¶ҖлӢҙмңјлЎң м§Җм ҒлҗңлӢӨ. лҚ” лӮҳм•„к°Җ нҷҳмһҗл“Өмқҳ мӢӨм ң м•Ҫм ң мӮ¬мҡ©лҘ мқҖ ліҙн—ҳ м Ғмҡ© нҷ•лҢҖ м—¬л¶ҖмҷҖ л°Җм ‘н•ҳкІҢ м—°кҙҖлҗҳм–ҙ мһҲмңјл©° FDA мҠ№мқёмқҖ кі§л°”лЎң л©”л””мјҖм–ҙ л°Ҹ л©”л””мјҖмқҙмҠӨ м„ң비мҠӨ м„јн„°(Centers for Medicare & Medicaid Services, CMS)мқҳ кёүм—¬ м •мұ… ліҖнҷ”лЎң мқҙм–ҙм ё мӮ¬нҡҢм Ғ л…јмҹҒмқ„ мҙүл°ңн•ҳмҳҖлӢӨ.2) мң лҹҪ м—°н•©
2) мң лҹҪ м—°н•©
мң лҹҪмқҳм•Ҫн’ҲмІӯ(European Medicines Agency, EMA)мқҖ 2024л…„ 7мӣ” м•Ҳм „м„ұ л¬ём ңлЎң мҠ№мқё кұ°л¶Җ к¶Ңкі лҘј лӮҙл ёмңјлӮҳ 2025л…„ 4мӣ” мөңмў…м ҒмңјлЎң APOE Оө4мң м „мһҗ 0к°ң лҳҗлҠ” 1к°ңмқё нҷҳмһҗ 집лӢЁм—җ н•ңм •н•ҳм—¬ мҠ№мқёмқ„ кІ°м •н•ҳмҳҖлӢӨ[33]. мқҙлҠ” нҷҳмһҗ м•Ҳм „м„ұм—җ лҢҖн•ң ліҙмҲҳм Ғ м ‘к·јмқ„ л°ҳмҳҒн•ң кІғмқҙлӢӨ. лҳҗн•ң мң лҹҪм—°н•© м°Ёмӣҗм—җм„ң нҶөм ңлҗң м ‘к·ј н”„лЎңк·ёлһЁ, ARIA лӘЁлӢҲн„°л§Ғ мІҙнҒ¬лҰ¬мҠӨнҠё м ңкіө, л“ұлЎқ мІҙкі„ кө¬м¶• л“ұ мң„н—ҳ кҙҖлҰ¬ мІҙкі„лҘј мЎ°кұҙмңјлЎң л¶Җкіјн•ҳмҳҖлӢӨ. к°ҖкІ©кіј кёүм—¬ нҳ‘мғҒмқҖ м•„м§Ғ 진н–ү мӨ‘мқҙлӢӨ. мқҙлҠ” мң лҹҪм—°н•© көӯк°Җлі„лЎң м•Ҫк°Җ кІ°м • кіјм •мқҙ лҸ…лҰҪм ҒмңјлЎң 진н–үлҗҳлҠ” м җкіј л§һл¬јл Ө мӢӨм ң мһ„мғҒ м Ғмҡ© мӢңм җмқҖ нҡҢмӣҗкөӯлі„лЎң м°Ёмқҙк°Җ мһҲмқ„ кІғмңјлЎң м „л§қлҗңлӢӨ.3) мқјліё
3) мқјліё
мқјліёмқҳ нӣ„мғқл…ёлҸҷм„ұ(Ministry of Health, Labour and Welfare, MHLW)мқҖ 2023л…„ 9мӣ” л Ҳм№ҙл„Өл§ҷмқ„ мҠ№мқён•ҳкі к°ҷмқҖ н•ҙ 12мӣ” көӯк°Җкұҙк°•ліҙн—ҳ(National Health Insurance, NHI) м•Ҫк°Җм—җ л“ұмһ¬н•ҳмҳҖлӢӨ[34]. мҙҲкё° м•Ҫк°ҖлҠ” м—°к°„ м•Ҫ 298л§Ң м—”мңјлЎң мұ…м •лҗҳм—Ҳмңјл©° м—°л №лі„ ліёмқё л¶ҖлӢҙлҘ мқҙ м Ғмҡ©лҗҳм—ҲлӢӨ. мқјліёмқҖ 비мҡ© нҡЁкіј нҸүк°ҖлҘј нҶөн•ҙ мһҘкё°м ҒмңјлЎң к°ҖкІ©мқ„ мқён•ҳн• кі„нҡҚмқ„ м„ёмҡ°кі мһҲмңјл©° 2025л…„ 11мӣ”л¶Җн„° к°ңм • м•Ҫк°Җк°Җ мӢңн–үлҗ мҳҲм •мқҙлӢӨ. мқҙ кіјм •м—җм„ң мқјліё м •л¶ҖлҠ” мқҳлЈҢ비лҝҗ м•„лӢҲлқј мһҘкё° мҡ”м–‘ 비мҡ©к№Ңм§Җ нҸ¬н•Ён•ң 비мҡ© нҡЁкіј 분м„қмқ„ лі‘н–үн•ҳм—¬ м •мұ…м Ғ кІ°м •мқ„ лӮҙл ёлӢӨ. мқјліё мӮ¬лЎҖлҠ” кі л №нҷ” мӮ¬нҡҢм—җм„ң м№ҳл§Ө кҙҖлҰ¬ м •мұ…кіј ліҙн—ҳ м ңлҸ„мқҳ м—°кі„к°Җ м–ҙл–»кІҢ мқҙлӨ„м ём•ј н•ҳлҠ”м§ҖлҘј ліҙм—¬мЈјлҠ” мӨ‘мҡ”н•ң лӘЁлҚёмқҙлӢӨ.
- 5. көӯлӮҙ л Ҳм№ҙл„Өл§ҷ лҸ„мһ… нӣ„ кі л Өн•ҙм•ј н• кіјм ң
- 5. көӯлӮҙ л Ҳм№ҙл„Өл§ҷ лҸ„мһ… нӣ„ кі л Өн•ҙм•ј н• кіјм ң
1) кІҪм ңм„ұ
1) кІҪм ңм„ұ
лӢӨмҲҳмқҳ ліҙкұҙкІҪм ң 분м„қм—җ л”°лҘҙл©ҙ л Ҳм№ҙл„Өл§ҷмқҖ м§Ҳлі‘ 진н–үмқ„ м–өм ңн•ҳм—¬ ліҙнҳёмһҗ лҸҢлҙ„ л¶ҖлӢҙмқ„ мӨ„мқҙкі мһҘкё° мҡ”м–‘ 비мҡ©мқ„ к°җмҶҢмӢңнӮ¬ мҲҳ мһҲлӢӨ. көӯлӮҙм—җм„ң 진н–үн•ң кІҪм ңм„ұ нҸүк°Җм—җ мқҳн•ҳл©ҙ көӯлҜјкұҙк°•ліҙн—ҳм—җм„ң м§Ғм ‘ м§Җл¶Ҳн•ҳлҠ” м•Ҫм ң비, мқҳлЈҢ비, мҡ”양비 л“ұ кіөмӢқм Ғ 비мҡ©л§Ң л°ҳмҳҒн•ҳм—¬ н‘ңмӨҖ м№ҳлЈҢмҷҖ 비көҗн•ң л Ҳм№ҙл„Өл§ҷмқҳ 비мҡ©-нҡЁкіјл№„(incremental cost-effectiveness ratio, ICER)лҘј кі„мӮ°н•ҳмҳҖмқ„ л•Ң мӮ¶мқҳ м§Ҳмқҙ ліҙм •лҗң мғқмЎҙ 1л…„(quality-adjusted life year)мқ„ лҚ” м–»кё° мң„н•ҳм—¬ 1м–ө 9,817л§Ң мӣҗмқҳ 비мҡ©мқҙ н•„мҡ”н•ҳлӢӨлҠ” кІ°кіјлҘј м–»м—ҲлӢӨ. н•ҳм§Җл§Ң лҸҢлҙ„мһҗмқҳ мӢңк°„ 비мҡ© л°Ҹ 비кёүм—¬ м§Җм¶ң, көҗнҶө비 к°ҷмқҖ к°„м ‘ 비мҡ©лҸ„ нҸ¬н•Ён•ң кІҪмҡ°м—җлҠ” ICERлҠ” 1м–ө 8,119л§Ңмӣҗмқҳ 비мҡ©мқҙ н•„мҡ”н•ҳлӢӨлҠ” кІ°кіјлҘј ліҙм—¬ лҸҢлҙ„мһҗмқҳ 비мҡ©мқ„ л°ҳмҳҒн•ҳл©ҙ ICERмқҙ к°ңм„ лҗЁмқ„ ліҙм—¬мЈјм—ҲлӢӨ. мқҙлҠ” мӮ¬нҡҢм Ғ 비мҡ©мқҳ мІҙкі„м Ғ л°ҳмҳҒмқҙ 비мҡ©-нҡЁкіјм„ұ нҢҗм •м—җм„ң мӨ‘мҡ”н•Ёмқ„ ліҙм—¬мӨҖлӢӨ. лҳҗн•ң мқҙ 분м„қм—җм„ң м Ғмқ‘мҰқмқ„ мҙҲкё° м•Ңмё н•ҳмқҙлЁёлі‘ м№ҳл§ӨлЎң ліҖкІҪн•ҳмҳҖмқ„ мӢң ICERмқҙ к°ңм„ лҗҳкі м•Ҫк°ҖлҘј 50% мқён•ҳн•ҳл©ҙ ICERмқҙ 52% мқҙмғҒ к°ңм„ лҗҳм–ҙ ICER кі„мӮ°м—җ лҢҖмғҒмһҗ л°Ҹ к°ҖкІ©мқ„ м–ҙл–»кІҢ м„Өм •н•ҳлҠ”м§Җк°Җ мӨ‘мҡ”н•Ёмқ„ ліҙмҳҖлӢӨ. лҚ”л¶Ҳм–ҙ м§Ҳлі‘ лӢЁкі„к°Җ мӢ¬нҷ”лҗҳм–ҙ мӨ‘мҰқ м№ҳл§ӨлЎң 진н–үн• мҲҳлЎқ мһҘкё° мҡ”м–‘ м§Җм¶ңмқҙ мқҳлЈҢ비мқҳ 3л°° мқҙмғҒмңјлЎң кёүмҰқн•ҳлҜҖлЎң мӢӨм ң мһ¬м • мҳҒн–ҘмқҖ м•Ҫк°Җлҝҗ м•„лӢҲлқј мҡ”м–‘ м „нҷҳ м§Җм—° нҡЁкіјм—җ мқҳн•ҙм„ңлҸ„ мҳҒн–Ҙмқ„ л°ӣкІҢ лҗңлӢӨ[5]. мқҙлҹ¬н•ң 비мҡ© нҡЁкіјм„ұмқҖ лҚ”мҡұ кө¬мІҙм ҒмңјлЎң, м •кё°м ҒмңјлЎң нҸүк°Җлҗ н•„мҡ”к°Җ мһҲмңјл©° мһҘкё°м ҒмңјлЎң мӮ¬нҡҢм Ғ 비мҡ© м Ҳк°җ нҡЁкіјлҘј м •мұ… кІ°м •м—җ л°ҳмҳҒн•ҳлҠ” кІғмқҙ мӨ‘мҡ”н•ҳлӢӨ.2) ліҙн—ҳ м Ғмҡ©
2) ліҙн—ҳ м Ғмҡ©
лҜёкөӯмқҳ кІҪмҡ° л Ҳм№ҙл„Өл§ҷмқҳ м—°к°„ м•Ҫк°ҖлҠ” 26,500лӢ¬лҹ¬лЎң мұ…м •лҗҳм—ҲмңјлӮҳ мқјл¶Җ л©”л””мјҖм–ҙ нҢҢнҠё Bм—җ м Ғмҡ©лҗҳлҠ” нҷҳмһҗмқҳ кІҪмҡ° м•Ҫ 20%мқё 5,300лӢ¬лҹ¬лҘј л¶ҖлӢҙн•ңлӢӨ. мқјліёмқҳ кІҪмҡ°лҠ” мҙҲкё° м•Ҫк°ҖлҠ” м—°к°„ м•Ҫ 298л§Ң м—”мңјлЎң мұ…м •лҗҳм—ҲмңјлӮҳ 25л…„ 7мӣ” 15% к°ҖкІ© мқён•ҳлҘј кІ°м •н•ҳм—¬ м—°к°„ м•Ҫ 253л§Ңм—”мңјлЎң м•Ҫк°ҖлҘј мһ¬мұ…м •н•ҳмҳҖкі мқҙ м•Ҫк°ҖлҠ” 2025л…„ 11мӣ” 1мқјл¶Җн„° м Ғмҡ©лҗ мҳҲм •мқҙлӢӨ. м—°л №лі„ ліёмқё л¶ҖлӢҙлҘ мқҖ 10-30%лҘј м Ғмҡ©н•ңлӢӨ. 75м„ё мқҙмғҒ кі л №мқҳ кІҪмҡ° 10% ліёмқё л¶ҖлӢҙлҘ мқ„ м Ғмҡ©н•ҳкі 65м„ём—җм„ң 74м„ё л…ёл…„мқҳ кІҪмҡ° 20%, 64м„ё мқҙн•ҳлҠ” 30% ліёмқё л¶ҖлӢҙн•ңлӢӨ. лӢЁ кі мҶҢл“қмһҗлҠ” м—°л №м—җ мғҒкҙҖм—Ҷмқҙ 30% ліёмқё л¶ҖлӢҙлҘ мқ„ м Ғмҡ©н•ңлӢӨ. н•ңкөӯмқҳ кІҪмҡ°лҠ” м•Ҫк°Җк°Җ м—°к°„ м•Ҫ 2,600л§ҢмӣҗмңјлЎң м¶”м •лҗҳлӮҳ лӘЁл“ кІҪмҡ°м—җм„ң м „м•Ў нҷҳмһҗ л¶ҖлӢҙмңјлЎң м Ғмҡ©н•ҳкі мһҲлӢӨ(Table).л Ҳм№ҙл„Өл§ҷ нҲ¬м—¬ м „ н•„мҲҳм Ғмқё кІҖмӮ¬лҠ” м•„л°ҖлЎңмқҙл“ң PET лҳҗлҠ” лҮҢмІҷмҲҳм•Ў кё°л°ҳ м•„л°ҖлЎңмқҙл“ң лІ нғҖ, мқёмӮ°нҷ”-нғҖмҡ° кІҖмӮ¬, ARIA мң„н—ҳлҸ„лҘј нҸүк°Җн•ҳкё° мң„н•ң лҮҢMRI к·ёлҰ¬кі APOEмң м „мһҗ кІҖмӮ¬мқҙлӢӨ. к·ёлҹ¬лӮҳ нҳ„мһ¬ мқҙл“Ө кІҖмӮ¬лҠ” көӯлӮҙм—җм„ң ліҙн—ҳ м Ғмҡ©мқ„ л°ӣм§Җ лӘ»н•ҳкі мһҲм–ҙ нҷҳмһҗ м ‘к·јм„ұмқҙ м ңн•ңлҗҳл©° н–Ҙнӣ„ м№ҳлЈҢ нҷ•мӮ°м—җ кұёлҰјлҸҢмқҙ лҗ к°ҖлҠҘм„ұмқҙ лҶ’лӢӨ. л”°лқјм„ң м•Ҫм ң кёүм—¬ м—¬л¶ҖмҷҖ лҚ”л¶Ҳм–ҙ л°ҳліө мҳҒмғҒ кІҖмӮ¬ л°Ҹ мғқл¬јн‘ңм§Җмһҗ кІҖмӮ¬мқҳ кёүм—¬нҷ”к°Җ н•Ёк»ҳ л…јмқҳлҗҳм–ҙм•ј н•ңлӢӨ.3) мқён”„лқј
3) мқён”„лқј
л Ҳм№ҙл„Өл§ҷмқҖ м •л§Ҙ мЈјмӮ¬м ң нҳ•нғңлЎң нҲ¬м—¬лҗҳлҜҖлЎң м•Ҳм •м Ғ нҲ¬м—¬лҘј мң„н•ң мӢңм„Өкіј м „л¬ё мқёл Ҙмқҙ н•„мҡ”н•ҳлӢӨ. лҚ”л¶Ҳм–ҙ м •л°Җ мҳҒмғҒ кІҖмӮ¬ л°Ҹ мң м „мһҗ кІҖмӮ¬лҘј мҲҳн–үн• мҲҳ мһҲлҠ” к¶Ңм—ӯлі„ кұ°м җ лі‘мӣҗмқҙ л¶ҖмЎұн•ҳм—¬ м§Җм—ӯ к°„ м ‘к·јм„ұ кІ©м°Ё л¬ём ңк°Җ мҡ°л ӨлҗңлӢӨ. мқҙм—җ л”°лқј мқён”„лқј нҷ•м¶©кіј мқҳлЈҢ진 көҗмңЎмқҙ н•„мҡ”н•ҳлӢӨ. лҳҗн•ң көӯлӮҙмқҳ м№ҳл§Ө мЎ°кё° 진лӢЁ мІҙкі„лҠ” м—¬м „нһҲ лҜёнқЎн•ҳлӢӨ. м№ҳл§Ө көӯк°Җ мұ…мһ„м ң мӢңн–ү мқҙнӣ„ м№ҳл§Өм•ҲмӢ¬м„јн„°к°Җ м „көӯм ҒмңјлЎң нҷ•м¶©лҗҳм—ҲмңјлӮҳ мЈјлЎң мһ„мғҒ мҰқмғҒмқҙ лҡңл ·н•ҙ진 нҷҳмһҗмқҳ кҙҖлҰ¬м—җ 집мӨ‘лҗҳм–ҙ мһҲлӢӨ. м•Ңмё н•ҳмқҙлЁёлі‘мқҳ нҠ№м„ұмғҒ л°ңлі‘ м „ лӢЁкі„м—җм„ң мқҳ к°ңмһ…мқҙ к°ҖмһҘ нҡЁкіјм Ғмқҙм§Җл§Ң нҳ„мһ¬ м„ лі„ кІҖмӮ¬ мІҙкі„мҷҖ ліҙн—ҳ м Ғмҡ© лІ”мң„лҠ” мқҙлҘј л’·л°ӣм№Ён•ҳм§Җ лӘ»н•ҳкі мһҲлӢӨ. н–Ҙнӣ„м—җлҠ” 1м°Ё мқҳлЈҢкё°кҙҖ м°Ёмӣҗмқҳ мЎ°кё° м„ лі„ кІҖмӮ¬ нҷ•лҢҖмҷҖ н•Ёк»ҳ мғқл¬јн‘ңм§Җмһҗ кё°л°ҳ мЎ°кё° 진лӢЁ мқён”„лқјк°Җ л§Ҳл Ёлҗ н•„мҡ”к°Җ мһҲлӢӨ.4) м•Ҳм „м„ұ кҙҖлҰ¬
4) м•Ҳм „м„ұ кҙҖлҰ¬
ARIA л°Ҹ мЈјмһ… кҙҖл Ё мқҙмғҒ л°ҳмқ‘мқҖ л°ңмғқ мӢң м№ҳлӘ…м Ғмқј мҲҳ мһҲмңјлҜҖлЎң көӯк°Җ м°Ёмӣҗмқҳ мІҙкі„м Ғ м•Ҳм „м„ұ кҙҖлҰ¬к°Җ н•„мҲҳм ҒмқҙлӢӨ. мқҙлҘј мң„н•ҳм—¬ н‘ңмӨҖнҷ”лҗң 추м Ғ кІҖмӮ¬ н”„лЎңнҶ мҪң л§Ҳл Ёкіј мһҘкё°м Ғ лҚ°мқҙн„° 축м Ғмқҙ н•„мҡ”н•ҳлӢӨ.5) мңӨлҰ¬м Ғ кі л Ө
5) мңӨлҰ¬м Ғ кі л Ө
кі к°Җ м•Ҫм ң лҸ„мһ…мқҖ нҷҳмһҗмқҳ кІҪм ңл Ҙм—җ л”°лқј м№ҳлЈҢ м ‘к·јм„ұмқҙ лӢ¬лқјм§ҖлҠ” л¬ём ңлҘј м•јкё°н• мҲҳ мһҲлӢӨ. көӯлӮҙ мӣ”нҸүк· мҶҢл“қмқҖ 506л§Ң мӣҗмқҙл©° нҠ№нһҲ 60м„ё мқҙмғҒ к°Җкө¬мқҳ мӣ”нҸүк· мҶҢл“қмқҖ 377л§Ң мӣҗмңјлЎң[35] лӢӨмҲҳмқҳ мӮ¬лһҢм—җкІҢлҠ” нҳ„мһ¬ л Ҳм№ҙл„Өл§ҷмқҳ к°ҖкІ©мқҙ м№ҳлЈҢн•ҳкё° л¶ҖлӢҙлҗҳлҠ” к°ҖкІ©мқҙкё° л•Ңл¬ём—җ кІҪм ңм Ғ м—¬мң к°Җ мһҲлҠ” мӮ¬лһҢл§Ң м•Ҫм ң м ‘к·јмқҙ к°ҖлҠҘн•ҳлӢӨ. лҳҗн•ң м§Җм—ӯм—җ л”°лҘё м ‘к·јм„ұмқҳ м°Ёмқҙк°Җ л°ңмғқн• мҲҳ мһҲлҠ”лҚ° л Ҳм№ҙл„Өл§ҷмқҖ 2мЈјм—җ н•ң лІҲ м •л§Ҙ мЈјмӮ¬лҘј нҶөн•ҙ нҲ¬м—¬лҗҳм–ҙм•ј н•ҳкі ARIA л¶Җмһ‘мҡ©кіј к°ҷмқҖ мӢ¬к°Ғн•ң л¶Җмһ‘мҡ©мқ„ мқјмңјнӮ¬ мҲҳ мһҲкё° л•Ңл¬ём—җ нҳ„мһ¬лҠ” MRIлҘј м •кё°м ҒмңјлЎң м°Қмқ„ мҲҳ мһҲкі мқ‘кёү 진лЈҢк°Җ к°ҖлҠҘн•ң лҢҖнҳ• лі‘мӣҗ мң„мЈјлЎң нҲ¬м—¬к°Җ мқҙлЈЁм–ҙм§Җкі мһҲлӢӨ. к·ёл Үкё° л•Ңл¬ём—җ лҸ„мӢңм—җ кұ°мЈјн•ҳкі мһҲлҠ” мӮ¬лһҢмқҖ л Ҳм№ҙл„Өл§ҷмқ„ л§һлҠ”лҚ° л¬ҙлҰ¬к°Җ м—Ҷм§Җл§Ң лҶҚмҙҢмқҳ кІҪмҡ° м •ліҙ м ‘к·јм„ұмқҙ л–Ём–ҙм ё л Ҳм№ҙл„Өл§ҷмқҳ м •ліҙлҘј м–»кё° м–ҙл өкі мЈјмӮ¬лҘј л§һкё° мң„н•ҳм—¬ лі‘мӣҗм—җ лӮҙмӣҗн•ҳмҳҖмқ„ л•Ң 진лЈҢлҘј мҲҳн–үн• мҲҳ мһҲлҠ” мқҳмӮ¬мқҳ мҲҳлҸ„ м ңн•ңм ҒмқҙлӢӨ. лҳҗн•ң л Ҳм№ҙл„Өл§ҷмқҳ л¶Җмһ‘мҡ©мқҙ л°ңмғқн•ҳмҳҖмқ„ л•Ң мқ‘кёү мІҳм№ҳк°Җ к°ҖлҠҘн•ң мӢңм„Өмқҙ л¶ҖмЎұн•ҳм—¬ м№ҳлЈҢ м ‘к·јм„ұмқҙ л–Ём–ҙ진лӢӨ. мқҙлҘј н•ҙкІ°н•ҳкё° мң„н•ҙм„ңлҠ” нҳ•нҸүм„ұмқ„ нҷ•ліҙн• м ңлҸ„м Ғ мһҘм№ҳ л§Ҳл Ёмқҙ н•„мҡ”н•ҳлӢӨ.
- 6. м •мұ… м ңм–ё
- 6. м •мұ… м ңм–ё
1) лӢЁкё° м „лһө: м ңн•ңм Ғ ліҙн—ҳ кёүм—¬
1) лӢЁкё° м „лһө: м ңн•ңм Ғ ліҙн—ҳ кёүм—¬
л Ҳм№ҙл„Өл§ҷ л°Ҹ н•„мҲҳ кІҖмӮ¬мқҳ мЎ°кұҙл¶Җ, л¶Җ분 кёүм—¬ м Ғмҡ©мқ„ мҡ°м„ кІҖнҶ н•ҙм•ј н•ңлӢӨ. мҳҲлҘј л“Өм–ҙ мЎ°л°ңнҳ• м•Ңмё н•ҳмқҙлЁёлі‘ нҷҳмһҗ нҳ№мқҖ мҙҲкё° кІҪлҸ„мқём§ҖмһҘм• нҷҳмһҗ л“ұ кі мң„н—ҳкө°м—җ м ңн•ңм ҒмңјлЎң м Ғмҡ©н•ҳм—¬ мӮ¬нҡҢм Ғ мҲҳмҡ©м„ұмқ„ нҷ•ліҙн• мҲҳ мһҲлӢӨ.2) мӨ‘кё° м „лһө
2) мӨ‘кё° м „лһө
- (1) көӯк°Җ л“ұлЎқ мІҙкі„ кө¬м¶•кіј м•Ҳм „м„ұ кҙҖлҰ¬
- (1) көӯк°Җ л“ұлЎқ мІҙкі„ кө¬м¶•кіј м•Ҳм „м„ұ кҙҖлҰ¬
л Ҳм№ҙл„Өл§ҷ нҲ¬м—¬ нҷҳмһҗмқҳ мһҘкё°м Ғ м•Ҳм „м„ұкіј нҡЁкіјлҘј лӘЁлӢҲн„°л§Ғн•ҳкё° мң„н•ҳм—¬ көӯк°Җ м№ҳл§Ө м•Ҫл¬ј л“ұлЎқ мІҙкі„лҘј кө¬м¶•н• н•„мҡ”к°Җ мһҲлӢӨ. л“ұлЎқ мІҙкі„лҘј нҶөн•ҙ мӢӨм ң мһ„мғҒ нҳ„мһҘм—җм„ң л°ңмғқн•ҳлҠ” ARIA л№ҲлҸ„, м№ҳлЈҢ нҡЁкіј, мӮ¶мқҳ м§Ҳ к°ңм„ м •лҸ„ л“ұмқҳ мӢӨмӮ¬мҡ© лҚ°мқҙн„°лҘј мҲҳ집н•ҳкі мқҙлҘј кё°л°ҳмңјлЎң ліҙн—ҳ м•Ҫк°Җ мһ¬нҸүк°ҖмҷҖ кёүм—¬ нҷ•лҢҖ м—¬л¶ҖлҘј м •кё°м ҒмңјлЎң кІҖнҶ н•ҙм•ј н•ңлӢӨ. лҳҗн•ң ARIA л°ңмғқ мң„н—ҳ кҙҖлҰ¬ мІҙкі„ к°•нҷ”лҘј мң„н•ҳм—¬ м „көӯ лӢЁмң„мқҳ мҳҒмғҒ кІҖмӮ¬ л°Ҹ м•Ҳм „м„ұ лӘЁлӢҲн„°л§Ғ н”„лЎңнҶ мҪңмқ„ н‘ңмӨҖнҷ”н•ҙм•ј н•ңлӢӨ.- (2) кІҪм ңм„ұ нҸүк°ҖмҷҖ мӮ¬нҡҢм Ғ 비мҡ© м Ҳк°җ к·јкұ° к°•нҷ”
- (2) кІҪм ңм„ұ нҸүк°ҖмҷҖ мӮ¬нҡҢм Ғ 비мҡ© м Ҳк°җ к·јкұ° к°•нҷ”
л Ҳм№ҙл„Өл§ҷ лҸ„мһ…мқҖ лӢЁкё°м ҒмңјлЎң м•Ҫм ң 비мҡ©мқҙ нҒ¬м§Җл§Ң мһҘкё°м ҒмңјлЎң м№ҳл§Ө 진н–ү м§Җм—°м—җ л”°лҘё мӮ¬нҡҢм Ғ 비мҡ© м Ҳк°җ нҡЁкіјк°Җ нҒ¬лӢӨ. мҳҲлҘј л“Өм–ҙ 5л…„к°„ л°ңлі‘ м§Җм—° мӢң м•Ңмё н•ҳмқҙлЁёлі‘ мң лі‘лҘ мқҙ м•Ҫ 40% к°җмҶҢн•ҳкі мқҙм—җ л”°лқј мҡ”м–‘ мӢңм„Ө мқҙмҡ©лҘ кіј ліҙнҳёмһҗ лҸҢлҙ„ мӢңк°„мқҙ нҒ¬кІҢ мӨ„м–ҙл“ лӢӨлҠ” ліҙкұҙкІҪм ң 분м„қ кІ°кіјк°Җ ліҙкі лҗң л°” мһҲлӢӨ[36]. л”°лқјм„ң көӯк°Җ м°Ёмӣҗмқҳ 분м„қмқ„ нҶөн•ҙ к°қкҙҖм Ғ мһҗлЈҢлҘј л§Ҳл Ён•ҳкі мқҙлҘј кёүм—¬ кІ°м • кіјм •м—җ л°ҳмҳҒн•ҙм•ј н•ңлӢӨ.
3) мһҘкё° м „лһө: нҶөн•©м Ғ кҙҖлҰ¬ л°Ҹ көӯк°Җ м „лһөкіјмқҳ м—°кі„
3) мһҘкё° м „лһө: нҶөн•©м Ғ кҙҖлҰ¬ л°Ҹ көӯк°Җ м „лһөкіјмқҳ м—°кі„
л Ҳм№ҙл„Өл§ҷ лҸ„мһ…мқҖ лӢЁмҲңнһҲ м•Ҫм ң мҠ№мқём—җ лЁёл¬ҙлҘҙм§Җ м•Ҡкі көӯк°Җ м№ҳл§Ө кҙҖлҰ¬ м •мұ…кіј мң кё°м ҒмңјлЎң м—°кі„лҗҳм–ҙм•ј н•ңлӢӨ. 1м°Ё мқҳлЈҢкё°кҙҖм—җм„ң мЎ°кё° м„ лі„ кІҖмӮ¬ нӣ„ м „л¬ёкё°кҙҖмңјлЎңмқҳ мӢ мҶҚн•ң м—°кі„лҘј к°ҖлҠҘн•ҳкІҢ н•ҙм•ј н•ҳл©° мғқл¬јн‘ңм§ҖмһҗлҘј нҶөн•ҙ м•„л°ҖлЎңмқҙл“ң лІ нғҖмҷҖ нғҖмҡ° лӢЁл°ұ л“ұ м•Ңмё н•ҳмқҙлЁёлі‘ н‘ңм§ҖмһҗлҘј мЎ°кё°м—җ кІҖм¶ңн•ҳм—¬ мқём§Җкё°лҠҘ м Җн•ҳк°Җ мӢ¬н•ҳм§Җ м•ҠмқҖ кі мң„н—ҳкө° нҷҳмһҗлҘј л°ңкөҙн•ҳм—¬ мЎ°кё°м—җ DMT м№ҳлЈҢлҘј л°ӣмқ„ мҲҳ мһҲлҸ„лЎқ н•ҙм•ј н•ңлӢӨ. лҳҗн•ң н–Ҙнӣ„ л””м§Җн„ё мғқл¬јн‘ңм§Җмһҗ л°Ҹ мқёкіөм§ҖлҠҘ кё°л°ҳ лӘЁлӢҲн„°л§Ғмқҙ л°ңлӢ¬н•ҳкІҢ лҗҳл©ҙ мқҙлҘј нҷңмҡ©н•ҳм—¬ нҲ¬м—¬ м „нӣ„ нҷҳмһҗ мғҒнғңлҘј 추м Ғ кҙҖлҰ¬н•ҳлҠ” л°©м•ҲлҸ„ м—јл‘җн•ҙм•ј н•ңлӢӨ. м№ҳл§Өм•ҲмӢ¬м„јн„°, м§Җм—ӯ мӮ¬нҡҢ мқён”„лқјмҷҖ м—°кі„н•ң м№ҳлЈҢ кҙҖлҰ¬ л„ӨнҠёмӣҢнҒ¬лҘј кө¬м¶•н•ЁмңјлЎңмҚЁ нҷҳмһҗ м№ҳлЈҢмқҳ м—°мҶҚм„ұкіј м§Җм—ӯмӮ¬нҡҢ кё°л°ҳ м§Җмӣҗмқ„ к°•нҷ”н• мҲҳ мһҲлӢӨ.4) мңӨлҰ¬ нҳ•нҸүм„ұ нҷ•ліҙ
4) мңӨлҰ¬ нҳ•нҸүм„ұ нҷ•ліҙ
кі к°Җ м•Ҫм ңмқҳ нҠ№м„ұмғҒ мҶҢл“қ мҲҳмӨҖм—җ л”°лҘё м№ҳлЈҢ м ‘к·јм„ұ л¶ҲнҸүл“ұмқҙ л°ңмғқн• мҲҳ мһҲмңјлҜҖлЎң мқҙлҘј мҷ„нҷ”н•ҳкё° мң„н•ҳм—¬ м ҖмҶҢл“қмёөм—җ лҢҖн•ң ліёмқё л¶ҖлӢҙлҘ м°Ёл“ұ м Ғмҡ©мқҙлӮҳ м •л¶Җ ліҙмЎ°кёҲ м§Җмӣҗ м ңлҸ„лҘј лҸ„мһ…н• н•„мҡ”к°Җ мһҲлӢӨ. м•„мҡёлҹ¬ кі л №мёө лҢҖмғҒ м№ҳлЈҢм ң лҸ„мһ…мқҙ м ҠмқҖ м„ёлҢҖмқҳ ліҙн—ҳлЈҢ л¶ҖлӢҙмңјлЎң мқҙм–ҙм§ҖлҠ” м„ёлҢҖ к°„ нҳ•нҸүм„ұ л¬ём ңлҘј кі л Өн•ҳм—¬ мӮ¬нҡҢм Ғ н•©мқҳлҘј кё°л°ҳмңјлЎң мһ¬мӣҗ л§Ҳл Ё л°©м•Ҳмқ„ лӘЁмғүн•ҙм•ј н•ңлӢӨ.
нҳ„мһ¬ көӯлӮҙм—җм„ңлҠ” 2024л…„ 5мӣ” л Ҳм№ҙл„Өл§ҷмқҙ н—Ҳк°Җлҗҳм—Ҳкі 11мӣ” м¶ңмӢңлҗҳм–ҙ мһ„мғҒм—җм„ң мӮ¬мҡ© мӨ‘мқҙлӢӨ. м•Ҫк°ҖлҠ” м „м•Ў нҷҳмһҗ л¶ҖлӢҙ мғҒнғңлЎң нҷҳмһҗмҷҖ к°ҖмЎұмқҳ кІҪм ңм Ғ л¶ҖлӢҙмқҙ нҒ¬лӢӨ. лҳҗн•ң ARIA нҷ•мқёмқ„ мң„н•ҳм—¬ л Ҳм№ҙл„Өл§ҷмқҳ 5лІҲм§ё, 7лІҲм§ё, 14лІҲм§ё нҲ¬м—¬ м „ мӢңн–үн•ҙм•ј н•ҳлҠ” н•„мҲҳ MRI кІҖмӮ¬мЎ°м°Ё ліҙн—ҳ м Ғмҡ©мқ„ л°ӣм§Җ лӘ»н•ҳлҠ” нҳ„мӢӨмқҖ м№ҳлЈҢ нҷ•мӮ°мқ„ м ңн•ңн•ҳлҠ” мЈјмҡ” мҡ”мқёмқҙлӢӨ.
- кІ° лЎ
- кІ° лЎ
м•Ңмё н•ҳмқҙлЁёлі‘мқҖ нҷҳмһҗмқҳ лҸ…лҰҪм Ғмқё мқјмғҒнҷңлҸҷ мң м§Җ лҠҘл Ҙмқ„ м җм°Ё мғҒмӢӨн•ҳкІҢ л§Ңл“Өм–ҙ кІ°көӯ к°ҖмЎұкіј мӮ¬нҡҢ м „мІҙм—җ л§үлҢҖн•ң л¶ҖлӢҙмқ„ мҙҲлһҳн•ңлӢӨ. нҷҳмһҗ к°ңмқёмқҖ кё°м–өл Ҙ м Җн•ҳмҷҖ кё°лҠҘ мҶҗмӢӨлЎң мқён•ҳм—¬ мһҗмңЁм Ғмқё мғқнҷңмқ„ мҳҒмң„н•ҳкё° м–ҙл ӨмӣҢм§Җкі к°ҖмЎұмқҖ лҸҢлҙ„м—җ л”°лҘё мӢ¬лҰ¬м Ғ, кІҪм ңм Ғ л¶ҖлӢҙмқ„ к°җлӢ№н•ҙм•ј н•ҳл©° көӯк°ҖмҷҖ мӮ¬нҡҢлҠ” мҡ”м–‘ л°Ҹ мқҳлЈҢ м„ң비мҠӨ нҷ•лҢҖлҘј мң„н•ҳм—¬ м§ҖмҶҚм ҒмңјлЎң мһ¬мӣҗмқ„ нҲ¬мһ…н•ҙм•ј н•ңлӢӨ. мқҙлҹ¬н•ң лӢӨмёөм Ғ л¶ҖлӢҙмқҖ м№ҳл§ӨлҘј лӢЁмҲңн•ң к°ңмқё м§Ҳнҷҳмқ„ л„ҳм–ҙ мӮ¬нҡҢм Ғ л¬ём ңлЎң мқёмӢқн•ҳкІҢ л§Ңл“ңлҠ” мӨ‘мҡ”н•ң мҡ”мқёмқҙлӢӨ.л Ҳм№ҙл„Өл§ҷмқҖ м•Ңмё н•ҳмқҙлЁёлі‘мқҳ 진н–үмқ„ к·јліём ҒмңјлЎң лҠҰм¶ң мҲҳ мһҲлҠ” мІ« лІҲм§ё DMT мӨ‘ н•ҳлӮҳлЎң кё°мЎҙмқҳ лҢҖмҰқ м№ҳлЈҢм ңмҷҖлҠ” м°Ёлі„нҷ”лҗң мқҳлҜёлҘј к°Җ진лӢӨ. нҠ№нһҲ м§Ҳлі‘мқҙ 비көҗм Ғ мҙҲкё° лӢЁкі„мқј л•Ң нҲ¬м—¬н•ҳл©ҙ нҷҳмһҗмқҳ мқјмғҒнҷңлҸҷ мң м§Җ лҠҘл Ҙмқ„ ліҙлӢӨ мҳӨлһ«лҸҷм•Ҳ ліҙмЎҙн• мҲҳ мһҲмңјл©° мқҙлЎңмҚЁ нҷҳмһҗмҷҖ к°ҖмЎұмқҙ кІӘлҠ” кі нҶөмқ„ м§Җм—°мӢңнӮ¬ мҲҳ мһҲмқ„ лҝҗл§Ң м•„лӢҲлқј мӮ¬нҡҢм Ғ 비мҡ© м Ҳк°җ нҡЁкіјлҸ„ кё°лҢҖлҗңлӢӨ. мқҙлҠ” лӢЁмҲңнһҲ м•Ҫм ң н•ҳлӮҳмқҳ лҸ„мһ…мқ„ л„ҳм–ҙ м№ҳл§Ө кҙҖлҰ¬ нҢЁлҹ¬лӢӨмһ„мқ„ мҰқмғҒ мЎ°м Ҳ мӨ‘мӢ¬м—җм„ң м§Ҳлі‘ м–өм ң мӨ‘мӢ¬мңјлЎң м „нҷҳн•ҳлҠ” кі„кё°к°Җ лҗ мҲҳ мһҲлӢӨ.к·ёлҹ¬лӮҳ нҳ„мһ¬ көӯлӮҙм—җм„ңлҠ” л Ҳм№ҙл„Өл§ҷмқҙ н—Ҳк°Җлҗҳм–ҙ мӮ¬мҡ© мӨ‘мһ„м—җлҸ„ л¶Ҳкө¬н•ҳкі ліҙн—ҳ кёүм—¬м—җ л“ұмһ¬лҗҳм§Җ м•Ҡм•„ нҷҳмһҗ ліёмқёмқҙ м „м•Ў л¶ҖлӢҙн•ҙм•ј н•ҳлҠ” мғҒнҷ©мқҙлӢӨ. мқҙлЎң мқён•ҙ м№ҳлЈҢ м ‘к·јм„ұмқҙ нҷҳмһҗмқҳ мҶҢл“қ мҲҳмӨҖм—җ л”°лқј нҒ¬кІҢ лӢ¬лқјм§Җкі мһҲмңјл©° кІҪм ңм Ғ м·Ём•Ҫ кі„мёөм—җм„ңлҠ” мӮ¬мӢӨмғҒ м№ҳлЈҢ кё°нҡҢк°Җ м°ЁлӢЁлҗҳлҠ” л¬ём ңк°Җ л°ңмғқн•ҳкі мһҲлӢӨ. мқҙлҠ” м№ҳл§Өмқҳ көӯк°Җм Ғ, мӮ¬нҡҢм Ғ л¶ҖлӢҙмқ„ кі л Өн• л•Ң л°”лһҢм§Ғн•ҳм§Җ м•ҠмқҖ нҳ„мғҒмқҙлӢӨ.лҳҗн•ң м•„л°ҖлЎңмқҙл“ң кё°л°ҳ м№ҳлЈҢм ңмқҳ нҠ№м„ұмғҒ м•Ҫл¬ј нҡЁкіјлҠ” мӢ кІҪм„ёнҸ¬мқҳ мҶҗмӢӨкіј лҮҢмң„축мқҙ мӢ¬н•ҳкІҢ 진н–үлҗҳкё° м „, мҰү м§Ҳлі‘мқҳ 비көҗм Ғ мҙҲкё° лӢЁкі„м—җм„ң нҲ¬м—¬н•ҳмҳҖмқ„ л•Ң к°ҖмһҘ нҒ¬лӢӨ. мқҙлҜё лҮҢм„ёнҸ¬ мҶҢмӢӨмқҙ кҙ‘лІ”мң„н•ҳкІҢ 진н–үлҗң мқҙнӣ„м—җлҠ” м№ҳлЈҢ нҡЁкіјк°Җ нҳ„м ҖнһҲ л–Ём–ҙ진лӢӨлҠ” кІғмқҙ мһ„мғҒ м—°кө¬м—җм„ң нҷ•мқёлҗң л°” мһҲлӢӨ. л”°лқјм„ң мЎ°кё° к°ңмһ…мқҙ кі§ м№ҳлЈҢ нҡЁкіј к·№лҢҖнҷ”мҷҖ м§ҒкІ°лҗҳл©° мқҙлҘј мң„н•ҙм„ңлҠ” мЎ°кё° 진лӢЁ мІҙкі„ к°•нҷ”мҷҖ лҸҷмӢңм—җ ліҙн—ҳ кёүм—¬ м Ғмҡ©мқҙ мӢ мҶҚнһҲ л’Өл”°лқјм•ј н•ңлӢӨ.нҳ„мһ¬ н•ңкөӯмқҖ м„ёкі„м—җм„ң к°ҖмһҘ л№ лҘё кі л №нҷ”лҘј кІҪн—ҳн•ҳкі мһҲмңјл©° мқҙм—җ л”°лқј м•Ңмё н•ҳмқҙлЁёлі‘ мң лі‘лҘ лҸ„ кёүкІ©нһҲ мҰқк°Җн• кІғмңјлЎң м „л§қлҗңлӢӨ. кі л №нҷ” мӮ¬нҡҢлЎң 진мһ…н•ҳлҠ” нҳ„ мӢңм җм—җм„ң л Ҳм№ҙл„Өл§ҷмқҳ м Ғк·№м Ғмқё лҸ„мһ…мқҖ лӢЁмҲңн•ң мӢ м•Ҫ мӮ¬мҡ©мқ„ л„ҳм–ҙ көӯк°Җ ліҙкұҙмқҳлЈҢ мІҙкі„мқҳ м§ҖмҶҚ к°ҖлҠҘм„ұмқ„ нҷ•ліҙн•ҳкё° мң„н•ң н•„мҲҳ м „лһөмңјлЎң ліј мҲҳ мһҲлӢӨ. ліҙн—ҳ кёүм—¬ м Ғмҡ©мқ„ м§Җм—°н•ҳлҠ” кІғмқҖ м№ҳлЈҢ кё°нҡҢлҘј лҶ“м№ҳкІҢ л§Ңл“Ө лҝҗ м•„лӢҲлқј мһҘкё°м ҒмңјлЎң лҚ” нҒ° мӮ¬нҡҢм Ғ 비мҡ©мқ„ мң л°ңн• к°ҖлҠҘм„ұмқҙ нҒ¬лӢӨ.л”°лқјм„ң көӯлӮҙ м№ҳл§Ө м •мұ…мқҖ л Ҳм№ҙл„Өл§ҷмқ„ нҸ¬н•Ён•ң нҳҒмӢ м№ҳлЈҢм ңмқҳ мЎ°кё° кёүм—¬нҷ”лҘј нҶөн•ҙ нҷҳмһҗмқҳ м№ҳлЈҢ м ‘к·јм„ұмқ„ ліҙмһҘн•ҳкі көӯк°Җм Ғ м°Ёмӣҗм—җм„ң м№ҳл§Ө л¶ҖлӢҙмқ„ мӨ„мқҙлҠ” л°©н–ҘмңјлЎң лӮҳм•„к°Җм•ј н•ңлӢӨ. нҠ№нһҲ мқҙм ң л§ү м•Ңмё н•ҳмқҙлЁёлі‘мқҙ мӢңмһ‘лҗң нҷҳмһҗкө°мқ„ лҢҖмғҒмңјлЎң н•ң м Ғк·№м Ғ м№ҳлЈҢ м „лһөмқ„ л§Ҳл Ён•ЁмңјлЎңмҚЁ к°ңмқёкіј к°ҖмЎұмқҳ мӮ¶мқҳ м§Ҳмқ„ к°ңм„ н•ҳкі мӮ¬нҡҢ м „мІҙмқҳ мһ¬м •м Ғ, кІҪм ңм Ғ л¶ҖлӢҙмқ„ мҷ„нҷ”н•ҳлҠ” м„ мҲңнҷҳ кө¬мЎ°лҘј кө¬м¶•н•ҙм•ј н•ңлӢӨ. мқҙлҠ” кі л №нҷ” мӮ¬нҡҢм—җ м§Ғл©ҙн•ң н•ңкөӯмқҙ м·Ён•ҙм•ј н• н•өмӢ¬м Ғмқё м •мұ…м Ғ м„ нғқм§Җлқј н• мҲҳ мһҲлӢӨ.
Table.
Comparison of leqembi prices and out-of-pocket costs across countries
- REFERENCES
- REFERENCES
- 1. Andersen CK, Wittrup-Jensen KU, Lolk A, Andersen K, Kragh-Sorensen P. Ability to perform activities of daily living is the main factor affecting quality of life in patients with dementia. Health Qual Life Outcomes 2004;2:52.
[Article] [PubMed] [PMC]2. Connell CM, Janevic MR, Gallant MP. The costs of caring: impact of dementia on family caregivers. J Geriatr Psychiatry Neurol 2001;14:179-187.
[Article] [PubMed]3. Ricci G. Social aspects of dementia prevention from a worldwide to national perspective: a review on the international situation and the example of Italy. Behav Neurol 2019;2019:8720904.
[Article] [PubMed] [PMC]4. Kim OS, Han J, Kim KW, Matthews SA, Shim C. Depopulation, super aging, and extreme heat events in South Korea. Clim Risk Manag 2022;38:100456.
[Article] [PubMed] [PMC]5. Shin S, Kim M, Hong SH. Economic evaluation of lecanemab for early symptomatic Alzheimer's disease in South Korea. Pharmacoecon Open 2025;9:793-804.
[Article] [PubMed] [PMC]6. Galimberti D, Scarpini E. Treatment of Alzheimer's disease: symptomatic and disease-modifying approaches. Curr Aging Sci 2010;3:46-56.
[Article] [PubMed]7. Sachdev PS, Blacker D, Blazer DG, Ganguli M, Jeste DV, Paulsen JS, et al. Classifying neurocognitive disorders: the DSM-5 approach. Nat Rev Neurol 2014;10:634-642.
[Article] [PubMed]8. Jessen F, Amariglio RE, van Boxtel M, Breteler M, Ceccaldi M, Chetelat G, et al. A conceptual framework for research on subjective cognitive decline in preclinical Alzheimer's disease. Alzheimers Dement 2014;10:844-852.
[PubMed]9. Petersen RC, Smith GE, Waring SC, Ivnik RJ, Tangalos EG, Kokmen E. Mild cognitive impairment: clinical characterization and outcome. Arch Neurol 1999;56:303-308.
[Article] [PubMed]10. Arvanitakis Z, Shah RC, Bennett DA. Diagnosis and management of dementia: review. JAMA 2019;322:1589-1599.
[Article] [PubMed] [PMC]11. Barnett JH, Lewis L, Blackwell AD, Taylor M. Early intervention in Alzheimer's disease: a health economic study of the effects of diagnostic timing. BMC Neurol 2014;14:101.
[Article] [PubMed] [PMC]12. AlzheimerвҖҷs Association. 2025 Alzheimer's disease facts and figures. AlzheimerвҖҷs Dement 2025;21:e70235.
[Article] [PMC]13. Central Dementia Center. Epidemiology and current status of dementia: national survey on cognitive health in the elderly In: Ministry of Health and Welfare. 2023 Cognitive Health Survey ofthe Elderly. Sejong: Ministry of Health and Welfare, 2023.14. Ossenkoppele R, Jansen WJ, Rabinovici GD, Knol DL, van der Flier WM, van Berckel BN, et al. Prevalence of amyloid PET positivity in dementia syndromes: a meta-analysis. JAMA 2015;313:1939-1949.
[Article] [PubMed] [PMC]15. Ye BS, Seo SW, Kim JH, Kim GH, Cho H, Noh Y, et al. Effects of amyloid and vascular markers on cognitive decline in subcortical vascular dementia. Neurology 2015;85:1687-1693.
[Article] [PubMed] [PMC]16. Hardy J, Selkoe DJ. The amyloid hypothesis of Alzheimer's disease: progress and problems on the road to therapeutics. Science 2002;297:353-356.
[Article] [PubMed]17. Webers A, Heneka MT, Gleeson PA. The role of innate immune responses and neuroinflammation in amyloid accumulation and progression of Alzheimer's disease. Immunol Cell Biol 2020;98:28-41.
[Article] [PubMed]18. Bai R, Guo J, Ye XY, Xie Y, Xie T. Oxidative stress: the core pathogenesis and mechanism of Alzheimer's disease. Ageing Res Rev 2022;77:101619.
[Article] [PubMed]19. Nelson AR, Sweeney MD, Sagare AP, Zlokovic BV. Neurovascular dysfunction and neurodegeneration in dementia and Alzheimer's disease. Biochim Biophys Acta 2016;1862:887-900.
[Article] [PubMed] [PMC]20. Li SM, Mo MS, Xu PY. Progress in mechanisms of acetylcholinesterase inhibitors and memantine for the treatment of Alzheimer's disease. Neurosciences 2015;2:274-280.
[Article]21. Pereverzev AP, Ostroumova OD, Tkacheva ON, Kotovskaya YV. Safety of cholinesterase inhibitors and NMDA receptors antagonists for the treatment of patients with dementia. Safety and Risk of Pharmacotherapy 2019;7:190-199.
[Article]22. Lemere CA, Masliah E. Can Alzheimer disease be prevented by amyloid-beta immunotherapy? Nat Rev Neurol 2010;6:108-119.
[Article] [PubMed] [PMC]23. van Dyck CH, Swanson CJ, Aisen P, Bateman RJ, Chen C, Gee M, et al. Lecanemab in early Alzheimer's disease. N Engl J Med 2023;388:9-21.
[Article] [PubMed]24. Jack CR Jr, Andrews JS, Beach TG, Buracchio T, Dunn B, Graf A, et al. Revised criteria for diagnosis and staging of Alzheimer's disease: Alzheimer's Association Workgroup. Alzheimers Dement 2024;20:5143-5169.
[Article] [PubMed] [PMC]25. Jack CR Jr, Knopman DS, Jagust WJ, Shaw LM, Aisen PS, Weiner MW, et al. Hypothetical model of dynamic biomarkers of the Alzheimer's pathological cascade. Lancet Neurol 2010;9:119-128.
[Article] [PubMed] [PMC]26. Burke AD, Goldfarb D. Facilitating treatment initiation in early-stage Alzheimer disease. J Clin Psychiatry 2022;83:LI21019DH2C.
[Article] [PubMed]27. Cummings JL, Doody R, Clark C. Disease-modifying therapies for Alzheimer disease: challenges to early intervention. Neurology 2007;69:1622-1634.
[Article] [PubMed]28. Sims JR, Zimmer JA, Evans CD, Lu M, Ardayfio P, Sparks J, et al. Donanemab in early symptomatic Alzheimer disease: the TRAILBLAZER-ALZ 2 randomized clinical trial. JAMA 2023;330:512-527.
[PubMed] [PMC]29. Park KH, Kim GH, Kim CH, Koh SH, Moon SY, Park YH, et al. Lecanemab: appropriate use recommendations by Korean Dementia Association. Dement Neurocogn Disord 2024;23:165-187.
[Article] [PubMed] [PMC]30. Sperling RA, Jack CR Jr, Black SE, Frosch MP, Greenberg SM, Hyman BT, et al. Amyloid-related imaging abnormalities in amyloid-modifying therapeutic trials: recommendations from the Alzheimer's Association Research Roundtable Workgroup. Alzheimers Dement 2011;7:367-385.
[Article] [PubMed] [PMC]31. Food and Drug Administration. Leqembi approval announcement. Silver Spring: Food and Drug Administration, 2023.32. Haeberlein SB, Aisen PS, Barkhof F, Chalkias S, Chen T, Cohen S, et al. Two randomized phase 3 studies of aducanumab in early Alzheimer's disease. J Prev Alzheimers Dis 2022;9:197-210.
[Article] [PubMed]33. European Medicines Agency. Leqembi CHMP opinion. Amsterdam: EMA, 2024.34. Ministry of Health, Labour and Welfare. Leqembi NHI listing decision. Tokyo: Ministry of Health, Labour and Welfare, 2023.35. Statistics Korea. Household income and expenditure survey, 2nd quarter 2025: average monthly income and expenditure per household by age of household head (nationwide, one or more persons). [online] [cited 2025 Aug 31]. Available from: https://kosis.kr/statHtml/statHtml.do?orgId=101&tblId=DT_1L9U108&conn_path=I2.