Age-related Changes in Sleep Physiology and Common Sleep Disorders in Older Adults
- Ki-Hwan Ji, MD
л…ёнҷ”м—җ л”°лҘё мҲҳл©ҙ мғқлҰ¬ ліҖнҷ”мҷҖ мЈјмҡ” л…ёмқё мҲҳл©ҙмһҘм•
- м§Җкё°нҷҳ
- Received July 17, 2025; В В В Revised August 10, 2025; В В В Accepted August 11, 2025;
- ABSTRACT
-
As individuals age, their sleep patterns and underlying physiological processes gradually change. While some of these modifications are normal adaptations to aging, others may increase the risk of cognitive decline and neurodegenerative diseases. This review examines age-related changes in sleep architecture, microstructure, and regulation of sleep homeostasis and discusses how these physiological alterations are associated with pathological sleep conditions and cognitive dysfunction. It further explores the clinical presentation, diagnostic considerations, and treatment strategies for prevalent sleep disorders in older adults, including insomnia, obstructive sleep apnea, restless legs syndrome, and rapid eye movement sleep behavior disorder. This review emphasizes that changes in sleep among the elderly should not be seen merely as consequences of normal aging, but should be carefully evaluated and addressed with individualized therapeutic approaches. This review aims to enhance the understanding of sleep physiology and sleep disorders in older adults and provide a foundation for clinical applications.
- м„ң лЎ
- м„ң лЎ
мҲҳл©ҙмқҖ мғқлӘ… мң м§Җм—җ н•„мҲҳм Ғмқё мғқлҰ¬ кё°лҠҘмңјлЎң к·ё м§Ҳкіј кө¬мЎ°лҠ” мӢ мІҙ л°Ҹ м •мӢ кұҙк°•м—җ м§Ғк°„м ‘м ҒмңјлЎң мҳҒн–Ҙмқ„ лҜём№ңлӢӨ. нҠ№нһҲ кі л № мқёкө¬мқҳ мҰқк°Җм—җ л”°лқј л…ёмқёмқҳ мҲҳл©ҙ кұҙк°•мқҖ м җм°Ё мӨ‘мҡ”н•ң кіөмӨ‘ліҙкұҙкіј м ңлЎң л¶Җк°Ғлҗҳкі мһҲлӢӨ. л…ёнҷ”м—җ л”°лҘё мҲҳл©ҙмқҳ мғқлҰ¬ ліҖнҷ”лҠ” мў…мў… лі‘м Ғ мғҒнғңлЎң мҳӨмқёлҗ мҲҳ мһҲмңјл©° мӢӨм ңлЎң л§ҺмқҖ л…ёмқёл“Өмқҙ мқҙлҹ¬н•ң ліҖнҷ”мҷҖ лҚ”л¶Ҳм–ҙ лӢӨм–‘н•ң лі‘м Ғ мҲҳл©ҙмһҘм• лҘј кІҪн—ҳн•ҳкі мһҲлӢӨ. л…ёнҷ”м—җ л”°лқј мҲҳл©ҙ н•ӯмғҒм„ұ(homeostasis) м Җн•ҳ, н•ҳлЈЁмЈјкё° лҰ¬л“¬(circadian rhythm)мқҳ мЎ°м Ҳл Ҙ м•Ҫнҷ”, мӢ кІҪм „лӢ¬л¬јм§Ҳ ліҖнҷ” л“ұ лӢӨм–‘н•ң мғқлҰ¬ мҡ”мқёмқҙ ліөн•©м ҒмңјлЎң мһ‘мҡ©н•ҳм—¬ мҲҳл©ҙмқҳ м§Ҳкіј кө¬мЎ°м—җ мҳҒн–Ҙмқ„ лҜём№ңлӢӨ. л…ёл…„кё°м—җлҠ” мҙқ мҲҳл©ҙ мӢңк°„, мҲҳл©ҙ нҡЁмңЁ, м„ңнҢҢмҲҳл©ҙмқҙ к°җмҶҢн•ҳкі м•јк°„ к°Ғм„ұкіј мҲҳл©ҙ мӨ‘ к№Ём–ҙ мһҲлҠ” мӢңк°„мқҙ мҰқк°Җн•ңлӢӨ[1]. м •мғҒм Ғмқё л…ёнҷ”м—җ л”°лҘё ліҖнҷ” мҷём—җлҸ„ л…ёмқёмқҖ л¶Ҳл©ҙмҰқ, нҸҗмҮ„мҲҳл©ҙл¬ҙнҳёнқЎ(obstructive sleep apnea), н•ҳм§Җл¶Ҳм•ҲмҰқнӣ„кө°(restless legs syndrome), л ҳмҲҳл©ҙн–үлҸҷмһҘм• (rapid eye movement [REM] sleep behavior disorder) л“ұ лӢӨм–‘н•ң мҲҳл©ҙмһҘм• лҘј нқ”нһҲ лҸҷл°ҳн•ҳл©° мқҙлҠ” мқём§Җ м Җн•ҳ, лӮҷмғҒ, мӢ¬нҳҲкҙҖм§Ҳнҷҳкіј к°ҷмқҖ мЈјмҡ” л…ёмқё м§Ҳнҷҳкіј л°Җм ‘н•ҳкІҢ м—°кҙҖлҗҳм–ҙ мһҲлӢӨ[2]. лҳҗн•ң лӢӨм•Ҫм ң ліөмҡ©кіј лӢӨм–‘н•ң лҸҷл°ҳ м§ҲнҷҳмқҖ мҲҳл©ҙмһҘм• мқҳ мң„н—ҳм„ұмқ„ лҶ’мқҙкі м •мғҒ л…ёнҷ”мҷҖмқҳ кө¬лі„мқ„ лҚ”мҡұ м–ҙл өкІҢ л§Ңл“ лӢӨ. ліё л…јл¬ём—җм„ңлҠ” лЁјм Җ л…ёнҷ”м—җ л”°лқј лӮҳнғҖлӮҳлҠ” м •мғҒм Ғмқё мҲҳл©ҙмғқлҰ¬ ліҖнҷ”лҘј м •лҰ¬н•ҳкі к·ёмҷҖ кө¬лі„лҗҳлҠ” лі‘м Ғмқё мҲҳл©ҙ ліҖнҷ”мҷҖ л…ёл…„кё°м—җ нқ”нһҲ лҸҷл°ҳлҗҳлҠ” мЈјмҡ” мҲҳл©ҙмһҘм• мқҳ мһ„мғҒм Ғ нҠ№м„ұкіј 진лӢЁ, м№ҳлЈҢ м ‘к·јм—җ лҢҖн•ҙ кі м°°н•ҳкі мһҗ н•ңлӢӨ.
- ліё л¬ё
- ліё л¬ё
- 1. л…ёнҷ”м—җ л”°лҘё мҲҳл©ҙмғқлҰ¬ ліҖнҷ”
- 1. л…ёнҷ”м—җ л”°лҘё мҲҳл©ҙмғқлҰ¬ ліҖнҷ”
1) мҲҳл©ҙмқҳ кұ°мӢңм Ғ кө¬мЎ° ліҖнҷ”
1) мҲҳл©ҙмқҳ кұ°мӢңм Ғ кө¬мЎ° ліҖнҷ”
л…ёнҷ”м—җ л”°лқј мҲҳл©ҙмқҳ кө¬мЎ°мҷҖ м–‘мғҒмқҖ м „л°ҳм ҒмңјлЎң мҳҲмёЎ к°ҖлҠҘн•ң л°©н–ҘмңјлЎң ліҖнҷ”н•ңлӢӨ. мІ«м§ё, мҲҳл©ҙмң„мғҒ м „м§„(advanced sleep phase) нҳ„мғҒмқҙ лӮҳнғҖлӮҳлҠ”лҚ° л…ёмқёмқҖ м ҠмқҖ м„ұмқём—җ 비н•ҙ лҚ” мқҙлҘё мӢңк°„м—җ мһ мһҗлҰ¬м—җ л“Өкі кё°мғҒн•ҳлҠ” кІҪн–Ҙмқҙ мһҲлӢӨ[6]. мқҙлҠ” кҙ‘ мһҗк·№кіј к°ҷмқҖ нҷҳкІҪ мӢ нҳём—җ лҢҖн•ң мӢңкөҗм°ЁмғҒн•ө(suprachiasmatic nucleus)мқҳ лҜјк°җлҸ„ к°җмҶҢ лҳҗлҠ” кё°лҠҘ м Җн•ҳмҷҖ кҙҖл Ёмқҙ мһҲлӢӨ[7]. л‘ҳм§ё, мҲҳл©ҙ к°ңмӢң л°Ҹ мң м§Җмқҳ м–ҙл ӨмӣҖмқҙ мҰқк°Җн•ңлӢӨ. мҲҳл©ҙ мһ ліөкё°(sleep latency)к°Җ кёём–ҙм§Җкі мҙқмҲҳл©ҙ мӢңк°„(total sleep time)мқҖ к°җмҶҢн•ҳл©° м•јк°„ к°Ғм„ұмқҙ мҰқк°Җн•ҳкі мҲҳл©ҙ нҡЁмңЁмқҙ м Җн•ҳлҗңлӢӨ[6,7]. лҳҗн•ң мҲҳл©ҙмқҳ 분м Ҳнҷ”(fragmentation)к°Җ л‘җл“ңлҹ¬м ё мҷёл¶Җ мһҗк·№м—җ мүҪкІҢ к№Ём–ҙлӮҳлҠ” мҲҳл©ҙ м·Ём•Ҫм„ұлҸ„ мҰқк°Җн•ңлӢӨ. м…Ӣм§ё, мҲҳл©ҙ лӢЁкі„ кө¬м„ұмқҳ ліҖнҷ”к°Җ лҸҷл°ҳлҗңлӢӨ. к№ҠмқҖ 비л ҳмҲҳл©ҙ(non-REM sleep, NREM), мҰү м„ңнҢҢмҲҳл©ҙ(slow wave sleep)мқҖ лҡңл ·н•ҳкІҢ к°җмҶҢн•ҳл©° лҢҖмӢ м–•мқҖ NREM 1лӢЁкі„мҷҖ 2лӢЁкі„м—җ лЁёл¬ҙлҠ” мӢңк°„мқҙ лҠҳм–ҙлӮңлӢӨ[8]. л ҳмҲҳл©ҙ(REM sleep) мӢңк°„мқҳ к°җмҶҢлҸ„ мқјл¶Җ ліҙкі лҗҳм—ҲмңјлӮҳ мқҙлҠ” мЈјлЎң 80м„ё мқҙмғҒмқҳ кі л №мёөм—җм„ңлӮҳ лӘ…нҷ•н•ҳкІҢ кҙҖм°°лҗҳл©° NREM ліҖнҷ”м—җ 비н•ҙ мғҒлҢҖм ҒмңјлЎң кІҪлҜён•ҳлӢӨ[6]. л„·м§ё, мЈјк°„ мЎёмқҢ л°Ҹ лӮ®мһ мҠөкҙҖмқҳ ліҖнҷ”к°Җ лӮҳнғҖлӮңлӢӨ. 55-64м„ё м„ұмқёмқҳ м•Ҫ 10%, 75-84м„ё м„ұмқёмқҳ м•Ҫ 25%к°Җ мЈјк°„м—җ лӮ®мһ мқ„ кІҪн—ҳн•ҳл©° мқҙ мӨ‘ м Ҳл°ҳмқҖ кі„нҡҚлҗҳм§Җ м•ҠмқҖ 비мқҳлҸ„м Ғ лӮ®мһ мқҙлӢӨ[9]. н•ҳм§Җл§Ң мқҙлҹ¬н•ң лӮ®мһ мҰқк°Җк°Җ л…ёнҷ”м—җ л”°лҘё л¶Ҳк°Җн”јн•ң ліҖнҷ”мқём§Җ м—¬л¶ҖлҠ” лӘ…нҷ•н•ҳм§Җ м•Ҡмңјл©° л§Ңм„ұ нҶөмҰқ, мҡ°мҡёмҰқ, м•јк°„ л№ҲлҮЁ, мҲҳл©ҙмһҘм• мҷҖ к°ҷмқҖ лҸҷл°ҳ м§Ҳнҷҳмқҳ мҳҒн–ҘлҸ„ кі л Өн•ҙм•ј н•ңлӢӨ.2) мҲҳл©ҙмқҳ лҜём„ёкө¬мЎ° ліҖнҷ”
2) мҲҳл©ҙмқҳ лҜём„ёкө¬мЎ° ліҖнҷ”
л…ёнҷ”лҠ” мҲҳл©ҙмқҳ кұ°мӢңм Ғ кө¬мЎ°лҝҗл§Ң м•„лӢҲлқј лҮҢнҢҢ кё°л°ҳмқҳ лҜём„ёкө¬мЎ°(microarchitecture)м—җлҸ„ ліҖнҷ”лҘј мҙҲлһҳн•ңлӢӨ. мҲҳл©ҙмқҳ лҜём„ёкө¬мЎ°лҠ” NREM мӨ‘ кҙҖм°°лҗҳлҠ” нҠ№м • лҮҢнҢҢ нҢЁн„ҙ, мҳҲлҘј л“Өм–ҙ мҲҳл©ҙ방추(sleep spindle), K-complex, м„ңнҢҢнҷңлҸҷ(slow wave activity)мқҳ нҠ№м„ұмңјлЎң кө¬м„ұлҗҳл©° мқҙлҠ” мҲҳл©ҙмқҳ м§Ҳ, кё°м–ө кіөкі нҷ”(memory consolidation), мӢңлғ…мҠӨ н•ӯмғҒм„ұ мң м§Җ л“ұкіј л°Җм ‘н•ҳкІҢ кҙҖл Ёлҗҳм–ҙ мһҲлӢӨ. мқҙ мӨ‘ м„ңнҢҢнҷңлҸҷкіј мҲҳл©ҙ방추мқҳ ліҖнҷ”к°Җ л…ёнҷ”мҷҖ к°ҖмһҘ л°Җм ‘н•ң н•өмӢ¬ мҡ”мҶҢлЎң к°„мЈјлҗңлӢӨ. л…ёнҷ”м—җ л”°лқј NREM мӨ‘ 0.5-4.5 HzлІ”мң„мқҳ м„ңнҢҢнҷңлҸҷмқҖ нҳ„м ҖнһҲ к°җмҶҢн•ҳл©° мқҙлҹ¬н•ң ліҖнҷ”лҠ” нҠ№нһҲ м „м „л‘җн”јм§Ҳ(prefrontal cortex)м—җм„ң л‘җл“ңлҹ¬м§ҖкІҢ лӮҳнғҖлӮңлӢӨ[10]. м ҠмқҖ м„ұмқёкіј 비көҗн• л•Ң м„ңнҢҢнҷңлҸҷмқҖ мөңлҢҖ 75-80%к№Ңм§Җ к°җмҶҢн• мҲҳ мһҲмңјл©° 진нҸӯ(amplitude), л°ҖлҸ„(density), кё°мҡёкё°(slope)лҸ„ м „л°ҳм ҒмңјлЎң м Җн•ҳлҗңлӢӨ[10,11]. мқём§Җм ҒмңјлЎң м •мғҒмқё л…ёмқём—җм„ңлҸ„ м„ңнҢҢмқҳ нҸүк· мЈјнҢҢмҲҳк°Җ м•Ҫ 0.1 Hz лҠҗл Өм§ҖлҠ” кІҪн–Ҙмқҙ мһҲмңјл©° мқҙлҠ” л…ёнҷ”м—җ л”°лҘё мӢ кІҪ мғқлҰ¬ ліҖнҷ”лЎң н•ҙм„қлҗңлӢӨ. лҳҗн•ң 12-15 Hz мЈјнҢҢмҲҳ лҢҖм—ӯм—җм„ң лӮҳнғҖлӮҳлҠ” мҲҳл©ҙ방추 м—ӯмӢң л…ёнҷ”м—җ л”°лқј л°ҖлҸ„, м§ҖмҶҚ мӢңк°„, 진нҸӯмқҙ лӘЁл‘җ к°җмҶҢн•ҳлҠ” кІҪн–Ҙмқ„ ліҙмқёлӢӨ. нҠ№нһҲ м „л‘җл¶Җ м „к·№(frontal derivations)м—җм„ңлҠ” л°ҖлҸ„мҷҖ 진нҸӯмқҙ, нӣ„л‘җл¶Җ м „к·№(occipital derivations)м—җм„ңлҠ” м§ҖмҶҚ мӢңк°„мқҙ к°ҖмһҘ лҡңл ·н•ҳкІҢ к°җмҶҢн•ҳлҠ” кІғмңјлЎң лӮҳнғҖлӮңлӢӨ[12,13]. мқҙлҹ¬н•ң ліҖнҷ”лҠ” NREM 2лӢЁкі„ мҲҳл©ҙмқҳ мҙқлҹүкіјлҠ” л¬ҙкҙҖн•ҳкІҢ лҸ…лҰҪм ҒмңјлЎң кҙҖм°°лҗҳл©° л…ёл…„кё° мҲҳл©ҙ м§Ҳ м Җн•ҳлҘј лӮҳнғҖлӮҙлҠ” мғқлҰ¬ м§Җн‘ңлЎң к°„мЈјлҗңлӢӨ.3) мҲҳл©ҙ мғқлҰ¬ мЎ°м Ҳ л©”м»ӨлӢҲмҰҳ
3) мҲҳл©ҙ мғқлҰ¬ мЎ°м Ҳ л©”м»ӨлӢҲмҰҳ
л…ёнҷ”лҠ” мҲҳл©ҙкіј к°Ғм„ұ мЎ°м Ҳмқҳ мЈјмҡ” мғқлҰ¬ мӢңмҠӨн…ңм—җ кҙ‘лІ”мң„н•ң ліҖнҷ”лҘј мҙҲлһҳн•ҳл©° мҲҳл©ҙмқҳ м§Ҳкіј м–‘ лӘЁл‘җм—җ мҳҒн–Ҙмқ„ лҜём№ңлӢӨ. мҲҳл©ҙ н•ӯмғҒм„ұ л“ңлқјмқҙлёҢ(homeostatic drive)лҠ” к№Ём–ҙ мһҲлҠ” мӢңк°„мқҙ кёёмҲҳлЎқ мҰқк°Җн•ҳлҠ” мҲҳл©ҙ м••л ҘмңјлЎң мқјл°ҳм ҒмңјлЎң м•„лҚ°л…ёмӢ мқҳ 축м Ғм—җ мқҳн•ҙ л§Өк°ңлҗңлӢӨ[3,14]. 60лҢҖ л§җл¶Җн„° н•ӯмғҒм„ұ л“ңлқјмқҙлёҢк°Җ м•Ҫнҷ”лҗҳкё° мӢңмһ‘н•ҳл©° мҲҳл©ҙмқ„ мң лҸ„н•ҳлҠ” м„ёнҸ¬ мҷё м•„лҚ°л…ёмӢ мқҙ 축м ҒлҗЁм—җлҸ„ л¶Ҳкө¬н•ҳкі м•„лҚ°л…ёмӢ A1мҲҳмҡ©мІҙмқҳ кҙ‘лІ”мң„н•ң мҶҢмӢӨлЎң мқён•ҳм—¬ к·ё нҡЁкіјлҠ” л–Ём–ҙ진лӢӨ[14]. мқҙлҠ” мҲҳл©ҙ к°ңмӢң л°Ҹ мң м§Җм—җ лҢҖн•ң л°ҳмқ‘м„ұмқҙ к°җмҶҢн•ҳлҠ” мӨ‘мҡ”н•ң кё°м „мңјлЎң мһ‘мҡ©н•ңлӢӨ. н•ҳлЈЁмЈјкё° мӢңмҠӨн…ң(circadian system) м—ӯмӢң л…ёнҷ”мқҳ мҳҒн–Ҙмқ„ л°ӣлҠ”лӢӨ. лҮҢмқҳ мЈјмҡ” мғқмІҙмӢңкі„мқё мӢңкөҗм°ЁмғҒн•өмқҖ м—°л № мҰқк°Җм—җ л”°лқј к·ё кё°лҠҘмқҙ м•Ҫнҷ”лҗҳкі мҷёл¶Җ нҷҳкІҪ мӢ нҳё, нҠ№нһҲ кҙ‘мһҗк·№м—җ лҢҖн•ң лҜјк°җлҸ„к°Җ к°җмҶҢн•ңлӢӨ[7]. нҠ№нһҲ н•ҳлЈЁмЈјкё° лҰ¬л“¬мқҳ м•Ҳм •м„ұкіј м •нҷ•м„ұмқ„ мң м§Җн•ҳлҠ” лҚ° н•өмӢ¬м Ғмқё м—ӯн• мқ„ н•ҳлҠ” нҳҲкҙҖ нҷңм„ұмһҘнҺ©нғҖмқҙл“ң(vasoactive intestinal peptide)лҘј л°ңнҳ„н•ҳлҠ” мӢңкөҗ м°ЁмғҒн•ө мӢ кІҪм„ёнҸ¬мқҳ нҮҙн–үмқҖ л…ёнҷ”м—җ л”°лҘё н•ҳлЈЁмЈјкё° лҰ¬л“¬мқҳ л‘”нҷ”мҷҖ л°Җм ‘н•ң кҙҖл Ёмқҙ мһҲлӢӨ[15]. мқҙмҷҖ лҚ”л¶Ҳм–ҙ н•ҳлЈЁмЈјкё° лҰ¬л“¬мқ„ мЎ°м Ҳн•ҳлҠ” мЈјмҡ” нҳёлҘҙлӘ¬мқё л©ңлқјнҶ лӢҢмқҳ м•јк°„ 분비 м—ӯмӢң л…ёнҷ”м—җ л”°лқј к°җмҶҢн•ҳлҠ” кІҪн–Ҙмқҙ мһҲлӢӨ[16].мҲҳл©ҙкіј к°Ғм„ұ мЎ°м Ҳ мӢңмҠӨн…ңмқҳ мӢ кІҪн•ҙл¶Җн•ҷм Ғ ліҖнҷ”лҸ„ лӮҳнғҖлӮңлӢӨ. мҲҳл©ҙмқ„ мң лҸ„н•ҳлҠ” мӢңмғҒн•ҳл¶Җ мӢңк°Ғм•һкө¬м—ӯ(preoptic area)мқҳ к°ҲлқјлӢҢ(galanin) л°ңнҳ„ мӢ кІҪм„ёнҸ¬ мҲҳлҠ” лӮҳмқҙк°Җ л“Өл©ҙм„ң нҳ„м ҖнһҲ к°җмҶҢн•ҳл©° мқҙлҠ” мҲҳл©ҙ к°ңмӢң лҠҘл Ҙмқҳ м Җн•ҳмҷҖ кҙҖл ЁлҗңлӢӨ[17]. лҸҷмӢңм—җ к°Ғм„ұмқ„ мҙү진н•ҳлҠ” мӢңмғҒн•ҳл¶Җ мёЎмҳҒм—ӯ(lateral hypothalamus)мқҳ н•ҳмқҙнҸ¬нҒ¬л ҲнӢҙ(hypocretin)/мҳӨл үмӢ (orexin) л°ңнҳ„ мӢ кІҪм„ёнҸ¬лҸ„ м—°л № мҰқк°Җм—җ л”°лқј мӨ„м–ҙл“ңлҠ”лҚ° мқҙлҠ” мҲҳл©ҙкіј к°Ғм„ұмқҳ л¶Ҳм•Ҳм •м„ұкіј м—°кҙҖлҗңлӢӨ[18]. л§Ҳм§Җл§үмңјлЎң лҮҢ кө¬мЎ°мқҳ ліҖнҷ”лҠ” мҲҳл©ҙ мғқм„ұ кё°м „м—җ м§Ғм ‘м Ғмқё мҳҒн–Ҙмқ„ лҜём№ңлӢӨ. л…ёнҷ”мҷҖ н•Ёк»ҳ мӢңмғҒ, н•ҙл§Ҳ, м„ мЎ°мІҙ(striatum), м „л‘җм—Ҫн”јм§Ҳ, мҡҙлҸҷн”јм§Ҳ, лҢҖмғҒн”јм§Ҳ(cingulate cortex) л“ұ кҙ‘лІ”мң„н•ң мҳҒм—ӯм—җм„ң нҡҢл°ұм§Ҳмқҳ к°җмҶҢк°Җ кҙҖм°°лҗҳл©° нҠ№нһҲ NREM мӨ‘ м„ңнҢҢ мғқм„ұмқ„ лӢҙлӢ№н•ҳлҠ” лӮҙмёЎ м „м „л‘җм—Ҫн”јм§Ҳ(medial prefrontal cortex)мқҳ мң„축мқҖ м„ңнҢҢ нҷңлҸҷ к°җмҶҢмҷҖ л°Җм ‘н•ҳкІҢ м—°кІ°лҗңлӢӨ[19]. лҳҗн•ң н•ҙл§Ҳ лӮҙ н”јм§Ҳн•ҳнҡҢл°ұм§Ҳ к°җмҶҢлҠ” мҲҳл©ҙ방추мқҳ л°ҖлҸ„ к°җмҶҢмҷҖ кҙҖл Ёлҗҳм–ҙ н•ҷмҠө л°Ҹ кё°м–ө нҶөн•© кё°лҠҘм—җлҸ„ мҳҒн–Ҙмқ„ мӨ„ мҲҳ мһҲлӢӨ[20].
л…ёмқёмқҳ мҲҳл©ҙмқҖ м •мғҒм Ғмқё мғқлҰ¬ л…ёнҷ” кіјм •мқҳ мқјл¶ҖлЎң л°ңмғқн•ҳлҠ” ліҖнҷ”мҷҖ м•Ңмё н•ҳмқҙлЁёлі‘(AlzheimerвҖҷs disease)кіј к°ҷмқҖ мӢ кІҪнҮҙн–ү м§Ҳнҷҳмқҳ м „мЎ° лҳҗлҠ” м§Җн‘ңлЎң к°„мЈјлҗ мҲҳ мһҲлҠ” лі‘лҰ¬ ліҖнҷ”лҘј н•Ёк»ҳ нҸ¬н•Ён•ңлӢӨ. л”°лқјм„ң мқҙл“Ө ліҖнҷ”мқҳ м„ұкІ©мқ„ кө¬л¶„н•ҳлҠ” кІғмқҖ л…ёл…„кё° мқём§Җ кё°лҠҘ м Җн•ҳмқҳ мЎ°кё° мӢқлі„ л°Ҹ к°ңмһ…м—җ мһҲм–ҙ мһ„мғҒмқҳм—җкІҢ мӨ‘мҡ”н•ң нҶөм°°мқ„ м ңкіөн•ңлӢӨ. мҳҲлҘј л“Өм–ҙ мҲҳл©ҙ н•ӯмғҒм„ұмқҖ к№Ём–ҙ мһҲлҠ” мӢңк°„мқҙ лҠҳм–ҙлӮ мҲҳлЎқ мҲҳл©ҙ м••л Ҙмқҙ мҰқк°Җн•ҳлҠ” мғқлҰ¬ кё°м „мңјлЎң мЈјлЎң м•„лҚ°л…ёмӢ мқҳ 축м Ғм—җ мқҳн•ҙ мЎ°м ҲлҗңлӢӨ[3]. н•ҳлЈЁмЈјкё° лҰ¬л“¬мқҖ мІҙлӮҙ мғқмІҙмӢңкі„мқҳ мЈјкё°м„ұмқ„ мЎ°м Ҳн•ҳлҠ” л©”м»ӨлӢҲмҰҳмңјлЎң мҲҳл©ҙк°Ғм„ұмЈјкё°(sleep wake cycle)лҘј нҸ¬н•Ён•ң лӢӨм–‘н•ң мғқлҰ¬ кё°лҠҘм—җ мҳҒн–Ҙмқ„ лҜём№ңлӢӨ[4,5]. мқҙлҹ¬н•ң мғқлҰ¬ ліҖнҷ”л“ӨмқҖ мҲҳл©ҙмқҳ м§Ҳкіј кө¬мЎ°лҘј ліҖнҷ”мӢңнӮӨл©° мқҙлҠ” л…ёмқём—җм„ң нқ”нһҲ кҙҖм°°лҗҳлҠ” лӢӨм–‘н•ң мҲҳл©ҙмһҘм• мқҳ л°ңмғқ мҶҢмқёмңјлЎң мһ‘мҡ©н• мҲҳ мһҲлӢӨ.- 2. лі‘лҰ¬м Ғ мҲҳл©ҙ ліҖнҷ”мҷҖ мқём§Җ нҮҙн–ү
- 2. лі‘лҰ¬м Ғ мҲҳл©ҙ ліҖнҷ”мҷҖ мқём§Җ нҮҙн–ү
нҠ№м • мҲҳл©ҙ нҠ№м„ұкіј мқҙмҷҖ кҙҖл Ёлҗң мғқлҰ¬м Ғ ліҖнҷ”лҠ” лӢЁмҲңн•ң л…ёнҷ”мқҳ мӮ°л¬јмқҙ м•„лӢҲлқј мқём§Җкё°лҠҘ м Җн•ҳ л°Ҹ мӢ кІҪнҮҙн–үм§Ҳнҷҳмқҳ мЎ°кё° м§Җн‘ңлЎң мһ‘мҡ©н• мҲҳ мһҲлӢӨ. мІ«м§ё, мҲҳл©ҙ мӢңк°„мқҙ 7мӢңк°„ лҜёл§Ңмқё кІҪмҡ°мқё м§ҖмһҘм• мқҳ мң„н—ҳ мҰқк°ҖмҷҖ мң мқҳн•ҳкІҢ м—°кҙҖлҗҳл©°[21] мқҙлҠ” м•„л°ҖлЎңмқҙл“ң-лІ нғҖ(amyloid-ОІ, AОІ)мқҳ 축м Ғ, мёЎл‘җм—Ҫ л°Ҹ н•ҙл§Ҳ мЈјліҖ лҮҢмӢӨ нҷ•мһҘ(cerebral ventricular dilatation) мҶҚлҸ„ мҰқк°ҖмҷҖ кҙҖл ЁлҗңлӢӨ[8]. мқҙлҹ¬н•ң кө¬мЎ°м Ғ ліҖнҷ”лҠ” м•Ңмё н•ҳмқҙлЁёлі‘кіј кҙҖл Ёлҗң мӢ кІҪнҮҙн–ү кіјм •мқ„ мҙүм§„н• мҲҳ мһҲлӢӨ. л‘ҳм§ё, мһҘкё°к°„м—җ кұёміҗ мҲҳл©ҙ мӢңк°„мқҙ нҒ¬кІҢ ліҖлҸҷн•ҳлҠ” кІғ м—ӯмӢң мқём§ҖмһҘм• мң„н—ҳмқ„ лҶ’мқҙлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬лӢӨ[21]. мқҙлҠ” лӢЁмҲңн•ң мғқнҷң мҠөкҙҖмқҳ л¬ём ңк°Җ м•„лӢҲлқј нҶөмҰқ, мҡ°мҡёмҰқкіј к°ҷмқҖ кё°м Җ м§Ҳнҷҳ нҳ№мқҖ лҮҢмқҳ мҲҳл©ҙкіј к°Ғм„ұ мЎ°м Ҳ мІҙкі„мқҳ кё°лҠҘ мқҙмғҒмқ„ л°ҳмҳҒн•ҳлҠ” мғқлҰ¬ 징нӣ„мқј мҲҳ мһҲлӢӨ. м…Ӣм§ё, мҲҳл©ҙ мӢңк°„мқҳ к°җмҶҢлҠ” лҮҢмң„축과 мқём§Җ м Җн•ҳмқҳ к°ҖмҶҚнҷ”мҷҖ л°Җм ‘н•ң кҙҖл Ёмқҙ мһҲлӢӨ. кұҙк°•н•ң л…ёмқёмқ„ лҢҖмғҒмңјлЎң н•ң м—°кө¬м—җ л”°лҘҙл©ҙ к°ңмқёмқҳ нҸүк· мҲҳл©ҙ мӢңк°„ліҙлӢӨ 1мӢңк°„ к°җмҶҢн• л•Ңл§ҲлӢӨ м—°к°„ лҮҢмӢӨ(cerebral ventricle) нҷ•мһҘлҘ мқҖ 0.59%, мқём§Җкё°лҠҘ м Җн•ҳмңЁмқҖ 0.67% мҰқк°Җн•ҳл©° мқҙлҹ° лҮҢмӢӨ нҷ•мһҘмқҳ к°ҖмҶҚнҷ”лҠ” кІҪлҸ„мқём§ҖмһҘм• мқҳ мһ„мғҒ мҰқмғҒліҙлӢӨ мҲҳл…„ лЁјм Җ кҙҖм°°лҗ мҲҳ мһҲм–ҙ[8] мӢ кІҪнҮҙн–үм§Ҳнҷҳмқҳ мЎ°кё° мҳҲмёЎмқ„ мң„н•ң кө¬мЎ°м Ғ мғқл¬јн‘ңм§Җмһҗ(biomarker)лЎң мЈјлӘ©л°ӣкі мһҲлӢӨ. л§Ҳм§Җл§үмңјлЎң мҲҳл©ҙмһҘм• лҠ” м№ҳл§Өмқҳ мҙҲкё° 징нӣ„лЎңмҚЁ мӨ‘мҡ”н•ң лӢЁм„ңк°Җ лҗ мҲҳ мһҲлӢӨ. м—¬лҹ¬ м—°кө¬м—җ л”°лҘҙл©ҙ м№ҳл§Ө л°ңлі‘ мқҙм „ лӢЁкі„м—җм„ңлҸ„ нҷҳмһҗмқҳ м•Ҫ 90%к°Җ мӨ‘л“ұлҸ„ мқҙмғҒмқҳ мҲҳл©ҙ л¬ём ңлҘј кІҪн—ҳн•ҳлҠ” кІғмңјлЎң ліҙкі лҗҳл©°[21] мқҙлҠ” мҲҳл©ҙмһҘм• к°Җ лӢЁмҲңн•ң кІ°кіјк°Җ м•„лӢҲлқј м§Ҳнҷҳ л°ңмғқмқҳ м „мЎ° мҰқмғҒ лҳҗлҠ” мң„н—ҳ мҡ”мқёмқј мҲҳ мһҲмқҢмқ„ мӢңмӮ¬н•ңлӢӨ.н•ңнҺё л…ёнҷ”мҷҖ м•Ңмё н•ҳмқҙлЁёлі‘ кҙҖл Ё мҲҳл©ҙ мғқлҰ¬ ліҖнҷ”лҠ” лҮҢнҢҢмқҳ нҠ№м„ұкіј м„ёнҸ¬ мҲҳмӨҖмқҳ м Ғмқ‘ л°ҳмқ‘м—җм„ңлҸ„ кҙҖм°°лҗң л°” мһҲлӢӨ. мқјл°ҳм ҒмңјлЎң мқём§Җ кё°лҠҘмқҙ м •мғҒмқё л…ёмқём—җм„ңлҠ” м„ңнҢҢмқҳ нҸүк· мЈјнҢҢмҲҳк°Җ м—°л №м—җ л”°лқј м•Ҫк°„ лҠҗл Өм§ҖлҠ” кІҪн–Ҙмқ„ ліҙмқёлӢӨ. к·ёлҹ¬лӮҳ лҢҖлҮҢ н”јм§Ҳ лӮҙ Aβ축м Ғмқҙ мӢ¬н•ҳкі кё°м–өл Ҙмқҙ м Җн•ҳлҗң л…ёмқём—җм„ңлҠ” м„ңнҢҢмқҳ мЈјнҢҢмҲҳк°Җ мҳӨнһҲл Ө л№„м •мғҒм ҒмңјлЎң мҰқк°Җн•ҳлҠ” нҳ„мғҒмқҙ кҙҖм°°лҗҳм—ҲлӢӨ. нҠ№нһҲ 1 Hz лҜёл§Ң м„ңнҢҢмқҳ м„ нғқм Ғ мҶҗмӢӨмқҖ м „нҳ•м Ғмқё м„ңнҢҢнҷңлҸҷ(0.6-4.8 Hz)мқҳ м „л°ҳм Ғ к°җмҶҢмҷҖлҠ” кө¬лі„лҗҳлҠ” нҳ„мғҒмқҙл©° AОІ 축м Ғкіј л°Җм ‘н•ң м—°кҙҖм„ұмқҙ мһҲлҠ” кІғмңјлЎң л°қнҳҖмЎҢлӢӨ[22]. лҳҗн•ң нӣ„л‘җ л°Ҹ л‘җм •м—Ҫ мҳҒм—ӯм—җм„ң лӮҳнғҖлӮҳлҠ” л№ лҘё мҲҳл©ҙ방추(13-15 Hz)мқҳ к°җмҶҢлҠ” кІҪлҸ„мқём§ҖмһҘм• л°Ҹ м•Ңмё н•ҳмқҙлЁёлі‘ нҷҳмһҗм—җм„ң кіөнҶөм ҒмңјлЎң лӮҳнғҖлӮңлӢӨ. нҠ№нһҲ NREM мӨ‘ мҲҳл©ҙ방추 л°ҖлҸ„ к°җмҶҢлҠ” кё°м–өмһҘм• мқҳ мӢ¬к°ҒлҸ„мҷҖ мң мқҳн•ң мғҒкҙҖкҙҖкі„лҘј ліҙмқҙл©° мқём§Җкё°лҠҘ м Җн•ҳмқҳ мӢ кІҪмғқлҰ¬ м§Җн‘ңлЎң м ңм•Ҳлҗҳкі мһҲлӢӨ[23].- 3. л…ёмқёмқҳ мҲҳл©ҙ н•„мҡ”м„ұ л…јмҹҒ
- 3. л…ёмқёмқҳ мҲҳл©ҙ н•„мҡ”м„ұ л…јмҹҒ
м •мғҒ л…ёнҷ”мҷҖ лі‘м Ғ л…ёнҷ”лҘј кө¬л¶„н•ҳлҠ” н•өмӢ¬ мҹҒм җ мӨ‘ н•ҳлӮҳлҠ” л…ёмқёмқҙ мӢӨм ңлЎң мҲҳл©ҙ мҡ”кө¬лҹүмқҙ мӨ„м–ҙл“ңлҠ”к°Җ, м•„лӢҲл©ҙ лҸҷмқјн•ң мҲҳл©ҙлҹүмқҙ м—¬м „нһҲ н•„мҡ”н•ҳм§Җл§Ң мқҙлҘј мғқм„ұн•ҳкі мң м§Җн•ҳлҠ” лҠҘл Ҙмқҙ м Җн•ҳлҗҳм—ҲлҠ”к°Җм—җ кҙҖн•ң кІғмқҙлӢӨ. мқјл¶Җ м—°кө¬лҠ” мҲҳл©ҙ л°•нғҲ мқҙнӣ„ л°ҳлҸҷ мҲҳл©ҙ(rebound sleep)мқҳ к°җмҶҢлӮҳ мЈјкҙҖм Ғмқё мЎёмқҢмқҳ к°җмҶҢлҘј к·јкұ°лЎң л…ёнҷ”м—җ л”°лқј мҲҳл©ҙ н•„мҡ”м„ұмқҙ мӨ„м–ҙл“ лӢӨлҠ” к°ҖлҠҘм„ұмқ„ м ңмӢңн•ңлӢӨ[24,25]. к·ёлҹ¬лӮҳ л°ҳлҢҖлЎң мҲҳл©ҙ мғқм„ұ л°Ҹ мЎ°м Ҳ кё°лҠҘмқҳ мҶҗмғҒмқ„ мӢңмӮ¬н•ҳлҠ” мҰқкұ°л“ӨлҸ„ мЎҙмһ¬н•ңлӢӨ. м „мҲ н•ң л°”мҷҖ к°ҷмқҙ мҲҳл©ҙ мң лҸ„ л¬јм§ҲлЎң м•Ңл Ө진 м„ёнҸ¬ мҷё м•„лҚ°л…ёмӢ мқҳ лҶҚлҸ„лҠ” л…ёнҷ”м—җ л”°лқј мҰқк°Җн•ҳм§Җл§Ң м•„лҚ°л…ёмӢ A1 мҲҳмҡ©мІҙлҠ” кҙ‘лІ”мң„н•ҳкІҢ мҶҗмӢӨлҗҳм–ҙ мқҙ мӢ нҳём—җ лҢҖн•ң лҮҢмқҳ лҜјк°җлҸ„лҠ” мҳӨнһҲл Ө м Җн•ҳлҗңлӢӨ[6,14]. лҳҗн•ң л…ёнҷ”лЎң мқён•ң м„ңнҢҢ л°Ҹ мҲҳл©ҙ방추 л“ұ 비 л ҳмҲҳл©ҙ 진лҸҷ(NREM oscillation)мқҳ мқҙмғҒмқҖ н•ҷмҠөкіј кё°м–ө нҶөн•©мқҳ мһҘм• мҷҖ к°ҷмқҖ мқём§Җ кІ°мҶҗкіј м—°кҙҖлҗҳм–ҙ мһҲлӢӨ[6,23]. мқҙлҠ” л…ёмқём—җкІҢлҸ„ мөңм Ғмқҳ мқём§Җ кё°лҠҘ мң м§ҖлҘј мң„н•ҳм—¬ м Ғм •н•ң м–‘кіј м§Ҳмқҳ мҲҳл©ҙмқҙ м—¬м „нһҲ н•„мҡ”н•ҳлӮҳ мӢӨм ңлЎңлҠ” мқҙлҘј мғқм„ұн•ҳкі мң м§Җн•ҳлҠ” лҠҘл Ҙмқҙ м Җн•ҳлҗҳм—ҲмқҢмқ„ мӢңмӮ¬н•ңлӢӨ. л”°лқјм„ң нҳ„мһ¬к№Ңм§Җмқҳ м—°кө¬ кІ°кіјлҘј мў…н•©н•ҙ ліј л•Ң л…ёл…„кё°м—җлҸ„ н•ҳлЈЁ 7-8мӢңк°„мқҳ мҲҳл©ҙмқҙ н•„мҡ”н•ҳлӢӨлҠ” кІ¬н•ҙм—җ л¬ҙкІҢк°Җ мӢӨлҰ¬кі мһҲлӢӨ. көӯлҰҪмҲҳл©ҙмһ¬лӢЁ(National Sleep Foundation)м—җм„ңлҸ„ 45м„ё мқҙмғҒ м„ұмқёмқҳ м Ғм • мҲҳл©ҙ мӢңк°„мңјлЎң 7-8мӢңк°„мқ„ к¶ҢмһҘн•ҳкі мһҲлӢӨ(Fig.) [26].- 4. мҲҳл©ҙмһҘм• к°Җ л…ёмқёмқҳ кұҙк°•м—җ лҜём№ҳлҠ” мҳҒн–Ҙ
- 4. мҲҳл©ҙмһҘм• к°Җ л…ёмқёмқҳ кұҙк°•м—җ лҜём№ҳлҠ” мҳҒн–Ҙ
л…ёмқёмқҳ мҲҳл©ҙмһҘм• лҠ” лӢЁмҲңн•ң л…ёнҷ” нҳ„мғҒмңјлЎң м№ҳл¶Җлҗҳм–ҙм„ңлҠ” м•Ҳлҗҳл©° лӢӨм–‘н•ң мӢ мІҙм Ғ, м •мӢ м Ғ кұҙк°• л¬ём ңлҘј мң л°ңн•ҳкұ°лӮҳ м•…нҷ”мӢңнӮ¬ мҲҳ мһҲлҠ” ліөн•©м Ғмқё мҠӨнҠёл ҲмҠӨ мҡ”мқёмңјлЎң к°„мЈјлҗҳм–ҙм•ј н•ңлӢӨ. мқҙлҹ¬н•ң мҲҳл©ҙмһҘм• лҠ” кі л № мқёкө¬м—җм„ң лҶ’мқҖ мң лі‘лҘ мқ„ ліҙмқҙл©° мқём§Җкё°лҠҘ м Җн•ҳ, мӢ кІҪнҮҙн–үм§Ҳнҷҳ, лҢҖмӮ¬ мқҙмғҒ, м •мӢ м§Ҳнҷҳ, лӮҷмғҒ мң„н—ҳ мҰқк°Җ л“ұ м—¬лҹ¬ кұҙк°• л¬ём ңмҷҖ л°Җм ‘н•ҳкІҢ м—°кҙҖлҗңлӢӨ.мҲҳл©ҙмқҖ кёҖлҰјнҢҢнӢұ мӢңмҠӨн…ң(glymphatic system)мқ„ нҶөн•ң AОІ л°Ҹ нғҖмҡ°(tau) лӢЁл°ұм§Ҳкіј к°ҷмқҖ лҮҢ лҢҖмӮ¬ мӮ°л¬јмқҳ м ңкұ°, мӢңлғ…мҠӨ н•ӯмғҒм„ұ мң м§Җ, лӢЁл°ұм§Ҳ мқ‘집 м–өм ң л“ұм—җм„ң н•өмӢ¬м Ғмқё м—ӯн• мқ„ н•ңлӢӨ[27]. нҠ№нһҲ м„ңнҢҢмҲҳл©ҙмқҖ кёҖлҰјнҢҢнӢұ нқҗлҰ„мқ„ мҙү진н•ҳм—¬ м•„л°ҖлЎңмқҙл“ң м ңкұ°лҘј мҰқк°ҖмӢңнӮӨл©° мҲҳл©ҙ л¶ҖмЎұмқҖ мқҙ кіјм •мқ„ л°©н•ҙн•ҳм—¬ AОІ 축м Ғмқ„ мң лҸ„н•ҳкі мӢ кІҪнҮҙн–үм§Ҳнҷҳмқҳ мң„н—ҳмқ„ лҶ’мқј мҲҳ мһҲлӢӨ[28]. мӢ мІҙ кұҙк°• мёЎл©ҙм—җм„ңлҸ„ мҲҳл©ҙмһҘм• лҠ” лӢӨм–‘н•ң мҳҒн–Ҙмқ„ лҜём№ңлӢӨ. л§Ңм„ұм Ғмқё мҲҳл©ҙмһҘм• мҷҖ мЈјк°„ мЎёмқҢмқҖ лӮҷмғҒ мң„н—ҳмқ„ мҰқк°ҖмӢңнӮӨл©°[29] мӢ¬нҳҲкҙҖ л°Ҹ лҮҢнҳҲкҙҖм§Ҳнҷҳкіјмқҳ мҢҚл°©н–Ҙм Ғ м—°кҙҖм„ұлҸ„ ліҙкі лҗҳм—ҲлӢӨ[30,31]. мҲҳл©ҙ л¶ҖмЎұмқҖ л©ңлқјнҶ лӢҢ лҢҖмӮ¬ мқҙмғҒ, к·ёл җлҰ°(ghrelin) 분비 мҰқк°Җ л“ұ лӮҙ분비 ліҖнҷ”лҝҗл§Ң м•„лӢҲлқј лҜёнҶ мҪҳл“ңлҰ¬м•„кё°лҠҘ м Җн•ҳ, мӮ°нҷ” мҠӨнҠёл ҲмҠӨ мҰқк°Җ, DNA л©”нӢёнҷ”(methylation) м Җн•ҳ л“ұмқ„ нҶөн•ҙ мӢ кІҪм„ёнҸ¬ мҶҗмғҒкіј л…ёнҷ”мқҳ к°ҖмҶҚмқ„ мң л°ңн• мҲҳ мһҲлӢӨ.32-34 м •мӢ кұҙк°• л°Ҹ н–үлҸҷм—җ лҜём№ҳлҠ” мҳҒн–ҘлҸ„ мӨ‘лҢҖн•ҳлӢӨ. мҲҳл©ҙ л¶ҖмЎұмқҖ л…ёмқём—җм„ң м§ҖлӮЁл Ҙ м Җн•ҳ, 섬л§қ, л¶Ҳм•Ҳ л°Ҹ м •м„ңм Ғ л¶Ҳм•Ҳм •м„ұмқҳ мң„н—ҳмқ„ лҶ’мқј мҲҳ мһҲмңјл©° н•ҳлЈЁмЈјкё° лҰ¬л“¬мһҘм• мҷҖлҸ„ кҙҖл Ёмқҙ мһҲлӢӨ. лҳҗн•ң л§Ңм„ұм Ғмқё мҲҳл©ҙ кІ°н•ҚмқҖ м „мӢ мғқлҰ¬ кё°лҠҘмқҳ мһҘм• лҘј мң л°ңн•ҳкұ°лӮҳ м•…нҷ”мӢңнӮ¬ мҲҳ мһҲлӢӨ. л…ёмқём—җкІҢм„ң мЈјк°„ мЎёмқҢкіј кіјлҸ„н•ң лӮ®мһ мқҖ нқ”нһҲ кҙҖм°°лҗҳм§Җл§Ң мқҙлҹ¬н•ң мҰқмғҒмқҖ мҡ°мҡёмҰқ, л§Ңм„ұ нҶөмҰқ, л¶Ҳл©ҙмҰқ л°Ҹ кё°нғҖ м •мӢ м§Ҳнҷҳкіј кҙҖл Ёлҗ мҲҳ мһҲмңјлҜҖлЎң мЈјмқҳк°Җ н•„мҡ”н•ҳлӢӨ.мқҙлҹ¬н•ң л¬ём ңл“ӨмқҖ лҢҖл¶Җ분 лӢӨмқём„ұ(multifactorial)мқҙл©° кё°м Җ м§Ҳнҷҳ л°Ҹ лҸҷл°ҳ м§Ҳнҷҳкіј ліөн•©м ҒмңјлЎң м–ҪнҳҖ мһҲлӢӨ. л…ёмқёмқҳ мҲҳл©ҙмһҘм• лҠ” лӢЁмҲңн•ң л…ёнҷ”лҝҗ м•„лӢҲлқј кіЁкҙҖм Ҳм—ј, мӢ¬нҸҗм§Ҳнҷҳ, м•јк°„ л№ҲлҮЁ, лӢ№лҮЁлі‘, м•”, мҡ°мҡёмҰқ, л¶Ҳм•Ҳ, лӢӨм•Ҫм ң ліөмҡ©(polypharmacy) л“ұкіјлҸ„ л°Җм ‘нһҲ кҙҖл ЁлҗңлӢӨ. лҳҗн•ң н•ҳм§Җл¶Ҳм•ҲмҰқнӣ„кө°, л ҳмҲҳл©ҙн–үлҸҷмһҘм• мҷҖ к°ҷмқҖ нҠ№м • мҲҳл©ҙмһҘм• лҠ” л¶Ҳл©ҙмҰқкіј мң мӮ¬н•ң мҰқмғҒмқ„ ліҙмқј мҲҳ мһҲмңјл©° нҠ№нһҲ л ҳмҲҳл©ҙн–үлҸҷмһҘм• лҠ” нҢҢнӮЁмҠЁлі‘, лЈЁмқҙмҶҢмІҙм№ҳл§Өмқҳ м „кө¬ мҰқмғҒмқј мҲҳ мһҲлӢӨ[35]. м•„м„ёнӢёмҪңлҰ°м—җмҠӨн…Ңлқјм•„м ңм–өм ңм ң(acetylcholinesterase inhibitor)мҷҖ к°ҷмқҖ м№ҳл§Ө м№ҳлЈҢм ңлҠ” мҲҳл©ҙмқ„ л°©н•ҙн•ҳкі м•…лӘҪмқ„ мң л°ңн• мҲҳ мһҲлӢӨ[36]. мқҙлҹ¬н•ң м „л°ҳм Ғмқё мҳҒн–Ҙмқ„ кі л Өн• л•Ң л…ёмқёмқҳ мҲҳл©ҙ мһҘм• лҠ” лӢЁмқј мҰқмғҒмқҙ м•„лӢҲлқј м „л°ҳм Ғмқё кұҙк°• мғҒнғңмқҳ мқјл¶ҖлЎң мқҙн•ҙлҗҳм–ҙм•ј н•ҳл©° 진лӢЁкіј м№ҳлЈҢ лӘЁл‘җм—җм„ң нҶөн•©м Ғмқҙкі лӢӨн•ҷм ңм Ғ м ‘к·јмқҙ мҡ”кө¬лҗңлӢӨ.- 5. мЈјмҡ” л…ёмқё мҲҳл©ҙмһҘм•
- 5. мЈјмҡ” л…ёмқё мҲҳл©ҙмһҘм•
1) л¶Ҳл©ҙмҰқ
1) л¶Ҳл©ҙмҰқ
л…ёмқёмқҳ л¶Ҳл©ҙмҰқмқҖ мҲҳл©ҙ кө¬мЎ°мқҳ м—°л № кҙҖл Ё ліҖнҷ”мҷҖ лӢӨм–‘н•ң лӮҙмҷём Ғ мҡ”мқём—җ мқҳн•ҙ м•…нҷ”лҗҳлҠ”, нқ”н•ҳл©ҙм„ңлҸ„ мӢ¬к°Ғн•ң кұҙк°• л¬ём ңмқҙлӢӨ. л…ёмқёмқҖ м ҠмқҖ м„ұмқёліҙлӢӨ мҲҳл©ҙмқҳ м§Ҳкіј м–‘мқҙ м Җн•ҳлҗҳлҠ” кІҪн–Ҙмқҙ мһҲмңјл©° л¶Ҳл©ҙ мҰқмғҒмқҖ л…ёнҷ”мқҳ мқјл°ҳм Ғмқё лҸҷл°ҳ нҳ„мғҒмңјлЎң к°„мЈјлҗҳкё°лҸ„ н•ңлӢӨ. к·ёлҹ¬лӮҳ к·ё мӢ¬к°ҒлҸ„мҷҖ кё°лҠҘм Ғ мҳҒн–ҘмқҖ к°ңмқём°Ёк°Җ нҒ¬л©° лӢЁмҲңн•ң л…ёнҷ”мқҳ мӮ°л¬јлЎң м№ҳл¶Җлҗҳм–ҙм„ңлҠ” м•Ҳ лҗңлӢӨ. мқјл°ҳ мқёкө¬м—җм„ңмқҳ мҲҳл©ҙ л¬ём ң мң лі‘лҘ мқҙ м•Ҫ 15.9-22.3% мҲҳмӨҖмқё л°ҳл©ҙ л…ёл…„мёөмқҳ м•Ҫ 50%к°Җ мҲҳл©ҙ л¬ём ңлҘј кІҪн—ҳн•ҳл©° нҠ№нһҲ мөңлҢҖ 43%лҠ” мҲҳл©ҙ к°ңмӢң лҳҗлҠ” мң м§Җмқҳ м–ҙл ӨмӣҖмқ„ нҳёмҶҢн•ҳлҠ” кІғмңјлЎң ліҙкі лҗңлӢӨ[7]. көӯлӮҙм—җм„ңлҸ„ 60м„ё мқҙмғҒм—җм„ң 3лӘ… мӨ‘ 1лӘ… м •лҸ„к°Җ л¶Ҳл©ҙ мҰқмғҒмқ„ нҳёмҶҢн•ңлӢӨкі м•Ңл Өм ё мһҲлӢӨ[37. 진лӢЁ кіјм •м—җм„ңлҠ” нҷҳмһҗ л°Ҹ лҸҷм№Ё нҢҢнҠёл„Ҳмқҳ лі‘л Ҙмқ„ л°”нғ•мңјлЎң мҲҳл©ҙ к°Ғм„ұ м–‘мғҒ(sleep wake pattern), мЈјк°„ кё°лҠҘ м Җн•ҳ м—¬л¶Җ, мқҙм „ м№ҳлЈҢ мқҙл Ҙ л“ұмқ„ нҸүк°Җн•ҳлҠ” кІғмқҙ н•„мҲҳм ҒмқҙлӢӨ. л¶Ҳл©ҙмҰқ мӢ¬к°ҒлҸ„ мІҷлҸ„(insomnia severity index) л°Ҹ н”јмё лІ„к·ё мҲҳл©ҙ м§Ҳ м§ҖмҲҳ(Pittsburgh sleep quality index)мҷҖ к°ҷмқҖ кө¬мЎ°нҷ”лҗң м„Өл¬ём§ҖлҘј нҷңмҡ©н• мҲҳ мһҲлӢӨ. мҲҳл©ҙлӢӨмӣҗ кІҖмӮ¬(polysomnography)лӮҳ нҷңлҸҷ кё°лЎқкё°(actigraphy)лҠ” мқјмғҒм Ғмқё л¶Ҳл©ҙмҰқ 진лӢЁм—җлҠ” к¶ҢмһҘлҗҳм§Җ м•Ҡм§Җл§Ң мҲҳл©ҙл¬ҙнҳёнқЎмҰқ, мЈјкё° мӮ¬м§ҖмҡҙлҸҷмһҘм• , н•ҳлЈЁмЈјкё° лҰ¬л“¬мһҘм• л“ұ лҸҷл°ҳ мҲҳл©ҙмһҘм• лҘј к°җлі„н• л•Ң нҷңмҡ©н• мҲҳ мһҲлӢӨ.м№ҳлЈҢлҠ” 비м•Ҫл¬јм Ғ м ‘к·јмқ„ мҡ°м„ н•ҳлҠ” лӢӨл©ҙм Ғ м „лһөмқҙ к¶ҢмһҘлҗңлӢӨ. 1м°Ё м№ҳлЈҢлЎңлҠ” мқём§Җн–үлҸҷ м№ҳлЈҢ(cognitive-behavioral therapy for insomnia)к°Җ к°ҖмһҘ нҡЁкіјм Ғмқё кІғмңјлЎң мһ…мҰқлҗҳм–ҙ мһҲмңјл©° мһҗк·№ мЎ°м Ҳ, мҲҳл©ҙ м ңн•ң, мқём§Җ мһ¬кө¬мЎ°нҷ”, мқҙмҷ„ кё°лІ•, мҲҳл©ҙ мң„мғқ көҗмңЎ л“ұмқҙ нҸ¬н•ЁлҗңлӢӨ[38]. м•Ҫл¬ј мҡ”лІ•мқҖ мӢ мӨ‘н•ҳкІҢ м ‘к·јн•ҙм•ј н•ҳл©° нҠ№нһҲ м§ҖмҶҚнҳ• лІӨмЎ°л””м•„м ңн•Җ(benzodiazepine)мқҖ мЈјк°„ мЎёлҰј, лӮҷмғҒ, м°©лһҖ л“ұмқҳ мң„н—ҳмңјлЎң мқён•ҳм—¬ н”јн•ҳлҠ” кІғмқҙ мўӢлӢӨ. мЎён”јлҺҖ(zolpidem)мқҙлӮҳ м—җмҠӨмЎ°н”јнҒҙлЎ (eszopiclone)кіј к°ҷмқҖ 비лІӨмЎ°л””м•„м ңн•Җкі„ мҲҳл©ҙм ңлҠ” 비көҗм Ғ 짧мқҖ мһ‘мҡ© мӢңк°„мқ„ к°Җм§Җл©° мқјл¶Җ кі л № нҷҳмһҗм—җм„ң мғҒлҢҖм ҒмңјлЎң м•Ҳм „н•ҳкІҢ мӮ¬мҡ©лҗ мҲҳ мһҲлӢӨ. к·ёлҹ¬лӮҳ м№ҳл§Ө лҳҗлҠ” мқём§Җкё°лҠҘ м Җн•ҳк°Җ лҸҷл°ҳлҗң кІҪмҡ°м—җлҠ” нҳјлҸҷ, 섬л§қ л“ұмқҳ л¶Җмһ‘мҡ© мң„н—ҳмқҙ лҶ’м•„ мӮ¬мҡ©мқ„ м ңн•ңн•ҳлҠ” кІғмқҙ л°”лһҢм§Ғн•ҳлӢӨ[7,38]. лқјл©ңн…ҢмҳЁ(ramelteon)кіј к°ҷмқҖ л©ңлқјнҶ лӢҢмҲҳмҡ©мІҙмһ‘мҡ©м ңлҠ” мҲҳл©ҙ к°ңмӢңм—җ лҸ„мӣҖмқ„ мӨ„ мҲҳ мһҲмңјл©° мқём§Җкё°лҠҘм—җ лҢҖн•ң мҳҒн–Ҙмқҙ м Ғм–ҙ кі л № нҷҳмһҗм—җм„ң 비көҗм Ғ м•Ҳм „н•ҳкІҢ мӮ¬мҡ©лҗ мҲҳ мһҲлӢӨ. н•ңнҺё нҠёлқјмЎ°лҸҲ(trazodone)мқҙлӮҳ лҜёлҘҙнғҖмһҗн•Җ(mirtazapine)кіј к°ҷмқҖ н•ӯмҡ°мҡём ңлҠ” мҡ°мҡёмҰқмқҙ лҸҷл°ҳлҗҳм§Җ м•ҠмқҖ кІҪмҡ°м—җлҠ” мқјл°ҳм ҒмңјлЎң мӮ¬мҡ©мқ„ м§Җм–‘н•ҙм•ј н•ҳл©° нҠ№нһҲ нҠёлқјмЎ°лҸҲмқҖ м–ҙм§ҖлҹјмҰқ, кё°лҰҪм„ұ м ҖнҳҲм••, лӮҷмғҒ л“ұмқҳ л¶Җмһ‘мҡ©мңјлЎң мқён•ҳм—¬ л…ёмқём—җкІҢлҠ” к¶ҢмһҘлҗҳм§Җ м•ҠлҠ”лӢӨ[39]. лҳҗн•ң н•ӯнһҲмҠӨнғҖлҜјм ңлҠ” н•ӯмҪңлҰ° л¶Җмһ‘мҡ© л°Ҹ мқём§Җкё°лҠҘ м Җн•ҳмқҳ мң„н—ҳ л“ұмңјлЎң мқён•ҳм—¬ л…ёмқём—җм„ңмқҳ мӮ¬мҡ©мқҖ м§Җм–‘лҗҳм–ҙм•ј н•ңлӢӨ[40].2) нҸҗмҮ„мҲҳл©ҙл¬ҙнҳёнқЎ
2) нҸҗмҮ„мҲҳл©ҙл¬ҙнҳёнқЎ
нҸҗмҮ„мҲҳл©ҙл¬ҙнҳёнқЎмқҖ мҲҳл©ҙ мӨ‘ мЈјкё°м ҒмңјлЎң мғҒкё°лҸ„к°Җ л¶Җ분 лҳҗлҠ” мҷ„м „нһҲ нҸҗмҮ„лҗҳм–ҙ кіөкё° нқҗлҰ„мқҙ к°җмҶҢн•ҳкұ°лӮҳ мқјмӢңм ҒмңјлЎң мӨ‘лӢЁлҗҳкі мқҙм—җ л”°лҘё мӮ°мҶҢ нҸ¬нҷ”лҸ„ к°җмҶҢмҷҖ л№ҲлІҲн•ң к°Ғм„ұмқҙ нҠ№м§•мқё м§ҲнҷҳмқҙлӢӨ[41]. мҲҳл©ҙл¬ҙнҳёнқЎмҰқмқҳ л°ңлі‘лҘ мқҖ м—°л №м—җ л”°лқј мҰқк°Җн•ҳлҠ”лҚ° 65м„ё мқҙмғҒ л…ёмқё лӮЁм„ұмқҖ м•Ҫ 70%, м—¬м„ұмқҖ м•Ҫ 56%лЎң ліҙкі лҗҳм–ҙ мқјл°ҳ м„ұмқё лӮЁм„ұ 15%, м—¬м„ұ 5%м—җ 비н•ҙ нҳ„м ҖнһҲ лҶ’мқҖ мҲҳмӨҖмқ„ лӮҳнғҖлӮёлӢӨ[42,43]. л…ёмқёмқҳ мҲҳл©ҙл¬ҙнҳёнқЎмқҖ м „нҳ•м Ғмқё мҪ”кіЁмқҙлӮҳ л¬ҙнҳёнқЎ мҰқмғҒліҙлӢӨлҠ” кіјлҸ„н•ң мЈјк°„ мЎёмқҢкіј м•јлҮЁмҰқ л“ұмқҳ 비нҠ№мқҙ мҰқмғҒмңјлЎң лӮҳнғҖлӮҳкё°лҸ„ н•ңлӢӨ. л¬ҙнҳёнқЎ-м ҖнҳёмҠөм§ҖмҲҳ(apnea-hypopnea index)к°Җ 30 мқҙмғҒмқё мӨ‘мҰқ мҲҳл©ҙл¬ҙнҳёнқЎмқҖ лҮҢкІҪмғүмқҳ мң„н—ҳ мҰқк°ҖмҷҖ кҙҖл Ёлҗҳл©° л…ёмқё кұҙк°•м—җ мӨ‘лҢҖн•ң м•…мҳҒн–Ҙмқ„ лҜём№ҳлҠ” мҡ”мқёмқҙлӢӨ[44]. л…ёмқём—җкІҢм„ң мҲҳл©ҙл¬ҙнҳёнқЎкіј кі нҳҲм•• к°„мқҳ м—°кҙҖм„ұмқҖ м—°кө¬м—җ л”°лқј мқјкҙҖлҗҳм§Җ м•Ҡм§Җл§Ң м„ұлі„м—җ мқҳн•ң м°ЁмқҙлҠ” мқјл¶Җ нҷ•мқёлҗң л°” мһҲлӢӨ. н•ң мў…лӢЁ м—°кө¬м—җ л”°лҘҙл©ҙ л¬ҙнҳёнқЎ-м ҖнҳёнқЎм§ҖмҲҳк°Җ 10 лӢЁмң„ мҰқк°Җн• л•Ң лӮЁм„ұм—җм„ңлҠ” мӢ¬л¶Җм „ мң„н—ҳмқҙ 13% мҰқк°Җн•ң л°ҳл©ҙ м—¬м„ұм—җм„ңлҠ” мң мқҳн•ң кҙҖл Ём„ұмқҙ лӮҳнғҖлӮҳм§Җ м•Ҡм•ҳлӢӨ[45]. лҳҗн•ң мҲҳл©ҙл¬ҙнҳёнқЎмқ„ нҸ¬н•Ён•ң мҲҳл©ҙмһҘм• лҠ” м№ҳл§Ө мң„н—ҳ мҰқк°ҖмҷҖ кҙҖл Ёлҗҳл©° нҠ№нһҲ нҳҲкҙҖм№ҳл§Ө нҷҳмһҗм—җм„ң нқ”н•ҳкІҢ кҙҖм°°лҗңлӢӨ.мҲҳл©ҙл¬ҙнҳёнқЎмқҳ 진лӢЁм—җлҠ” мҲҳл©ҙлӢӨмӣҗ кІҖмӮ¬к°Җ н•„мҡ”н•ҳлӢӨ. к°Җм • мҲҳл©ҙлӢӨмӣҗ кІҖмӮ¬лҸ„ мһ„мғҒм ҒмңјлЎң мӨ‘л“ұлҸ„ мқҙмғҒ мҲҳл©ҙл¬ҙнҳёнқЎмқҙ мқҳмӢ¬лҗҳлҠ” кІҪмҡ°м—җлҠ” кі л Өлҗ мҲҳ мһҲмңјлӮҳ мҡ°лҰ¬лӮҳлқјм—җм„ңлҠ” к°Җм • мҲҳл©ҙлӢӨмӣҗ кІҖмӮ¬ кІ°кіјк°Җ мҲҳл©ҙл¬ҙнҳёнқЎ м№ҳлЈҢм—җ лҢҖн•ң кұҙк°•ліҙн—ҳ м Ғмҡ© кё°мӨҖм—җ нҸ¬н•Ёлҗҳм§Җ м•ҠлҠ”лӢӨ. кі л № нҷҳмһҗм—җм„ң мҲҳл©ҙл¬ҙнҳёнқЎ м№ҳлЈҢмқҳ 1м°Ё м„ нғқмқҖ м§ҖмҶҚ м–‘м••кё°(continuous positive airway pressure)мқҙл©° мқҙлҠ” мҲҳл©ҙ мӨ‘ мғҒкё°лҸ„ нҸҗмҮ„лҘј л°©м§Җн•ҳлҠ” к°ҖмһҘ нҡЁкіјм Ғмқё л°©лІ•мқҙлӢӨ. лӢӨл§Ң м–‘м••кё°мқҳ м№ҳлЈҢ мҲңмқ‘лҸ„лҠ” 40-80% лӮҙмҷёлЎң лӮ®мқҖ нҺёмқҙл©° мқҙлҠ” м№ҳлЈҢ нҡЁкіјмқҳ м§ҖмҶҚм Ғмқё нҷ•ліҙм—җ м ңн•ң мҡ”мқёмқҙ лҗ мҲҳ мһҲлӢӨ. к·ёлҹ¬лӮҳ мөңк·ј м–‘м••кё° м№ҳлЈҢмқҳ кұҙк°•ліҙн—ҳ м Ғмҡ©мқҙ нҷ•лҢҖлҗҳл©ҙм„ң көӯлӮҙм—җм„ң м–‘м••кё° мҲңмқ‘лҸ„к°Җ н–ҘмғҒлҗҳм—ҲлӢӨлҠ” ліҙкі к°Җ мһҲлӢӨ[46]. кі л № мһҗмІҙлҠ” мҲңмқ‘лҸ„м—җ нҒ° мҳҒн–Ҙмқ„ лҜём№ҳм§Җ м•Ҡм§Җл§Ң лӮҙкіј лҸҷл°ҳ м§Ҳнҷҳ, 기분мһҘм• , мқём§ҖмһҘм• , м•јлҮЁмҰқ, л°°мҡ°мһҗмқҳ л¶Җмһ¬ л“ұмқҖ л¶Җм •м Ғмқё мҳҒн–Ҙмқ„ мӨ„ мҲҳ мһҲлӢӨ. м–‘м••кё° м№ҳлЈҢлҠ” кі л № нҷҳмһҗмқҳ мқём§Җкё°лҠҘ, кё°м–өл Ҙ, мӢӨн–үлҠҘл Ҙ, мҲҳл©ҙмқҳ м§Ҳ, мӢ¬нҳҲкҙҖ кё°лҠҘмқ„ к°ңм„ н•ҳлҠ” лҚ° кёҚм •м Ғмқё нҡЁкіјлҘј лӮҳнғҖлӮёлӢӨ[47]. мқҙмҷҖ лҚ”л¶Ҳм–ҙ мІҙмӨ‘ к°җлҹү, кёҲм—°, м·Ём№Ё м „ мқҢмЈјлҘј мӮјк°Җкі м§„м •м ң л“ұмқҳ м•Ҫл¬ј ліөмҡ©мқ„ н”јн•ҳлҠ” л“ұмқҳ мғқнҷң мҠөкҙҖ көҗм •лҸ„ мӨ‘мҡ”н•ҳлӢӨ. м–‘м••кё°лҘј мӮ¬мҡ©н• мҲҳ м—Ҷкұ°лӮҳ мҲңмқ‘н•ҳм§Җ лӘ»н•ҳлҠ” нҷҳмһҗм—җкІҢлҠ” кө¬к°• лӮҙ мһҘм№ҳ(oral appliance)лҘј лҢҖм•ҲмңјлЎң кі л Өн• мҲҳ мһҲлӢӨ. мқҙлҠ” кІҪмҰқм—җм„ң мӨ‘л“ұлҸ„мқҳ мҲҳл©ҙл¬ҙнҳёнқЎмқҙлӮҳ мҪ”кіЁмқҙ нҷҳмһҗм—җкІҢ нҡЁкіјм Ғмқј мҲҳ мһҲмңјлӮҳ м№ҳм•„к°Җ м—ҶлҠ” кі л №мһҗм—җкІҢлҠ” м Ғмҡ©мқҙ м–ҙл өкі кө¬к°• кұҙмЎ°, нғҖм•Ў 분비 мҰқк°Җ, м№ҳнҶө, н„ұкҙҖм Ҳ нҶөмҰқ л“ұмқҳ л¶Җмһ‘мҡ©мқ„ мқјмңјнӮ¬ мҲҳ мһҲлӢӨ[48]. н•ңнҺё мғҒкё°лҸ„ мҲҳмҲ мқҖ лҸҷл°ҳ м§Ҳнҷҳмқҙ л§ҺмқҖ кі л № нҷҳмһҗм—җм„ңлҠ” мқјл°ҳм ҒмңјлЎң к¶ҢмһҘлҗҳм§Җ м•ҠлҠ”лӢӨ.3) н•ҳм§Җл¶Ҳм•ҲмҰқнӣ„кө°
3) н•ҳм§Җл¶Ҳм•ҲмҰқнӣ„кө°
н•ҳм§Җл¶Ҳм•ҲмҰқнӣ„кө°мқҖ кі л №мһҗм—җкІҢ нқ”нһҲ лӮҳнғҖлӮҳлҠ” мҲҳл©ҙ кҙҖл Ё мҡҙлҸҷмһҘм• лЎң лӢӨлҰ¬лҘј мӣҖм§Ғмқҙкі мӢ¶мқҖ 충лҸҷкіј н•Ёк»ҳ л¶ҲмҫҢн•ҳкұ°лӮҳ мқҙмғҒн•ң к°җк°Ғмқҙ мЈјлЎң м Җл…ҒмқҙлӮҳ м•јк°„ нңҙмӢқ мӨ‘м—җ л°ңмғқн•ҳлҠ” кІғмқҙ нҠ№м§•мқҙлӢӨ. мқҙлҹ¬н•ң к°җк°ҒмқҖ мҲҳл©ҙ мӢңмһ‘мқ„ л°©н•ҙн•ҳкі мҲҳл©ҙ мӨ‘ л°ҳліөм Ғмқё к°Ғм„ұмқ„ мң л°ңн•ҳм—¬ мҲҳл©ҙ мң м§Җм—җлҸ„ м–ҙл ӨмӣҖмқ„ мҙҲлһҳн• мҲҳ мһҲлӢӨ. н•ҳм§Җ л¶Ҳм•ҲмҰқнӣ„кө° нҷҳмһҗмқҳ лҢҖл¶Җ분мқҖ мҲҳл©ҙ мӨ‘ мЈјкё° мӮ¬м§ҖмҡҙлҸҷ(periodic limb movements)мқ„ лҸҷл°ҳн•ңлӢӨ. мЈјкё° мӮ¬м§ҖмҡҙлҸҷмқҖ мЈјлЎң н•ҳм§Җм—җм„ң л°ңмғқн•ҳл©° м—„м§Җл°ңк°ҖлқҪмқҳ мӢ м „(extension)кіј н•Ёк»ҳ л°ңлӘ©, л¬ҙлҰҺ, л•ҢлЎңлҠ” кі кҙҖм Ҳмқҳ л¶Җ분 көҙкіЎ(flexion)мқҙ лҸҷл°ҳлҗҳлҠ” л°ҳліөм Ғмқҙкі м •нҳ•нҷ”лҗң мӣҖм§Ғмһ„мқ„ нҠ№м§•мңјлЎң н•ңлӢӨ[41]. н•ҳм§Җл¶Ҳм•ҲмҰқнӣ„кө°мқҖ м—¬м„ұмқҙ м „л°ҳм ҒмңјлЎң лӮЁм„ұліҙлӢӨ 2-3л°° лҚ” нқ”н•ҳм§Җл§Ң л…ёмқём—җм„ңлҠ” мқҙлҹ¬н•ң м„ұлі„м—җ л”°лҘё мң лі‘лҘ м°Ёмқҙк°Җ к°җмҶҢн•ҳлҠ” кІҪн–Ҙмқҙ мһҲмңјл©° л…ёмқё мң лі‘лҘ мқҖ м•Ҫ 10-35%лЎң ліҙкі лҗңлӢӨ[49]. н•ҳм§Җл¶Ҳм•ҲмҰқнӣ„кө°мқҖ мІ кІ°н•Қл№ҲнҳҲ, л§Ңм„ұ мҪ©нҢҘлі‘, л§җмҙҲмӢ кІҪлі‘мҰқ л“ұкіј к°ҷмқҖ кё°м Җ м§Ҳнҷҳм—җ мқҙм°Ём ҒмңјлЎң л°ңмғқн• мҲҳлҸ„ мһҲлӢӨ[37,41]. лҳҗн•ң м„ нғқм„ёлЎңнҶ лӢҢмһ¬нқЎмҲҳм–өм ңм ң(selective serotonin reuptake inhibitor), мӮјнҷҳкі„ н•ӯмҡ°мҡём ң, лҰ¬нҠ¬ л“ұмқҳ м•Ҫл¬јмқҙлӮҳ м№ҙнҺҳмқё кіјлӢӨ м„ӯм·Ё л°Ҹ нқЎм—°лҸ„ мҰқмғҒмқ„ м•…нҷ”мӢңнӮ¬ мҲҳ мһҲлӢӨ. лі‘нғңмғқлҰ¬лҠ” м•„м§Ғ мҷ„м „нһҲ к·ңлӘ…лҗҳм§ҖлҠ” м•Ҡм•ҳм§Җл§Ң лҮҢ лӮҙ мІ кІ°н•Қкіј лҸ„нҢҢлҜј мӢ кІҪм „лӢ¬ мқҙмғҒмқҙ н•өмӢ¬м Ғмқё м—ӯн• мқ„ н•ҳлҠ” кІғмңјлЎң м•Ңл Өм ё мһҲлӢӨ[50].н•ҳм§Җл¶Ҳм•ҲмҰқнӣ„кө°мқҖ м „л°ҳм Ғмқё кұҙк°• м•…нҷ” л°Ҹ ліөн•©м Ғмқё л§Ңм„ұ м§Ҳнҷҳкіј м—°кҙҖлҗҳл©° мқјл¶Җ лҢҖк·ңлӘЁ кҙҖм°° м—°кө¬м—җм„ңлҠ” мӢ¬нҳҲкҙҖм§Ҳнҷҳ, лҮҢмЎёмӨ‘, нҳҲкҙҖм№ҳл§Ө, мӢ¬нҳҲкҙҖ мӮ¬л§қлҘ , м „мІҙ мӮ¬л§қлҘ мҰқк°ҖмҷҖмқҳ лҸ…лҰҪм Ғмқё кҙҖл Ём„ұмқҙ ліҙкі лҗҳм—ҲлӢӨ[51,52]. 진лӢЁмқҖ мЈјлЎң мһ„мғҒ мҰқмғҒм—җ кё°л°ҳн•ҳл©° мҲҳл©ҙлӢӨмӣҗ кІҖмӮ¬лҠ” мЈјкё° мӮ¬м§ҖмҡҙлҸҷмқҳ к·јм „лҸ„ нҢЁн„ҙмқ„ кё°лЎқн•ҳлҠ” лҚ° мң мҡ©н• мҲҳ мһҲмңјлӮҳ 진лӢЁм—җ н•„мҲҳм Ғмқҙм§Җ м•ҠлӢӨ. мөңк·јм—җлҠ” мІ кҙҖл Ё кІҖмӮ¬лҘј н‘ңмӨҖ 진лӢЁ м§Җн‘ңлЎң мұ„нғқн•ҳм—¬ н•ҳм§Җл¶Ҳм•ҲмҰқнӣ„кө°мқҙ мқҳмӢ¬лҗҳлҠ” нҷҳмһҗм—җкІҢлҠ” нҳҲмІӯнҺҳлҰ¬нӢҙ(ferritin)кіј нҠёлһңмҠӨнҺҳлҰ°(transferrin) нҸ¬нҷ”лҸ„м—җ лҢҖн•ң мЈјкё°м Ғмқё кІҖмӮ¬лҘј к¶Ңкі н•ҳкі мһҲлӢӨ[53]. мЈјкё° мӮ¬м§ҖмҡҙлҸҷмқҖ л¬ҙмҰқмғҒмқј мҲҳ мһҲм§Җл§Ң мӣҗмқё л¶ҲлӘ…мқҳ л¶Ҳл©ҙмҰқмқ„ нҳёмҶҢн•ҳлҠ” кІҪмҡ° м№ҳлЈҢлҘј мҡ”н• мҲҳ мһҲлӢӨ. н•ҳм§Җл¶Ҳм•ҲмҰқнӣ„кө°мқҳ м№ҳлЈҢ м „лһөмқҖ нҳҲмІӯ нҺҳлҰ¬нӢҙ(ferritin) 75 Ојg/L лҜёл§ҢмқҙлӮҳ нҠёлһңмҠӨнҺҳлҰ° нҸ¬нҷ”лҸ„к°Җ 20% лҜёл§Ңмқё кІҪмҡ° кІҪкө¬ мІ л¶„м ң лҳҗлҠ” м •л§Ҙ ferric carboxymaltose м№ҳлЈҢлҘј, нҺҳлҰ¬нӢҙ 75-100 Ојg/Lмқё кІҪмҡ°м—җлҠ” кІҪкө¬ мІ л¶„м ң м№ҳлЈҢмқҳ нҡЁкіјк°Җ лҡңл ·н•ҳм§Җ м•Ҡм•„ м •л§Ҙ м№ҳлЈҢлҘј кі л Өн•ңлӢӨ[53]. мІ ліҙ충м—җ л°ҳмқ‘мқҙ м—Ҷкұ°лӮҳ мҙҲкё° нҺҳлҰ¬нӢҙ мҲҳм№ҳк°Җ 100 Ојg/L мқҙмғҒмқҙкі нҠёл ҢмҠӨнҺҳлҰ° нҸ¬нҷ”лҸ„к°Җ м •мғҒмқё кІҪмҡ° к°Җл°”нҺңнӢҙ(gabapentin), к°Җл°”нҺңнӢҙ м—җлӮҳм№ҙл№Ң(gabapentin enacarbil), н”„л Ҳк°Җл°ңлҰ°(pregabalin) л“ұмқҳ Оұ2-Оҙ м№јмҠҳ мұ„л„җ лҰ¬к°„л“ңк°Җ нҡЁкіјм Ғмқё м•Ҫм ңлЎң мӮ¬мҡ©н• мҲҳ мһҲлӢӨ[53]. лЎңн”јлӢҲлЎӨ(ropinirole)мқҙлӮҳ н”„лқјлҜёнҺҷмҶ”(pramipexole)кіј к°ҷмқҖ лҸ„нҢҢлҜј мһ‘мҡ©м ңлҸ„ мң нҡЁн•ҳлӮҳ мһҘкё° мӮ¬мҡ© мӢң 충лҸҷ мЎ°м ҲмһҘм• , м№ҳлЈҢм—җ мқҳн•ҳм—¬ н•ҳм§Җл¶Ҳм•ҲмҰқнӣ„кө° мҰқмғҒмқҳ м•…нҷ”к°Җ лӮҳнғҖлӮҳлҠ” мҰқк°•(augmentation) л“ұмқҳ л¶Җмһ‘мҡ©мқҙ л°ңмғқн• мҲҳ мһҲм–ҙ кі л №мһҗм—җм„ңлҠ” мЈјмқҳк°Җ н•„мҡ”н•ҳлӢӨ[53,54]. мқҙмҷҖ кҙҖл Ён•ҳм—¬ н”„л Ҳк°Җл°ңлҰ°мқҖ мҰқк°• л°ңмғқлҘ мқҙ лҚ” лӮ®мқҖ кІғмңјлЎң ліҙкі лҗҳкі мһҲлӢӨ[55]. мҰқмғҒмқҙ л¶Ҳмқ‘м„ұмқ„ ліҙмқј кІҪмҡ° м„ңл°©нҳ• мҳҘмӢңмҪ”лҸҲ(oxycodone) лҳҗлҠ” мҳӨн”јмҳӨмқҙл“ң(opioid) мӮ¬мҡ©мқ„ кі л Өн• мҲҳ мһҲм§Җл§Ң53 л…ёмқём—җм„ңлҠ” лӮҷмғҒ л°Ҹ мқём§Җ м Җн•ҳ л“ұмқҳ л¶Җмһ‘мҡ© мң„н—ҳмңјлЎң мқён•ҳм—¬ мӢ мӨ‘н•ң м ‘к·јмқҙ н•„мҡ”н•ҳлӢӨ.4) л ҳмҲҳл©ҙн–үлҸҷмһҘм•
4) л ҳмҲҳл©ҙн–үлҸҷмһҘм•
л ҳмҲҳл©ҙн–үлҸҷмһҘм• лҠ” л ҳмҲҳл©ҙ мӨ‘ м •мғҒм ҒмңјлЎң м–өм ңлҗҳм–ҙм•ј н• к·јмңЎ нҷңлҸҷмқҙ мӮ¬лқјм§Җл©ҙм„ң кҝҲм—җм„ң н•ҳлҠ” н–үлҸҷмқ„ мӢӨм ң н–үлҸҷмңјлЎң н‘ңнҳ„н•ҳлҠ” кІғмқҙ нҠ№м§•мқҙлӢӨ. нҷҳмһҗлҠ” мҲҳл©ҙ мӨ‘ л§җн•ҳкё°, мҶҢлҰ¬ м§ҖлҘҙкё°, нҢ”лӢӨлҰ¬лҘј нңҳл‘җлҘҙкұ°лӮҳ мЈјлЁ№мқ„ лӮҙм§ҖлҘҙлҠ” л“ұмқҳ ліөмһЎн•ң н–үлҸҷмқ„ лӮҳнғҖлӮј мҲҳ мһҲм–ҙ ліёмқёкіј м№ЁлҢҖ нҢҢнҠёл„Ҳ лӘЁл‘җм—җкІҢ мң„н—ҳмқҙ лҗ мҲҳ мһҲлӢӨ[41]. л ҳмҲҳл©ҙн–үлҸҷмһҘм• лҠ” 60м„ё мқҙмғҒ лӮЁм„ұм—җм„ң мЈјлЎң лӮҳнғҖлӮҳл©° мөңк·ј м—°кө¬м—җ л”°лҘҙл©ҙ м„ұмқёмқҳ 0.68%м—җм„ң лӮҳнғҖлӮңлӢӨкі ліҙкі н•ҳкі мһҲлӢӨ[56]. л°ңлі‘ мӣҗмқёмқҖ мқҙм°Ём„ұ лҳҗлҠ” кёүм„ұ л°Ҹ нҠ№л°ңм„ұ лҳҗлҠ” л§Ңм„ұ мң нҳ•м—җ л”°лқј лӢӨлҘј мҲҳ мһҲлӢӨ. мқҙм°Ём„ұ лҳҗлҠ” кёүм„ұ л ҳмҲҳл©ҙн–үлҸҷмһҘм• лҠ” лҮҢлі‘ліҖмқҙлӮҳ мӮјнҷҳкі„н•ӯмҡ°мҡём ң, м„ нғқм„ёлЎңнҶ лӢҢмһ¬нқЎмҲҳм–өм ңм ң лҳҗлҠ” м•ҢмҪ”мҳ¬ л°Ҹ м§„м •м ң кёҲлӢЁкіј к°ҷмқҖ м•Ҫл¬ј кҙҖл Ё мӣҗмқёкіј м—°кҙҖлҗҳм–ҙ мһҲлӢӨ[57]. л°ҳл©ҙ нҠ№л°ңм„ұ лҳҗлҠ” л§Ңм„ұ л ҳмҲҳл©ҙн–үлҸҷмһҘм• лҠ” нҢҢнӮЁмҠЁлі‘, лЈЁмқҙмҶҢмІҙм№ҳл§Ө, лӢӨкі„нҶөмң„축мҰқкіј к°ҷмқҖ м•ҢнҢҢ-мӢңлҲ„нҒҙл Ҳмқё лі‘лҰ¬(synucleinopathy) кё°л°ҳмқҳ мӢ кІҪнҮҙн–үм§Ҳнҷҳкіј л°Җм ‘н•ң кҙҖл Ёмқҙ мһҲмңјл©° л ҳмҲҳл©ҙн–үлҸҷмһҘм• мҰқмғҒмқҙ мҡҙлҸҷ мҰқмғҒ л°ңнҳ„ мҲҳл…„ м „м—җ м„ н–ү мҰқмғҒмңјлЎң лӮҳнғҖлӮҳлҠ” кІҪмҡ°к°Җ л§ҺлӢӨ[35,41].л ҳмҲҳл©ҙн–үлҸҷмһҘм• лҠ” мҲҳл©ҙмқҳ м§Ҳмқ„ м Җн•ҳмӢңнӮ¬ лҝҗл§Ң м•„лӢҲлқј мҲҳл©ҙ мӨ‘ мӢ мІҙ нҷңлҸҷмңјлЎң мқён•ҳм—¬ нҷҳмһҗмҷҖ м№ЁлҢҖ нҢҢнҠёл„Ҳм—җкІҢ мһ мһ¬м Ғмқё л¶ҖмғҒ мң„н—ҳмқ„ мҙҲлһҳн•ңлӢӨ. мқҙлҹ¬н•ң мң„н—ҳмқ„ мҷ„нҷ”н•ҳкё° мң„н•ҙм„ңлҠ” м Ғм Ҳн•ң м•Ҳм „ мЎ°м№ҳ л°Ҹ м•Ҫл¬ј м№ҳлЈҢлҘј нҸ¬н•Ён•ң мЎ°кё° 진лӢЁ л°Ҹ кҙҖлҰ¬к°Җ н•„мҲҳм ҒмқҙлӢӨ. 진лӢЁмқҖ мҲҳл©ҙлӢӨмӣҗ кІҖмӮ¬к°Җ н•„мҲҳмқҙл©° л ҳмҲҳл©ҙ мӨ‘ к·јкёҙмһҘ м Җн•ҳмқҳ мҶҢмӢӨ(REM sleep without atonia)мқ„ нҷ•мқён•ҳкё° мң„н•ҳм—¬ н„ұкіј м•һм •к°•к·ј(anterior tibialis), н•„мҡ”мӢң м–•мқҖмҶҗк°ҖлқҪ көҪнһҳк·ј(flexor digitorum superficialis) нҳ№мқҖ мҶҗк°ҖлқҪнҸ„к·ј(extensor digitorum communis)м—җ лҢҖн•ң к·јм „лҸ„лҘј нҸ¬н•Ён•ңлӢӨ[58]. м№ҳлЈҢ л°Ҹ м•Ҳм „ кҙҖлҰ¬ лҳҗн•ң мӨ‘мҡ”н•ҳл©° нҷҳмһҗ л°Ҹ ліҙнҳёмһҗ көҗмңЎмқ„ нҶөн•ҙ мҲҳл©ҙ мӨ‘ мӮ¬кі лҘј л°©м§Җн•ҳкё° мң„н•ң мң„н—ҳ л¬јн’Ҳ м ңкұ°, м№ЁлҢҖ л§ӨнҠёлҰ¬мҠӨлҘј л°”лӢҘм—җ л‘җкё° л“ұ м№ЁмӢӨ нҷҳкІҪ к°ңм„ мқҙ мҡ°м„ м ҒмңјлЎң мқҙлЈЁм–ҙм ём•ј н•ңлӢӨ. м•Ҫл¬ј м№ҳлЈҢлЎңлҠ” мһҘкё° м§ҖмҶҚнҳ• лІӨмЎ°л””м•„м ңн•Җмқё нҒҙлЎңлӮҳм ңнҢң(clonazepam)мқҙ нқ”нһҲ мӮ¬мҡ©лҗҳл©° л ҳмҲҳл©ҙн–үлҸҷмһҘм• нҷҳмһҗмқҳ м•Ҫ 90%м—җм„ң мқҙмғҒ н–үлҸҷмқ„ мң мқҳн•ҳкІҢ к°җмҶҢмӢңнӮӨлҠ” кІғмңјлЎң ліҙкі лҗҳм—ҲлӢӨ[59]. к·ёлҹ¬лӮҳ кі л № нҷҳмһҗм—җм„ңлҠ” мқём§Җ м Җн•ҳ, мЈјк°„ мЎёлҰј, лӮҷмғҒ л“ұмқҳ л¶Җмһ‘мҡ© мҡ°л ӨлЎң мқён•ҳм—¬ лӮҙм•Ҫм„ұмқҙ мҡ°мҲҳн•ң л©ңлқјнҶ лӢҢмқҙ лҢҖм•Ҳ м№ҳлЈҢм ңлЎң кі л Өлҗҳл©° нҠ№нһҲ мқём§Җ м Җн•ҳлӮҳ лӮҷмғҒ мң„н—ҳмқҙ мһҲлҠ” нҷҳмһҗм—җм„ң м„ нҳёлҗңлӢӨ[60].
л…ёнҷ”лЎң мқён•ң м •мғҒм Ғмқё мҲҳл©ҙ ліҖнҷ”мҷҖ лі‘м Ғмқё мҲҳл©ҙмһҘм• мқҳ м°ЁмқҙлҘј мқҙн•ҙн•ҳлҠ” кІғмқҖ м •нҷ•н•ң 진лӢЁкіј м№ҳлЈҢм—җ мӨ‘мҡ”н•ҳлӢӨ. лӢӨмқҢм—җм„ңлҠ” л…ёмқём—җкІҢ нқ”н•ң мҲҳл©ҙмһҘм• лҘј мӮҙнҺҙліҙкі к·ё мһ„мғҒм Ғ нҠ№м§•, 진лӢЁм Ғ кі л Ө мӮ¬н•ӯ, м№ҳлЈҢ л°©лІ•мқ„ мӨ‘м җм ҒмңјлЎң лӢӨлЈЁлҸ„лЎқ н•ңлӢӨ(Table).
- кІ° лЎ
- кІ° лЎ
м •мғҒм Ғмқё л…ёнҷ” кіјм •м—җм„ң м„ңнҢҢмҲҳл©ҙмқҳ к°җмҶҢ, мҲҳл©ҙ нҡЁмңЁмқҳ м Җн•ҳ, к°Ғм„ұмқҳ мҰқк°Җ, мҲҳл©ҙ мң„мғҒмқҳ м•һлӢ№кІЁм§җ л“ұмқҙ нқ”нһҲ кҙҖм°°лҗңлӢӨ[6]. мқҙлҹ¬н•ң ліҖнҷ”лҠ” м§Ҳнҷҳмқҙлқјкё°ліҙлӢӨлҠ” мғқлҰ¬мқё л…ёнҷ”мқҳ мқјнҷҳмңјлЎң к°„мЈјлҗҳм–ҙм•ј н•ҳл©° лі‘м Ғ мҲҳл©ҙмһҘм• мҷҖмқҳ к°җлі„мқҙ мӨ‘мҡ”н•ҳлӢӨ. мқҙлҘј мң„н•ҙм„ңлҠ” л©ҙл°Җн•ң лі‘л Ҙ мІӯм·Ёлҝҗл§Ң м•„лӢҲлқј мҲҳл©ҙ кҙҖл Ё м„Өл¬ём§Җ, нҷңлҸҷкё°лЎқкё°, мҲҳл©ҙлӢӨмӣҗ кІҖмӮ¬ л“ұмқҳ лҸ„кө¬ нҷңмҡ©мқҙ н•„мҡ”н• мҲҳ мһҲлӢӨ. л…ёмқём—җм„ңлҠ” л¶Ҳл©ҙмҰқ, мҲҳл©ҙл¬ҙнҳёнқЎ, н•ҳм§Җл¶Ҳм•ҲмҰқнӣ„кө°, л ҳмҲҳл©ҙн–үлҸҷмһҘм• л°Ҹ мҲҳл©ҙ к°Ғм„ұ лҰ¬л“¬мһҘм• л“ұ лӢӨм–‘н•ң нҳ•нғңлЎң л№ҲлІҲн•ҳкІҢ лӮҳнғҖлӮңлӢӨ. мқҙлҹ¬н•ң мҲҳл©ҙ мһҘм• лҠ” мӢ мІҙ кё°лҠҘ м Җн•ҳ, мқём§ҖмһҘм• , лӮҷмғҒ мң„н—ҳ мҰқк°Җ, мӮ¶мқҳ м§Ҳ м Җн•ҳмҷҖ л°Җм ‘н•ҳкІҢ кҙҖл Ёлҗҳм–ҙ мқҙнҷҳмңЁкіј мӮ¬л§қлҘ мқ„ лҶ’мқҙлҠ” мҡ”мқёмқҙ лҗңлӢӨ. л”°лқјм„ң л…ёмқёмқҳ мҲҳл©ҙ кұҙк°•мқҖ мӨ‘мҡ”н•ң кіөмӨ‘ліҙкұҙ кіјм ңлЎң мқёмӢқлҗҳм–ҙм•ј н•ңлӢӨ. мқҙлҹ¬н•ң л¬ём ңм—җ нҡЁкіјм ҒмңјлЎң лҢҖмқ‘н•ҳкё° мң„н•ҙм„ңлҠ” мҲҳл©ҙмқҳн•ҷмқҳ нҷңм„ұнҷ”мҷҖ лҚ”л¶Ҳм–ҙ м „л¬ё мқёл Ҙм—җ лҢҖн•ң мІҙкі„м Ғмқё көҗмңЎмқҙ н•„мҡ”н•ҳлӢӨ. нҠ№нһҲ мһ„мғҒмқҳлҠ” л…ёнҷ”м—җ л”°лҘё мғқлҰ¬м Ғ мҲҳл©ҙ ліҖнҷ”мҷҖ л…ёмқё мҲҳл©ҙмһҘм• м—җ лҢҖн•ң мқҙн•ҙлҘј л°”нғ•мңјлЎң нқ”нһҲ л°ңмғқн• мҲҳ мһҲлҠ” мҲҳл©ҙмһҘм• м—җ лҢҖн•ң кІҪк°ҒмӢ¬мқ„ лҶ’мқҙкі мЎ°кё° 진лӢЁмқ„ нҶөн•ҙ к°ңлі„нҷ”лҗң 비м•Ҫл¬јм Ғ м№ҳлЈҢ м „лһөмқ„ мҡ°м„ м ҒмңјлЎң м Ғмҡ©н•ҙм•ј н•ңлӢӨ. м•Ҫл¬ј м№ҳлЈҢк°Җ н•„мҡ”н•ң кІҪмҡ°м—җлҠ” кі л №мһҗмқҳ м•Ҫл¬ј л¶Җмһ‘мҡ©кіј лӢӨм•Ҫм ң лі‘мҡ©мңјлЎң мқён•ң мң„н—ҳм„ұмқ„ л©ҙл°ҖнһҲ кі л Өн•ҙм•ј н•ҳл©° мҲҳл©ҙмһҘм• к°Җ лӢӨмҲҳмқҳ л§Ңм„ұ м§Ҳнҷҳкіј мғҒнҳёмһ‘мҡ©н•Ёмқ„ к°җм•Ҳн•ҳм—¬ лӮҙкіј, м •мӢ кұҙк°•мқҳн•ҷкіј л“ұкіјмқҳ лӢӨн•ҷм ң нҳ‘진мқҙ н•„мҲҳм ҒмқҙлӢӨ.
Figure.
Recommended sleep duration and polysomnography parameters by age group. WASO; waking after sleep onset, REM; rapid eye movement.
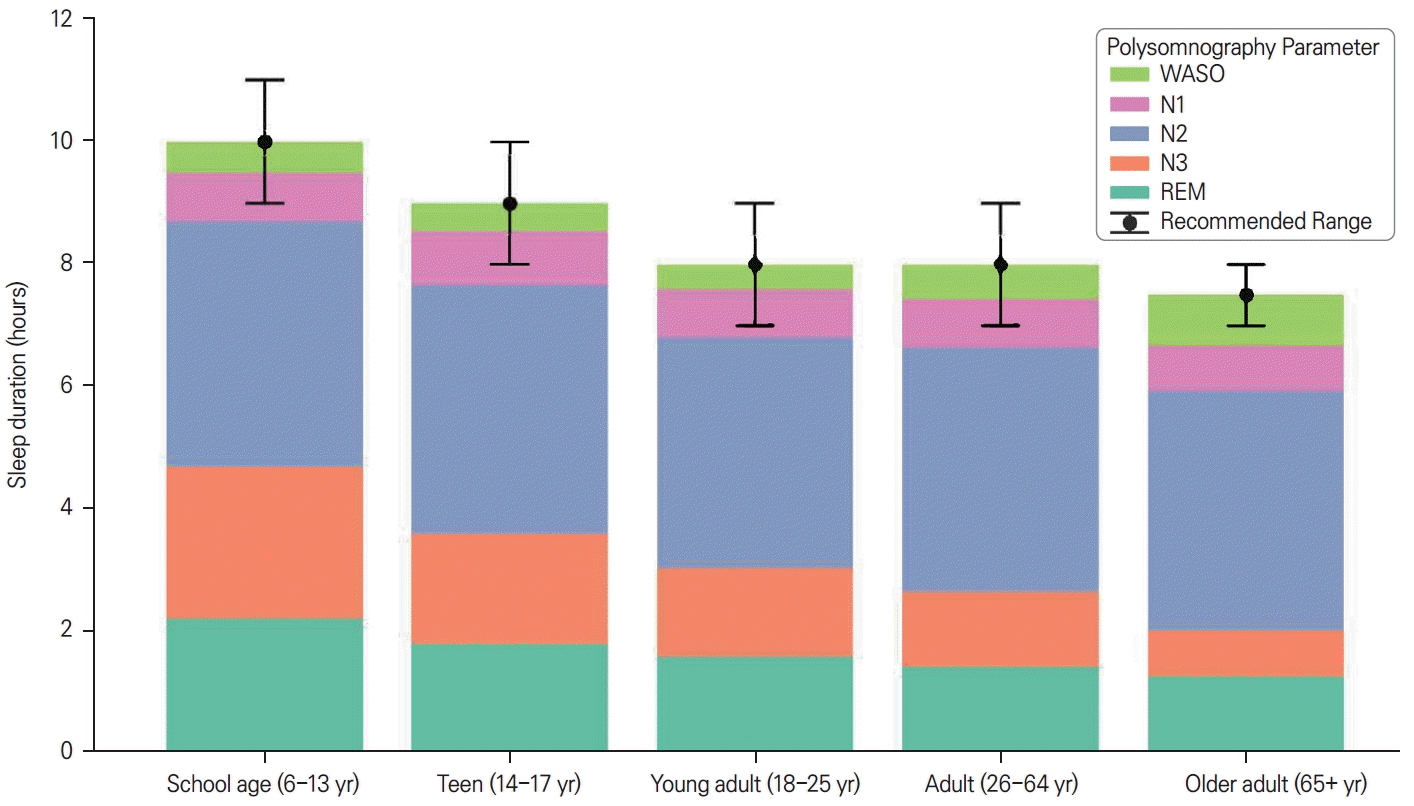
Table.
Clinical features, diagnosis, and management of common sleep disorders in older adults
DSM-5; diagnostic and statistical manual of mental disorders 5th edition, ICSD-3; international classification of sleep disorder 3rd edition, CBT-I; cognitive behavioral therapy for insomnia, PSG; polysomnography, AHI; apnea-hypopnea index, CPAP; continuous positive airway pressure, REM; rapid eye movement.
- REFERENCES
- REFERENCES
- 1. Ohayon MM, Carskadon MA, Guilleminault C, Vitiello MV. Meta-analysis of quantitative sleep parameters from childhood to old age in healthy individuals: developing normative sleep values across the human lifespan. Sleep 2004;27:1255-1273.
[Article] [PubMed]2. Miner B, Kryger MH. Sleep in the aging population. Sleep Med Clin 2020;15:311-318.
[Article] [PubMed]3. Reichert CF, Deboer T, Landolt HP. Adenosine, caffeine, and sleepwake regulation: state of the science and perspectives. J Sleep Res 2022;31:e13597.
[Article] [PubMed] [PMC]4. Meyer N, Harvey AG, Lockley SW, Dijk DJ. Circadian rhythms and disorders of the timing of sleep. Lancet 2022;400:1061-1078.
[Article] [PubMed]5. Dijk DJ, Lockley SW. Integration of human sleep-wake regulation and circadian rhythmicity. J Appl Physiol (1985) 2002;92:852-862.
[Article] [PubMed]7. Tatineny P, Shafi F, Gohar A, Bhat A. Sleep in the elderly. Mo Med 2020;117:490-495.
[PubMed] [PMC]8. Lo JC, Loh KK, Zheng H, Sim SK, Chee MW. Sleep duration and age-related changes in brain structure and cognitive performance. Sleep 2014;37:1171-1178.
[Article] [PubMed] [PMC]9. Foley DJ, Vitiello MV, Bliwise DL, Ancoli-Israel S, Monjan AA, Walsh JK. Frequent napping is associated with excessive daytime sleepiness, depression, pain, and nocturia in older adults: findings from the National Sleep Foundation '2003 Sleep in America' poll. Am J Geriatr Psychiatry 2007;15:344-350.
[Article] [PubMed]10. Mander BA, Rao V, Lu B, Saletin JM, Lindquist JR, Ancoli-Israel S, et al. Prefrontal atrophy, disrupted NREM slow waves and impaired hippocampal-dependent memory in aging. Nat Neurosci 2013;16:357-364.
[Article] [PubMed] [PMC]11. Landolt HP, BorbГ©ly AA. Age-dependent changes in sleep EEG topography. Clin Neurophysiol 2001;112:369-377.
[Article] [PubMed]12. Mander BA, Rao V, Lu B, Saletin JM, Ancoli-Israel S, Jagust WJ, et al. Impaired prefrontal sleep spindle regulation of hippocampal-dependent learning in older adults. Cereb Cortex 2014;24:3301-3309.
[Article] [PubMed] [PMC]13. Martin N, Lafortune M, Godbout J, Barakat M, Robillard R, Poirier G, et al. Topography of age-related changes in sleep spindles. Neurobiol Aging 2013;34:468-476.
[Article] [PubMed]14. Meyer PT, Elmenhorst D, Boy C, Winz O, Matusch A, Zilles K, et al. Effect of aging on cerebral A1 adenosine receptors: a [18F]CPFPX PET study in humans. Neurobiol Aging 2007;28:1914-1924.
[Article] [PubMed]15. Wang JL, Lim AS, Chiang WY, Hsieh WH, Lo MT, Schneider JA, et al. Suprachiasmatic neuron numbers and rest-activity circadian rhythms in older humans. Ann Neurol 2015;78:317-322.
[Article] [PubMed] [PMC]16. Karasek M. Melatonin, human aging, and age-related diseases. Exp Gerontol 2004;39:1723-1729.
[Article] [PubMed]17. Lim AS, Ellison BA, Wang JL, Yu L, Schneider JA, Buchman AS, et al. Sleep is related to neuron numbers in the ventrolateral preoptic/intermediate nucleus in older adults with and without Alzheimer's disease. Brain 2014;137:2847-2861.
[Article]18. Hunt NJ, Rodriguez ML, Waters KA, Machaalani R. Changes in orexin (hypocretin) neuronal expression with normal aging in the human hypothalamus. Neurobiol Aging 2015;36:292-300.
[Article] [PubMed]19. Toor B, van den Berg N, Ray LB, Fogel SM. Sleep spindles and slow waves are physiological markers for age-related changes in gray matter in brain regions supporting problem-solving skills. Learn Mem 2023;30:12-24.
[Article] [PubMed] [PMC]20. Fogel S, Vien C, Karni A, Benali H, Carrier J, Doyon J. Sleep spindles: a physiological marker of age-related changes in gray matter in brain regions supporting motor skill memory consolidation. Neurobiol Aging 2017;49:154-164.
[Article] [PubMed]21. Keil SA, Schindler AG, Wang MX, Piantino J, Silbert LC, Elliott JE, et al. Longitudinal sleep patterns and cognitive impairment in older adults. JAMA Netw Open 2023;6:e2346006.
[Article] [PubMed] [PMC]22. Mander BA, Marks SM, Vogel JW, Rao V, Lu B, Saletin JM, et al. ОІ-amyloid disrupts human NREM slow waves and related hippocampus-dependent memory consolidation. Nat Neurosci 2015;18:1051-1057.
[Article]23. Gorgoni M, Lauri G, Truglia I, Cordone S, Sarasso S, Scarpelli S, et al. Parietal fast sleep spindle density decrease in Alzheimer's disease and amnesic mild cognitive impairment. Neural Plast 2016;2016:8376108.
[Article] [PubMed] [PMC]24. Dijk DJ, Groeger JA, Stanley N, Deacon S. Age-related reduction in daytime sleep propensity and nocturnal slow wave sleep. Sleep 2010;33:211-223.
[Article] [PubMed] [PMC]25. MГјnch M, Knoblauch V, Blatter K, SchrГ¶der C, Schnitzler C, KrГӨuchi K, et al. The frontal predominance in human EEG delta activity after sleep loss decreases with age. Eur J Neurosci 2004;20:1402-1410.
[Article] [PubMed]26. Hirshkowitz M, Whiton K, Albert SM, Alessi C, Bruni O, DonCarlos L, et al. National Sleep Foundation's sleep time duration recommendations: methodology and results summary. Sleep Health 2015;1:40-43.
[Article] [PubMed]27. Picchioni D, Reith RM, Nadel JL, Smith CB. Sleep, plasticity and the pathophysiology of neurodevelopmental disorders: the potential roles of protein synthesis and other cellular processes. Brain Sci 2014;4:150-201.
[Article] [PubMed] [PMC]28. Xie L, Kang H, Xu Q, Chen MJ, Liao Y, Thiyagarajan M, et al. Sleep drives metabolite clearance from the adult brain. Science 2013;342:373-377.
[Article] [PubMed] [PMC]29. Stone KL, Blackwell TL, Ancoli-Israel S, Cauley JA, Redline S, Marshall LM, et al. Sleep disturbances and risk of falls in older community-dwelling men: the outcomes of sleep disorders in older men (MrOS Sleep) study. J Am Geriatr Soc 2014;62:299-305.
[Article] [PubMed] [PMC]30. Kim JS, Kim SH, Lee SH, Lee HY, Lee SY, Im KB. Increased risk of ischemic stroke during sleep in apneic patients. J Clin Neurol 2018;14:174-178.
[Article] [PubMed] [PMC]31. Jehan S, Farag M, Zizi F, Pandi-Perumal SR, Chung A, Truong A, et al. Obstructive sleep apnea and stroke. Sleep Med Disord 2018;2:120-125.
[PubMed] [PMC]32. Lahtinen A, Puttonen S, Vanttola P, Viitasalo K, Sulkava S, Pervjakova N, et al. A distinctive DNA methylation pattern in insufficient sleep. Sci Rep 2019;9:1193.
[Article] [PubMed] [PMC]33. Möller-Levet CS, Archer SN, Bucca G, Laing EE, Slak A, Kabiljo R, et al. Effects of insufficient sleep on circadian rhythmicity and expression amplitude of the human blood transcriptome. Proc Natl Acad Sci U S A 2013;110:E1132-E1141.
[Article] [PubMed] [PMC]34. Spiegel K, Tasali E, Penev P, Van Cauter E. Brief communication: sleep curtailment in healthy young men is associated with decreased leptin levels, elevated ghrelin levels, and increased hunger and appetite. Ann Intern Med 2004;141:846-850.
[Article] [PubMed]35. Postuma RB, Iranzo A, Hu M, Högl B, Boeve BF, Manni R, et al. Risk and predictors of dementia and parkinsonism in idiopathic REM sleep behaviour disorder: a multicentre study. Brain 2019;142:744-759.
[PubMed] [PMC]36. Kitabayashi Y, Ueda H, Tsuchida H, Yamashita T, Narumoto J, Fukui K. Donepezil-induced nightmares in mild cognitive impairment. Psychiatry Clin Neurosci 2006;60:123-124.
[Article] [PubMed]37. Cho YW, Shin WC, Yun CH, Hong SB, Kim JH, Earley CJ. Epidemiology of insomnia in Korean adults: prevalence and associated factors. J Clin Neurol 2009;5:20-23.
[Article] [PubMed] [PMC]38. Schutte-Rodin S, Broch L, Buysse D, Dorsey C, Sateia M. Clinical guideline for the evaluation and management of chronic insomnia in adults. J Clin Sleep Med 2008;4:487-504.
[Article] [PubMed] [PMC]39. Sateia MJ, Buysse DJ, Krystal AD, Neubauer DN, Heald JL. Clinical practice guideline for the pharmacologic treatment of chronic insomnia in adults: an American Academy of Sleep Medicine clinical practice guideline. J Clin Sleep Med 2017;13:307-349.
[Article] [PubMed] [PMC]40. 2023 American Geriatrics Society Beers CriteriaВ® Update Expert Panel. American Geriatrics Society 2023 updated AGS Beers Criteria В® for potentially inappropriate medication use in older adults. J Am Geriatr Soc 2023;71:2052-2081.
[Article] [PubMed] [PMC]41. American Academy of Sleep Medicine. International classification of sleep disorders. 3rd ed. Darien: American Academy of Sleep Medicine, 2014.42. Ancoli-Israel S, Kripke DF, Klauber MR, Mason WJ, Fell R, Kaplan O. Sleep-disordered breathing in community-dwelling elderly. Sleep 1991;14:486-495.
[Article] [PubMed] [PMC]43. Young T, Palta M, Dempsey J, Skatrud J, Weber S, Badr S. The occurrence of sleep-disordered breathing among middle-aged adults. N Engl J Med 1993;328:1230-1235.
[Article] [PubMed]44. Munoz R, Duran-Cantolla J, MartГӯnez-Vila E, Gallego J, Rubio R, Aizpuru F, et al. Severe sleep apnea and risk of ischemic stroke in the elderly. Stroke 2006;37:2317-2321.
[Article] [PubMed]45. Gottlieb DJ, Yenokyan G, Newman AB, O'Connor GT, Punjabi NM, Quan SF, et al. Prospective study of obstructive sleep apnea and incident coronary heart disease and heart failure: the sleep heart health study. Circulation 2010;122:352-360.
[Article] [PubMed] [PMC]46. Choi WR, Bae MR, Chung YS. The impact of national health insurance coverage on compliance with positive airway pressure therapy in patients with obstructive sleep apnea. Clin Exp Otorhinolaryngol 2022;15:100-106.
[Article] [PubMed] [PMC]47. Weaver TE, Chasens ER. Continuous positive airway pressure treatment for sleep apnea in older adults. Sleep Med Rev 2007;11:99-111.
[Article] [PubMed] [PMC]48. Ramar K, Dort LC, Katz SG, Lettieri CJ, Harrod CG, Thomas SM, et al. Clinical practice guideline for the treatment of obstructive sleep apnea and snoring with oral appliance therapy: an update for 2015. J Clin Sleep Med 2015;11:773-827.
[Article] [PubMed] [PMC]49. Milligan SA, Chesson AL. Restless legs syndrome in the older adult: diagnosis and management. Drugs Aging 2002;19:741-751.
[PubMed]50. Castillo-ГҒlvarez F, Marzo-Sola ME. Restless legs syndrome. Pathophysiology, diagnosis and treatment. Med Clin (Barc) 2025;164:84-90.
[Article] [PubMed]51. Winkelman JW, Blackwell T, Stone K, Ancoli-Israel S, Redline S. Associations of incident cardiovascular events with restless legs syndrome and periodic leg movements of sleep in older men, for the outcomes of sleep disorders in older men study (MrOS sleep study). Sleep 2017;40:zsx023.
[Article] [PubMed] [PMC]52. Kim KY, Kim EH, Lee MJ, Ha JH, Jung IK, Kim ES. Restless leg syndrome and risk of all-cause dementia: a nationwide retrospective cohort study. Alzheimers Res Ther 2023;15:46.
[Article] [PubMed] [PMC]53. Winkelman JW, Berkowski JA, DelRosso LM, Koo BB, Scharf MT, Sharon D, et al. Treatment of restless legs syndrome and periodic limb movement disorder: an American Academy of Sleep Medicine clinical practice guideline. J Clin Sleep Med 2025;21:137-152.
[Article] [PubMed]54. Cornelius JR, Tippmann-Peikert M, Slocumb NL, Frerichs CF, Silber MH. Impulse control disorders with the use of dopaminergic agents in restless legs syndrome: a case-control study. Sleep 2010;33:81-87.
[Article] [PubMed] [PMC]55. Allen RP, Chen C, Garcia-Borreguero D, Polo O, DuBrava S, Miceli J, et al. Comparison of pregabalin with pramipexole for restless legs syndrome. N Engl J Med 2014;370:621-631.
[Article] [PubMed]56. Cicero CE, Giuliano L, Luna J, Zappia M, Preux PM, Nicoletti A. Prevalence of idiopathic REM behavior disorder: a systematic review and meta-analysis. Sleep 2021;44:zsaa294.
[Article] [PubMed]57. Barone DA. Secondary RBD: not just neurodegeneration. Sleep Med Rev 2024;76:101938.
[Article] [PubMed]58. Cesari M, Heidbreder A, St Louis EK, Sixel-Döring F, Bliwise DL, Baldelli L, et al. Video-polysomnography procedures for diagnosis of rapid eye movement sleep behavior disorder (RBD) and the identification of its prodromal stages: guidelines from the International RBD Study Group. Sleep 2022;45:zsab257.
[Article] [PubMed]59. Schenck CH, Mahowald MW. Polysomnographic, neurologic, psychiatric, and clinical outcome report on 70 consecutive cases with REM sleep behavior disorder (RBD): sustained clonazepam efficacy in 89.5% of 57 treated patients. Cleve Clin J Med 1990;57:S9-S23.
[Article]
