A Genetically Confirmed Korean Case of CANVAS: Cerebellar Ataxia, Neuropathy, and Vestibular Areflexia Syndrome
- Seung Hee Lee, MD, Hee-Jae Jung, MD, Ji-Hee Yoon, MDa, Gu-Hwan Kim, PhDb, June-Young Koh, MD, PhDc, Yuna Lee, MSc, Young Seok Ju, MD, PhDc, Eun-Jae Lee, MD, PhD, Beom Hee Lee, MD, PhDa, Young-Min Lim, MD, PhD, Hyunjin Kim, MD, PhD
мң м „м ҒмңјлЎң нҷ•м§„лҗң н•ңкөӯмқё CANVAS мҰқлЎҖ
- мқҙмҠ№нқ¬, м •нқ¬мһ¬, мңӨм§Җнқ¬a, к№Җкө¬нҷҳb, кі мӨҖмҳҒc, мқҙмң лӮҳc, мЈјмҳҒм„қc, мқҙмқҖмһ¬, мқҙлІ”нқ¬a, мһ„мҳҒлҜј, к№Җнҳ„진
- Received October 30, 2024; В В В Revised December 14, 2024; В В В Accepted December 18, 2024;
- ABSTRACT
-
Cerebellar ataxia, neuropathy, and vestibular areflexia syndrome (CANVAS) is a neurodegenerative disorder caused by a biallelic expansion of pentanucleotide repeats in the RFC1 gene. Previous studies have reported up to 22% of patients with late-onset ataxia harbor this pathogenic repeat expansion. Despite its relatively high prevalence, CANVAS is often underdiagnosed because the disease is not well recognized and genetic testing is not performed in clinical practice. Here, we present a patient with characteristic clinical features, confirmed by genetic testing.
Cerebellar ataxia, neuropathy, and vestibular areflexia syndrome (CANVAS)мқҖ replication factor C subunit 1 (RFC1)мң м „мһҗмқҳ л°ҳліөм Ғмқё 5м—јкё° нҷ•мһҘ(pentanucleotide)мқҙ м–‘мӘҪ лҢҖлҰҪ мң м „мһҗм—җм„ң л°ңмғқн•ҳм—¬ мң л°ңлҗҳлҠ” мӢ кІҪнҮҙн–үм§ҲнҷҳмқҙлӢӨ[1]. мқҙм „ м—°кө¬м—җ л”°лҘҙл©ҙ нӣ„кё°л°ңлі‘мӢӨмЎ° нҷҳмһҗмқҳ мөңлҢҖ 22%м—җм„ң RFC1 мң м „мһҗмқҳ лі‘м Ғмқё л°ҳліө нҷ•мһҘмқҙ нҷ•мқёлҗҳм—ҲлӢӨ[2]. мқҙмІҳлҹј CANVASлҠ” 비көҗм Ғ лҶ’мқҖ мң лі‘лҘ м—җлҸ„ л¶Ҳкө¬н•ҳкі м§Ҳнҷҳмқҙ мһҳ м•Ңл Өм ё мһҲм§Җ м•Ҡкі мӢӨм ң мһ„мғҒ 진лЈҢм—җм„ңлҠ” мң м „мһҗ кІҖмӮ¬к°Җ мҲҳн–үлҗҳкі мһҲм§Җ м•Ҡкё° л•Ңл¬ём—җ 진лӢЁмқҙ м§Җм—°лҗҳкұ°лӮҳ лҶ“м№ҳкё° мүҪлӢӨ. м Җмһҗл“ӨмқҖ мң м „мһҗ кІҖмӮ¬лЎң нҷ•м§„лҗң, м „нҳ•м Ғмқё мһ„мғҒ мҰқмғҒмқ„ ліҙмқҙлҠ” CANVAS нҷҳмһҗлҘј ліҙкі н•ҳкі мһҗ н•ңлӢӨ.
- мҰқ лЎҖ
- мҰқ лЎҖ
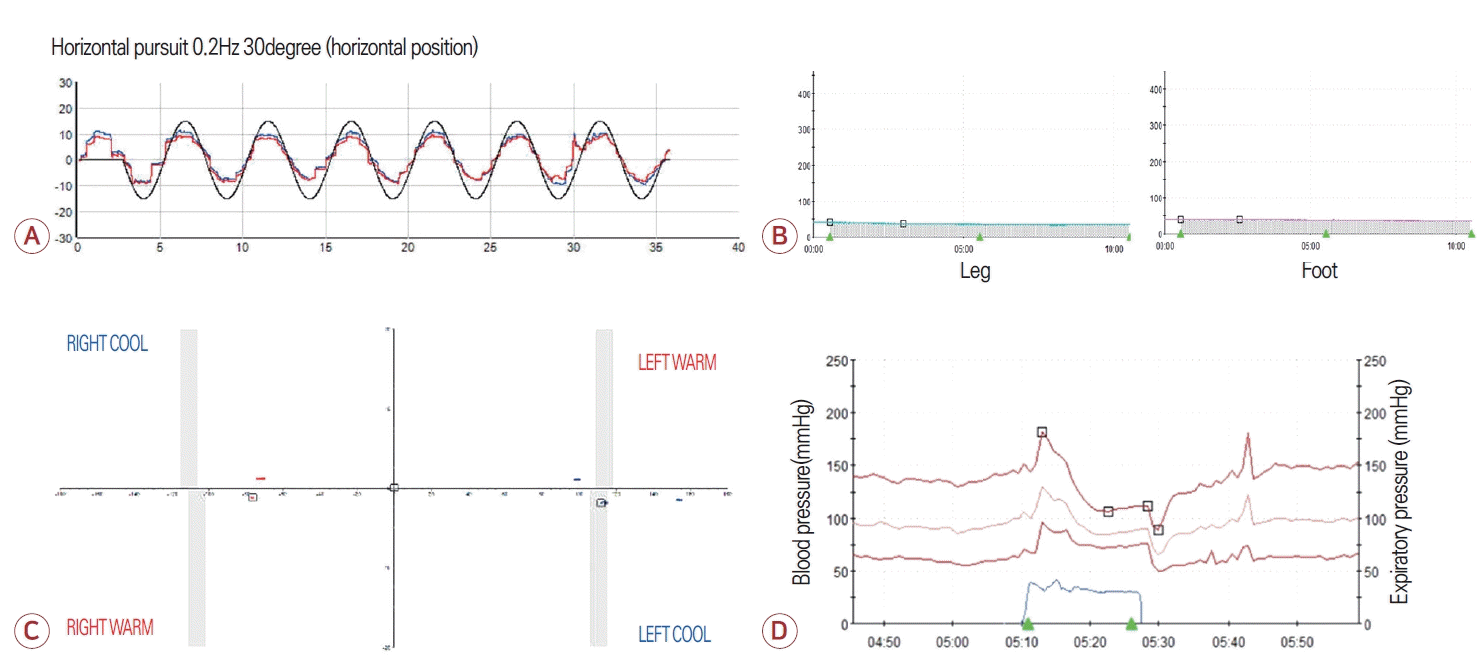
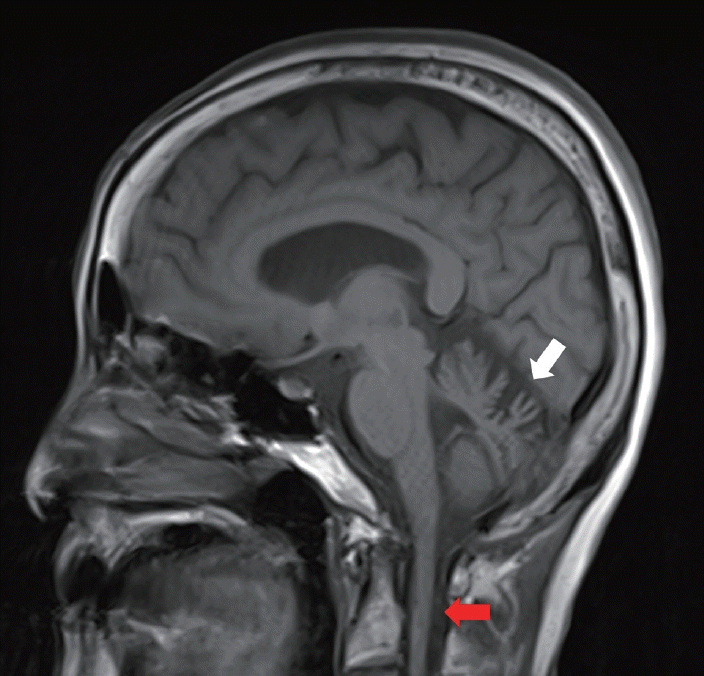
71м„ё м—¬мһҗк°Җ 5л…„ мқҙмғҒ м җ진м ҒмңјлЎң м•…нҷ”н•ҳлҠ” ліҙн–ү мқҙмғҒмңјлЎң лӮҙмӣҗн•ҳмҳҖлӢӨ. ліҙн–үмһҘм• мқҳ к°ҖмЎұл ҘмқҖ м—Ҷм—Ҳкі 10лҢҖ л•Ң нҸҗл ҙмқ„ м•“мқҖ мқҙнӣ„лЎң л§Ңм„ұм Ғмқё л§ҲлҘё кё°м№Ёмқҙ мһҲлҠ”лҚ° нғҖ лі‘мӣҗм—җм„ң нҳёнқЎкё°лҠҘнҸүк°Җ л°Ҹ кё°кҙҖм§ҖлӮҙмӢңкІҪ л“ұмқ„ н•ң м Ғмқҙ мһҲмңјлӮҳ мӣҗмқёмқ„ м°ҫм§Җ лӘ»н•ҳмҳҖлӢӨкі н•ҳмҳҖлӢӨ. кіјкұ°л ҘмғҒ лӢ№лҮЁлҠ” м—Ҷм—ҲмңјлӮҳ кі нҳҲм••мқ„ 진лӢЁл°ӣкі кі нҳҲм•• м•Ҫмқ„ ліөмҡ© мӨ‘мқҙм—Ҳкі 2л…„ м „м—җ 4-5лІҲ мҡ”추нҳ‘м°©мҰқм—җ лҢҖн•ҳм—¬ к°җм•• мҲҳмҲ мқ„ л°ӣм•ҳлӢӨ. к°җм••мҲҳмҲ мқҙнӣ„ н—ҲлҰ¬ нҶөмҰқмқҖ нҳём „лҗҳм—ҲмңјлӮҳ ліҙн–ү мһҘм• лҠ” нҳём „ м—Ҷмқҙ м•…нҷ”лҗҳм—Ҳкі мһҰмқҖ лӮҷмғҒмңјлЎң лӮҷмғҒ мҳҲл°©мқ„ мң„н•ҳм—¬ м§ҖнҢЎмқҙлҘј м§ҡкі лӢӨлӢҢлӢӨкі н•ҳмҳҖлӢӨ. лҸҷл°ҳ мҰқмғҒмңјлЎңлҠ” мҳӨлһҳ м„ң мһҲкұ°лӮҳ мғӨмӣҢ нӣ„м—җ м–‘ н•ҳм§Җк°Җ л¶үм–ҙ진лӢӨкі н•ҳмҳҖлӢӨ.мӢ кІҪ계진찰м—җм„ң мһҗл°ңм•Ҳ진мқҖ кҙҖм°°лҗҳм§Җ м•Ҡм•ҳкі мӢ мҶҚлҲҲмҡҙлҸҷ(saccadic eye movement) мӢң м–‘мёЎ мҲҳнҸү л°Ҹ мҲҳм§Ғ мёЎм •кіјлҢҖ(hypermetria)к°Җ нҷ•мқёлҗҳм—ҲлӢӨ. мӣҗнҷң추종мҡҙлҸҷ(smooth pursuit) мӢң л¶Ҳм—°мҶҚм Ғмқё м•Ҳкө¬мҡҙлҸҷмқҙ кҙҖм°°лҗҳм—Ҳмңјл©° л‘җл¶Җ충лҸҷ кІҖмӮ¬(head impulse test) мӢң м–‘мёЎм—җм„ң л”°лқјмһЎкё° мӢ мҶҚлҲҲмҡҙлҸҷ(catch-up saccade)мқҙ ліҙмҳҖлӢӨ. к·јл ҘмқҖ м •мғҒмқҙм—ҲмңјлӮҳ м–‘ н•ҳм§Җм—җм„ң нҶөк°Ғ л°Ҹ 진лҸҷк°җк°Ғмқҙ м Җн•ҳлҗҳм–ҙ мһҲм—Ҳкі лЎ¬лІ„к·ё кІҖмӮ¬(Romberg test) мӢң нҷҳмһҗлҠ” лҲҲмқ„ к°җкұ°лӮҳ лң¬ мғҒнғң лӘЁл‘җм—җм„ң к· нҳ•мқ„ мһҳ мһЎм§Җ лӘ»н•ҳмҳҖмңјлӮҳ лҲҲмқ„ к°җм•ҳмқ„ л•Ң нқ”л“ӨлҰјмқҙ лҚ” мӢ¬н•ҳмҳҖлӢӨ. мӮ¬м§Җ мӢӨмЎ°лҠ” лҡңл ·н•ҳм§Җ м•Ҡм•ҳмңјлӮҳ мқјмһҗліҙн–ү(tandem gait)мқҖ мҲҳн–үн•ҳм§Җ лӘ»н•ҳмҳҖлӢӨ. мӢ¬л¶Җкұҙл°ҳмӮ¬лҠ” мғҒн•ҳм§Җм—җм„ң лӘЁл‘җ м Җн•ҳлҗҳм–ҙ мһҲм—ҲлӢӨ. лҳҗн•ң мҡҙлҸҷ мҷ„л§Ң(bradykinesia)мқҙлӮҳ кІҪ축(rigidity), л–ЁлҰј(tremor)кіј к°ҷмқҖ нҢҢнӮЁмҠЁмҰқмқҖ кҙҖм°°лҗҳм§Җ м•Ҡм•ҳлӢӨ.비디мҳӨм•Ҳкө¬мҡҙлҸҷ кІҖмӮ¬(video-oculography) мӢң мһҗл°ңм•Ҳ진 л°Ҹ мЈјмӢңмң л°ңм•Ҳ진мқҖ ліҙмқҙм§Җ м•Ҡм•ҳкі м–‘мёЎ мҲҳнҸү л°Ҹ мҲҳм§Ғ мӣҗнҷң추종мҡҙлҸҷмқҙ мҶҗмғҒлҗҳм–ҙ мһҲм—ҲлӢӨ(Fig. 1-A). мӢ мҶҚлҲҲмҡҙлҸҷ мӢңм—җлҠ” мҲҳнҸүм—җм„ң мҡ°мёЎ мёЎм •кіјлҢҖ(hypermetria)мҷҖ мҲҳм§Ғм—җм„ң мғҒн•ҳ мёЎм •кіјмҶҢ(hypometria)к°Җ кҙҖм°°лҗҳм—ҲлӢӨ. нҷҳмһҗмқҳ нҳ‘мЎ°к°Җ мһҳ мқҙлЈЁм–ҙм§Җм§Җ м•Ҡм•„ 비디мҳӨлЁёлҰ¬м¶©лҸҷ кІҖмӮ¬лҠ” мӢңн–үн•ҳм§Җ лӘ»н•ҳмҳҖкі мҳЁлҸ„м•Ҳ진 кІҖмӮ¬(caloric test)м—җм„ңлҠ” м–‘мёЎ м „м •мӢ кІҪлі‘мҰқмқҙ нҷ•мқёлҗҳм—ҲлӢӨ(Fig. 1-B). мӢ кІҪм „лҸ„ кІҖмӮ¬м—җм„ң мҡҙлҸҷмӢ кІҪмқҖ м •мғҒмқҙм—ҲмңјлӮҳ м—¬лҹ¬ мғҒн•ҳм§Җ к°җк°ҒмӢ кІҪмқҳ 진нҸӯмқҙ мёЎм •лҗҳм§Җ м•ҠлҠ” к°җк°ҒлӢӨл°ңмӢ кІҪлі‘мқҙ нҷ•мқёлҗҳм—ҲлӢӨ. мһҗмңЁмӢ кІҪ кІҖмӮ¬м—җм„ңлҠ” л•Җ분비 кІҖмӮ¬мқё м •лҹүл•Җ분비축мӮӯл°ҳмӮ¬ кІҖмӮ¬(quantitative sudomotor axon reflex test) кІ°кіј н•ҳм§Җм—җм„ң к°җмҶҢлҗң мҶҢкІ¬мқ„ ліҙмҳҖкі (Fig. 1-C) л°ңмӮҙ바비 к°җмҶҢ л°Ҹ л°ңмӮҙл°”мҲҳкё° мӢңм—җ мқҙмғҒ нҳҲм•• л°ҳмқ‘мқ„ ліҙмҳҖмңјлӮҳ кё°лҰҪм ҖнҳҲм••мқҖ нҷ•мқёлҗҳм§Җ м•Ҡм•ҳлӢӨ(Fig. 1-D). к°җк°Ғ л°Ҹ мһҗмңЁмӢ кІҪлі‘мқҳ мӣҗмқёмқ„ м°ҫкё° мң„н•ҳм—¬ мӢңн–үн•ң лӢ№нҷ”нҳҲмғүмҶҢ, 비нғҖлҜјB12, мӢ мғқл¬јл”ёлҰјмҰқнӣ„кө°н•ӯмІҙнҢЁл„җ(paraneoplastic antibody panel), н•ӯн•өн•ӯмІҙ(antinuclear antibody), н•ӯнҳёмӨ‘кө¬м„ёнҸ¬м§Ҳн•ӯмІҙ(anti-neutrophil cytoplasmic antibody), н•ӯRoн•ӯмІҙ, н•ӯLaн•ӯмІҙ, нҳҲмІӯлӢЁл°ұм§Ҳм „кё°мҳҒлҸҷ, лјҲмҠӨмә”(bone scan) кІҖмӮ¬лҠ” лӘЁл‘җ м •мғҒмқҙм—ҲлӢӨ. лҮҢ л°Ҹ мІҷмҲҳ magnetic resonance imaging (MRI)м—җм„ңлҠ” лҡңл ·н•ң мҶҢлҮҢ л°Ҹ мІҷмҲҳ мң„축мқҙ нҷ•мқёлҗҳм—ҲлӢӨ(Fig. 2).л§Ңм„ұм Ғмқё кё°м№Ёмқҳ кіјкұ°л Ҙмқҙ мһҲлҠ” нӣ„кё°л°ңлі‘мӢӨмЎ° нҷҳмһҗм—җм„ң мҶҢлҮҢ, к°җк°ҒмӢ кІҪ, м „м •кё°лҠҘ мқҙмғҒмқҙ лӘЁл‘җ нҷ•мқёлҗҳм–ҙ CANVASлҘј мқҳмӢ¬н•ҳмҳҖкі м—°кө¬ лӘ©м ҒмңјлЎң мӢңн–үн•ң м „мһҘмң м „мІҙ кІҖмӮ¬(whole genome sequencing; RareVision, San Diego, CA, USA)м—җм„ң AAGGG л°ҳліө нҷ•мһҘмқҙ мқҳмӢ¬лҗҳлҠ” soft-clipped readsк°Җ нҷ•мқёлҗҳм—ҲлӢӨ(Fig. 3-A). нҷ•м§„мқ„ мң„н•ҳм—¬ RFC1мң м „мһҗм—җ лҢҖн•ң repeated primed-polymerase chain reaction (RP-PCR) кІҖмӮ¬лҘј мӢңн–үн•ҳмҳҖмқ„ л•Ң м–‘мёЎ лҢҖлҰҪ мң м „мһҗм—җм„ң AAGGG л°ҳліө нҷ•мһҘмқҙ нҷ•мқёлҗҳм—ҲлӢӨ(Fig. 3-B). м ң3нҳ• мІҷмҲҳмҶҢлҮҢмӢӨмЎ° л°Ҹ Friedreich мӢӨмЎ° мң м „мһҗ кІҖмӮ¬лҸ„ лӘЁл‘җ мқҢм„ұмңјлЎң нҷ•мқёлҗҳм–ҙ мөңмў…м ҒмңјлЎң нҷҳмһҗлҘј CANVASлЎң 진лӢЁн•ҳмҳҖлӢӨ. мһ¬нҷңмқҳн•ҷкіј нҳ‘진мқ„ нҶөн•ҙ ліҙн–ү л°Ҹ м „м • мһ¬нҷң м№ҳлЈҢлҘј 진н–үн•ҳмҳҖмңјл©° 진лӢЁ нӣ„ 16к°ңмӣ”м§ё мҷёлһҳ 추м Ғ кҙҖм°°м—җм„ң лҡңл ·н•ң м•…нҷ” мҶҢкІ¬мқҖ нҷ•мқёлҗҳм§Җ м•Ҡм•ҳлӢӨ.
- кі м°°
- кі м°°
CANVASлҠ” м„ңм„ңнһҲ 진н–үн•ҳлҠ” мҶҢлҮҢмӢӨмЎ°, мӢ кІҪлі‘мҰқ, м „м •л¬ҙл°ҳмӮ¬мҰқмқҳ мһ„мғҒм Ғ нҠ№м§•мқ„ к°Җм§ҖлҠ” м§Ҳлі‘мңјлЎң RFC1мң м „мһҗмқҳ лҸҷнҳ• м ‘н•©м„ұ нҺңнғҖлүҙнҒҙл ҲмҳӨнғҖмқҙл“ң л°ҳліө нҷ•мһҘмңјлЎң л°ңмғқн•ңлӢӨ[1]. RFC1мң м „мһҗлҠ” DNA ліөм ң л°Ҹ мҲҳм„ м—җ кҙҖм—¬н•ҳлҠ” DNAмӨ‘н•©нҡЁмҶҢліҙмЎ°лӢЁл°ұм§Ҳмқҳ нҒ° мҶҢлӢЁмң„(subunit)лҘј м•”нҳёнҷ”н•ҳлҠ” мң м „мһҗмқҙлӢӨ. мөңк·ј RFC1 мң м „мһҗмқҳ мқёнҠёлЎ 2м—җм„ң мқҙл°°мІҙ AAGGG л°ҳліө нҷ•мһҘмқҙ мҶҢлҮҢмӢӨмЎ°, мӢ кІҪлі‘мҰқ, м „м •л¬ҙл°ҳмӮ¬мҰқнӣ„кө°мқ„ нҸ¬н•Ён•ҳлҠ” н‘ңнҳ„нҳ•мңјлЎң лӮҳнғҖлӮңлӢӨлҠ” кІғмқҙ л°қнҳҖмЎҢлӢӨ[3]. лҳҗн•ң м—¬лҹ¬ м—°кө¬м—җм„ң нӣ„кё°л°ңлі‘мҶҢлҮҢмӢӨмЎ°лҘј к°Җ진 집лӢЁмқҳ мөңлҢҖ 22%м—җм„ң мқҙл°°мІҙ AAGGG л°ҳліө нҷ•мһҘмқ„ нҷ•мқён•ҳмҳҖлӢӨ[2,4]. мқҙлҹ¬н•ң кІ°кіјлҠ” мҶҢлҮҢмӢӨмЎ° нҷҳмһҗмқҳ мқјл¶Җм—җм„ң RFC1 мң м „мһҗ мқҙмғҒмқҙ мһҲмқ„ мҲҳ мһҲмңјл©° нҳ„мһ¬ мһ„мғҒм—җм„ң н•ҙлӢ№ мң м „мһҗ кІҖмӮ¬к°Җ мғҒмҡ©нҷ”лҗҳм–ҙ мһҲм§Җ м•Ҡм•„ 진лӢЁмңЁмқҙ лӮ®м•ҳмқ„ к°ҖлҠҘм„ұмқ„ ліҙм—¬мӨҖлӢӨ. нҳ„мһ¬ RFC1мң м „мһҗ л°ҳліө нҷ•мһҘмқҳ 분мһҗ 진лӢЁмқҖ лӘЁнӢ°н”„нҠ№мқҙн”„лқјмқҙлЁё(motif-specific primer)лҘј мқҙмҡ©н•ң RP-PCRлЎң мӢңн–үн•ңлӢӨ[2]. мҙҲкё° м—°кө¬м—җм„ңлҠ” AAGGGк°Җ м•Ҫ 400нҡҢ мқҙмғҒ л°ҳліөлҗ кІҪмҡ° лі‘мӣҗм„ұмқҙ мһҲлӢӨкі л°қнҳҖмЎҢкі к·ё мҷё (AAAGG)10-25(AAGGG)exp (AAAGG)4-6кіј ACAGGexpмқҙ мөңк·ј нҷ•мқёлҗҳм—ҲлӢӨ[2,5,6].RFC1 нҷ•мһҘмңјлЎң мқён•ң лі‘лҰ¬ кё°м „мқҖ м•„м§Ғ мһҳ м•Ңл Өм ё мһҲм§Җ м•Ҡм§Җл§Ң мқҙл°°мІҙ AAGGG нҷ•мһҘмқ„ к°Җ진 нҷҳмһҗл“Өмқҳ л¶ҖкІҖ кІ°кіјм—җм„ң мЈјлЎң мҶҢлҮҢмқҳ лІҢл Ҳм—Ҫм—җм„ң мӢ¬н•ң н‘ёлҘҙнӮӨл„Өм„ёнҸ¬(Purkinje cell)мқҳ нҳ„м Җн•ң к°җмҶҢмҷҖ н•Ёк»ҳ л’ӨлҝҢлҰ¬(dorsal root)мҷҖ мӮјм°ЁмӢ кІҪ, м•Ҳл©ҙмӢ кІҪ, м „м •мӢ кІҪмқҳ мӢ кІҪм Ҳм—җм„ң к°җк°ҒмӢ кІҪм„ёнҸ¬мқҳ мҶҗмӢӨмқҙ нҷ•мқёлҗҳм—ҲлӢӨ[7]. лӢӨл§Ң лӢ¬нҢҪмқҙмӢ кІҪ(cochlear nerve)кіј лӢ¬нҢҪмқҙмӢ кІҪм Ҳ(spiral ganglia)мқҖ м№ЁлІ”н•ҳм§Җ м•ҠлҠ” кІғмқҙ нҷ•мқёлҗҳкё°лҸ„ н•ҳмҳҖлӢӨ[8]. CANVAS нҷҳмһҗмқҳ л§җмҙҲмӢ кІҪ мғқкІҖм—җм„ңлҠ” нҒ¬кі мһ‘мқҖ л§җмқҙ집мӢ кІҪ(myelinated nerve)мқҳ мӢ¬н•ң л§Ңм„ұм Ғмқё мҶҢмӢӨмқҙ кҙҖм°°лҗҳм—Ҳмңјл©° нҷңлҸҷм Ғмқё 축мӮӯ нҮҙнҷ”лӮҳ мһ¬мғқмқҳ мҰқкұ°лҠ” м—Ҷм—ҲлӢӨ.CANVASмқҳ нҠ№м§•м Ғмқё 3к°Җм§Җ мҰқмғҒ мӨ‘ мҶҢлҮҢмӢӨмЎ°лҠ” мӢ мҶҚлҲҲмҡҙлҸҷм—җм„ң мқҙмғҒмқ„ ліҙмқҙкұ°лӮҳ мЈјмӢңмң л°ңм•Ҳ진(gaze-evoked nystagmus), мҶҢлҮҢм„ұ кө¬мқҢмһҘм• , мӮ¬м§ҖмӢӨмЎ°мҰқ л“ұ лӢӨм–‘н•ң л°©мӢқмңјлЎң нҷ•мқёлҗңлӢӨ[1]. лҮҢMRIм—җм„ң мҶҢлҮҢмң„축мҰқмқҖ мЈјлЎң м•һмӘҪ л°Ҹ л“ұмӘҪ лІҢл Ҳм—Ҫ(vermis)м—җ л‘җл“ңлҹ¬м§ҖлҠ” нҠ№м§•мқ„ к°Җм§Җкі мһҲлӢӨ. мқҙлҹ¬н•ң мҶҢлҮҢмӢӨмЎ°мқҳ нҠ№м§•кіј лҚ”л¶Ҳм–ҙ мһҗмңЁмӢ кІҪ мқҙмғҒлҸ„ нқ”н•ҳкё° л•Ңл¬ём—җ CANVASлҠ” нҠ№нһҲ мҶҢлҮҢнҳ• лӢӨкі„нҶөмң„축мҰқ(multiple system atrophy-cerebellar type, MSA-C)мңјлЎң мһҳлӘ» 진лӢЁлҗ мҲҳ мһҲлӢӨ. лі‘л Ҙ мІӯм·Ём—җм„ң л§Ңм„ұм Ғмқё л§ҲлҘё кё°м№Ёмқҙ мһҲкұ°лӮҳ мӢ кІҪ계진찰м—җм„ң м „м •кё°лҠҘ л°Ҹ к°җк°ҒмӢ кІҪ мқҙмғҒмқ„ ліҙмқј кІҪмҡ° CANVASлҘј мқҳмӢ¬н•ҙм•ј н•ҳкі MSA-Cм—җм„ң нҠ№м§•м Ғмқҙлқјкі м•Ңл Ө진 hot cross-bun signкіј к°ҷмқҖ лҮҢMRIм—җм„ңмқҳ м°Ёмқҙм җмқ„ нҶөн•ң к°җлі„ 진лӢЁмқҙ н•„мҡ”н•ҳлӢӨ. мөңк·јм—җлҠ” 분мһҗмҳҒмғҒмқ„ нҶөн•ң к°җлі„ 진лӢЁм—җ лҢҖн•ң м—°кө¬лҸ„ мқҙлЈЁм–ҙм§Җкі мһҲм–ҙ к·Җ추к°Җ мЈјлӘ©лҗңлӢӨ[9]. мқҙм „ м—°кө¬м—җ л”°лҘҙл©ҙ лӢӨкі„нҶөмң„축мҰқ нҷҳмһҗмқҳ л¶ҖкІҖ кІ°кіј лӢЁм§Җ 62%м—җм„ң лӢӨкі„нҶөмң„축мҰқм—җ л§ҢмЎұн•ҳлҠ” лі‘лҰ¬ кІ°кіјк°Җ нҷ•мқёлҗҳлҠ” л§ҢнҒј CANVAS нҷҳмһҗк°Җ кіјмҶҢ 진лӢЁ(underdiagnosis)лҗҳм–ҙ мҷ”мқ„ к°ҖлҠҘм„ұлҸ„ кі л Өн•ҙм•ј н•ҳкІ лӢӨ[10]. лӢӨкі„нҶөмң„축мҰқ мҷём—җлҸ„ ліҙн–үмӢӨмЎ°мҷҖ к°җк°Ғ мқҙмғҒмқ„ ліҙмқј мҲҳ мһҲлҠ” мІҷмҲҳмҶҢлҮҢмӢӨмЎ° л°Ҹ FriedreichмӢӨмЎ°м—җ лҢҖн•ң к°җлі„ 진лӢЁлҸ„ н•„мҡ”н•ҳлӢӨ. м „м •лі‘мҰқмңјлЎң мқён•ң мҶҢкІ¬мңјлЎңлҠ” м „м •м•Ҳкө¬л°ҳмӮ¬ мқҙл“қмқҳ к°җмҶҢк°Җ лЁёлҰ¬м¶©лҸҷ кІҖмӮ¬м—җм„ң нҷ•мқёлҗҳл©° мӢңк°Ғ м „м •м•Ҳл°ҳмӮ¬(visually enhanced vestibulo-ocular reflex, VVOR)мқҳ мҶҗмғҒмқҙ лҸҷл°ҳлҗ мҲҳ мһҲлӢӨ. мӢ кІҪлі‘мҰқмқҖ мЈјлЎң к°җк°ҒмӢ кІҪм Ҳлі‘мҰқ(sensory ganglionopathy)мңјлЎң л’ӨлҝҢлҰ¬мӢ кІҪм Ҳмқҳ мҶҗмӢӨмқҙ л‘җл“ңлҹ¬м§„лӢӨ. мһ„мғҒм ҒмңјлЎңлҠ” кі мң к°җк°Ғ л°Ҹ нҶөк°Ғ м Җн•ҳ, мӢ кІҪлі‘мҰқ нҶөмҰқ л“ұмқҙ нҷ•мқёлҗңлӢӨ.мқҙм—җ л”°лқј CANVASлҘј 진лӢЁн•ҳкё° мң„н•ҙм„ң лӢӨмқҢкіј к°ҷмқҖ 4к°Җм§Җ кё°мӨҖ(clinically definite CANVAS)мқҙ м ңмӢңлҗҳм—ҲлӢӨ. мІ«м§ё, кі мҶҚ 비디мҳӨм•Ҳкө¬мҡҙлҸҷ кІҖмӮ¬(high-speed video-oculography), нҡҢм „мқҳмһҗ кІҖмӮ¬(rotational chair testing) л“ұм—җм„ң л№„м •мғҒм Ғмқё VVORмқ„ ліҙмқёлӢӨ. л‘ҳм§ё, лҮҢMRIм—җм„ң мҶҢлҮҢмқҳ м•һмӘҪ л°Ҹ л“ұмӘҪ лІҢл Ҳм—Ҫ(VI, VIIA, VIIB)мқҳ мң„축과 мёЎл©ҙ л°ҳкө¬мқҳ мң„축мқ„ ліҙмқёлӢӨ. м…Ӣм§ё, мӢ кІҪмғқлҰ¬ кІҖмӮ¬м—җм„ң мӢ кІҪм„ёнҸ¬лі‘мҰқмқҙ нҷ•мқёлҗңлӢӨ. л„·м§ё, мң м „мһҗ кІҖмӮ¬лҘј нҶөн•ҙ м ң3нҳ• мІҷмҲҳмҶҢлҮҢмӢӨмЎ° л°Ҹ FriedreichмӢӨмЎ°к°Җ л°°м ңлҗҳм–ҙм•ј н•ңлӢӨ[1]. ліё мҰқлЎҖлҠ” нҷҳмһҗмқҳ нҳ‘мЎ°к°Җ мһҳ мқҙлЈЁм–ҙм§Җм§Җ м•Ҡм•„ л№„м •мғҒ VVORмқҙ нҷ•мқёлҗҳм§ҖлҠ” м•Ҡм•ҳмңјлӮҳ м–‘мёЎ м „м •мӢ кІҪ мқҙмғҒ, нҠ№м§•м Ғмқё мҶҢлҮҢмң„축, к°җк°ҒмӢ кІҪм Ҳлі‘мҰқкіј н•Ёк»ҳ RFC1мң м „мһҗм—җм„ң AAGGG нҷ•мһҘмқҙ нҷ•мқёлҗҳм–ҙ CANVASлЎң 진лӢЁн• мҲҳ мһҲм—ҲлӢӨ.CANVASлҠ” мң м „м§Ҳнҷҳмһ„м—җлҸ„ л¶Ҳкө¬н•ҳкі мӨ‘л…„кё°м—җ л°ңлі‘н•ңлӢӨлҠ” нҠ№м§•мқҙ мһҲкі мғҒлҢҖм ҒмңјлЎң лҶ’мқҖ л°ңлі‘лҘ м—җ 비н•ҙ мһҳ м•Ңл Өм ё мһҲм§Җ м•Ҡм•„ кіјмҶҢ 진лӢЁлҗҳм–ҙ мҷ”мқ„ к°ҖлҠҘм„ұмқҙ мһҲлӢӨ. лҳҗн•ң нҳ„мһ¬ мһ„мғҒм—җм„ң мң м „мһҗ кІҖмӮ¬к°Җ мғҒмҡ©нҷ”лҗҳм–ҙ мһҲм§Җ м•ҠмқҖ м җлҸ„ кіјмҶҢ 진лӢЁмқҳ мӣҗмқёмңјлЎң мғқк°ҒлҗңлӢӨ. ліҙн–үмӢӨмЎ°лЎң лӮҙмӣҗн•ң мӨ‘мһҘл…„мқҳ нҷҳмһҗм—җм„ң мҶҢлҮҢмӢӨмЎ°, к°җк°ҒмӢ кІҪлі‘ л°Ҹ м „м •кё°лҠҘ мқҙмғҒмқҳ нҠ№м§•м Ғмқё н‘ңнҳ„нҳ•кіј н•Ёк»ҳ л§Ңм„ұ кё°м№Ёмқҳ кіјкұ°л Ҙмқ„ ліҙмқј кІҪмҡ° CANVASлҘј мқҳмӢ¬н•ҳм—¬ RFC1мң м „мһҗ кІҖмӮ¬лҘј кі л Өн•ҙ ліҙлҠ” кІғмқҙ н•„мҡ”н•ҳкІ лӢӨ.
FigureВ 1.
Neurophysiological studies of the patient. (A) Video-oculography demonstrated impaired smooth pursuit. (B) Caloric test showed a bilateral absent response during bi-thermal caloric irrigation. (C) Quantitative sudomotor axon reflex test revealed a reduced sweat response in the leg and foot. (D) Blood pressure response to the Valsalva maneuver showed adrenergic dysfunction, indicated by the absence of late-phase II and phase IV responses.
FigureВ 2.
T1-weighted sagittal MRI of the patient. The brain MRI demonstrates cerebellar atrophy, predominantly affecting the anterior and dorsal vermis (white arrow), along with spinal cord atrophy (red arrow). MRI; magnetic resonance imaging.
FigureВ 3.
Genetic tests of the patient. (A) Visualization on the integrative genomics viewer (IGV) of reads aligned to the short repeat and flanking region in intron 2 of RFC1 gene shows the presence of a mutated AAGGG repeat unit. Note that, according to the IGVвҖҷs default settings, AAGGG repeat units that do not map to the (AAAAG)11 reference sequences are soft-clipped and do not contribute to the coverage, making them virtually absent (black-lined box). However, if soft-clipped reads were displayed, the reads containing the AAGGG repeat unit could be observed. (B) Repeat-primed (RP) polymerase chain reaction for the pentanucleotide repeat of the RFC1 gene. Using the (AAGGG)-RP primer set, a homozygous (biallelic) AAGGG expansion was detected (black arrow), with no non-repeat alleles observed (red arrow).

- REFERENCES
- REFERENCES
- 1. Szmulewicz DJ, Roberts L, McLean CA, MacDougall HG, Halmagyi GM, Storey E. Proposed diagnostic criteria for cerebellar ataxia with neuropathy and vestibular areflexia syndrome (CANVAS). Neurol Clin Pract 2016;6:61-68.
[Article] [PubMed] [PMC]2. Cortese A, Simone R, Sullivan R, Vandrovcova J, Tariq H, Yau WY, et al. Biallelic expansion of an intronic repeat in RFC1 is a common cause of late-onset ataxia. Nat Genet 2019;51:649-658.
[Article] [PubMed] [PMC]3. Rafehi H, Szmulewicz DJ, Bennett MF, Sobreira NLM, Pope K, Smith KR, et al. Bioinformatics-based identification of expanded repeats: a non-reference intronic pentamer expansion in RFC1 causes CANVAS. Am J Hum Genet 2019;105:151-165.
[Article] [PubMed] [PMC]4. Wan L, Chen Z, Wan N, Liu M, Xue J, Chen H, et al. Biallelic intronic AAGGG expansion of RFC1 is related to multiple system atrophy. Ann Neurol 2020;88:1132-1143.
[PubMed]5. Beecroft SJ, Cortese A, Sullivan R, Yau WY, Dyer Z, Wu TY, et al. A MДҒori specific RFC1 pathogenic repeat configuration in CANVAS, likely due to a founder allele. Brain 2020;143:2673-2680.
[Article] [PubMed] [PMC]6. Scriba CK, Beecroft SJ, Clayton JS, Cortese A, Sullivan R, Yau WY, et al. A novel RFC1 repeat motif (ACAGG) in two Asia-Pacific CANVAS families. Brain 2020;143:2904-2910.
[Article] [PubMed] [PMC]7. Huin V, Coarelli G, Guemy C, Boluda S, Debs R, Mochel F, et al. Motor neuron pathology in CANVAS due to RFC1 expansions. Brain 2022;145:2121-2132.
[Article] [PubMed]8. Szmulewicz DJ, Merchant SN, Halmagyi GM. Cerebellar ataxia with neuropathy and bilateral vestibular areflexia syndrome: a histopathologic case report. Otol Neurotol 2011;32:e63-e65.
[PubMed] [PMC]
