Use of Non-Vitamin K Dependent Oral Anticoagulant in Ischemic Stroke
- Hyungjong Park, MD, Joonsang Yoo, MDa
н—ҲнҳҲлҮҢмЎёмӨ‘м—җм„ң 비нғҖлҜј K 비мқҳмЎҙкІҪкө¬н•ӯмқ‘кі м ңмқҳ мӮ¬мҡ©
- л°•нҳ•мў…, мң мӨҖмғҒa
- Received July 12, 2021; В В В Revised July 30, 2021; В В В Accepted July 30, 2021;
- ABSTRACT
-
Atrial fibrillation (AF) is associated with an increased incidence of ischemic stroke and transient ischemic attack. A confluence of various factors such as blood stasis, endothelial dysfunction, and prothrombotic state could be contributing to the thrombogenesis in AF. Anticoagulation is the first-line therapy for the prevention of thromboembolism by AF. In current days, non-vitamin K dependent oral anticoagulants (NOAC) are considered as the preferred choice of anticoagulants to prevent ischemic stroke in patients with AF. NOACs have comparable good efficacy and better safety with a predictable anticoagulant effect without the routine coagulation monitoring compared to vitamin K dependent oral anticoagulant. However, the proper use of NOACs needs a careful approach to many practical aspects for balancing the preventing thromboembolic events and bleeding risk. Thus, understanding the drug metabolism and indication of NOAC for a specific situation is essential. In this article, we review major clinical trials, the mechanism, and the use of NOACs in the actual clinical setting of managing ischemic stroke patients.
- м„ң лЎ
- м„ң лЎ
мӢ¬л°©м„ёлҸҷмқҖ н—ҲнҳҲлҮҢмЎёмӨ‘мқҳ мЈјмҡ”н•ң мң„н—ҳмқёмһҗмқҙлӢӨ. мӢ¬л°©м„ёлҸҷмқҙ мһҲлҠ” нҷҳмһҗмқҳ мӢ¬мһҘм—җм„ңлҠ” нҳҲм „мқҙ мүҪкІҢ л§Ңл“Өм–ҙм§Җл©°, мқҙлЎң мқён•ҳм—¬ л°ңмғқн• мҲҳ мһҲлҠ” н—ҲнҳҲлҮҢмЎёмӨ‘мқҳ мқјм°Ё л°Ҹ мқҙм°Ё мҳҲл°©мқ„ мң„н•ҳм—¬лҠ” м§ҖмҶҚм Ғмқё н•ӯмқ‘кі м ң м№ҳлЈҢк°Җ н•„мҡ”н•ҳлӢӨ. 1950л…„лҢҖм—җ кІҪкө¬н•ӯмқ‘кі м ңмқё мҷҖнҢҢлҰ°(warfarin)мқҙ лҸ„мһ…лҗң мқҙнӣ„ мҳӨлһң кё°к°„ мқҙлҘј лҢҖмІҙн• мҲҳ мһҲлҠ” мғҲлЎңмҡҙ кІҪкө¬н•ӯмқ‘кі м ңк°Җ мһ„мғҒ нҳ„мһҘм—җ м Ғмҡ©лҗҳм§Җ м•Ҡм•„мҷ”лӢӨ. к·ёлҹ¬лӮҳ 2009л…„ лӢӨ비к°ҖнҠёлһҖ(dabigatran)мқҙ лҢҖк·ңлӘЁ мһ„мғҒ м—°кө¬м—җм„ң нҡЁкіјлҘј мһ…мҰқн•ң мқҙнӣ„ 2011л…„ лҰ¬л°”лЎқмӮ¬л°ҳ(rivaroxaban)кіј м•„н”ҪмӮ¬л°ҳ(apixaban), 2013л…„ м—җлҸ…мӮ¬л°ҳ(edoxaban)мқҙ м°ЁлЎҖм°ЁлЎҖ к·ё нҡЁкіјлҘј мһ…мҰқн•ҳм—¬ нҳ„мһ¬лҠ” лҮҢмЎёмӨ‘мқҳ мқјм°Ё мҳҲл°©кіј мқҙм°Ё мҳҲл°©м—җ л„җлҰ¬ м“°мқҙкі мһҲлӢӨ[1]. н•ҙлӢ№ м•Ҫл¬јл“Өмқҳ лҸ„мһ… мҙҲкё°м—җлҠ” мғҲлЎңмҡҙ кІҪкө¬н•ӯмқ‘кі м ңлқјлҠ” мқҳлҜёмқҳ new oral anticoagulant (NOAC)лЎң нҶөмҡ©лҗҳм—ҲмңјлӮҳ, мӢңк°„мқҙ нқҗлҘё нҳ„мһ¬м—җлҠ” мғҲлЎӯлӢӨлҠ” мқҳлҜё ліҙлӢӨлҠ” 비нғҖлҜј Kмқҳ лҢҖмӮ¬лҘј м–өм ңн•ҳм—¬ к°„м ‘м ҒмңјлЎң мқ‘кі мқёмһҗм—җ мһ‘мҡ©н•ҳлҠ” мҷҖнҢҢлҰ°кіј лӢ¬лҰ¬ мқ‘кі мқёмһҗм—җ м§Ғм ‘ мһ‘мҡ©н•ҳлҠ” м•Ҫл¬јмқҳ мһ‘мҡ©кё°м „мқ„ к°•мЎ°н•ҳм—¬ 비нғҖлҜј K 비мқҳмЎҙкІҪкө¬н•ӯмқ‘кі м ң(non-vitamin K dependent oral anticoagulant, NOAC) лҳҗлҠ” м§Ғм ‘мһ‘мҡ© кІҪкө¬н•ӯмқ‘кі м ң(direct oral anticoagulant, DOAC)лЎң м№ӯн•ҙ진лӢӨ.ліё мў…м„Өм—җм„ңлҠ” н—ҲнҳҲлҮҢмЎёмӨ‘м—җм„ң NOACмқҳ мЈјмҡ” мһ„мғҒ м—°кө¬мҷҖ мһ‘мҡ©кё°м „ л°Ҹ мӢӨм ң мһ„мғҒ нҳ„мһҘм—җм„ңмқҳ мӮ¬мҡ©м—җ лҢҖн•ҳм—¬ л…јмқҳн•ҳкі мһҗ н•ңлӢӨ.
- ліё лЎ
- ліё лЎ
- 1. мЈјмҡ” мһ„мғҒ м—°кө¬
- 1. мЈјмҡ” мһ„мғҒ м—°кө¬
1) лӢӨ비к°ҖнҠёлһҖ
1) лӢӨ비к°ҖнҠёлһҖ
2009л…„ л°ңн‘ңлҗң randomized evaluation of long-term anticoagulation therapy (RE-LY) м—°кө¬м—җм„ң лӢӨ비к°ҖнҠёлһҖ 150 mg 1мқј 2нҡҢ ліөмҡ©кө°мқҖ мҷҖнҢҢлҰ°м—җ 비н•ҳм—¬ лҮҢмЎёмӨ‘кіј м „мӢ мғүм „ л°ңмғқмқҳ мҳҲл°©нҡЁкіјк°Җ мҡ°мҲҳн•ҳмҳҖмңјл©°(RR, 0.66; 95% CI, 0.53-0.82 for superiority), м¶ңнҳҲмқҳ мң„н—ҳм„ұмқҖ 비мҠ·н•ҳмҳҖлӢӨ[3]. лӢӨ비к°ҖнҠёлһҖ 110 mg 1мқј 2нҡҢ ліөмҡ©кө°мқҖ мҷҖнҢҢлҰ°кіј 비көҗн•ҳм—¬ лҮҢмЎёмӨ‘ л°Ҹ м „мӢ мғүм „ л°ңмғқмқҖ 비м—ҙл“ұн•ҳмҳҖкі , мЈјмҡ” м¶ңнҳҲ л¶Җмһ‘мҡ©мқҖ 20% м •лҸ„ м Ғм—ҲлӢӨ. н—ҲнҳҲлҮҢмЎёмӨ‘мңјлЎң н•ңм •н•ҳмҳҖмқ„ л•Ңм—җлҠ” лӢӨ비к°ҖнҠёлһҖ 150 mg 1мқј 2нҡҢ ліөмҡ©кө°м—җм„ңл§Ң мҷҖнҢҢлҰ°м—җ 비н•ҳм—¬ мҡ°мӣ”н•Ёмқ„ мһ…мҰқн•ҳмҳҖмңјл©°, лӢӨ비к°ҖнҠёлһҖ 110 mg 1мқј 2нҡҢ ліөмҡ©кө°м—җм„ңлҠ” 비м—ҙл“ұм„ұмқ„ мһ…мҰқн•ҳмҳҖлӢӨ. м¶ңнҳҲлҮҢмЎёмӨ‘мқҖ лӢӨ비к°ҖнҠёлһҖ 110 mg, 150 mg мҡ©лҹү лӘЁл‘җм—җм„ң мҷҖнҢҢлҰ°м—җ 비н•ҙ м ҒкІҢ л°ңмғқн•ҳмҳҖмңјлӮҳ мң„мһҘкҙҖ м¶ңнҳҲмқҳ кІҪмҡ°, лӢӨ비к°ҖнҠёлһҖ 150 mg кө°м—җм„ң мҷҖнҢҢлҰ°м—җ 비н•ҙ 50% мҰқк°Җн•ҳмҳҖлӢӨ. мӢ¬к·јкІҪмғүмҰқмқҳ л°ңмғқмқҖ нҶөкі„м ҒмңјлЎңлҠ” мң мқҳн•ҳм§Җ м•ҠмқҖ м •лҸ„м—җм„ң лӢӨн”јк°ҖнҠёлһҖ 110 mg, 150 mg мҡ©лҹү лӘЁл‘җ мҷҖнҢҢлҰ°м—җ 비н•ҳм—¬ мҰқк°Җн•ҳлҠ” кІҪн–Ҙмқ„ ліҙмҳҖмңјлӮҳ, лҢҖк·ңлӘЁ нӣ„н–Ҙ분м„қм—җм„ңлҠ” мһ¬нҳ„лҗҳм§Җ м•Ҡм•ҳлӢӨ[4].2) м•„н”ҪмӮ¬л°ҳ
2) м•„н”ҪмӮ¬л°ҳ
2011л…„ л°ңн‘ңлҗң apixaban for reduction in stroke and other thromboembolic events in atrial fibrillation (ARISTOTLE) м—°кө¬м—җм„ңлҠ” м•„н”ҪмӮ¬л°ҳ 5 mg 1мқј 2нҡҢ нҲ¬м—¬мҷҖ мҷҖнҢҢлҰ°мқ„ 비көҗн•ҳмҳҖлӢӨ[5]. м•„н”ҪмӮ¬л°ҳмқ„ нҲ¬м—¬н•ң кө°м—җм„ң лҮҢмЎёмӨ‘ л°Ҹ м „мӢ мғүм „мҰқмқҳ л°ңмғқмқҖ 21% к°җмҶҢн•ҳмҳҖмңјл©°, м „мІҙ мӮ¬л§қлҘ лҳҗн•ң 11% к°җмҶҢн•ҳмҳҖлӢӨ. мЈјмҡ” м¶ңнҳҲмқҖ 31% к°җмҶҢн•ҳмҳҖмңјл©° нҠ№нһҲ м¶ңнҳҲлҮҢмЎёмӨ‘мқҖ мң мқҳн•ҳкІҢ к°җмҶҢн•ҳмҳҖлӢӨ. мң„мһҘкҙҖ м¶ңнҳҲмқҳ л°ңмғқлҘ мқҖ м–‘ кө°м—җм„ң 비мҠ·н•ҳмҳҖлӢӨ. лӢӨл§Ң, мҷҖнҢҢлҰ°м—җ 비н•ҳм—¬ н—ҲнҳҲлҮҢмЎёмӨ‘мқ„ лҚ” мӨ„м—¬ мЈјм§ҖлҠ” лӘ»н•ҳмҳҖлӢӨ. Apixaban versus acetylsalicylic acid to prevent stroke in atrial fibrillation patients who have failed or are unsuitable for vitamin K antagonist treatment (AVERROES) м—°кө¬лҠ” лӘ©н‘ң мҲҳмӨҖмқҳ international normalized ratio (INR)мқҳ мң м§Җк°Җ мһҳ лҗҳм§Җ м•Ҡм•ҳкұ°лӮҳ, лӘ©н‘ң мҲҳмӨҖмқҳ INR ліҙлӢӨ лҶ’кІҢ мң м§Җлҗҳм–ҙ м¶ңнҳҲ кҙҖл Ё л¶Җмһ‘мҡ©мқ„ кІӘмқҖ кІҪмҡ°, мҷҖнҢҢлҰ°кіј мғҒнҳёмһ‘мҡ©мқҙ мһҲлҠ” м•Ҫл¬јмқҳ нҲ¬м•Ҫмқҙ н•„мҡ”н•ҳм—¬ мҷҖнҢҢлҰ°мқҳ мӮ¬мҡ©мқҙ л¶Җм Ғн•©н•ҳлӢӨкі нҢҗлӢЁлҗҳлҠ” мӢ¬л°©м„ёлҸҷ нҷҳмһҗл“Өмқ„ лҢҖмғҒмңјлЎң м•„н”ҪмӮ¬л°ҳ 5 mg 1мқј 2нҡҢ нҲ¬м—¬мҷҖ м•„мҠӨн”јлҰ° 81-324 mgмқ„ м§Ғм ‘ 비көҗн•ҳмҳҖлӢӨ[6]. лҮҢмЎёмӨ‘ мҳҲл°©м—җм„ң м•„н”ҪмӮ¬л°ҳкө°мқҖ м•„мҠӨн”јлҰ°м—җ 비н•ҙ мҡ°мҲҳн•ҳмҳҖмңјл©°(HR, 0.45; 95% CI, 0.32-0.62 for superiority) м¶ңнҳҲмқҳ мң„н—ҳм„ұмқҖ мң мӮ¬н•ҳмҳҖлӢӨ.3) лҰ¬л°”лЎқмӮ¬л°ҳ
3) лҰ¬л°”лЎқмӮ¬л°ҳ
2011л…„ л°ңн‘ңлҗң rivaroxaban once daily oral direct factor Xa inhibition compared with vitamin K antagonism for prevention of stroke embolism trial in atrial fibrillation (ROCKET-AF) м—°кө¬м—җм„ңлҠ” лҰ¬л°”лЎқмӮ¬л°ҳ 20 mgмқ„ 1мқј 1нҡҢ нҲ¬м—¬н•ң кө°кіј мҷҖнҢҢлҰ° нҲ¬м—¬кө°мқ„ 비көҗн•ҳмҳҖлӢӨ[7]. лӢӨл§Ң Crockroft-Gault кіөмӢқм—җ мқҳн•ҙ м¶”м •лҗҳлҠ” нҒ¬л Ҳм•„нӢ°лӢҢмІӯмҶҢмңЁмқҙ 30-49 mL/minмқё нҷҳмһҗлҠ” 15 mgмқ„ 1мқј 1нҡҢ нҲ¬м—¬н•ҳмҳҖлӢӨ. лҮҢмЎёмӨ‘ л°Ҹ м „мӢ мғүм „мҰқ мҳҲл°©нҡЁкіјлҠ” мҷҖнҢҢлҰ°ліҙлӢӨ 비м—ҙл“ұн•ҳмҳҖмңјл©°, н”„лЎңнҶ мҪңм—җ л”°лҘё м№ҳлЈҢ-нҡЁкіј 분м„қм—җм„ң лҮҢмЎёмӨ‘ лҳҗлҠ” м „мӢ мғүм „мҰқмқҙ мҷҖнҢҢлҰ° лҢҖ비 21% к°җмҶҢн•ҳмҳҖлӢӨ. н•ҳм§Җл§Ң, лҰ¬л°”лЎқмӮ¬л°ҳмқҖ мҷҖнҢҢлҰ°кіј 비көҗн•ҳм—¬ н—ҲнҳҲлҮҢмЎёмӨ‘кіј мӮ¬л§қлҘ мқҖ к°җмҶҢмӢңнӮӨм§Җ лӘ»н•ҳмҳҖлӢӨ. мЈјмҡ” м¶ңнҳҲ л°ңмғқмқҖ мҷҖнҢҢлҰ°м—җ 비н•ҳм—¬ к°җмҶҢн•ҳмҳҖмңјл©° нҠ№нһҲ м¶ңнҳҲлҮҢмЎёмӨ‘кіј л‘җк°ңлӮҙ м¶ңнҳҲмқҖ мң мқҳн•ҳкІҢ к°җмҶҢн•ҳмҳҖлӢӨ. н•ҳм§Җл§Ң, мң„мһҘкҙҖмқҳ м¶ңнҳҲмқҖ мң мқҳлҜён•ң мҰқк°Җк°Җ мһҲм—ҲлӢӨ.4) м—җлҸ…мӮ¬л°ҳ
4) м—җлҸ…мӮ¬л°ҳ
2013л…„ л°ңн‘ңлҗң the effective anticoagulation with factor Xa next generation in atrial fibrillation-thrombolysis in myocardial infarction 48 (ENGAGE AF-TIMI 48) м—°кө¬лҠ” кі мҡ©лҹү(60 mg), м Җмҡ©лҹү(30 mg) нҲ¬м—¬кө°кіј мҷҖнҢҢлҰ° нҲ¬м—¬кө°мқ„ 비көҗн•ҳмҳҖлӢӨ. лӢӨл§Ң к°Ғ кі мҡ©лҹү, м Җмҡ©лҹүкө°м—җм„ң нҒ¬л Ҳм•„нӢ°лӢҢмІӯмҶҢмңЁ 30-50 mL/min, мІҙмӨ‘ вүӨ60 kg, лІ лқјнҢҢл°Җ(verapamil)мқҙлӮҳ нҖҙлӢҲл”ҳ(quinidine)кіј к°ҷмқҖ P-лӢ№лӢЁл°ұ(P-glycoprotein, P-gp)м–өм ңм ң лі‘мҡ© мӮ¬мҡ©мқҳ м„ёк°Җм§Җ мҡ©лҹү к°җлҹү кё°мӨҖмқ„ л°”нғ•мңјлЎң н•ҳлӮҳлқјлҸ„ н•ҙлӢ№н•ҳлҠ” нҷҳмһҗмқҳ кІҪмҡ°, мҡ©лҹүмқ„ м Ҳл°ҳмңјлЎң к°җлҹүн•ҳм—¬ нҲ¬м—¬н•ҳлҸ„лЎқ м„Өкі„н•ҳмҳҖлӢӨ[8]. к·ёлҹ¬н•ң кІ°кіј, м—җлҸ…мӮ¬л°ҳ 60 mg 1мқј 1нҡҢ нҲ¬м—¬кө°мқҖ мҷҖнҢҢлҰ° нҲ¬м—¬кө°м—җ 비н•ҙ лҮҢмЎёмӨ‘кіј м „мӢ мғүм „мҰқмқҙ 21% к°җмҶҢн•ҳмҳҖмңјл©° мЈјмҡ” м¶ңнҳҲ мӮ¬кұҙмқҖ 20% к°җмҶҢн•ҳмҳҖлӢӨ. м—җлҸ…мӮ¬л°ҳ 30 mg 1мқј 1нҡҢ нҲ¬м—¬кө°м—җм„ңлҠ” лҮҢмЎёмӨ‘кіј м „мӢ мғүм „мҰқмқҳ л°ңмғқмңЁмқҙ мҷҖнҢҢлҰ°м—җ 비н•ҙ м—ҙл“ұн•ҳм§Җ м•Ҡм•ҳмңјлӮҳ н—ҲнҳҲлҮҢмЎёмӨ‘л§ҢмңјлЎң н•ңм •н•ҳмҳҖмқ„ л•Ңм—җлҠ” мҷҖнҢҢлҰ°м—җ 비н•ҳм—¬ лҚ” лҶ’м•ҳлӢӨ. к·ёлҹ¬лӮҳ 30 mg нҲ¬м—¬кө°м—җм„ң м¶ңнҳҲмң„н—ҳмқҖ мҷҖнҢҢлҰ°м—җ 비н•ҳм—¬ 53% к°җмҶҢн•ҳмҳҖлӢӨ. мӢ¬нҳҲкҙҖкі„ кҙҖл Ё мӮ¬л§қ лҳҗн•ң, 60 mg 1мқј 1нҡҢ, 30 mg 1мқј 1нҡҢ нҲ¬м—¬кө° лӘЁл‘җ мҷҖнҢҢлҰ° нҲ¬м—¬кө°м—җ 비н•ҳм—¬ к°җмҶҢн•ҳмҳҖлӢӨ.мқҙлҹ¬н•ң 4к°Җм§Җ NOAC лӘЁл‘җ лҢҖк·ңлӘЁ л¬ҙмһ‘мң„ лҢҖмЎ°мӢңн—ҳм—җм„ң мҷҖнҢҢлҰ°кіј 비көҗн•ҳм—¬ нҸүк°Җлҗҳм—Ҳкі нҡЁкіјмҷҖ м•Ҳм „м„ұмқҙ мҰқлӘ…лҗҳм—ҲлӢӨ. ARISTOTLE, ROCKET-AF м—°кө¬м—җм„ңлҠ” кё°ліём ҒмңјлЎң м•„н”ҪмӮ¬л°ҳмқҖ 5 mg, лҰ¬л°”лЎқмӮ¬л°ҳмқҖ 20 mgмқ„ мЈјмҡ©лҹүмңјлЎң м—°кө¬лҗҳм—Ҳкі , нҷҳмһҗмқҳ нҠ№м„ұм—җ л”°лқј мҡ©лҹүмқ„ к°җлҹүн•ҳмҳҖмңјлӮҳ, м Җмҡ©лҹүкө°м—җ л°°м •лҗң нҷҳмһҗмқҳ мҲҳлҠ” мғҒлҢҖм ҒмңјлЎң м Ғм—ҲлӢӨ. RE-LYмҷҖ ENGAGE AF-TIMI 48 м—°кө¬м—җм„ңлҠ” н‘ңмӨҖмҡ©лҹүкіј м Җмҡ©лҹүкө°м—җ 충분н•ң нҷҳмһҗлҘј л°°м •н•ҳмҳҖлӢӨ. лӢӨл§Ң л‘җ м—°кө¬ мӨ‘, ENGAGE AF-TIMI 48 м—°кө¬м—җм„ңл§Ң мҡ©лҹү к°җмҶҢ кё°мӨҖмқ„ м Ғмҡ©н•ҳм—¬ мҷҖнҢҢлҰ°кіј 비көҗн•ҳмҳҖлӢӨ. мӢӨм ң мһ„мғҒнҳ„мһҘм—җм„ңлҠ” м¶ңнҳҲ л“ұм—җ лҢҖн•ң мҡ°л ӨлЎң к¶Ңкі мҡ©лҹүліҙлӢӨ м ҒкІҢ мӮ¬мҡ©лҗҳлҠ” кІҪмҡ°к°Җ нқ”н•ҳлӮҳ, мқҙ кІҪмҡ° лҮҢмЎёмӨ‘мқҳ л°ңмғқ к°ҖлҠҘм„ұмқ„ лҶ’мқҙкІҢ лҗҳлҜҖлЎң[9], л°ңн‘ңлҗң к°җлҹү кё°мӨҖм—җ к·јкұ°н•ҳм—¬ мҡ©лҹүмқ„ к°җлҹүн•ҳкі м •н•ҙ진 к¶Ңкі мҡ©лҹүм—җ л§һкІҢ мӮ¬мҡ©н•ҳлҠ” кІғмқҙ к¶ҢмһҘлҗңлӢӨ. нҳ„мһ¬ нҶөмҡ©лҗҳлҠ” NOACмқҳ к¶Ңкі мҡ©лҹү л°Ҹ мҡ©лҹү к°җмҶҢкё°мӨҖмқ„ Table 1м—җм„ң м ңмӢңн•ҳмҳҖлӢӨ.
- 2. м•Ҫл¬јмқҳ к°„лӢЁн•ң мһ‘мҡ© кё°м „кіј м•Ҫл¬ј мғҒнҳёмһ‘мҡ©
- 2. м•Ҫл¬јмқҳ к°„лӢЁн•ң мһ‘мҡ© кё°м „кіј м•Ҫл¬ј мғҒнҳёмһ‘мҡ©
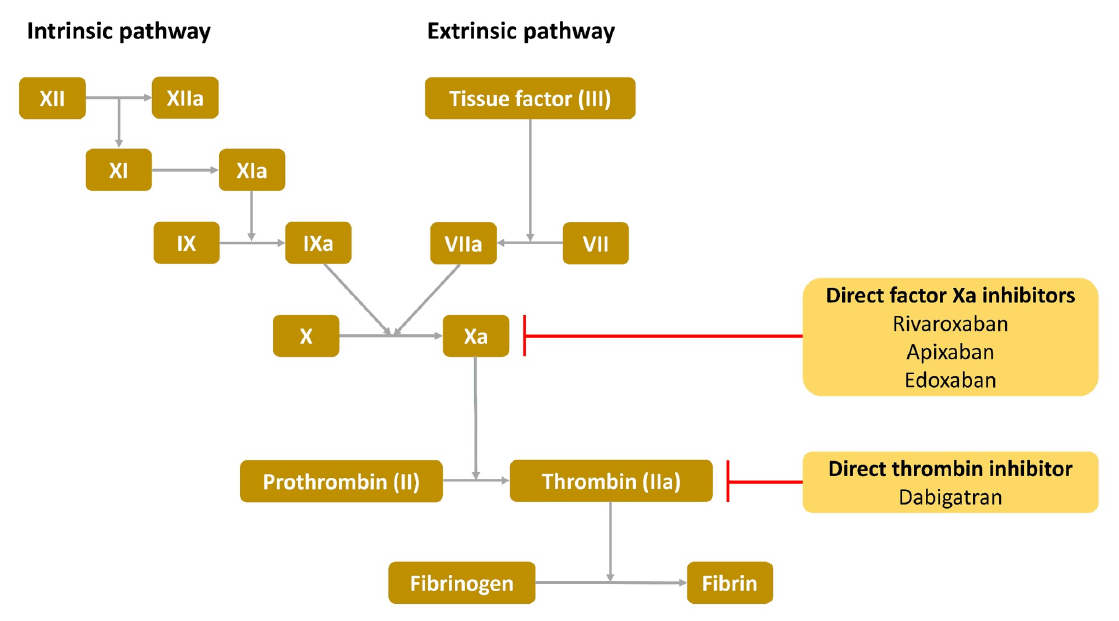
NOACмқҳ мһ‘мҡ©кё°м „мқҖ м§Ғм ‘ нҠёлЎ¬л№Ҳм–өм ңм ңмҷҖ мқ‘кі мқёмһҗXaм–өм ңм ңлЎң м„ңлЎң лӢӨлҘҙлӮҳ к¶Ғк·№м ҒмңјлЎңлҠ” нҠёлЎ¬л№Ҳмқ„ м–өм ңн•ҳлҠ”лҚ° мҙҲм җмқ„ л‘”лӢӨ. нҠёлЎ¬л№ҲмқҖ лӢӨкё°лҠҘ нҡЁмҶҢлЎңмҚЁ, 섬мң мҶҢмӣҗ(fibrinogen)мқ„ 섬мң мҶҢ(fibrin)лЎң м „нҷҳн•ҳкі , нҳҲмҶҢнҢҗмқ„ нҷңм„ұнҷ”мӢңнӮЁлӢӨ. лӢӨ비к°ҖнҠёлһҖмқҖ мқҙлҹ¬н•ң нҠёлЎ¬л№Ҳмқ„ кІҪмҹҒм ҒмңјлЎң м–өм ңн•ҳлҠ” к°Җм—ӯм Ғ 비нҺ©нғҖмқҙл“ң кёён•ӯм ңмқҙлӢӨ. мқҙлҹ¬н•ң нҠёлЎ¬л№Ҳм–өм ңм ңлҠ” нҠёлЎ¬л№Ҳм—җ мһ‘мҡ©н•ҳм—¬, 섬мң мҶҢмӣҗмқҙ 섬мң мҶҢлЎң м „нҷҳлҗҳлҠ” кІғмқ„ м–өм ңн•ңлӢӨ. лҰ¬л°”лЎқмӮ¬л°ҳ, м•„н”ҪмӮ¬л°ҳ, м—җлҸ…мӮ¬л°ҳмқҖ нҷңм„ұнҷ”лҗң мқ‘кі мқёмһҗXaм—җ лҢҖн•ң к°Җм—ӯм Ғ кёён•ӯм ңмқҙлӢӨ. мқ‘кі мқёмһҗXaлҠ” н”„лЎңнҠёлЎ¬л№Ҳ 분н•ҙнҡЁмҶҢ ліөн•©м ңмқҳ нҷңм„ұ м„ұ분мңјлЎң н”„лЎңнҠёлЎ¬л№Ҳ(prothrombin, factor II)м—җм„ң нҠёлЎ¬л№Ҳ(factor IIa)мңјлЎңмқҳ м „нҷҳмқ„ мҙүл§Өн•ңлӢӨ. мқ‘кі мқёмһҗXaм–өм ңм ңлҠ” мқ‘кі мқёмһҗXaм—җ мһ‘мҡ©н•ҳм—¬, нҠёлЎ¬л№Ҳмқҳ мғқм„ұмқ„ м–өм ңн•ңлӢӨ(Fig).мҷҖнҢҢлҰ°мқ„ мӮ¬мҡ©н•ҳлҠ” кІҪмҡ°лҠ” м—¬лҹ¬ мқҢмӢқкіј м•Ҫм ң к°„мқҳ мғҒнҳёмһ‘мҡ©мқ„ мӢ мӨ‘нһҲ кі л Өн•ҳм—¬м•ј н•ңлӢӨ. NOACлҠ” мҷҖнҢҢлҰ°м—җ 비н•ҳм—¬ мғҒлҢҖм ҒмңјлЎң мғҒнҳёмһ‘мҡ©мқҙ м Ғкё°лҠ” н•ҳм§Җл§Ң л°ҳл“ңмӢң лҸҷл°ҳ м•Ҫм ң л°Ҹ кё°м Җм§Ҳнҷҳм—җ лҢҖн•ҳм—¬ кі л Өн•ҳм—¬м•ј н•ңлӢӨ. мқҙлҘј нҶөн•ҙ нҠ№м„ұм—җ л§һлҠ” мІҳл°©мқ„ н•ҙм•ј н•ҳл©°, мқҙлҘј мң„н•ҙ NOACмқҳ лҢҖмӮ¬ л°Ҹ нқЎмҲҳкіјм •м—җ лҢҖн•ң м§ҖмӢқмқҙ л°ҳл“ңмӢң н•„мҡ”н•ҳл©° мқҙлҠ” Table 2м—җ м •лҰ¬н•ҳмҳҖлӢӨ. лҰ¬л°”лЎқмӮ¬л°ҳмқҖ лӢӨлҘё NOACмҷҖ лӢ¬лҰ¬ мқҢмӢқл¬јкіј н•Ёк»ҳ м„ӯм·Ён•ҳм—¬м•ј н•ңлӢӨ. лӢӨ비к°ҖнҠёлһҖмқҳ кІҪмҡ° м–‘м„ұмһҗнҺҢн”„м Җн•ҙм ңлӮҳ H2м°ЁлӢЁм ңмҷҖ к°ҷмқҖ м ңмӮ°м ңмҷҖ н•Ёк»ҳ ліөмҡ© мӢң мғқмІҙ мқҙмҡ©лҘ мқҙ 12-30%к№Ңм§Җ к°җмҶҢлҗңлӢӨкі ліҙкі лҗҳм—ҲмңјлӮҳ мһ„мғҒм Ғ нҡЁкіјмқҳ м°ЁмқҙлҠ” м—Ҷм—ҲлӢӨ[10]. 비мң„кҙҖмқ„ нҶөн•ң 분л§җнҳ•нғңмқҳ нҲ¬м•ҪмӢңм—җ лҰ¬л°”лЎқмӮ¬л°ҳ, м•„н”ҪмӮ¬л°ҳ, м—җлҸ…мӮ¬л°ҳмқҳ мғқмІҙмқҙмҡ©мңЁм—җлҠ” м°Ёмқҙк°Җ м—Ҷм—ҲлӢӨ. лӢӨл§Ң, лӢӨ비к°ҖнҠёлһҖмқҖ мәЎмҠҗ м ңм ңмқҙл©°, мәЎмҠҗмқ„ м ңкұ°н•ң нӣ„ нҲ¬м—¬мӢңм—җлҠ” мғқмІҙ мқҙмҡ©лҘ мқҙ м•Ҫ 75% к°Җлҹү мҰқк°Җн•ҳлҠ” кІғмңјлЎң м•Ңл Өм ё мһҲм–ҙ, мәЎмҠҗмқ„ м ңкұ°н•ҳм—¬ нҲ¬м—¬н•ҳлҠ” кІғмқҖ к¶Ңкі лҗҳкі мһҲм§Җ м•ҠлӢӨ[11].лҸҷл°ҳ м•Ҫм ңмҷҖ NOACмқҳ мғҒнҳёмһ‘мҡ©мқҖ мң„мһҘкҙҖм—җм„ң нқЎмҲҳлҗң л’Ө P-gpлҘј нҶөн•ң мһ¬л¶„л°°кіјм •кіј кҙҖл Ёмқҙ мһҲлӢӨ. лҳҗн•ң P-gpлҠ” мӢ мһҘмқ„ нҶөн•ң NOACмқҳ л°°м„Өм—җлҸ„ кҙҖм—¬н•ңлӢӨ. P-gp лҢҖмӮ¬кіјм •мқҳ кІҪмҹҒм Ғмқё м–өм ңлҠ” NOACмқҳ нҳҲмӨ‘ лҶҚлҸ„лҘј мҰқк°ҖмӢңнӮӨкІҢ лҗҳл©°, NOACлҘј к°ҖмһҘ л§Һмқҙ мӮ¬мҡ©н•ҳлҠ” мқҙмң мқё мӢ¬л°©м„ёлҸҷ нҷҳмһҗм—җм„ң мӮ¬мҡ©н•ҳлҠ” м•Ҫм ң мӨ‘ мғҒлӢ№мҲҳк°Җ P-gpм–өм ңм ңмқҙлӢӨ(м•„лҜёмҳӨлӢӨлЎ , лІ лқјнҢҢл°Җ, л“ңлЎңл„ӨлӢӨлЎ , нҖҙлӢҲл”ҳ л“ұ). лҰ¬л°”лЎқмӮ¬л°ҳкіј м•„н”ҪмӮ¬л°ҳмқҖ к°„мқҳ CYP3A4 нҳ•мқҳ мӮ¬мқҙнҶ нҒ¬лЎ¬ P450кі„(cytochrome P450 system)лҘј нҶөн•ҳм—¬ лҢҖмӮ¬к°Җ лҗңлӢӨ. CYP3A4лҘј м–өм ңмӢңнӮӨлҠ” м•Ҫл¬јмқҖ лҰ¬л°”лЎқмӮ¬л°ҳ, м•„н”ҪмӮ¬л°ҳмқҳ нҳҲмӨ‘ лҶҚлҸ„лҘј мҰқк°ҖмӢңнӮ¬ мҲҳ мһҲмңјл©° л°ҳлҢҖлЎң, мң лҸ„н•ҳлҠ” м•Ҫл¬јмқҖ к°җмҶҢмӢңнӮ¬ мҲҳ мһҲлӢӨ. кІ°лЎ м ҒмңјлЎң к°•л Ҙн•ң P-gpм–өм ңм ңлӮҳ CYP3A4м–өм ңм ңлҠ” NOACмқҳ нҳҲмӨ‘лҶҚлҸ„лҘј мҳ¬лҰҙ мҲҳ мһҲкі , л°ҳлҢҖлЎң к°•л Ҙн•ң P-gpмң лҸ„м ңлӮҳ CYP3A4мң лҸ„м ңлҠ” нҳҲмӨ‘ лҶҚлҸ„лҘј лӮ®м¶ң мҲҳ мһҲм–ҙ мқҙлҹ¬н•ң кІҪн–Ҙмқ„ к°Җ진 м•Ҫм ңмҷҖмқҳ лі‘мҡ©мқҖ мЈјмқҳлҘј мҡ”н•ңлӢӨ. NOACм—җ лҸҷл°ҳн•ҳм—¬ нқ”нһҲ мӮ¬мҡ©лҗҳлҠ” м•„нҶ лҘҙл°”мҠӨнғҖнӢҙ(atorvastatin)мқҖ P-gp кІҪмҹҒм ңмқҙмһҗ CYP3A4м–өм ңм ңмқҙлӮҳ мӢӨм ң atorvastatinмқҳ лі‘мҡ©нҲ¬м—¬лҘј н•ҳм—¬лҸ„ м¶ңнҳҲкІҪн–ҘмқҖ мҰқк°Җн•ҳм§Җ м•ҠлҠ” кІғмңјлЎң ліҙкі лҗҳм–ҙ мһҲлӢӨ[12]. м•Ҫл¬ј мғҒнҳё мһ‘мҡ©кіј кҙҖл Ён•ҳм—¬ NOACмқҳ лҶҚлҸ„м—җ мҳҒн–Ҙмқ„ лҜём№ мҲҳ мһҲлҠ” м•Ҫл¬јлЎң мң лҹҪмӢ¬мһҘн•ҷнҡҢм—җм„ң м ңмӢңн•ҳлҠ” лӮҙмҡ©мқ„ Table 3м—җ м •лҰ¬н•ҳмҳҖлӢӨ[11].л§Ҳм§Җл§үмңјлЎң, лҮҢмЎёмӨ‘мқҖ л…ёмқём—җм„ң мӨ‘мҡ”н•ң мҰқмғҒлҮҢм „мҰқмқҳ мӣҗмқё мӨ‘мқҳ н•ҳлӮҳлЎң мӢ¬л°©м„ёлҸҷм—җ мқҳн•ң лҮҢкІҪмғүкіј мҰқмғҒлҮҢм „мҰқмқҙ мһҲлҠ” кІҪмҡ°, NOACмҷҖ н•ӯкІҪл Ём ңмқҳ лҸҷмӢң мӮ¬мҡ©мқҙ н•„мҡ”н• мҲҳ мһҲлӢӨ. м•Ҫл¬јмғҒнҳёмһ‘мҡ©м—җ мқҳн•ҳм—¬, NOACмқҳ лҶҚлҸ„лҘј мҰқк°ҖмӢңнӮ¬ мҲҳ мһҲлҠ” н•ӯкІҪл Ём ңмҷҖмқҳ лҸҷмӢңмӮ¬мҡ©мқҖ кІҪл Ё мӢң лӮҷмғҒ л“ұм—җ мқҳн•ң мҷёмғҒм„ұлҮҢм¶ңнҳҲмқҳ мң„н—ҳмқ„ мҰқк°ҖмӢңнӮ¬ мҲҳ мһҲмңјл©°, NOACмқҳ лҶҚлҸ„лҘј к°җмҶҢмӢңнӮ¬ мҲҳ мһҲлҠ” н•ӯкІҪл Ём ңлҠ” н—ҲнҳҲлҮҢмЎёмӨ‘мқҳ мң„н—ҳмқ„ мҰқк°ҖмӢңнӮ¬ мҲҳ мһҲлӢӨ. л”°лқјм„ң NOACмқҳ м•Ҫл¬ј лҶҚлҸ„м—җ мҳҒн–Ҙмқ„ мӨ„ мҲҳ мһҲлҠ” н•ӯкІҪл Ём ңмқҳ мӮ¬мҡ©мқҖ мЈјмқҳк°Җ н•„мҡ”н•ҳлӢӨ. нҳ„мһ¬к№Ңм§Җ мқҙмҷҖ кҙҖл Ён•ҳм—¬ лҢҖк·ңлӘЁ м—°кө¬лҠ” 진н–үлҗң л°” м—ҶлӢӨ. лӢӨл§Ң, к°„нҡЁмҶҢлҘј мң лҸ„мӢңнӮӨлҠ” м№ҙл°”л§Ҳм ңн•Җ, нҺҳ노바비нғҲ, нҺҳлӢҲнҶ мқё, н”„лҰ¬лҜёлҸҲмқҙлӮҳ кІҪн•ҳкІҢ мң лҸ„мӢңнӮӨлҠ” мҳҘмҠӨм№ҙл°”м ңн•Җ, лқјлӘЁнҠёлҰ¬м§„ л“ұмқҖ NOACмқҳ лҶҚлҸ„лҘј к°җмҶҢмӢңнӮ¬ мҲҳ мһҲм–ҙ мЈјмқҳлҘј мҡ”н•ңлӢӨ. нҠ№нһҲ м№ҙл°”л§Ҳм ңн•ҖмқҖ лӢӨ비к°ҖнҠёлһҖмқҳ лҶҚлҸ„лҘј 29%, м•„н”ҪмӮ¬л°ҳмқҳ лҶҚлҸ„лҘј 50% м •лҸ„ к°җмҶҢмӢңнӮЁлӢӨкі м•Ңл Өм ё мһҲлӢӨ[11]. лҳҗн•ң, л°ңн”„лЎңмӮ°мқҖ CYP3A4м—җ лҢҖн•ң мҳҒн–Ҙмқҙ мҳҲмёЎн•ҳкё°к°Җ нһҳл“Өм–ҙ NOACмқҳ лҶҚлҸ„м—җ лҜём№ҳлҠ” мҳҒн–Ҙ лҳҗн•ң мҳҲмёЎмқҙ м–ҙл ӨмӣҢ лҸҷл°ҳ мӮ¬мҡ©мӢң мқҙ м җмқ„ кі л Өн•ҳм—¬м•ј н•ңлӢӨ[13]. к·ё мҷём—җ м№ҙл°”л§Ҳм ңн•Җ, л ҲлІ нӢ°лқјм„ёнғҗ, нҺҳ노바비нғҲ, нҺҳлӢҲнҶ мқёмқҖ P-gpмң лҸ„м ңлЎңм„ң, NOACмқҳ лҶҚлҸ„лҘј лӮ®м¶ң мҲҳ мһҲлӢӨ. P-gpлӮҳ CYP3A4мқҳ мғҒлҢҖм ҒмңјлЎң м ҒмқҖ кІғмңјлЎң м•Ңл Ө진 лқјмҪ”мӮ¬л§Ҳмқҙл“ң, мЎ°лӢҲмӮ¬л§Ҳмқҙл“ң, н”„лҰ¬к°Җл°ңлҰ°, к°Җл°”нҺңнӢҙ, м—җнҶ мҲҷ мӢңл§Ҳмқҙл“ң л“ұмқҖ к·јкұ°лҠ” л¶ҖмЎұн•ҳлӮҳ, кё°м „ мғҒ NOACмҷҖмқҳ мғҒнҳёмһ‘мҡ©мқҙ м Ғм–ҙ, лҸҷл°ҳ мӮ¬мҡ© мӢң мҡ°м„ м ҒмңјлЎң кі л Өн• мҲҳ мһҲлҠ” м•Ҫл¬јмқҙлӢӨ[14].- 3. н—ҲнҳҲлҮҢмЎёмӨ‘ нҷҳмһҗм—җкІҢ м•Ҫл¬ј нҲ¬м—¬мӢңкё°
- 3. н—ҲнҳҲлҮҢмЎёмӨ‘ нҷҳмһҗм—җкІҢ м•Ҫл¬ј нҲ¬м—¬мӢңкё°
1) м—ӯм „м ң(reversal agent)
1) м—ӯм „м ң(reversal agent)
4к°Җм§Җ NOAC м—°кө¬м—җм„ңлҠ” NOACк°Җ 비нғҖлҜј K кёён•ӯм ңм—җ 비н•ҙ м¶ңнҳҲлҮҢмЎёмӨ‘кіј мғқлӘ…мқ„ мң„нҳ‘н•ҳлҠ” мЈјмҡ” м¶ңнҳҲмқҙ к°җмҶҢлҗЁмқ„ ліҙмҳҖлӢӨ. лҳҗн•ң мғқлӘ…мқ„ мң„нҳ‘н•ҳлҠ” мЈјмҡ” м¶ңнҳҲмқ„ кІӘмқҖ нҷҳмһҗм—җм„ңлҸ„ NOACлҠ” 비нғҖлҜј K кёён•ӯм ңм—җ 비н•ҳм—¬ м „л°ҳм Ғмқё мӮ¬л§қлҘ мқҙ к°җмҶҢн•ҳмҳҖлӢӨ. н•ҳм§Җл§Ң, кі л №мқёкө¬мқҳ мҰқк°ҖлЎң мқён•ң мӢ¬л°©м„ёлҸҷмқҳ л°ңлі‘лҘ мқҳ мҰқк°ҖмҷҖ лҮҢмЎёмӨ‘ нҷҳмһҗмқҳ мҰқк°ҖлҘј кі л Өн•ҳл©ҙ NOACмқҳ мӮ¬мҡ©мқҖ м җм җ лҠҳм–ҙлӮ кІғмқҙл©°, мқҙм—җ л”°лҘё м¶ңнҳҲ л¶Җмһ‘мҡ© лҳҗн•ң мҰқк°Җн• кІғмңјлЎң мҳҲмғҒлҗңлӢӨ. л”°лқјм„ң NOACлҘј мӮ¬мҡ©н•ҳл©ҙм„ң л°ңмғқн•ң м¶ңнҳҲнҷҳмһҗм—җ лҢҖн•ң м Ғм Ҳн•ң м „лһөмқҖ л°ҳл“ңмӢң н•„мҡ”н•ҳлӢӨ. мғқлӘ…мқ„ мң„нҳ‘н•ҳлҠ” мӨ‘лҢҖн•ң м¶ңнҳҲм—җ лҢҖн•ҳм—¬ м—ӯм „м ңмқҳ к°ңл°ң м „м—җлҠ” н”„лЎңнҠёлЎ¬л№Ҳ ліөн•©м ң л“ұмқҳ нҲ¬м—¬ л°©лІ• л°–м—җлҠ” м—Ҷм—ҲлӢӨ. н•ҳм§Җл§Ң, нҳ„мһ¬ 2к°Җм§Җмқҳ м—ӯм „м ңк°Җ к°ңл°ңлҗҳм—Ҳмңјл©°, мқҙлҹ¬н•ң м—ӯм „м ңлҠ” мӨ‘лҢҖн•ң м¶ңнҳҲмқҳ л°ңмғқ мӢң лҸ„мӣҖмқҙ лҗ мҲҳ мһҲлӢӨ.2) Idarucizumab [21]
2) Idarucizumab [21]
REVERSE-AD м—°кө¬лҠ” лӢӨ비к°ҖнҠёлһҖмқ„ ліөмҡ©мӨ‘мқё нҷҳмһҗм—җм„ң мғқлӘ…мқ„ мң„нҳ‘н•ҳлҠ” мӨ‘лҢҖн•ң м¶ңнҳҲмқҙлӮҳ, мқ‘кёүмҲҳмҲ мқҙ н•„мҡ”н• л•Ң м—ӯм „м ңмқё idarucizumabмқҳ нҡЁкіјлҘј ліё м—°кө¬мқҙлӢӨ. лӢӨ비к°ҖнҠёлһҖмқҳ н•ӯмқ‘кі нҷңм„ұмқҖ idarucizumab нҲ¬м—¬ лҸ„мӨ‘ мҰүмӢң м–өм ңк°Җ мқҙлЈЁм–ҙмЎҢмңјл©°, мӨ‘лҢҖн•ң л¶Җмһ‘мҡ©мқҖ нҷ•мқёлҗҳм§Җ м•Ҡм•ҳлӢӨ. мҡ©лІ•мңјлЎңлҠ” мҙқ 5 gмқҳ idarucizumabмқ„ л‘җлІҲмңјлЎң лӮҳлҲ„м–ҙ к°Ғк°Ғ 2.5 gм”© м •л§Ҙ лӮҙ м җм Ғ мЈјмӮ¬н•ҳл©°, мқҙл•Ң л‘җ лІҲмқҳ мЈјмӮ¬лҠ” 15분 мқҙлӮҙмқҳ к°„кІ©мңјлЎң нҲ¬м—¬н•ҳмҳҖлӢӨ. кіјлӢӨ ліөмҡ© лҳҗлҠ” мӢ кё°лҠҘ м Җн•ҳ нҷҳмһҗмқҳ кІҪмҡ° лӢӨ비к°ҖнҠёлһҖмқҙ мҷ„м „нһҲ мӨ‘нҷ”лҗҳм§Җ м•Ҡмқ„ мҲҳ мһҲм–ҙ мһ„мғҒмҰқмғҒ л°Ҹ нҳҲм•ЎкІҖмӮ¬ нҶөн•ң кҙҖм°°мқҙ н•„мҡ”н•ҳл©° нҷҳмһҗмғҒнғңк°Җ м•Ҳм •лҗҳм—ҲлӢӨл©ҙ 24мӢңк°„ мқҙнӣ„ лӢӨ비к°ҖнҠёлһҖмқ„ мӢңмһ‘н• мҲҳ мһҲлӢӨ.3) Andexanet alfa [22]
3) Andexanet alfa [22]
Andexanet alfaлҠ” лҰ¬л°”лЎқмӮ¬л°ҳ, м•„н”ҪмӮ¬л°ҳ, м—җлҸ…мӮ¬л°ҳ к°ҷмқҖ мқ‘кі мқёмһҗ Xaм–өм ңм ңмқҳ м—ӯм „м ңмқҙлӢӨ. мҡ©лІ•мқҖ NOACмқҳ мў…лҘҳмҷҖ л§Ҳм§Җл§ү ліөмҡ© нӣ„ мӢңк°„м—җ л”°лқј лӢӨлҘҙлӢӨ. лҰ¬л°”лЎқмӮ¬л°ҳ(м—ӯм „ мӢңлҸ„ м „ л§Ҳм§Җл§ү ліөмҡ©мқҙ 7мӢңк°„мқҙ л„ҳмқ„ кІҪмҡ°) лҳҗлҠ” м•„н”ҪмӮ¬л°ҳмқҳ кІҪмҡ° 400 mgмқҳ мҙҲкё° нҲ¬м—¬мҷҖ 480 mgмқҳ мң м§Җ мҡ©лҹү(4 mg/min)мқҙ нҲ¬м—¬лҗңлӢӨ. лҰ¬л°”лЎқмӮ¬л°ҳмқҳ л§Ҳм§Җл§ү ліөмҡ© мӢңк°„мқҙ 7мӢңк°„ лҜёл§Ңмқҙкұ°лӮҳ м•Ң мҲҳ м—ҶлҠ” кІҪмҡ° л°Ҹ м—җлҸ…мӮ¬л°ҳмқҳ кІҪмҡ° 800 mgмқҳ мҙҲкё° нҲ¬м—¬мҷҖ 960 mgмқҳ мң м§Җ мҡ©лҹү(8 g/min)мқҙ нҲ¬м—¬лҗңлӢӨ. 2019л…„ andexanet alfaмҷҖ кҙҖл Ён•ҳм—¬, ANNEXA-4 м—°кө¬к°Җ л°ңн‘ңлҗҳм—ҲлӢӨ. Andexanet alfaлҘј нҲ¬м—¬ нӣ„ anti-factor Xa нҷңм„ұмқҙ м ҖлӘ…н•ҳкІҢ к°җмҶҢлҗҳм—Ҳмңјл©°, 82%мқҳ нҷҳмһҗм—җм„ң нҲ¬м—¬ 12мӢңк°„ мқҙлӮҙм—җ нӣҢлҘӯн•ң м§ҖнҳҲ нҡЁкіјлҘј ліҙм—¬мЈјм—ҲлӢӨ. Andexanet alfaлҠ” лҜёкөӯм—җм„ңлҠ” мҠ№мқёмқҙ лҗҳм—ҲмңјлӮҳ, көӯлӮҙ мҠ№мқёмқҖ м•„м§Ғ мқҙлЈЁм–ҙм§Җм§Җ м•ҠмқҖ мғҒнғңлЎң мһ„мғҒнҳ„мһҘм—җм„ң мӮ¬мҡ©мқҙ л¶Ҳк°ҖлҠҘн•ҳлӢӨ.
мӢ¬л°©м„ёлҸҷм—җ мқҳн•ң лҮҢкІҪмғү мқҙнӣ„ мҙҲкё° 14мқј мқҙлӮҙмқҳ лҮҢкІҪмғүмқҳ мһ¬л°ңмңЁмқҖ 0.5-1.3%лЎң ліҙкі к°Җ лҗҳкі мһҲмңјл©°, мқҙлҹ¬н•ң мһ¬л°ң к°ҖлҠҘм„ұмқ„ лӮ®м¶”кё° мң„н•ҳм—¬ н•ӯмқ‘кі м ңмқҳ мӮ¬мҡ©мқҙ н•„мҡ”н•ҳлӢӨ[15]. н•ҳм§Җл§Ң, мҙҲкё° н•ӯмқ‘кі м ңмқҳ мӮ¬мҡ©мқҖ лҮҢм¶ңнҳҲкіј м¶ңнҳҲліҖнҷҳмқҳ мң„н—ҳмқ„ мҰқк°ҖмӢңнӮ¬ мҲҳ мһҲлӢӨ. мӢ¬л°©м„ёлҸҷм—җ мқҳн•ң мғүм „м—җ мқҳн•ҙ л§үнһҢ нҳҲкҙҖмқҖ мў…мў… мһҗм—°мҠӨлҹ¬мҡҙ мһ¬к°ңнҶөмқҳ кіјм •мқ„ кІӘлҠ”лӢӨкі м•Ңл Өм ё мһҲлӢӨ. мқҙлҹ¬н•ң мһ¬к°ңнҶөмқҳ кіјм •мқҖ 50% нҷҳмһҗм—җм„ң 6-24мӢңк°„мқҙлӮҙм—җ мқјм–ҙлӮҳл©°, мқҙлҠ” м¶ңнҳҲліҖнҷҳмқҳ л°ңмғқкіј мң мқҳн•ҳкІҢ м—°кҙҖмқҙ мһҲм—ҲлӢӨ[16]. л”°лқјм„ң мҙҲкё° н•ӯмқ‘кі м ңмқҳ мӮ¬мҡ©мқҙ м¶ңнҳҲліҖнҷҳмңјлЎң мқҙм–ҙм§Ҳ к°ҖлҠҘм„ұ л•Ңл¬ём—җ лҮҢкІҪмғүмҳҲл°©мқ„ мң„н•ң мЎ°кё° н•ӯмқ‘кі м ң мӮ¬мҡ©м—җ лҢҖн•ҳм—¬лҠ” м•„м§Ғ л…јлһҖмқҙ мһҲлӢӨ. м•Ҫл¬ј нҲ¬м—¬мӢңкё°м—җ лҢҖн•ң лҢҖк·ңлӘЁ л¬ҙмһ‘мң„ лҢҖмЎ°мӢңн—ҳмқҙ м—Ҷм–ҙ мқҙм—җ лҢҖн•ң м •нҷ•н•ң к°Җмқҙл“ңлқјмқёмқҖ нҳ„мһ¬ м—ҶлҠ” мӢӨм •мқҙл©°, NIH лҮҢмЎёмӨ‘мІҷлҸ„м—җ л”°лқј м•Ҫл¬ј нҲ¬м—¬ мӢңкё°лҘј кІ°м •н•ҳлҸ„лЎқ н•ң мҶҢмң„ 1-3-6-12 days ruleлЎң л¶ҲлҰ¬лҠ” 2013л…„ European heart rhythm association (EHRA)мқҳ кё°мӨҖмқҙ нҶөмҡ©лҗҳкі мһҲмңјл©°, 2016 мң лҹҪ лҮҢмЎёмӨ‘н•ҷнҡҢм—җм„ңлҠ” мһ‘мқҖ нҒ¬кё°мқҳ мһ„мғҒмҰқмғҒмқҙ кІҪн•ң лҮҢкІҪмғүмқҖ лҮҢкІҪмғү л°ңмғқ 4мқјм§ё, мӨ‘к°„ нҒ¬кё°мқҳ мһ„мғҒмҰқмғҒмқҙ мӨ‘л“ұлҸ„мқё лҮҢкІҪмғүмқҳ кІҪмҡ°лҠ” 7мқјм§ё, лҮҢкІҪмғүмқҳ нҒ¬кё°к°Җ нҒ¬кі , мһ„мғҒмҰқмғҒмқҙ мӢ¬н•ң лҮҢкІҪмғүмқҖ 14мқјм§ём—җ н•ӯмқ‘кі м№ҳлЈҢмқҳ мӢңмһ‘мқ„ к¶Ңкі н•ҳмҳҖлӢӨ[17].2020л…„ к°ңм •лҗң мң лҹҪ мӢ¬мһҘн•ҷнҡҢмқҳ к°Җмқҙл“ңлқјмқём—җм„ңлҠ” 1-3-6-12 days ruleмқҳ к¶Ңкі мӮ¬н•ӯмқҙ мӮӯм ңлҗҳкі лӢЁмҲңнҷ”лҗҳм–ҙ, лҮҢмЎёмӨ‘ л°ңмғқ 2мЈј мқҙлӮҙм—җ н•ӯмқ‘кі м ңлҘј мӮ¬мҡ©н•ҳлҠ” кІғмқ„ к¶Ңкі н•ҳкі мһҲлӢӨ[18]. лӢӨл§Ң көӯлӮҙм—җм„ң нӣ„н–Ҙм ҒмңјлЎң 진н–үлҗң м—°кө¬м—җм„ң кё°мЎҙ мң лҹҪмӢ¬мһҘн•ҷнҡҢмқҳ к°Җмқҙл“ңлқјмқём—җ л”°лқј н•ӯмқ‘кі м ңлҘј нҲ¬м—¬н•ҳмҳҖмқ„ л•Ң к·ёл Үм§Җ м•ҠмқҖ нҷҳмһҗл“Өм—җ 비н•ҳм—¬ ліҙлӢӨ мўӢмқҖ мһ„мғҒкІ°кіјлҘј ліҙмҳҖкё°м—җ мӢңмһ‘мӢңм җмқ„ кІ°м •н•ҳлҠ” лҚ° м°ёкі н• мҲҳлҠ” мһҲмқ„ кІғмқҙлӢӨ[19]. 2021л…„ лҜёкөӯ лҮҢмЎёмӨ‘н•ҷнҡҢмқҳ к°Җмқҙл“ңлқјмқём—җм„ңлҠ” кҙ‘лІ”мң„н•ң лҮҢкІҪмғү лі‘ліҖмқ„ к°Җ진 нҷҳмһҗм—җм„ңлҠ” м¶ңнҳҲліҖнҷҳ л°Ҹ лҮҢм¶ңнҳҲмқҳ мң„н—ҳмқ„ кі л Өн•ҳм—¬ лҮҢкІҪмғү л°ңмғқ 14мқј мқҙнӣ„ н•ӯмқ‘кі м ңмқҳ нҲ¬м—¬лҘј к¶Ңкі н•ҳмҳҖлӢӨ. м—¬кё°м„ң кҙ‘лІ”мң„н•ң лҮҢкІҪмғүмқҙлһҖ NIHлҮҢмЎёмӨ‘мІҷлҸ„>15, лҸҷл§ҘмҳҒм—ӯ м „мІҙ(complete arterial territory)лі‘ліҖ лҳҗлҠ” 2к°ң мқҙмғҒмқҳ лӢӨл°ңм„ұ лҸҷл§Ҙ мҳҒм—ӯмқҳ лі‘ліҖмқё кІҪмҡ°лЎң м •мқҳн•ҳмҳҖлӢӨ[2].мң„ л‘җ к°Җмқҙл“ңлқјмқё лӘЁл‘җ лі‘ліҖмқҳ нҒ¬кё°к°Җ м»ёмқ„ л•Ңм—җлҠ” м¶ңнҳҲліҖнҷҳ л°Ҹ лҮҢм¶ңнҳҲмқҳ мң„н—ҳм„ұ л•Ңл¬ём—җ лҮҢкІҪмғү мҙҲкё°мқҳ н•ӯмқ‘кі м ң м№ҳлЈҢлҠ” к¶Ңкі н•ҳм§Җ м•Ҡкі мһҲлӢӨ. көӯлӮҙм—җм„ң мҲҳн–үлҗң Triple Axel м—°кө¬м—җм„ңлҠ” лҮҢ лі‘ліҖмқҳ нҒ¬кё°к°Җ мһ‘мқҖ лҮҢкІҪмғү нҷҳмһҗлҘј лҢҖмғҒмңјлЎң лҮҢкІҪмғү л°ңмғқ 5мқј мқҙлӮҙ лҰ¬л°”лЎқмӮ¬л°ҳкіј мҷҖнҢҢлҰ°(лӘ©н‘ң INR 2-3)мқ„ нҲ¬м—¬н•ң л‘җ кө°м—җм„ң нҲ¬м—¬ 30мқјм§ёмқҳ мғҲлЎңмҡҙ лҮҢкІҪмғү лі‘ліҖ лҳҗлҠ” лҮҢм¶ңнҳҲмқҳ л°ңмғқмқ„ 비көҗн•ҳмҳҖлӢӨ. мғҲлЎңмҡҙ н—ҲнҳҲ лі‘ліҖмқҳ л°ңмғқмқҖ лҰ¬л°”лЎқмӮ¬л°ҳ кө°м—җм„ң 29.5%, мҷҖнҢҢлҰ°кө°м—җм„ң 35.6%мҳҖмңјл©°, мғҲлЎңмҡҙ м¶ңнҳҲмқҖ лҰ¬л°”лЎқмӮ¬л°ҳкө°м—җм„ң 31.6%, мҷҖнҢҢлҰ°кө°м—җм„ң 28.7%лЎң л‘җ кө°м—җм„ң мң мқҳн•ң м°ЁмқҙлҠ” м—Ҷм—ҲлӢӨ[20]. лҳҗн•ң, л°ңмғқн•ң лҮҢм¶ңнҳҲ лӘЁл‘җ л¬ҙмҰқмғҒ лі‘ліҖмқҙм—ҲлӢӨ. мқҙлҘј л°”нғ•мңјлЎң лі‘ліҖмқҳ нҒ¬кё°к°Җ мһ‘мқ„ кІҪмҡ°, н•ӯмқ‘кі м ңмқҳ мЎ°кё° нҲ¬м—¬лҘј кі л Өн• мҲҳ мһҲмқ„ кІғмңјлЎң ліҙмқёлӢӨ.кіјкұ° лҮҢкІҪмғү л°ңмғқ мқҙнӣ„ н•ӯмқ‘кі м ңмқҳ мЎ°кё° нҲ¬м—¬ мӢң, лҮҢм¶ңнҳҲкіј м¶ңнҳҲліҖнҷҳмқҙ мң мқҳн•ҳкІҢ мҰқк°Җн•ҳмҳҖлҚҳ м—°кө¬л“ӨмқҖ мҷҖнҢҢлҰ° лҳҗлҠ” н—ӨнҢҢлҰ°мқ„ мӮ¬мҡ©н•ң м—°кө¬мҳҖлӢӨ. NOACлҠ” мҷҖнҢҢлҰ°м—җ 비н•ҳм—¬ м¶ңнҳҲмӮ¬кұҙмқҳ л°ңмғқм—җ мқҙл“қмқҙ мһҲлҠ” м•Ҫл¬јлЎңм„ң, н–Ҙнӣ„ мӢ¬л°©м„ёлҸҷм—җ мқҳн•ң лҮҢкІҪмғү нҷҳмһҗм—җм„ң NOACлҘј мқҙмҡ©н•ң м Ғм Ҳн•ң н•ӯмқ‘кі м ңмқҳ мӮ¬мҡ©мӢңкё°м—җ лҢҖн•ң м—°кө¬к°Җ н•„мҡ”н•ҳлӢӨ. нҳ„мһ¬ мқҙмҷҖ кҙҖл Ён•ҳм—¬ ELAN (NCT03148457; Switzerland), OPTIMAS (EudraCT, 2018-003859-38; UK), TIMING (NCT02961348; Sweden), START (NCT03021928; USA)л“ұмқҳ м—°кө¬к°Җ 진н–үлҗҳкі мһҲм–ҙ н–Ҙнӣ„ кІ°кіјлҘј мЈјлӘ©н• н•„мҡ”к°Җ мһҲлӢӨ.- 4. нҠ№мҲҳн•ң мғҒнҷ©л“Ө
- 4. нҠ№мҲҳн•ң мғҒнҷ©л“Ө
1) мҲҳмҲ л°Ҹ мӢңмҲ (procedure/surgery)
1) мҲҳмҲ л°Ҹ мӢңмҲ (procedure/surgery)
мӢӨм ң мһ„мғҒм—җм„ң мҲҳмҲ кіј кҙҖл Ён•ң NOACмқҳ мӨ‘лӢЁмқҖ мӢ кІҪкіјлЎң нқ”н•ҳкІҢ нҳ‘진мқҙ мқҳлў°лҗҳлҠ” мӮ¬н•ӯ мӨ‘мқҳ н•ҳлӮҳмқҙлӢӨ. NOACмқҳ мӨ‘лӢЁкё°к°„мқҙ л„Ҳл¬ҙ кёё кІҪмҡ° лҮҢкІҪмғүмқҳ мң„н—ҳмқҖ мҰқк°Җн•ҳл©°, NOACмқҳ мӨ‘лӢЁкё°к°„мқҙ л„Ҳл¬ҙ 짧мқ„ кІҪмҡ° мҲҳмҲ м „нӣ„ мӢңкё°мқҳ м¶ңнҳҲ л¶Җмһ‘мҡ©мқҙ л°ңмғқн• мң„н—ҳм„ұмқ„ лҶ’м—¬ н–Ҙнӣ„ н•ӯмқ‘кі м№ҳлЈҢмқҳ мӢңмһ‘мӢңм җмқ„ лҠҰ추кІҢ л§Ңл“Ө мҲҳ мһҲлӢӨ. мҲҳмҲ м „ мҷҖнҢҢлҰ° мӨ‘лӢЁ мӢңм—җлҠ” н—ӨнҢҢлҰ° м—°кІ°(bridging) мҡ”лІ•мқҙ мў…мў… мӮ¬мҡ©лҗҳм—ҲлӢӨ. к·ёлҹ¬лӮҳ 8-14мӢңк°„ м •лҸ„мқҳ NOACмқҳ мғҒлҢҖм ҒмңјлЎң л№ лҘё мҶҢмӢӨл°ҳк°җкё°лҘј кі л Өн• л•Ң[23], м—°кІ°мҡ”лІ•мқҖ н•„мҡ”м№ҳ м•Ҡм•„ ліҙмқҙл©°, мҳӨнһҲл Ө м¶ңнҳҲл¶Җмһ‘мҡ©мқ„ мҰқк°ҖмӢңнӮ¬ мҲҳ мһҲмқ„ кІғмңјлЎң ліҙмқёлӢӨ. 2019л…„ л°ңн‘ңлҗң PAUSE studyлҠ” м•„н”ҪмӮ¬л°ҳ, лҰ¬л°”лЎқмӮ¬л°ҳ, лӢӨ비к°ҖнҠёлһҖмқ„ нҲ¬м—¬л°ӣлҠ” 3007лӘ…мқҳ нҷҳмһҗл“Өмқ„ лҢҖмғҒмңјлЎң н—ӨнҢҢлҰ° м—°кІ°мҡ”лІ•мқ„ н•ҳм§Җ м•ҠмқҖ мғҒнғңм—җм„ң м •к·ң мҲҳмҲ л°Ҹ мӢңмҲ мқ„ мң„н•ҳм—¬ н‘ңмӨҖнҷ”лҗң н”„лЎңнҶ мҪңмқ„ мӮ¬мҡ©н•ҳм—¬ NOACлҘј мӨ‘лӢЁн–Ҳмқ„ л•Ңмқҳ лҸҷл§Ҙ нҳҲм „мғүм „мҰқкіј мЈјмҡ” м¶ңнҳҲмқҳ мң„н—ҳмқ„ 비көҗн•ҳмҳҖлӢӨ. к·ё кІ°кіј, perioperative мӢңкё°м—җ мЈјмҡ” м¶ңнҳҲмқҳ л°ңмғқлҘ мқҖ 2% лҜёл§Ңмқҙм—Ҳмңјл©°, лҸҷл§Ҙ нҳҲм „мғүм „мҰқмқҳ л°ңмғқлҘ мқҖ 1% лҜёл§Ңмқҙм—ҲлӢӨ[24]. мҲҳмҲ л°Ҹ мӢңмҲ лі„ м¶ңнҳҲ мң„н—ҳлҸ„лҠ” Table 4м—җ мҡ”м•Ҫн•ҳмҳҖмңјл©°, мқҙлҘј л°”нғ•мңјлЎң мң лҹҪ мӢ¬мһҘн•ҷнҡҢм—җм„ң м ңмӢңн•ҳлҠ” м•Ҫл¬ј мӨ‘лӢЁ м „лһөмқҖ Table 5м—җ м ңмӢңн•ҳмҳҖлӢӨ[11]. 2021л…„ лҜёкөӯмӢ¬мһҘн•ҷнҡҢ/лҜёкөӯлҮҢмЎёмӨ‘н•ҷнҡҢм—җм„ңлҸ„ 비мӢ¬мһҘмҲҳмҲ мӢңм—җ м•Ҫл¬ј мӨ‘лӢЁ м „лһөм—җ кҙҖн•ң м„ұлӘ…м„ңлҘј л°ңн‘ңн•ҳмҳҖлҠ”лҚ°, м¶ңнҳҲ мң„н—ҳмқҙ нҒ° кІҪмҡ°м—җлҠ” 2мқј м „л¶Җн„° нҲ¬м•Ҫ мӨ‘лӢЁ л°Ҹ мҲҳмҲ 2-3мқј нӣ„ нҲ¬м•Ҫ мһ¬к°ңлҘј, м¶ңнҳҲ мң„н—ҳмқҙ мһ‘мқҖ кІҪмҡ°м—җлҠ” 1мқјм „ нҲ¬м•Ҫ мӨ‘лӢЁ л°Ҹ мҲҳмҲ 24мӢңк°„ нӣ„ нҲ¬м•Ҫ мһ¬к°ңлҘј к¶Ңкі н•ҳмҳҖлӢӨ[25]. лӢӨл§Ң лӢӨ비к°ҖнҠёлһҖмқҳ кІҪмҡ°, нҒ¬л Ҳм•„нӢ°лӢҢ мІӯмҶҢмңЁмқҙ 50 mL/min лҜёл§Ңмқј мӢң м¶ңнҳҲм Җмң„н—ҳкө°мқҳ кІҪмҡ°лҠ” 3мқјм „, кі мң„н—ҳкө°мқҳ кІҪмҡ°лҠ” 5мқј м „м—җ мӨ‘лӢЁн•ҳлқјкі 추к°Җм ҒмңјлЎң лӘ…мӢңн•ҳмҳҖлӢӨ. л§Ҳм§Җл§үмңјлЎң, лӢӨ비к°ҖнҠёлһҖмқ„ ліөмҡ©н•ҳкі мһҲлҚҳ нҷҳмһҗлҠ” мқ‘кёүмғҒнҷ©м—җм„ң idarucizumabмқҳ нҲ¬м—¬лҘј кі л Өн• мҲҳ мһҲлӢӨ[25].2) мЈҪкІҪнҷ”мҰқ(atherosclerosis)
2) мЈҪкІҪнҷ”мҰқ(atherosclerosis)
мӢ¬л°©м„ёлҸҷ нҷҳмһҗм—җм„ң н–Ҙнӣ„ лҮҢкІҪмғү л°ңмғқмқҳ мң„н—ҳмңЁмқ„ мҳҲмёЎн•ҳлҠ” CHA2DS2-VASc м җмҲҳлҠ” лӮҳмқҙ, м„ұлі„, мӢ¬л¶Җм „, кі нҳҲм••, лҮҢкІҪмғү/мқјкіјм„ұ н—ҲнҳҲл°ңмһ‘/мғүм „мҰқмқҳ кіјкұ°л Ҙ, мӢ¬к·јкІҪмғү, л§җмҙҲлҸҷл§Ҙм§Ҳнҷҳл“ұмқҳ нҳҲкҙҖм§Ҳнҷҳмқҳ кіјкұ°л Ҙ л°Ҹ лӢ№лҮЁлЎң мқҙлЈЁм–ҙм ё мһҲлӢӨ[26]. мң„мқҳ кө¬м„ұ мқёмһҗл“ӨмқҖ мһҳ м•Ңл Ө진 мЈҪкІҪнҷ”мҰқмқҳ мң„н—ҳмқёмһҗл“ӨмқҙлӢӨ. мқҙлЎң мқён•ҙ мӢ¬л°©м„ёлҸҷм—җ мқҳн•ң лҮҢкІҪмғү нҷҳмһҗл“Өм—җкІҢм„ң мЈҪкІҪнҷ”мҰқмқҙ лҸҷл°ҳлҗң кІҪмҡ°лҘј мһ„мғҒм—җм„ң м Ғм§Җ м•ҠкІҢ м ‘н•ҳкІҢ лҗңлӢӨ. мқҙлҹ¬н•ң мӢ¬л°©м„ёлҸҷкіј мЈҪкІҪнҷ”мҰқмқҙ лҸҷл°ҳлҗң лҮҢкІҪмғү нҷҳмһҗлҠ” мЈҪкІҪнҷ”мҰқмқҙ м—ҶлҠ” нҷҳмһҗм—җ 비н•ҳм—¬ мҳҲнӣ„к°Җ мўӢм§Җ м•ҠмқҢмқҙ м•Ңл Өм ё мһҲлӢӨ[27]. к·ёлҹ¬лҜҖлЎң мӢ¬л°©м„ёлҸҷкіј лҸҷл°ҳлҗң мЈҪкІҪнҷ”мҰқм—җ мқҳн•ң л‘җк°Җм§Җ кё°м „мқҳ лҮҢкІҪмғүмқ„ лҸҷмӢңм—җ мҳҲл°©н•ҳкё° мң„н•ҳм—¬ н•ӯмқ‘кі м ңм—җ н•ӯнҳҲм „м ңлҘј мЎ°н•©н•ң м№ҳлЈҢлҘј кі л Өн• мҲҳ мһҲлӢӨ. мӢӨм ңлЎң CRCS-K registryлҘј л°”нғ•мңјлЎң мҲҳн–үлҗң м—°кө¬м—җм„ң мӢ¬л°©м„ёлҸҷкіј 50% мқҙмғҒмқҳ мҰқмғҒлҮҢнҳҲкҙҖнҳ‘м°©мқҙ мһҲкұ°лӮҳ, лӢӨлҘё нҳҲкҙҖм—җ мЈҪкІҪнҷ”мҰқмқҳ кіјкұ°л Ҙмқҙ мһҲлҠ” 2,553лӘ…мқҳ нҷҳмһҗм—җм„ң 30% нҷҳмһҗк°Җ н•ӯмқ‘кі м ңмҷҖ н•ӯнҳҲм „м ңмқҳ мЎ°н•©мқ„ мӮ¬мҡ©н•ҳкі мһҲм—ҲлӢӨ[28]. мқҙлҠ” мӢ¬л°©м„ёлҸҷм—җ мЈҪкІҪнҷ”мҰқмқҙ лҸҷл°ҳлҗң кІҪмҡ°м—җ, н•ӯмқ‘кі м ң лӢЁлҸ… м№ҳлЈҢлЎңлҠ” лҮҢкІҪмғүмқҳ мҳҲл°©м—җ 충분н•ҳм§Җ м•Ҡмқ„ кІғмқҙлқјлҠ” мһ„мғҒм Ғ мҡ°л Өк°Җ л°ҳмҳҒлҗң кІ°кіјмқј кІғмқҙлӢӨ. н•ҳм§Җл§Ң, мқҙлҹ¬н•ң н•ӯмқ‘кі м ңмҷҖ н•ӯнҳҲм „м ңмқҳ лҸҷл°ҳ мӮ¬мҡ©мқҖ м¶ңнҳҲмқҳ л¶Җмһ‘мҡ©мқ„ мҰқк°ҖмӢңнӮӨлҜҖлЎң, мғҒнҷ©м—җ л§һлҠ” м Ғм Ҳн•ң м•Ҫм ңмқҳ м„ нғқмқҙ н•„мҡ”н•ҳлӢӨ. н•ҙлӢ№ м—°кө¬м—җм„ңлҸ„ мӢ¬л°©м„ёлҸҷкіј 50% мқҙмғҒмқҳ мҰқмғҒ лҮҢнҳҲкҙҖнҳ‘м°© лҳҗлҠ” нҸҗмғүмқҙ лҸҷл°ҳлҗң лҮҢкІҪмғү нҷҳмһҗм—җм„ң н•ӯмқ‘кі м ңмқҳ лӢЁлҸ… мӮ¬мҡ©кіј н•ӯмқ‘кі м ңмҷҖ н•ӯнҳҲм „м ң, лҸҷмӢңмӮ¬мҡ©мқ„ 비көҗн•ҳмҳҖмқ„ л•Ң н•ӯмқ‘кі м ңмҷҖ н•ӯнҳҲм „м ңлҘј лҸҷмӢң мӮ¬мҡ©н•ңкө°м—җм„ң 3к°ңмӣ”м§ё лҮҢкІҪмғү, мӢ¬к·јкІҪмғү, мӮ¬л§қмқҳ мў…н•©мӮ¬кұҙмқҳ л°ңмғқлҘ мқҙ лҶ’м•ҳлӢӨ[28]. к·ёлҹ¬лҜҖлЎң лӢЁмҲңнһҲ мҰқмғҒлҮҢнҳҲкҙҖнҳ‘м°©мқ„ лҸҷл°ҳн•ң кІғ л§ҢмңјлЎң н•ӯнҳҲмҶҢнҢҗм ңлҘј лі‘мҡ© нҲ¬м—¬н•ҳлҠ” кІғмқҖ мЈјмқҳн•ҳм—¬м•ј н•ңлӢӨ.л‘җк°ңлӮҙнҳҲкҙҖмқҙлӮҳ кІҪлҸҷл§Ҙмқҳ нҳ‘м°©мқ„ лҸҷл°ҳн•ң мӢ¬л°©м„ёлҸҷ нҷҳмһҗл“Өмқ„ лҢҖмғҒмңјлЎң н•ң лҢҖк·ңлӘЁ л¬ҙмһ‘мң„л°°м • м—°кө¬лҠ” м•„м§Ғ м—ҶлҠ” мӢӨм •мқҙлӢӨ. лӢӨл§Ң мӢ¬л°©м„ёлҸҷкіј кёүм„ұмӢ¬к·јкІҪмғү лҳҗлҠ” кҙҖмғҒлҸҷл§ҘмӨ‘мһ¬мӢңмҲ мқ„ л°ӣмқҖ нҷҳмһҗл“Өмқ„ лҢҖмғҒмңјлЎң мҷҖнҢҢлҰ°м—җ 비н•ҳм—¬ мғҒлҢҖм ҒмңјлЎң м¶ңнҳҲмқҳ мң„н—ҳмқҙ лӮ®мқҖ NOACлҘј н•ӯнҳҲм „м ңмҷҖ мЎ°н•©н•ң лҢҖк·ңлӘЁ л¬ҙмһ‘мң„ м—°кө¬л“Өмқҙ 진н–үлҗҳм—ҲлӢӨ[29-32]. мқҙл“Ө м—°кө¬м—җ кҙҖн•ң л©”нғҖ분м„қм—җм„ңлҠ” NOACмҷҖ P2Y12м–өм ңм ң лі‘мҡ© кө°, NOACмҷҖ мқҙмӨ‘нҳҲмҶҢнҢҗм ң(dual antiplatelet) лі‘мҡ©кө°, мҷҖнҢҢлҰ°кіј P2Y12 м–өм ңкІҢ мӮ¬мҡ©кө°кіј мҷҖнҢҢлҰ°кіј мқҙмӨ‘нҳҲмҶҢнҢҗм ңлҘј мӮ¬мҡ©н•ң 4к°ңмқҳ кө°мңјлЎң лӮҳлҲ„м–ҙ мЈјмҡ” мӢ¬нҳҲкҙҖкі„ л¶Җмһ‘мҡ© мӮ¬кұҙмқҳ л°ңмғқкіј м¶ңнҳҲмӮ¬кұҙмқҳ л°ңмғқмқ„ 비көҗн•ҳмҳҖлӢӨ. к·ё кІ°кіј NOACмҷҖ P2Y12м–өм ңм ң лҸҷмӢңмӮ¬мҡ© кө°м—җм„ң мҷҖнҢҢлҰ°кіј мқҙмӨ‘нҳҲмҶҢнҢҗм ңлҘј лҸҷмӢңм—җ мӮ¬мҡ©н•ң кө°м—җ 비н•ҳм—¬ мЈјмҡ” мӢ¬нҳҲкҙҖкі„ л¶Җмһ‘мҡ© мӮ¬кұҙмқҳ л°ңмғқмқҖ м°Ёмқҙк°Җ м—Ҷм—Ҳмңјл©° м¶ңнҳҲ мӮ¬кұҙмқҖ мң мқҳлҜён•ҳкІҢ лӮ®кІҢ лӮҳнғҖлӮ¬лӢӨ[33].кіјкұ° мҰқмғҒм„ұмқҳ 50-99%мқҳ л‘җк°ңлӮҙлҮҢнҳҲкҙҖмқҳ нҳ‘м°©мқ„ к°Җ진 нҷҳмһҗлҘј лҢҖмғҒмңјлЎң н•ҳлЈЁ м•„мҠӨн”јлҰ° 1300 mg лҳҗлҠ” мҷҖнҢҢлҰ°(лӘ©н‘ң INR 2.0-3.0)мқ„ нҲ¬м—¬н•ҳм—¬ н—ҲнҳҲлҮҢмЎёмӨ‘, лҮҢм¶ңнҳҲ, нҳҲкҙҖм„ұ мӮ¬л§қмӮ¬кұҙмқ„ ліё WASID м—°кө¬м—җм„ңлҠ” нҸүк· 1.8л…„мқҳ 추м Ғкё°к°„ лҸҷм•Ҳ м•„мҠӨн”јлҰ°кө°м—җм„ңлҠ” 22.1%, мҷҖнҢҢлҰ°кө°м—җм„ңлҠ” 21.8% лЎң л‘җ кө° к°„мқҳ мң мқҳн•ң мӮ¬кұҙ л°ңмғқмқҳ м°ЁмқҙлҠ” м—Ҷм—ҲлӢӨ[34]. лӢӨл§Ң, м¶ңнҳҲ мӮ¬кұҙмқҳ л°ңмғқмқҙ м•„мҠӨн”јлҰ°кө°м—җм„ңлҠ” 3.2%, мҷҖнҢҢлҰ°кө°м—җм„ңлҠ” 8.3%лЎң мҷҖнҢҢлҰ°кө°м—җм„ң мң мқҳн•ҳкІҢ л§Һмқҙ л°ңмғқн•ҳмҳҖлӢӨ. мқҙ м—°кө¬мқҳ мЈјмҡ” кІ°кіјлҠ” мҰқмғҒ л‘җк°ңлӮҙнҳҲкҙҖмқҳ нҳ‘м°© к°ҷмқҖ мЈҪкІҪнҷ”мҰқм—җ мқҳн•ң лҮҢкІҪмғүмқҳ мҳҲл°©м—җ м•„мҠӨн”јлҰ°мқҙ нҡЁкіјм ҒмқҙлқјлҠ” кІ°лЎ мқ„ лҸ„м¶ңн•ҳмҳҖлӢӨ. н•ҙлӢ№ м—°кө¬лҠ” н•ӯмқ‘кі м ңмқё мҷҖнҢҢлҰ°мқҙ м•„мҠӨн”јлҰ°м—җ 비н•ҳм—¬ м¶ңнҳҲмқҳ мң„н—ҳм„ұмқҖ лҶ’мңјлӮҳ н—ҲнҳҲмӮ¬кұҙм—җ лҢҖн•ң нҡЁкіјлҠ” мң мӮ¬н•Ёмқ„ мӢңмӮ¬н•ңлӢӨ. NOACмқҳ кІҪмҡ° мҷҖнҢҢлҰ°м—җ 비н•ҳм—¬ м¶ңнҳҲмқҳ мң„н—ҳмқҙ лҚ” мӨ„м–ҙл“Өм—Ҳкё° л•Ңл¬ём—җ мҷҖнҢҢлҰ°ліҙлӢӨ мўҖ лҚ” мң лҰ¬н•ң кІ°кіјлҘј ліҙм—¬мӨ„ мҲҳ мһҲмқ„ кІғмңјлЎң мҳҲмёЎлҗҳлӮҳ м•„м§Ғ мқҙлҘј л’·л°ӣм№Ён• лҢҖк·ңлӘЁ м—°кө¬лҠ” м—Ҷм–ҙ к·јкұ°лҠ” л¶ҖмЎұн•ҳлӢӨ.мқҙлҹ¬н•ң м—°кө¬ кІ°кіјл“Өмқ„ л°”нғ•мңјлЎң, м•„м§Ғ к·јкұ°лҠ” л¶ҖмЎұн•ҳлӮҳ мӢ¬л°©м„ёлҸҷм—җ лҸҷл°ҳлҗң мЈҪкІҪнҷ”мҰқ нҷҳмһҗм—җм„ң NOACмқҳ мӮ¬мҡ©мқ„ лЁјм Җ кі л Өн• мҲҳ мһҲкІ лӢӨ. к·ёлҹ¬лӮҳ 50% мқҙмғҒмқҳ мҰқмғҒм„ұ лҮҢнҳҲкҙҖмқҳ нҳ‘м°©мқҙ лҸҷл°ҳлҗҳлҠ” кІҪмҡ° лҳҗлҠ” лҮҢкІҪмғүмқҳ кё°м „мқҙ мӢ¬л°©м„ёлҸҷліҙлӢӨлҠ” мЈҪкІҪнҷ”мҰқм—җ мқҳн•ң лҮҢкІҪмғүмңјлЎң нҢҗлӢЁлҗҳлҠ” кІҪмҡ°, лҳҗлҠ” лҸҷл°ҳлҗң кҙҖмғҒлҸҷл§Ҙм§Ҳнҷҳмқҙ мһҲлҠ” кІҪмҡ°м—җлҠ” н•ӯнҳҲм „м ңмқҳ 추к°ҖлҘј мЈјмқҳк№ҠкІҢ кі л Өн• мҲҳ мһҲмқ„ кІғмңјлЎң ліҙмқёлӢӨ. лӢӨл§Ң, мқҙл•Ң мӮ¬мҡ©лҗҳлҠ” н•ӯмқ‘кі м ңлЎңлҠ” NOACк°Җ мҡ°м„ м ҒмңјлЎң кі л Өлҗҳм–ҙм•ј н•ҳл©° н•ӯнҳҲм „м ңлҠ” ліөн•©н•ӯнҳҲм „м ң лҢҖмӢ лӢЁлҸ…н•ӯнҳҲм „м ң, нҠ№нһҲ P2Y12м–өм ңм ңмқҳ 추к°ҖлҘј кі л Өн• мҲҳ мһҲмқ„ кІғмқҙлӢӨ. нҳ„мһ¬ көӯлӮҙм—җм„ң мЈҪкІҪнҷ”мҰқмқ„ лҸҷл°ҳн•ң 비нҢҗл§ү мӢ¬л°©м„ёлҸҷ нҷҳмһҗм—җм„ң м—җлҸ…мӮ¬л°ҳ лӢЁлҸ…м№ҳлЈҢмҷҖ н•ӯнҳҲмҶҢнҢҗ 추к°ҖлҘј 비көҗн•ҳлҠ” кҙҖм°°м—°кө¬к°Җ 진н–үмӨ‘мңјлЎң, кІ°кіјм—җ л”°лқј н–Ҙнӣ„ м№ҳлЈҢм „лһөмқ„ кІ°м •н•ҳлҠ”лҚ° лҸ„мӣҖмқҙ лҗ кІғмңјлЎң ліҙмқёлӢӨ(ADD-ON; NCT04010955).3) мӢ¬мһҘнҢҗл§үм§Ҳнҷҳмқҙ мһҲлҠ” нҷҳмһҗ
3) мӢ¬мһҘнҢҗл§үм§Ҳнҷҳмқҙ мһҲлҠ” нҷҳмһҗ
мӨ‘л“ұлҸ„ мқҙмғҒмқҳ мҠ№лӘЁнҢҗнҳ‘м°©мҰқ л°Ҹ кё°кі„ нҢҗл§үмқ„ к°Җм§Җкі мһҲлҠ” нҷҳмһҗлҠ” 4к°ңмқҳ мЈјмҡ” л¬ҙмһ‘мң„ лҢҖмЎ°мӢңн—ҳм—җм„ң м ңмҷёлҗҳм—ҲлӢӨ. кё°кі„нҢҗл§үмқ„ к°Җм§Җкі мһҲлҠ” нҷҳмһҗл“Өмқ„ лҢҖмғҒмңјлЎң мҲҳн–үлҗң NOAC л¬ҙмһ‘мң„ лҢҖмЎ°мӢңн—ҳмқҖ лӢӨ비к°ҖнҠёлһҖмқ„ лҢҖмғҒмңјлЎң мӢңн–үлҗң м—°кө¬ н•ҳлӮҳл§Ң мһҲмңјл©°, н•ҙлӢ№ м—°кө¬м—җм„ң лӢӨ비к°ҖнҠёлһҖмқҖ нҳҲм „мғүм „мҰқкіј м¶ңнҳҲ л°ңмғқмқҙ мҷҖнҢҢлҰ°м—җ 비н•ҳм—¬ л§Һм•ҳлӢӨ[35]. мқҙлҹ¬н•ң м—°кө¬ кІ°кіјлҘј л°”нғ•мңјлЎң кё°кі„ нҢҗл§үмқҙ мһҲлҠ” нҷҳмһҗм—җм„ң NOACмқҳ мӮ¬мҡ©мқҖ кёҲкё°мҰқм—җ н•ҙлӢ№лҗңлӢӨ.мқёкіөмЎ°м§ҒмҠ№лӘЁнҢҗл§ү(bioprosthetic mitral valve)мқ„ к°Җ진 нҷҳмһҗл“ӨмқҖ RE-LY м—°кө¬мҷҖ ROCKET-AF м—°кө¬м—җм„ң м ңмҷёлҗҳм—ҲмңјлӮҳ, ARISTOTLE м—°кө¬мҷҖ ENGAGE AF-TIMI 48 м—°кө¬м—җлҠ” нҸ¬н•Ёлҗҳм—ҲлӢӨ. к·ёлҹ¬лӮҳ к·ё мҲҳк°Җ к°Ғк°Ғ 31лӘ…(0.2%)кіј 131лӘ…(0.6%)мңјлЎң м „мІҙ нҷҳмһҗм—җ 비н•ҳм—¬ л§Өмҡ° м ҒмқҖ мҲҳмҳҖлӢӨ. лӢӨ비к°ҖнҠёлһҖмқҖ мқҙнӣ„ 27лӘ…мқҳ нҷҳмһҗл“Өмқ„ лҢҖмғҒмңјлЎң н•ң мҶҢк·ңлӘЁ м—°кө¬к°Җ 진н–үлҗҳм—ҲлӢӨ[36]. лёҢлқјм§Ҳм—җм„ң мқёкіөмЎ°м§Ғ мҠ№лӘЁнҢҗл§үм№ҳнҷҳмҲ мқ„ л°ӣмқҖ лҰ¬л°”лЎқмӮ¬л°ҳкө° 500лӘ…кіј мҷҖнҢҢлҰ°кө° 505лӘ…мқ„ л¬ҙмһ‘мң„ л°°м •н•ҳм—¬ 2020л…„ л°ңн‘ңлҗң м—°кө¬м—җм„ңлҠ” мӮ¬л§қ, лҮҢмЎёмӨ‘мқ„ нҸ¬н•Ён•ң мЈјмҡ” мӢ¬лҮҢнҳҲкҙҖм§Ҳнҷҳ, м¶ңнҳҲмқ„ мў…н•©н•ң кІ°кіјм—җм„ң лҰ¬л°”лЎқмӮ¬л°ҳмқҙ мҷҖнҢҢлҰ°м—җ 비м—ҙл“ұн•Ёмқ„ ліҙмҳҖлӢӨ[37]. мқёкіөмЎ°м§Ғ мҠ№лӘЁнҢҗл§үм№ҳнҷҳмҲ мқ„ л°ӣмқҖ 220лӘ…мқҳ нҷҳмһҗл“Өмқ„ лҢҖмғҒмңјлЎң нҡЁкіј л°Ҹ м¶ңнҳҲмқ„ мЈјмҡ” кІ°кіјлЎң н•ҳм—¬ мөңк·ј көӯлӮҙм—җм„ң мҲҳн–үлҗң л¬ҙмһ‘мң„ лҢҖмЎ°мӢңн—ҳм—җм„ңлҠ” м—җлҸ…мӮ¬л°ҳмқҙ мҷҖнҢҢлҰ°м—җ 비м—ҙл“ұн•Ёмқ„ ліҙмҳҖлӢӨ[38]. 4к°ңмқҳ мЈјмҡ” л¬ҙмһ‘мң„ лҢҖмЎ°мӢңн—ҳмқ„ лҢҖмғҒмңјлЎң мҲҳн–үлҗң л©”нғҖ м—°кө¬м—җм„ң кё°кі„нҢҗл§ү л°Ҹ мӨ‘л“ұлҸ„ мқҙмғҒмқҳ мҠ№лӘЁнҢҗ нҳ‘м°©мҰқмқ„ м ңмҷён•ң лӢӨлҘё мӢ¬мһҘнҢҗл§үм§Ҳнҷҳмқ„ к°Җ진 нҷҳмһҗм—җм„ң н‘ңмӨҖмҡ©лҹүмқҳ NOACлҠ” нҢҗл§үм§Ҳнҷҳмқҙ м—ҶлҠ” нҷҳмһҗмҷҖ мң мӮ¬н•ң нҡЁкіјмҷҖ м•Ҳм „м„ұмқ„ ліҙмҳҖлӢӨ[39]. көӯлӮҙм—җм„ң кұҙк°•ліҙн—ҳмӢ¬мӮ¬нҸүк°Җмӣҗмқҳ мһҗлЈҢлҘј мқҙмҡ©н•ҳм—¬ мӨ‘л“ұлҸ„ мқҙмғҒмқҳ мҠ№лӘЁнҢҗ нҳ‘м°©мҰқ нҷҳмһҗлҘј лҢҖмғҒмңјлЎң off-labelлЎң мІҳл°©лҗң NOACмқҳ нҡЁкіјлҘј ліҙкё° мң„н•ҳм—¬ propensity score matchingмқ„ мӢңн–үн•ҳм—¬ мҲҳн–үлҗң нӣ„н–Ҙ м—°кө¬м—җм„ң NOACлҠ” нҳҲм „мҰқ л°Ҹ лҮҢмЎёмӨ‘мқҳ л°ңмғқкіј мӮ¬л§қмқҙ мҷҖнҢҢлҰ°ліҙлӢӨ м Ғм—Ҳмңјл©°, лҮҢлӮҙм¶ңнҳҲмқҳ л°ңмғқмқҖ мҷҖнҢҢлҰ°кіј нҶөкі„м Ғмқё м°ЁмқҙлҘј ліҙмқҙм§Җ м•Ҡм•ҳлӢӨ[40]. к·ёлҹ¬лӮҳ 2021л…„ л°ңн‘ңлҗң лҜёкөӯ лҮҢмЎёмӨ‘н•ҷнҡҢмқҳ 진лЈҢм§Җм№Ём—җм„ңлҸ„ мӨ‘л“ұлҸ„ мқҙмғҒмқҳ мҠ№лӘЁнҢҗнҳ‘м°©мҰқмқ„ к°Җм§Җкі мһҲлҠ” мӢ¬л°©м„ёлҸҷ нҷҳмһҗм—җм„ңлҠ” м—¬м „нһҲ NOACліҙлӢӨлҠ” мҷҖнҢҢлҰ°мқ„ к¶ҢмһҘн•ҳкі мһҲлӢӨ[2].4) мӢ¬мһҘ лӮҙ нҳҲм „мқҙ мһҲлҠ” нҷҳмһҗ
4) мӢ¬мһҘ лӮҙ нҳҲм „мқҙ мһҲлҠ” нҷҳмһҗ
мӢ¬л°©м„ёлҸҷмқҙ мһҲлҠ” нҷҳмһҗм—җм„ң нҳҲм „мқҙ мғқм„ұлҗҳлҠ” мЈјмҡ”н•ң мһҘмҶҢк°Җ мўҢмӢ¬л°©/мўҢмӢ¬л°©к·Җ(left atrial appendage)мқҙлҜҖлЎң, мӢ¬л°©м„ёлҸҷмқҙ мһҲлҠ” нҷҳмһҗл“Өм—җкІҢ лҮҢмЎёмӨ‘ мҳҲл°© нҡЁкіјк°Җ мһҲлҠ” NOACк°Җ мӢ¬мһҘлӮҙ нҳҲм „мқҙ мһҲлҠ” нҷҳмһҗл“Өм—җкІҢ нҡЁкіјк°Җ мһҲмқ„ кІғмңјлЎң мғқк°ҒлҗҳлҠ” кІғмқҖ мһҗм—°мҠӨлҹ¬мҡҙ мғқк°ҒмқҙлӢӨ. к·ёлҹ¬лӮҳ мӢ¬мһҘ лӮҙ нҳҲм „мқҖ кІҪмӢқлҸ„мӢ¬мҙҲмқҢнҢҢлӮҳ мӢ¬мһҘ CTмҷҖ к°ҷмқҖ кІҖмӮ¬лҘј мӢңн–үн•ҳм§Җ м•Ҡкі лҠ” л°ңкІ¬мқҙ м–ҙл Өмҡ°лҜҖлЎң, мқҙ нҷҳмһҗл“Өмқ„ лҢҖмғҒмңјлЎң лҢҖк·ңлӘЁ л¬ҙмһ‘мң„ лҢҖмЎ°мӢңн—ҳмқ„ мҲҳн–үн•ҳлҠ” кІғмқҖ мүҪм§Җ м•ҠлӢӨ. мқҙм—җ л”°лқј мӢ¬мһҘлӮҙ нҳҲм „мқҙ мһҲлҠ” нҷҳмһҗл“Өмқ„ лҢҖмғҒмңјлЎң 충분н•ң мҲҳмқҳ нҷҳмһҗлҘј лӘЁм§‘н•ҳм—¬ NOACмҷҖ мҷҖнҢҢлҰ°мқ„ 비көҗн•ң л¬ҙмһ‘мң„ лҢҖмЎ°мӢңн—ҳмқҖ л¶ҖмЎұн•ң мӢӨм •мқҙлӢӨ. мўҢмӢ¬л°©/мўҢмӢ¬л°©к·Җмқҳ нҳҲм „мқҙ мһҲлҠ” нҷҳмһҗл“Өмқ„ лҢҖмғҒмңјлЎң мҲҳн–үлҗң мҶҢк·ңлӘЁ м „н–Ҙ м—°кө¬л“Өм—җ лӢӨ비к°ҖнҠёлһҖ н•ҳлЈЁ 2нҡҢ 150 mg нҲ¬м—¬ л°Ҹ н‘ңмӨҖмҡ©лҹүмқҳ лҰ¬л°”лЎқмӮ¬л°ҳмқҖ н—ӨнҢҢлҰ°/мҷҖнҢҢлҰ°кіј мң мӮ¬н•ң нҡЁкіјлҘј ліҙмҳҖлӢӨ[41,42]. лӢӨл§Ң н•ҙлӢ№ м—°кө¬л“ӨмқҖ мһҳ нҶөм ңлҗң 맹кІҖ м—°кө¬лҠ” м•„лӢҲм—ҲлӢӨ. н‘ңмӨҖмҡ©лҹүмқҳ м•„н”ҪмӮ¬л°ҳкіј н—ӨнҢҢлҰ°/мҷҖнҢҢлҰ°мқ„ 비көҗн•ң 맹кІҖ м—°кө¬м—җм„ң м•„н”ҪмӮ¬л°ҳмқҖ н—ӨнҢҢлҰ° л°Ҹ мҷҖнҢҢлҰ°кө°кіј мң мӮ¬н•ң нҳҲм „ м ңкұ°мңЁмқ„ ліҙмҳҖкі , мҡ°мӣ”н•ң лҮҢмЎёмӨ‘/мғүм „ мӮ¬кұҙ л°Ҹ м¶ңнҳҲ мӮ¬кұҙмқ„ ліҙмҳҖлӢӨ[43]. мқҙлҹ¬н•ң кІ°кіјл“Өмқ„ мў…н•©н•ҳм—¬ ліј л•Ң м•„м§Ғ нҷ•кі н•ң к·јкұ°лҠ” л¶ҖмЎұн•ҳлӮҳ мўҢмӢ¬л°©/мўҢмӢ¬л°©к·Җм—җ нҳҲм „мқҙ мһҲлҠ” нҷҳмһҗм—җм„ң NOACмқҳ мӮ¬мҡ©мқҖ мҷҖнҢҢлҰ°мқҳ мӮ¬мҡ©мқҙ м–ҙл Өмҡҙ нҷҳмһҗм—җкІҢ мң л§қн•ң м„ нғқм§Җк°Җ лҗ мҲҳ мһҲлӢӨ.мӢ¬мӢӨлӮҙ нҳҲм „мқҖ мӢ¬л°©м„ёлҸҷліҙлӢӨлҠ” мӢ¬к·јкІҪмғүкіј к°ҷмқҖ мқҙмң лЎң мӢ¬к·јмқҳ мҲҳ축л Ҙмқҙ м Җн•ҳлҗҳм—Ҳмқ„ л•Ң мһҳ л°ңмғқн•ҳкІҢ лҗңлӢӨ. мӢ¬мӢӨлӮҙ нҳҲм „мқҙ мһҲлҠ” нҷҳмһҗм—җм„ң NOACмҷҖ мҷҖнҢҢлҰ°мқ„ 비көҗн•ң лҢҖк·ңлӘЁ л¬ҙмһ‘мң„ лҢҖмЎ°мӢңн—ҳмқҖ м•„м§Ғ м—ҶлҠ” мғҒнғңмқҙлӮҳ, 2020л…„ л°ңн‘ңлҗң 514лӘ…мқҳ мӢ¬мӢӨлӮҙ нҳҲм „мқҙ мһҲлҠ” нҷҳмһҗл“Өмқ„ лҢҖмғҒмңјлЎң н•ң нӣ„н–Ҙ м—°кө¬м—җм„ң NOACлҘј мӮ¬мҡ©н•ң нҷҳмһҗл“ӨмқҖ мҷҖнҢҢлҰ°м—җ 비н•ҳм—¬ лҮҢмЎёмӨ‘кіј нҳҲм „мғүм „мҰқмқҳ л°ңмғқмқҙ лҚ” л§Һм•ҳлӢӨ[44].5) кі л №
5) кі л №
4к°ңмқҳ мЈјмҡ” л¬ҙмһ‘мң„ лҢҖмЎ°мӢңн—ҳм—җм„ң м—°кө¬м—җ м°ём—¬н•ң нҷҳмһҗл“Өмқҳ нҸүк· м—°л №мқҖ 70м„ём—җм„ң 73м„ёмҳҖмңјл©°, к°Ғ м—°кө¬м—җм„ң 75м„ё мқҙмғҒмқҳ кі л № нҷҳмһҗлҠ” 31-43%к°Җ нҸ¬н•Ёлҗҳм—ҲлӢӨ. ARISTOTLE м—°кө¬лҠ” лӮҳмқҙлҘј к°җм•Ҳн•ҳм—¬ мҡ©лҹүмЎ°м Ҳмқ„ н•ҳмҳҖмңјл©°, н•ҙлӢ№ м—°кө¬м—җм„ң 80м„ё мқҙмғҒмқҳ кі л №мқҖ мІҙмӨ‘ л°Ҹ мӢ мһҘкё°лҠҘкіј н•Ёк»ҳ к°җлҹүмқ„ кі л Өн• мҲҳ мһҲлҠ” мЎ°кұҙ(3к°Җм§Җ мӨ‘ 2к°Җм§Җ л§ҢмЎұ) мӨ‘мқҳ н•ҳлӮҳмҳҖкі [5], лӢӨлҘё NOAC лҢҖмғҒ л¬ҙмһ‘мң„ лҢҖмЎ°мӢңн—ҳм—җм„ң лӮҳмқҙлҠ” мҡ©лҹүмЎ°м Ҳмқ„ мң„н•ң мЎ°кұҙм—җлҠ” н•ҙлӢ№н•ҳм§Җ м•Ҡм•ҳлӢӨ.мЈјмҡ” л¬ҙмһ‘мң„ лҢҖмЎ°мӢңн—ҳм—җм„ң NOACлҠ” кі л № нҷҳмһҗм—җм„ңлҸ„ 비көҗм Ғ м ҠмқҖ нҷҳмһҗмҷҖ лҸҷмқјн•ң нҡЁкіјлҘј ліҙмҳҖлӢӨ. лӮҳмқҙк°Җ л“ӨмҲҳлЎқ мӢ¬л°©м„ёлҸҷм—җ мқҳн•ң лҮҢмЎёмӨ‘мқҳ л°ңмғқмқҙ мҰқк°Җн•ҳкё° л•Ңл¬ём—җ, NOACлҘј мӮ¬мҡ©н•ҳмҳҖмқ„ л•Ң мҷҖнҢҢлҰ°м—җ лҢҖ비н•ң лҮҢмЎёмӨ‘мқҳ м ҲлҢҖк°җмҶҢ(absolute reduction)лҠ” кі л № нҷҳмһҗм—җм„ң мғҒлҢҖм ҒмңјлЎң лҚ” нҒ¬л©°, 75м„ё мқҙмғҒмқҳ нҷҳмһҗл“ӨмқҖ 4к°ңмқҳ мЈјмҡ” л¬ҙмһ‘мң„ лҢҖмЎ°мӢңн—ҳм—җм„ң лӘЁл“ NOACк°Җ мҷҖнҢҢлҰ°м—җ 비н•ҳм—¬ мҡ°мӣ”н•ң лҮҢмЎёмӨ‘/м „мӢ мғүм „мҰқ мҳҲл°©нҡЁкіјлҘј ліҙмҳҖлӢӨ. л°ҳл©ҙ лӮҳмқҙк°Җ л“ӨмҲҳлЎқ м¶ңнҳҲ кІҪн–Ҙмқҙ лҠҳм–ҙлӮҳлҜҖлЎң NOAC мІҳл°©мӢңм—җлҠ” м¶ңнҳҲм—җ лҢҖн•ҳм—¬лҸ„ к°җм•Ҳн•ҳм—¬м•ј н•ңлӢӨ. мЈјмҡ”м¶ңнҳҲм—җ кҙҖн•ҳм—¬лҠ” 75м„ё мқҙмғҒмқҳ нҷҳмһҗм—җм„ң м•„н”ҪмӮ¬л°ҳкіј м—җлҸ…мӮ¬л°ҳл§Ңмқҙ мҷҖнҢҢлҰ°ліҙлӢӨ м ҒмқҖ кІҪн–Ҙмқ„ ліҙмҳҖлӢӨ[45]. RE-LY м—°кө¬м—җм„ң 75м„ё мқҙмғҒмқҳ нҷҳмһҗк°Җ н•ҳлЈЁм—җ лӢӨ비к°ҖнҠёлһҖ 150 mgмқ„ 2нҡҢ нҲ¬м—¬н•ҳмҳҖмқ„ л•Ңм—җлҠ” мҷҖнҢҢлҰ°м—җ 비н•ҳм—¬ ліҙлӢӨ л§ҺмқҖ м¶ңнҳҲмқ„ ліҙмҳҖкё° л•Ңл¬ём—җ м¶ңнҳҲмқҙ мҡ°л ӨлҗҳлҠ” 75м„ё мқҙмғҒмқҳ нҷҳмһҗм—җм„ңлҠ” лӢӨ비к°ҖнҠёлһҖмқ„ н•ҳлЈЁ 110 mg, 2нҡҢлЎң к°җлҹүмқ„ кі л Өн•ҳм—¬м•ј н•ңлӢӨ[46]. мөңк·ј мқјліём—җм„ң 80м„ё мқҙмғҒмқҳ кі л №м—җм„ң н‘ңмӨҖмҡ©лҹүмқҳ н•ӯмқ‘кі м ңмқҳ нҲ¬м—¬к°Җ л¶Ҳк°ҖлҠҘн•ҳл©ҙм„ң м¶ңнҳҲ мң„н—ҳмқҙ лҶ’мқҖ нҷҳмһҗл“Өмқ„ лҢҖмғҒмңјлЎң мҲҳн–үлҗң м—°кө¬м—җм„ң 15 mgмқҳ м Җмҡ©лҹү м—җлҸ…мӮ¬л°ҳмқҖ мң„м•Ҫ лҢҖмЎ°кө°м—җ 비н•ҳм—¬ нҶөкі„м ҒмңјлЎң мҡ°мӣ”н•ң лҮҢмЎёмӨ‘/м „мӢ мғүм „мҰқ мҳҲл°©нҡЁкіјлҘј ліҙмҳҖмңјл©°, мўҖ лҚ” л§ҺмқҖ мЈјмҡ”м¶ңнҳҲмӮ¬кұҙмқ„ ліҙмҳҖмңјлӮҳ, нҶөкі„м ҒмңјлЎң мқҳлҜёк°Җ мһҲлҠ” м°ЁмқҙлҠ” м•„лӢҲм—ҲлӢӨ[47].6) м ҖмІҙмӨ‘
6) м ҖмІҙмӨ‘
м ҖмІҙмӨ‘мқҖ м•Ҫл¬јмқҳ нҳҲмӨ‘ лҶҚлҸ„м—җ мҳҒн–Ҙмқ„ лҒјм№ҳл©°, мқҙлЎң мқён•ҳм—¬ NOACлҘј мӮ¬мҡ©н•ҳлҠ” нҷҳмһҗмқҳ м ҖмІҙмӨ‘мқҖ ліҙлӢӨ л§ҺмқҖ м¶ңнҳҲкіј кҙҖл Ёмқҙ мһҲлӢӨ[48]. лҳҗн•ң м ҖмІҙмӨ‘ нҷҳмһҗлҠ” лӢӨлҘё лҸҷл°ҳм§Ҳнҷҳмқ„ к°Җм§Җкі мһҲлҠ” кІҪмҡ°к°Җ нқ”н•ҳл©°, мғҒлҢҖм ҒмңјлЎң мҷёкөӯм—җ 비н•ҳм—¬ м ҖмІҙмӨ‘ нҷҳмһҗк°Җ л§ҺмқҖ көӯлӮҙ нҳ„мӢӨмғҒ NOAC нҲ¬м—¬ мӢң м ҖмІҙмӨ‘мқҖ кі л Өн•ҳм—¬м•ј н•ҳлҠ” мЈјмҡ”н•ң мӮ¬н•ӯ мӨ‘ н•ҳлӮҳмқҙлӢӨ. ARISTOTLE м—°кө¬мҷҖ ENGAGE AF-TIMI 48 м—°кө¬лҠ” мІҙмӨ‘мқ„ мҡ©лҹү к°җлҹүмқҳ мЎ°кұҙ мӨ‘ н•ҳлӮҳлЎң м„Өм •н•ҳм—¬ м—°кө¬к°Җ 진н–үлҗҳм—Ҳмңјл©°, м ҖмІҙмӨ‘ нҷҳмһҗлҘј лҢҖмғҒмңјлЎң 분м„қн•ң кІ°кіјлҠ” м „мІҙ кІ°кіјмҷҖ м°Ёмқҙк°Җ м—Ҷм—ҲлӢӨ[49,50]. RE-LY м—°кө¬м—җм„ң 50 kg лҜёл§Ңмқҳ м ҖмІҙмӨ‘ нҷҳмһҗм—җм„ң нҡЁкіјлҠ” мң мӮ¬н•ҳмҳҖмңјлӮҳ м¶ңнҳҲкІҪн–Ҙмқҙ мҰқк°Җн•ҳмҳҖмңјл©°, ROCKET-AF м—°кө¬лҠ” м ҖмІҙмӨ‘мқҳ кё°мӨҖмқ„ 70 kg мқҙн•ҳлЎң м„Өм •н•ҳм—¬, көӯлӮҙмқҳ мқјл°ҳм Ғмқё нҷҳмһҗмқҳ мІҙмӨ‘мқ„ кі л Өн•ҳмҳҖмқ„ л•Ң көӯлӮҙмқҳ мһ„мғҒм—җм„ң мӢӨм ңлЎң м Ғмҡ©н•ҳкё°м—җлҠ” к·јкұ°к°Җ л¶ҖмЎұн•ҳлӢӨ. ліҙн—ҳкіөлӢЁмқҳ мһҗлЈҢлҘј мӮ¬мҡ©н•ҳм—¬ көӯлӮҙм—җм„ң мҲҳн–үлҗң м—°кө¬м—җм„ң NOACлҠ” 60 kg мқҙн•ҳмқҳ м ҖмІҙмӨ‘ нҷҳмһҗм—җм„ң мҷҖнҢҢлҰ°м—җ 비н•ҳм—¬ мҡ°мӣ”н•ң нҡЁкіјмҷҖ м•Ҳм „м„ұмқ„ ліҙмҳҖмңјл©°, мқҙлҠ” 50 kg лҜёл§Ңмқҳ мҙҲ м ҖмІҙмӨ‘ нҷҳмһҗм—җм„ңлҸ„ мң мӮ¬н•ң кІ°кіјлҘј ліҙмҳҖлӢӨ[51]. мқҙлҹ¬н•ң кІ°кіјлҠ” 4к°Җм§Җ NOAC лӘЁл‘җ мң мӮ¬н•ҳмҳҖлӢӨ. мөңк·ј л°ңн‘ңлҗң 2021л…„ EHRAмқҳ 진лЈҢм§Җм№Ём—җм„ңлҠ” 50-60 kg нҷҳмһҗм—җм„ң NOACлҘј мӮ¬мҡ©н• кІҪмҡ°, м•„н”ҪмӮ¬л°ҳкіј м—җлҸ…мӮ¬л°ҳмқ„ мҡ°м„ м ҒмңјлЎң к¶Ңкі н•ҳкі мһҲмңјл©°, лӢӨ비к°ҖнҠёлһҖкіј лҰ¬л°”лЎқмӮ¬л°ҳмқ„ мӮ¬мҡ©н•ҳлҠ” кІҪмҡ°м—җлҠ” нҲ¬м—¬ мӢң нҳҲмӨ‘лҶҚлҸ„ мёЎм •мқ„ к¶Ңкі н•ҳкі мһҲлӢӨ. лҳҗн•ң 50 kg лҜёл§Ңмқҳ нҷҳмһҗм—җкІҢм„ң NOACлҘј мӮ¬мҡ©н• кІҪмҡ°, нҳҲмӨ‘ лҶҚлҸ„ мёЎм •мқ„ к¶Ңкі н•ҳкі мһҲмңјл©°, NOAC лҢҖмӢ мҷҖнҢҢлҰ° мӮ¬мҡ©лҸ„ кі л Өн• мҲҳ мһҲлӢӨкі к¶Ңкі н•ҳкі мһҲлӢӨ[52].7) мғҒл¶Җмң„мһҘкҙҖ м¶ңнҳҲ
7) мғҒл¶Җмң„мһҘкҙҖ м¶ңнҳҲ
4к°ңмқҳ мЈјмҡ” л¬ҙмһ‘мң„ л°°м • м—°кө¬лҘј 분м„қн•ң л©”нғҖ м—°кө¬м—җм„ң NOACлҠ” мҷҖнҢҢлҰ°м—җ 비н•ҳм—¬ лҮҢлӮҙм¶ңнҳҲмқҖ лҚ” м Ғм—ҲмңјлӮҳ, мҶҢнҷ”кё°кҙҖмқҳ м¶ңнҳҲмқҖ мң мқҳлҜён•ҳкІҢ мҰқк°Җн•ҳмҳҖлӢӨ[53]. мЈјмҡ” л¬ҙмһ‘мң„ лҢҖмЎ°мӢңн—ҳм—җм„ң м•„н”ҪмӮ¬л°ҳкіј м Җмҡ©лҹү лӢӨ비к°ҖнҠёлһҖ л°Ҹ м Җмҡ©лҹү м—җлҸ…мӮ¬л°ҳмқҖ мң„мһҘкҙҖм¶ңнҳҲмқ„ мҰқк°ҖмӢңнӮӨм§Җ м•Ҡм•ҳлӢӨ. 비нғҖлҜј KлҘј нҶөн•ҳм—¬ к°„м ‘м ҒмңјлЎң мһ‘мҡ©н•ҳлҠ” мҷҖнҢҢлҰ°кіј лӢ¬лҰ¬ NOACлҠ” мҶҢнҷ”кё°кҙҖм—җм„ң м§Ғм ‘ нқЎмҲҳлҗңлӢӨлҠ” м җмқҙ мҷҖнҢҢлҰ°м—җ 비н•ҳм—¬ мҶҢнҷ”кё°кҙҖмқҳ м¶ңнҳҲмқҙ мҰқк°Җн•ҳлҠ” мӣҗмқёмңјлЎң мғқк°ҒлҗңлӢӨ. лӢӨл§Ң мқҙнӣ„мқҳ л©”нғҖ м—°кө¬м—җм„ңлҠ” NOACк°Җ мҷҖнҢҢлҰ°м—җ 비н•ҳм—¬ мЈјмҡ” мң„мһҘкҙҖм¶ңнҳҲмқҙ мҰқк°Җн•ҳм§Җ м•ҠлҠ”лӢӨлҠ” ліҙкі лҸ„ мһҲлӢӨ[54]. к°ңлі„ NOACл“Өмқ„ 비көҗн•ң лҢҖк·ңлӘЁ л¬ҙмһ‘мң„ лҢҖмЎ°мӢңн—ҳмқҖ м—ҶмңјлӮҳ, лҢҖк·ңлӘЁ кҙҖм°° м—°кө¬м—җм„ң лҰ¬л°”лЎқмӮ¬л°ҳ 20 mgмқҖ лӢӨ비к°ҖнҠёлһҖ 150 mgм—җ 비н•ҳм—¬ ліҙлӢӨ л§ҺмқҖ мң„мһҘкҙҖм¶ңнҳҲмқ„ ліҙмҳҖкі [55], м•„н”ҪмӮ¬л°ҳмқҖ лӢӨлҘё NOACм—җ 비н•ҳм—¬ ліҙлӢӨ м ҒмқҖ мң„мһҘкҙҖм¶ңнҳҲмқ„ ліҙмҳҖлӢӨ. лҜёкөӯм—җм„ң 164л§ҢлӘ…мқҳ нҷҳмһҗлҘј лҢҖмғҒмңјлЎң мҲҳн–үлҗң нӣ„н–ҘмҪ”нҳёнҠё м—°кө¬м—җм„ңлҸ„ мң„мһҘкҙҖм¶ңнҳҲлЎң мқён•ң мһ…мӣҗмқҖ лҰ¬л°”лЎқмӮ¬л°ҳм—җм„ң к°ҖмһҘ лҶ’м•ҳмңјл©°, м•„н”ҪмӮ¬л°ҳмқҙ к°ҖмһҘ лӮ®мқҖ кІҪн–Ҙмқ„ ліҙмҳҖкі , м–‘м„ұмһҗ нҺҢн”„м Җн•ҙм ңлҘј лі‘мҡ©н•ң нҷҳмһҗл“ӨмқҖ мң„мһҘкҙҖм¶ңнҳҲлЎң мқён•ң мһ…мӣҗмқҙ м Ғм—ҲлӢӨ[56]. лҰ¬л°”лЎқмӮ¬л°ҳмқҖ н•ҳлЈЁ н•ңлІҲ ліөмҡ©н•ҳкё° л•Ңл¬ём—җ мғҒлҢҖм ҒмңјлЎң лҶ’мқҖ мөңкі нҳҲмӨ‘ лҶҚлҸ„лҘј ліҙмқҙл©°, мқҙкІғмқҙ ліҙлӢӨ л§ҺмқҖ мң„мһҘкҙҖм¶ңнҳҲкіј кҙҖл Ёмқҙ мһҲлҠ” кІғмңјлЎң мғқк°Ғлҗҳл©°, лӢӨ비к°ҖнҠёлһҖмқҖ м•Ҫл¬ј м ңнҳ•м—җ н•Ёмң лҗң мЈјм„қмӮ°мқҙ м җл§ү мҶҗмғҒкіј кҙҖл Ёмқҙ мһҲлҠ” кІғмңјлЎң 여겨진лӢӨ.8) Embolic stroke of undetermined source (ESUS)
8) Embolic stroke of undetermined source (ESUS)
мӢ¬л°©м„ёлҸҷкіј к°ҷмқҖ лҡңл ·н•ң мӢ¬мһҘм„ұмғүм „ мӣҗмқёмқҙ м—ҶмңјлӮҳ, мғүм „м„ұ лҮҢмЎёмӨ‘мқҙ мқҳмӢ¬лҗҳлҠ” ESUS нҷҳмһҗм—җм„ң н•ӯмқ‘кі м ң нҲ¬м—¬лҘј к¶Ңкі н•ҳлҠ” мқҳкІ¬мқҙ мһҲм–ҙмҷ”лӢӨ[57]. ESUS нҷҳмһҗм—җм„ң м•„мҠӨн”јлҰ° 100 mgкіј лҰ¬л°”лЎқмӮ¬л°ҳ 15 mgмқ„ 비көҗн•ң NAVIGATE-ESUS [58] л°Ҹ лӢӨ비к°ҖнҠёлһҖ 110 mg лҳҗлҠ” 150 mgмқ„ 비көҗн•ң RE-SPECT ESUS [59] м—°кө¬к°Җ 진н–үлҗҳм—ҲмңјлӮҳ л‘җ м•Ҫл¬ј лӘЁл‘җ м•„мҠӨн”јлҰ°м—җ лҢҖ비н•ҳм—¬ мһ¬л°ңм„ұ лҮҢмЎёмӨ‘ мҳҲл°©мқҳ мҡ°мӣ”м„ұмқ„ мһ…мҰқн•ҳм§Җ лӘ»н•ҳмҳҖмңјл©°, мЈјмҡ” м¶ңнҳҲмқҖ лҰ¬л°”лЎқмӮ¬л°ҳм—җм„ңлҠ” мҰқк°Җн•ҳмҳҖмңјлӮҳ лӢӨ비к°ҖнҠёлһҖмқҖ м•„мҠӨн”јлҰ°кіј мқҳлҜё мһҲлҠ” м°ЁмқҙлҠ” м—Ҷм—ҲлӢӨ.9) л§Ңм„ұмҪ©нҢҘлі‘
9) л§Ңм„ұмҪ©нҢҘлі‘
мӢ¬л°©м„ёлҸҷмқҙ мһҲлҠ” нҷҳмһҗм—җм„ң мҪ©нҢҘлі‘мқҳ мң лі‘лҘ мқҖ мҰқк°Җн•ҳл©°, мҪ©нҢҘлі‘мқҖ мӢ¬л°©м„ёлҸҷмқҳ л°ңмғқмқ„ мҙү진н•ңлӢӨ[60]. лҳҗн•ң мӢ мһҘмқҖ NOACмқҳ л°°м¶ңм—җ мЈјмҡ”н•ң м—ӯн• мқ„ н•ҳлҠ”лҚ°, лӢӨ비к°ҖнҠёлһҖмқҖ 80%к°Җ мӢ мһҘмңјлЎң л°°м„Өлҗҳл©°, м—җлҸ…мӮ¬л°ҳмқҖ 50%, лҰ¬л°”лЎқмӮ¬л°ҳмқҖ 35%, м•„н”ҪмӮ¬л°ҳмқҖ 27%к°Җ мӢ мһҘмңјлЎң л°°м„ӨлҗңлӢӨ(Table 2). мқҙм—җ л”°лқј 4к°Җм§Җ NOAC лӘЁл‘җ нҲ¬м—¬мӢңм—җ мӢ мһҘкё°лҠҘмқ„ кі л Өн•ҳм—¬ мҡ©лҹүмқ„ мЎ°м Ҳн• кІғмқҙ к¶Ңкі лҗҳкі мһҲлӢӨ. 4к°ңмқҳ мЈјмҡ” л¬ҙмһ‘мң„ лҢҖмЎ°мӢңн—ҳм—җм„ң NOACлҠ” мӨ‘л“ұлҸ„мқҳ л§Ңм„ұмҪ©нҢҘлі‘(нҒ¬л Ҳм•„нӢ°лӢҢ мІӯмҶҢмңЁ, 30-49 mL/min)мқҙ мһҲлҠ” нҷҳмһҗм—җм„ңлҸ„ мҷҖнҢҢлҰ°м—җ 비н•ҳм—¬ мң мӮ¬н•ҳкұ°лӮҳ мҡ°мӣ”н•ң кІ°кіјлҘј ліҙмҳҖлӢӨ. ARISTOTLE м—°кө¬м—җм„ңлҠ” нҒ¬л Ҳм•„нӢ°лӢҢмІӯмҶҢмңЁмқҙ 25-30 mL/minмқё нҷҳмһҗ 270лӘ…мқҙ л“ұлЎқлҗҳм—ҲлҠ”лҚ°, н•ҳмң„к·ёлЈ№ 분м„қм—җм„ң нҡЁкіјлҠ” мҷҖнҢҢлҰ°кіј мң мӮ¬н•ҳмҳҖмңјл©°, м¶ңнҳҲмқҖ мҷҖнҢҢлҰ°м—җ 비н•ҳм—¬ м Ғм—ҲлӢӨ[61]. к·ёлҹ¬лӮҳ мқҙліҙлӢӨ мӢ мһҘкё°лҠҘмқҙ м Җн•ҳлҗң нҷҳмһҗл“ӨмқҖ мЈјмҡ” л¬ҙмһ‘мң„ лҢҖмЎ°мӢңн—ҳм—җм„ң м ңмҷёлҗҳм—Ҳмңјл©°, мқҙм—җ л”°лқј мқҙ нҷҳмһҗл“Өм—җкІҢм„ң NOACмқҳ нҲ¬м—¬лҠ” к·јкұ°к°Җ л¶ҖмЎұн•ҳлӢӨ.лҢҖн•ңл¶Җм •л§Ҙн•ҷнҡҢмқҳ 2018л…„ 진лЈҢм§Җм№Ём—җм„ң лӢӨ비к°ҖнҠёлһҖмқҖ нҒ¬л Ҳм•„нӢ°лӢҢмІӯмҶҢмңЁмқҙ 30-50 mL/minмқё нҷҳмһҗм—җкІҢ н•ҳлЈЁ 110 mg 2нҡҢ нҲ¬м—¬лҘј к¶Ңкі н•ҳкі мһҲмңјл©°, лҰ¬л°”лЎқмӮ¬л°ҳмқҖ нҒ¬л Ҳм•„нӢ°лӢҢмІӯмҶҢмңЁмқҙ 15-50 mL/minмқё нҷҳмһҗм—җкІҢ н•ҳлЈЁ 15 mg 1нҡҢ нҲ¬м—¬, м•„н”ҪмӮ¬л°ҳмқҖ нҳҲмӨ‘ нҒ¬л Ҳм•„нӢ°лӢҢмқҙ 1.5 mg/dLмқҙмғҒмқё нҷҳмһҗм—җм„ң(лӢӨлҘё кё°мӨҖ мӨ‘ 1к°Җм§Җ мқҙмғҒ 충мЎұ мӢң) н•ҳлЈЁ 2.5 mg 2нҡҢ нҲ¬м—¬, м—җлҸ…мӮ¬л°ҳмқҖ нҒ¬л Ҳм•„нӢ°лӢҢмІӯмҶҢмңЁмқҙ 15-50 mL/minмқё нҷҳмһҗм—җм„ң н•ҳлЈЁ 30 mg 1нҡҢ нҲ¬м—¬н•ҳлҸ„лЎқ к¶Ңкі н•ҳкі мһҲлӢӨ(Table 1) [62]. лҜёкөӯм—җм„ңлҠ” м•ҪлҸҷн•ҷм Ғмқё м—°кө¬ кІ°кіјлҘј л°”нғ•мңјлЎң нҒ¬л Ҳм•„нӢ°лӢҢмІӯмҶҢмңЁмқҙ 15м—җм„ң 29 mL/minмӮ¬мқҙмқё нҷҳмһҗм—җкІҢ лӢӨ비к°ҖнҠёлһҖ 75 mgмқҳ нҲ¬м—¬к°Җ н—Ҳмҡ©лҗҳм–ҙ мһҲкі , мң лҹҪм—җм„ңлҠ” к°ҷмқҖ нҷҳмһҗл“Өм—җкІҢ лҰ¬л°”лЎқмӮ¬л°ҳ, м•„н”ҪмӮ¬л°ҳ, м—җлҸ…мӮ¬л°ҳмқ„ мҡ©лҹү мЎ°м Ҳн•ҳм—җ мЈјмқҳн•ҳм—¬ мӮ¬мҡ©н•ҳлҸ„лЎқ к¶Ңкі лҗңлӢӨ. мӢ мһҘкё°лҠҘмқҳ м Җн•ҳк°Җ мўҖ лҚ” 진н–үлҗң кІҪмҡ°(нҒ¬л Ҳм•„нӢ°лӢҢмІӯмҶҢмңЁ 15 mL/min лҜёл§Ң) л°Ҹ нҲ¬м„қнҷҳмһҗм—җм„ң NOACмқҳ нҲ¬м—¬лҠ” м•„м§Ғ лҢҖк·ңлӘЁ л¬ҙмһ‘мң„ лҢҖмЎ°мӢңн—ҳмқҙ м—Ҷмңјл©°, нҲ¬м—¬ к·јкұ°к°Җ л¶ҖмЎұн•ҳм—¬ нҳ„мһ¬ көӯлӮҙ 진лЈҢм§Җм№Ём—җм„ңлҠ” к¶Ңкі лҗҳкі мһҲм§Җ м•ҠмңјлӮҳ, 2021л…„ к°ңм •лҗң лҜёкөӯмӢ¬мһҘ/лҮҢмЎёмӨ‘н•ҷнҡҢмқҳ 진лЈҢм§Җм№Ём—җм„ңлҠ” л§җкё°мӢ мһҘлі‘мқҙ мһҲлҠ” нҷҳмһҗмқҙкұ°лӮҳ нҲ¬м„қ нҷҳмһҗм—җм„ң мҷҖнҢҢлҰ°кіј н•Ёк»ҳ м•„н”ҪмӮ¬л°ҳмқ„ мӮ¬мҡ©н• мҲҳ мһҲлӢӨкі к¶Ңкі н•ҳкі мһҲлӢӨ(к¶Ңкі мҲҳмӨҖ 2b) [2]. м•Ҫ 25,500лӘ…мқҳ нҲ¬м„қмқ„ л°ӣлҠ” л©”л””мјҖм–ҙ нҷҳмһҗл“Өмқ„ лҢҖмғҒмңјлЎң лҜёкөӯм—җм„ң 진н–үлҗң кҙҖм°° м—°кө¬м—җм„ң м•„н”ҪмӮ¬л°ҳ 5 mg н•ҳлЈЁ 2нҡҢ нҲ¬м—¬кө°мқҖ мҷҖнҢҢлҰ°кіј мң мӮ¬н•ң лҮҢмЎёмӨ‘/м „мӢ мғүм „мҰқмқ„ ліҙмҳҖмңјл©°, мЈјмҡ” м¶ңнҳҲмқҖ лҚ” м Ғм—ҲлӢӨ[63]. нҳҲм•ЎнҲ¬м„қ нҷҳмһҗл“Өмқ„ лҢҖмғҒмңјлЎң н•ң кҙҖм°° м—°кө¬л“Өмқ„ л©”нғҖ 분м„қн•ң м—°кө¬м—җм„ңлҸ„ м•„н”ҪмӮ¬л°ҳ 5 mg н•ҳлЈЁ 2нҡҢ нҲ¬м—¬кө°мқҖ м•„н”ҪмӮ¬л°ҳ 2.5 mg н•ҳлЈЁ 2нҡҢ нҲ¬м—¬кө°м—җ 비н•ҳм—¬ лҚ” м ҒмқҖ мӮ¬л§қмқ„, мҷҖнҢҢлҰ°мқҙлӮҳ лӢӨ비к°ҖнҠёлһҖ, лҰ¬л°”лЎқмӮ¬л°ҳ нҲ¬м—¬кө°м—җ 비н•ҳм—¬ м ҒмқҖ м¶ңнҳҲмқ„ ліҙмҳҖлӢӨ[64].10) к°„м§Ҳнҷҳ
10) к°„м§Ҳнҷҳ
к°„м§Ҳнҷҳмқҙ мһҲлҠ” нҷҳмһҗлҠ” м¶ңнҳҲ кІҪн–Ҙмқҙ мҰқк°Җн•ҳм§Җл§Ң, мқҙмҷҖ н•Ёк»ҳ нҳҲм „мқҙ л°ңмғқн• к°ҖлҠҘм„ұлҸ„ мҰқк°Җн•ңлӢӨ. к°„мқҖ лҳҗн•ң NOACмқҳ м•Ҫл¬ј лҢҖмӮ¬м—җ кҙҖм—¬н•ҳлҠ”лҚ°, 73%мқҳ м•„н”ҪмӮ¬л°ҳмқҙ к°ҖмһҘ л§ҺмқҖ к°„лҢҖмӮ¬лҘј кұ°м№ҳл©°, лҰ¬л°”лЎқмӮ¬л°ҳмқҖ 65%, м—җлҸ…мӮ¬л°ҳмқҖ 50%, лӢӨ비к°ҖнҠёлһҖмқҖ м•Ҫл¬јмқҳ 20%к°Җ к°„лҢҖмӮ¬лҘј кұ°міҗ м ңкұ°лҗңлӢӨ(Table 2). мқјл°ҳм ҒмңјлЎң Child-Pugh class Aмқҳ к°„кІҪнҷ” нҷҳмһҗм—җм„ңлҠ” лӘЁл“ NOACмқҳ мӮ¬мҡ©мқҙ к°ҖлҠҘн•ҳл©°, Child-Pugh class Bмқҳ к°„кІҪнҷ” нҷҳмһҗм—җм„ң лӢӨ비к°ҖнҠёлһҖ, м•„н”ҪмӮ¬л°ҳ, м—җлҸ…мӮ¬л°ҳмқҖ мҡ©лҹүмқ„ мЎ°м Ҳн•ҳм—¬ мӮ¬мҡ©н• кІғмқ„, лҰ¬л°”лЎқмӮ¬л°ҳмқҖ мӮ¬мҡ©мқ„ м ңн•ңн•ҳлҠ” кІғмқ„ к¶Ңкі н•ҳкі мһҲмңјл©°, class Cмқҳ к°„кІҪнҷ” нҷҳмһҗм—җм„ңлҠ” лӘЁл“ NOACмқҳ мӮ¬мҡ©мқ„ м ңн•ңн• кІғмқ„ к¶Ңкі н•ҳкі мһҲлӢӨ[65]. көӯлҜјкұҙк°•ліҙн—ҳкіөлӢЁмқҳ мһҗлЈҢлҘј мқҙмҡ©н•ҳм—¬ к°„м§Ҳнҷҳмқҙ мһҲлҠ” 24,757лӘ…мқҳ NOACлҘј мӮ¬мҡ©н•ң нҷҳмһҗл“Өкіј 12,778лӘ…мқҳ мҷҖнҢҢлҰ°мқ„ мӮ¬мҡ©н•ң нҷҳмһҗл“Өмқ„ 비көҗ분м„қн•ң м—°кө¬м—җм„ң NOACлҠ” лҮҢмЎёмӨ‘, лҮҢм¶ңнҳҲ, мҶҢнҷ”кё°м¶ңнҳҲ л“ұмқҳ н•ӯлӘ©м—җм„ң лӘЁл‘җ мҷҖнҢҢлҰ°м—җ 비н•ҳм—¬ мҡ°мӣ”н•ҳмҳҖмңјл©°, мқҙлҹ¬н•ң кІҪн–ҘмқҖ ліҙлӢӨ мӢ¬к°Ғн•ң к°„м§Ҳнҷҳмқҙ мһҲлҠ” нҷҳмһҗм—җм„ңлҸ„ мң мӮ¬н•ҳмҳҖлӢӨ[66].11) м•” нҷҳмһҗ
11) м•” нҷҳмһҗ
м•” нҷҳмһҗм—җм„ңлҠ” лҮҢмЎёмӨ‘мқҳ л°ңмғқмқҙ мҰқк°Җн•ҳлҠ” кІғмңјлЎң м•Ңл Өм ё мһҲмңјл©°, лӢӨм–‘н•ң кё°м „мқҙ м ңмӢңлҗҳкі мһҲлӢӨ[67,68]. м•” нҷҳмһҗм—җм„ң NOACлҘј лҢҖмғҒмңјлЎң мҲҳн–үлҗң л¬ҙмһ‘мң„ лҢҖмЎ°мӢңн—ҳл“ӨмқҖ м•” нҷҳмһҗм—җм„ң 비көҗм Ғ нқ”н•ҳкІҢ л°ңмғқн•ҳлҠ” м •л§ҘнҳҲм „мғүм „мҰқмқ„ мЈјмҡ”н•ң кІ°кіјлЎң мӮјм•„м„ң 진н–үлҗҳм–ҙ лҮҢмЎёмӨ‘мқҖ мЈјмҡ” кІ°кіјм—җ нҸ¬н•Ёлҗҳм§Җ м•Ҡм•ҳмңјл©°, м•” нҷҳмһҗм—җкІҢм„ң л°ңмғқн•ң лҮҢмЎёмӨ‘мқҳ м•Ҫл¬ј м№ҳлЈҢлҠ” м•„м§Ғ нҷ•лҰҪлҗҳм–ҙ мһҲм§Җ м•ҠлӢӨ[69]. м•” нҷҳмһҗм—җм„ң лҢҖк·ңлӘЁ л¬ҙмһ‘мң„ лҢҖмЎ° мӢңн—ҳмқҖ м Җ분мһҗлҹү н—ӨнҢҢлҰ°мқё лӢ¬н…ҢнҢҢлҰ°(dalteparin)кіј м—җлҸ…мӮ¬л°ҳ, м•„н”ҪмӮ¬л°ҳ, лҳҗлҠ” лҰ¬л°”лЎқмӮ¬л°ҳмқ„ 비көҗн•ҳм—¬ мҲҳн–үлҗҳм—ҲлӢӨ. м—җлҸ…мӮ¬л°ҳмқҖ м •л§ҘнҳҲм „ мғүм „мҰқмқҳ мһ¬л°ңкіј мЈјмҡ” м¶ңнҳҲмқ„ н•©н•ҳмҳҖмқ„ л•Ң лӢ¬н…ҢнҢҢлҰ°м—җ 비н•ҳм—¬ 비м—ҙл“ұн•ҳмҳҖмңјлӮҳ, мЈјмҡ”м¶ңнҳҲл§Ңмқ„ 분м„қн•ҳмҳҖмқ„ л•Ңм—җлҠ” мҰқк°Җн•ҳлҠ” кІҪн–Ҙмқ„ ліҙмҳҖлӢӨ[70]. лҰ¬л°”лЎқмӮ¬л°ҳмқҖ м •л§ҘнҳҲм „мғүм „мҰқ мһ¬л°ңм—җ мһҲм–ҙм„ң лӢ¬н…ҢнҢҢлҰ°м—җ 비н•ҳм—¬ мҡ°мӣ”н•ң кІҪн–Ҙмқ„ ліҙмҳҖмңјл©°, мЈјмҡ” м¶ңнҳҲмқҖ м•Ҫк°„ мҰқк°Җн•ҳмҳҖмңјлӮҳ, нҶөкі„м ҒмңјлЎңлҠ” мқҳлҜёмһҲлҠ” м°ЁмқҙлҠ” м—Ҷм—ҲлӢӨ[71]. м•„н”ҪмӮ¬л°ҳмқҖ м •л§ҘнҳҲм „мғүм „мҰқмқҳ мһ¬л°ңмқ„ мҳҲл°©н•ҳлҠ” лҚ° мһҲм–ҙ лӢ¬н…ҢнҢҢлҰ°м—җ 비н•ҳм—¬ 비м—ҙл“ұн•ҳмҳҖмңјл©°, мЈјмҡ”м¶ңнҳҲмқҖ лӢ¬н…ҢнҢҢлҰ°кіј м°Ёмқҙк°Җ м—Ҷм—ҲлӢӨ[72]. көӯлӮҙм—җм„ңлҸ„ м•” нҷҳмһҗм—җкІҢм„ң л°ңмғқн•ң лҮҢмЎёмӨ‘мқҖ NOACмқҳ н—Ҳк°ҖмӮ¬н•ӯмқҙ м•„лӢҲл©°, м•”нҷҳмһҗм—җм„ң лҮҢмЎёмӨ‘мқҳ мһ¬л°ңмқ„ мЈјмҡ” кІ°кіјлЎң мӮјм•„ м—җлҸ…мӮ¬л°ҳкіј лӢ¬н…ҢнҢҢлҰ°мқ„ 비көҗн•ҳлҠ” л¬ҙмһ‘мң„ лҢҖмЎ°мӢңн—ҳмқҙ нҳ„мһ¬ мҲҳн–ү мӨ‘мқҙлӢӨ(OASIS-CANCER; NCT02743052).
нҳ„мһ¬ мӮ¬мҡ©н• мҲҳ мһҲлҠ” NOACмқҳ мў…лҘҳлЎңлҠ” м§Ғм ‘ нҠёлЎ¬л№Ҳм–өм ңм ң(direct thrombin inhibitor)мқё лӢӨ비к°ҖнҠёлһҖкіј мқ‘кі мқёмһҗ Xaм–өм ңм ң(factor Xa inhibitor)мқё лҰ¬л°”лЎқмӮ¬л°ҳ, м•„н”ҪмӮ¬л°ҳ, м—җлҸ…мӮ¬л°ҳмқҙ мһҲлӢӨ. NOACлҠ” 비нҢҗл§ү мӢ¬л°©м„ёлҸҷм—җ мқҳн•ң н—ҲнҳҲлҮҢмЎёмӨ‘ лҳҗлҠ” мқјкіјм„ұ н—ҲнҳҲл°ңмһ‘ нҷҳмһҗмқҳ мқҙм°Ё мҳҲл°© м•Ҫм ңлЎң мҷҖнҢҢлҰ°м—җ мҡ°м„ н•ҳм—¬ к¶Ңкі лҗңлӢӨ[2]. мқҙлҹ¬н•ң 4к°Җм§Җ NOAC м•Ҫм ңлҠ” лҢҖк·ңлӘЁ л¬ҙмһ‘мң„ лҢҖмЎ°мӢңн—ҳм—җм„ң мҷҖнҢҢлҰ°м—җ 비н•ҳм—¬ н—ҲнҳҲлҮҢмЎёмӨ‘ л°Ҹ м „мӢ мғүм „мқҳ л°ңмғқлҘ мқҖ мң мӮ¬н•ҳкұ°лӮҳ м Ғм—Ҳмңјл©°, мЈјмҡ” м¶ңнҳҲл¶Җмһ‘мҡ©мқҖ м Ғм—ҲлӢӨ. 2021л…„ л°ңн‘ңлҗң лҜёкөӯ лҮҢмЎёмӨ‘н•ҷнҡҢмқҳ 진лЈҢ м§Җм№Ём—җм„ңлҠ” NOAC мӮ¬мҡ©мқҳ кёҲкё°м—җ н•ҙлӢ№лҗҳлҠ” кІҪмҡ°к°Җ м•„лӢҲл©ҙ, 비нҢҗл§ү мӢ¬л°©м„ёлҸҷ нҷҳмһҗмқҳ н—ҲнҳҲлҮҢмЎёмӨ‘мқҳ мҳҲл°©мқ„ мң„н•ҳм—¬ 비нғҖлҜј K кёён•ӯм ңліҙлӢӨлҠ” NOACмқҳ мӮ¬мҡ©мқ„ мҡ°м„ м ҒмңјлЎң к¶ҢмһҘн•ҳкі мһҲлӢӨ[2].
- кІ° лЎ
- кІ° лЎ
мһ„мғҒнҳ„мһҘм—җм„ң мӢ¬л°©м„ёлҸҷм—җ мқҳн•ң н—ҲнҳҲлҮҢмЎёмӨ‘мқ„ мҳҲл°©н•ҳкё° мң„н•ң н•ӯмқ‘кі м ңлЎңм„ң NOACлҠ” л„җлҰ¬ м“°мқҙкі мһҲлӢӨ. NOACлҠ” мЈјкё°м Ғмқё н”„лЎңнҠёлЎ¬л№Ҳ мӢңк°„мқҳ 추м ҒкІҖмӮ¬к°Җ н•„мҡ”к°Җ м—Ҷкі , 비көҗм Ғ м•Ҫл¬ј мғҒнҳёмһ‘мҡ©мқҙ м Ғмңјл©°, м•Ҫл¬јмқҳ нҡЁкіјмҳҲмёЎмқҙ 비көҗм Ғ лӢЁмҲңн•ң м җ л“ұмқҳ мһҘм җмқҙ мһҲм–ҙ мҷҖнҢҢлҰ°мқҳ мң„м№ҳлҘј лҢҖмІҙн•ҳкі мһҲлӢӨ. нҠ№нһҲ мҡ°лҰ¬лӮҳлқјм—җм„ңлҠ” 비нғҖлҜј KмҷҖ л¬ҙкҙҖн•ң NOACмқҳ м•Ҫл¬ј мһ‘мҡ© кё°м „ лҚ•л¶„м—җ мқҢмӢқл¬јкіјмқҳ мғҒнҳёмһ‘мҡ©мңјлЎң мқён•ҳм—¬ мҷҖнҢҢлҰ°мқҳ м№ҳлЈҢлІ”мң„м—җм„ң мһҳ мЎ°м Ҳлҗҳм§Җ м•Ҡм•„ м Ғм Ҳн•ң н•ӯмқ‘кі м№ҳлЈҢлҘј л°ӣм§Җ лӘ»н•ҳлҚҳ нҷҳмһҗл“Өм—җкІҢ мўӢмқҖ лҢҖмІҙм ңк°Җ лҗҳм—ҲлӢӨ. NOAC лҸ„мһ… мҙҲкё°м—җлҠ” 비нҢҗл§ү мӢ¬л°©м„ёлҸҷмқ„ лҸҷл°ҳн•ң нҷҳмһҗм—җм„ңл§Ң мӮ¬мҡ©лҗҳм—Ҳмңјл©°, кёҲкё°м—җ н•ҙлӢ№н•ҳлҠ” м§ҲнҷҳлҸ„ л§Һм•ҳмңјлӮҳ, лӢӨм–‘н•ң мһ„мғҒ м—°кө¬лҘј нҶөн•ҳм—¬ мӢ¬л°©м„ёлҸҷ мқҙмҷёмқҳ лӢӨм–‘н•ң м§ҲнҷҳмңјлЎң м Ғмҡ©лІ”мң„к°Җ м җм°Ё л„“м–ҙм§Җкі мһҲлӢӨ[73].нҳ„мһ¬ мҡ°лҰ¬лӮҳлқјм—җм„ң мІҳл°© к°ҖлҠҘн•ң NOACлҠ” л„Ө к°Җм§ҖмқҙлӢӨ. лӮҳмқҙ, мІҙмӨ‘ л°Ҹ к°„кё°лҠҘ, мӢ кё°лҠҘкіј к°ҷмқҖ лӢӨм–‘н•ң мһ„мғҒмҡ”мқёмқ„ кі л Өн•ҳм—¬ м•Ңл§һмқҖ NOACлҘј м„ нғқн•ҳкі к°Ғк°Ғмқҳ мҡ©лҹү кё°мӨҖм—җ л§һкІҢ мӮ¬мҡ©н•ҳм—¬м•ј н•ңлӢӨ. лҳҗн•ң мҷҖнҢҢлҰ°ліҙлӢӨлҠ” м Ғм§Җл§Ң, лӢӨлҘё м•Ҫл¬јкіјмқҳ мғҒнҳёмһ‘мҡ©мқҖ NOACмқҳ лҶҚлҸ„м—җ мҳҒн–Ҙмқ„ мӨ„ мҲҳ мһҲлӢӨ. л”°лқјм„ң м•Ҫл¬ј к°„мқҳ мғҒнҳёмһ‘мҡ©м—җ лҢҖн•ҳм—¬лҸ„ мҲҷм§Җн• н•„мҡ”к°Җ мһҲмңјл©°, 추к°Җм ҒмңјлЎң NOACмқҳ мІҳл°© лҳҗлҠ” мң м§Җ мӢң, нҳ„мһ¬ ліөмҡ© лҳҗлҠ” мғҲлЎң мӢңмһ‘н•ҳлҠ” м•Ҫл¬јм—җ лҢҖн•ң нҷ•мқёлҸ„ н•„мҡ”н• кІғмқҙлӢӨ. NOACмқҳ м Ғмқ‘мҰқмқҖ м җм°Ё нҷ•лҢҖлҗҳкі мһҲмңјл©°, нҳ„мһ¬ мқ‘кі мқёмһҗXIм—җ мһ‘мҡ©н•ҳлҠ” мғҲлЎңмҡҙ NOACк°Җ к°ңл°ңлҗҳкі мһҲлӢӨ. лҳҗн•ң, м•„м§Ғ л°қнҳҖм§Җм§Җ м•ҠмқҖ NOACмқҳ м—¬лҹ¬ м Ғмҡ© к°ҖлҠҘн•ң мғҒнҷ© л°Ҹ м•Ҳм „н•ң мӮ¬мҡ©мқ„ мң„н•ң м—¬лҹ¬ м—°кө¬л“Өмқҙ нҳ„мһ¬ 진н–үлҗҳкі мһҲм–ҙ мқҙм—җ лҢҖн•ң м§ҖмҶҚм Ғмқё кҙҖмӢ¬мқҙ н•„мҡ”н•ҳлӢӨ.
Figure.
Coagulation cascade and sites of NOAC action. NOAC; non-vitamin K dependent oral anticoagulant.
TableВ 1.
Dose selection criteria of the NOACs
TableВ 2.
Absorption and metabolism of the NOACs
TableВ 3.
Effect of drug-to-drug interaction on NOACs plasma levels [12]
| Via | Dabigatran | Rivaroxaban | Apixaban | Edoxaban | ||
|---|---|---|---|---|---|---|
| P-gp substrate | Yes | Yes | Yes | Yes | ||
| CYP3A4 substrate | No | Yes (about 18%) | Yes (about 25%) | No (<4%) | ||
| Anti-arrythmic agent | ||||||
| вҖғ | Amiodarone | Moderate P-gp inhibition | +12-60%a | Minor effecta | No dataa | +40%a |
| Digoxin | P-gp competition | No effect | No effect | No effect | No effect | |
| Diltiazem | Weak P-gp inhibition & CYP3A4 inhibition | No effect | No effect | +40% | No data | |
| Dronedarone | P-gp & CYP3A4 inhibition | +70-110%c | Moderate affect, should be avoidedc | With cautiona | +85% (dose reduction to 30 mg QD)b | |
| Quinidine | P-gp inhibition | +53%a | Increase but unknown extent.a | No data | +77% (no dose reduction required)a | |
| Verapamil | P-gp inhibition & weak CYP3A4 inhibition | +12-180% (110 mg BID if taken simultaneoulsy)b | +40% a | No data | +53% (no dose reduction required)a | |
| Other cardiovascular drug | ||||||
| Atorvastatin | P-gp inhibitor & CYP3A4 competition | No relevant interaction | No effect | No data | No data | |
| Ticagrelor | P-gp inhibition | +24-65% (loading dose 2 hours after dabigatran)a | No data-carefully monitora | No data-carefully monitora | No data-carefully monitora | |
| Antibiotics | ||||||
| Clarithromycin; Erythromycin | P-gp inhibition & strong CYP3A4 inhibition | Clarithromycin:+19%; +15% Cmaxa | Clarithromycin: +50% AUC; +40% Cmaxa | Clarithromycin: +60% AUC; +30% Cmaxa | Erythromycin: +85% AUC; +69% Cmax,(dose reduction to 30 mg QD)b | |
| Erythromcyin: +30% AUC; +30% Cmaxa | ||||||
| Rifampicin | P-gp/BCRP & CYP3A4/CYP2J2 induction | -66% AUC; -67% Cmaxd | -50% AUC, -22% Cmaxd | -54% AUC; -42% Cmaxd | -35% AUC (but with compensatory increase of active metabolites)e | |
| Antiviral drug | . | |||||
| HIV protease inhibitors (e,g. ritonavir) | P-gp & BRCP inhibition or induction, CYP3A4 inhibition | Variable increase/decreasec | +153% AUC; +55% Cmaxc | Strong increasec | No datac | |
| Antifungal agent | ||||||
| Fluconazole | Moderate CYP3A4 inhibition | No data | +42% AUC; +33% Cmaxa | No data | No data | |
| Itraconazole; ketoconazole | Potent P-gp & BRCP competition, strong CYP3A4 inhibition | +140-150% c | +160% AUC, +72% Cmaxc | +100% AUC; +64% Cmaxc | +87 AUC; +89% Cmax (dose reduction to 30 mg QD)b | |
| Voriconazole | Strong CYP3A4 inhibition | No data | c | c | No data | |
| Other drugs | ||||||
| Naproxen | P-gp competition, pharmacodynamically increased bleeding time | No dataa | No relevant increase of AUCa | +55% AUC; +61% Cmaxa | No difference in AUCa | |
| H2 blocker, PPI, Al-Mg-hydroxide | GI absortpion | Minor effect, not clinically relevant | No effect | No effect | Minor effect, not clinically relevant | |
| SSRIs; SNRIs | Pharmacodynamic effect on platelets | a | a | a | a | |
NOACs; non-vitamin K dependent oral anticoagulants, BID; twice daily, AUC; area under curve, QD; once daily, BRCP; breast cancer resistance protein, HIV; human immunodeficiency virus, PPI; proton pump inhibitor, GI; gastrointestinal, SSRI; selective serotonin reuptake inhibitor, SNRI; serotonin and norepinephrine reuptake inhibitor.
TableВ 4.
Bleeding risk according to the elective surgery/intervention [12]
TableВ 5.
Timing of last NOAC intake before an elective surgery/intervention [12]
- REFERENCES
- REFERENCES
- 1. Jung K-H, Yu K-h, Kim Y-D, Park J-M, Hong K-S, Rha J-H, et al. Focused update of guidelines for antithrombotic management of patients with atrial fibrillation and ischemic stroke or transient ischemic attack. J Korean Neurol Assoc 2016;34:184-192.
[Article]2. Kleindorfer DO, Towfighi A, Chaturvedi S, Cockroft KM, Gutierrez J, Lombardi-Hill D, et al. 2021 guideline for the prevention of stroke in patients with stroke and transient ischemic attack: a guideline from the American Heart Association/American Stroke Association. Stroke 2021;52:e364-e467.
[Article] [PubMed]3. Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Oldgren J, Parekh A, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009;361:1139-1151.
[Article] [PubMed]4. Graham DJ, Reichman ME, Wernecke M, Zhang R, Southworth MR, Levenson M, et al. Cardiovascular, bleeding, and mortality risks in elderly medicare patients treated with dabigatran or warfarin for nonvalvular atrial fibrillation. Circulation 2015;131:157-164.
[Article] [PubMed]5. Granger CB, Alexander JH, McMurray JJ, Lopes RD, Hylek EM, Hanna M, et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011;365:981-992.
[Article] [PubMed]6. Connolly SJ, Eikelboom J, Joyner C, Diener HC, Hart R, Golitsyn S, et al. Apixaban in patients with atrial fibrillation. N Engl J Med 2011;364:806-817.
[Article] [PubMed]7. Patel MR, Mahaffey KW, Garg J, Pan G, Singer DE, Hacke W, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011;365:883-891.
[Article] [PubMed]8. Giugliano RP, Ruff CT, Braunwald E, Murphy SA, Wiviott SD, Halperin JL, et al. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2013;369:2093-2104.
[Article] [PubMed]9. Lee SR, Lee YS, Park JS, Cha MJ, Kim TH, Park J, et al. Label adherence for non-vitamin K antagonist oral anticoagulants in a prospective cohort of asian patients with atrial fibrillation. Yonsei Med J 2019;60:277-284.
[Article] [PubMed] [PMC]10. Blech S, Ebner T, Ludwig-Schwellinger E, Stangier J, Roth W. The metabolism and disposition of the oral direct thrombin inhibitor, dabigatran, in humans. Drug Metab Dispos 2008;36:386-399.
[Article] [PubMed]11. Steffel J, Collins R, Antz M, Cornu P, Desteghe L, Haeusler KG, et al. 2021 European heart rhythm association practical guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation. Europace 2021;23:1612-1676.
[PubMed]12. Chang SH, Chou IJ, Yeh YH, Chiou MJ, Wen MS, Kuo CT, et al. Association between use of non-vitamin K oral anticoagulants with and without concurrent medications and risk of major bleeding in nonvalvular atrial fibrillation. JAMA 2017;318:1250-1259.
[Article] [PubMed] [PMC]13. Stollberger C, Finsterer J. Interactions between non-vitamin k oral anticoagulants and antiepileptic drugs. Epilepsy Res 2016;126:98-101.
[Article] [PubMed]14. de Biase S, Nilo A, Bernardini A, Gigli GL, Valente M, Merlino G. Timing use of novel anti-epileptic drugs: Is earlier better? Expert Rev Neurother 2019;19:945-954.
[Article] [PubMed]15. Seiffge DJ, Werring DJ, Paciaroni M, Dawson J, Warach S, Milling TJ, et al. Timing of anticoagulation after recent ischaemic stroke in patients with atrial fibrillation. Lancet Neurol 2019;18:117-126.
[Article] [PubMed]16. Molina CA, Montaner J, Abilleira S, Ibarra B, Romero F, Arenillas JF, et al. Timing of spontaneous recanalization and risk of hemorrhagic transformation in acute cardioembolic stroke. Stroke 2001;32:1079-1084.
[Article] [PubMed]17. Ahmen N, Steiner T, Caso V; Wahlgren N and for the ESO-KSU session participants. Recommendation from the ESO-Karolinska stroke update conference, Stockholm 13-15 November 2016. Eur Stroke J 2017;2:95-102.
[PubMed] [PMC]18. Hindricks G, Potpara T, Dagres N, Arbelo E, Bax JJ, Blomström-Lundqvist C, et al. 2020 ESC guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The task force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) developed with the special contribution of the European Heart Rhythm Association (EHRA) of the esc. Eur Heart J 2021;42:373-498.
[PubMed]19. Eun MY, Kim JY, Hwang YH, Park MS, Kim JT, Choi KH, et al. Initiation of guideline-matched oral anticoagulant in atrial fibrillation-related stroke. J Stroke 2021;23:113-123.
[Article] [PubMed] [PMC]20. Hong KS, Kwon SU, Lee SH, Lee JS, Kim YJ, Song TJ, et al. Rivaroxaban vs warfarin sodium in the ultra-early period after atrial fibrillation-related mild ischemic stroke: a randomized clinical trial. JAMA Neurol 2017;74:1206-1215.
[Article] [PubMed] [PMC]21. Reilly PA, van Ryn J, Eikelboom JW, Glund S, Bernstein RA, et al. Idarucizumab for dabigatran reversal - full cohort analysis. N Engl J Med 2017;377:431-441.
[Article] [PubMed]22. Connolly SJ, Crowther M, Eikelboom JW, Gibson CM, Curnutte JT, Lawrence JH, et al. Full study report of andexanet alfa for bleeding associated with factor xa inhibitors. N Engl J Med 2019;380:1326-1335.
[Article] [PubMed] [PMC]23. Spyropoulos AC, Douketis JD. How i treat anticoagulated patients undergoing an elective procedure or surgery. Blood 2012;120:2954-2962.
[Article] [PubMed]24. Douketis JD, Spyropoulos AC, Duncan J, Carrier M, Le Gal G, Tafur AJ, et al. Perioperative management of patients with atrial fibrillation receiving a direct oral anticoagulant. JAMA Intern Med 2019;179:1469-1478.
[Article] [PubMed] [PMC]25. Benesch C, Glance LG, Derdeyn CP, Fleisher LA, Holloway RG, MessГ© SR, et al. Perioperative neurological evaluation and management to lower the risk of acute stroke in patients undergoing noncardiac, nonneurological surgery: a scientific statement from the American Heart Association/American Stroke Association. Circulation 2021;143:e923-e946.
[Article] [PubMed]26. Lip GY, Nieuwlaat R, Pisters R, Lane DA, Crijns HJ. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the euro heart survey on atrial fibrillation. Chest 2010;137:263-272.
[Article] [PubMed]27. Park H, Han M, Kim YD, Yoo J, Lee HS, Choi JK, et al. Impact of the total number of carotid plaques on the outcome of ischemic stroke patients with atrial fibrillation. J Clin Med 2019;8:1897.
[Article] [PubMed] [PMC]28. Kim JT, Lee JS, Kim BJ, Park JM, Kang K, Lee SJ, et al. Effectiveness of adding antiplatelets to oral anticoagulants in patients with acute ischemic stroke with atrial fibrillation and concomitant large artery steno-occlusion. Transl Stroke Res 2020;11:1322-1331.
[Article] [PubMed]29. Cannon CP, Bhatt DL, Oldgren J, Lip GYH, Ellis SG, Kimura T, et al. Dual antithrombotic therapy with dabigatran after pci in atrial fibrillation. N Engl J Med 2017;377:1513-1524.
[Article] [PubMed]30. Lopes RD, Heizer G, Aronson R, Vora AN, Massaro T, Mehran R, et al. Antithrombotic therapy after acute coronary syndrome or pci in atrial fibrillation. N Engl J Med 2019;380:1509-1524.
[Article] [PubMed]31. Gibson CM, Mehran R, Bode C, Halperin J, Verheugt FW, Wildgoose P, et al. Prevention of bleeding in patients with atrial fibrillation undergoing pci. N Engl J Med 2016;375:2423-2434.
[Article] [PubMed]32. Dewilde WJ, Oirbans T, Verheugt FW, Kelder JC, De Smet BJ, Herrman JP, et al. Use of clopidogrel with or without aspirin in patients taking oral anticoagulant therapy and undergoing percutaneous coronary intervention: An open-label, randomised, controlled trial. Lancet 2013;381:1107-1115.
[Article] [PubMed]33. Lopes RD, Hong H, Harskamp RE, Bhatt DL, Mehran R, Cannon CP, et al. Safety and efficacy of antithrombotic strategies in patients with atrial fibrillation undergoing percutaneous coronary intervention: a network meta-analysis of randomized controlled trials. JAMA Cardiol 2019;4:747-755.
[Article] [PubMed] [PMC]34. Chimowitz MI, Lynn MJ, Howlett-Smith H, Stern BJ, Hertzberg VS, Frankel MR, et al. Comparison of warfarin and aspirin for symptomatic intracranial arterial stenosis. N Engl J Med 2005;352:1305-1316.
[Article] [PubMed]35. Eikelboom JW, Connolly SJ, Brueckmann M, Granger CB, Kappetein AP, Mack MJ, et al. Dabigatran versus warfarin in patients with mechanical heart valves. N Engl J Med 2013;369:1206-1214.
[Article] [PubMed]36. DurГЈes AR, de Souza Roriz P, de Almeida Nunes B, Albuquerque FP, de BulhГөes FV, de Souza Fernandes AM, et al. Dabigatran versus warfarin after bioprosthesis valve replacement for the management of atrial fibrillation postoperatively: dawa pilot study. Drugs R D 2016;16:149-154.
[Article] [PubMed] [PMC]37. GuimarГЈes HP, Lopes RD, de Barros ESPGM, Liporace IL, Sampaio RO, Tarasoutchi F, et al. Rivaroxaban in patients with atrial fibrillation and a bioprosthetic mitral valve. N Engl J Med 2020;383:2117-2126.
[Article] [PubMed]38. Shim CY, Seo J, Kim YJ, Lee SH, De Caterina R, Lee S, et al. Efficacy and safety of edoxaban in patients early after surgical bioprosthetic valve implantation or valve repair: a randomized clinical trial. J Thorac Cardiovasc Surg 2021.
[Article]39. Renda G, Ricci F, Giugliano RP, De Caterina R. Non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation and valvular heart disease. J Am Coll Cardiol 2017;69:1363-1371.
[Article] [PubMed]40. Kim JY, Kim SH, Myong JP, Kim YR, Kim TS, Kim JH, et al. Outcomes of direct oral anticoagulants in patients with mitral stenosis. J Am Coll Cardiol 2019;73:1123-1131.
[Article] [PubMed]41. Hao L, Zhong JQ, Zhang W, Rong B, Xie F, Wang JT, et al. Uninterrupted dabigatran versus warfarin in the treatment of intracardiac thrombus in patients with non-valvular atrial fibrillation. Int J Cardiol 2015;190:63-66.
[Article] [PubMed]42. Lip GY, Hammerstingl C, Marin F, Cappato R, Meng IL, Kirsch B, et al. Left atrial thrombus resolution in atrial fibrillation or flutter: Results of a prospective study with rivaroxaban (x-tra) and a retrospective observational registry providing baseline data (clot-af). Am Heart J 2016;178:126-134.
[Article] [PubMed]43. Ezekowitz MD, Pollack CV Jr, Halperin JL, England RD, VanPelt Nguyen S, Spahr J, et al. Apixaban compared to heparin/vitamin k antagonist in patients with atrial fibrillation scheduled for cardioversion: The emanate trial. Eur Heart J 2018;39:2959-2971.
[Article] [PubMed] [PMC]44. Robinson AA, Trankle CR, Eubanks G, Schumann C, Thompson P, Wallace RL, et al. Off-label use of direct oral anticoagulants compared with warfarin for left ventricular thrombi. JAMA Cardiol 2020;5:685-692.
[Article] [PubMed] [PMC]45. Caldeira D, Nunes-Ferreira A, Rodrigues R, Vicente E, Pinto FJ, Ferreira JJ. Non-vitamin K antagonist oral anticoagulants in elderly patients with atrial fibrillation: a systematic review with meta-analysis and trial sequential analysis. Arch Gerontol Geriatr 2019;81:209-214.
[Article] [PubMed]46. Eikelboom JW, Wallentin L, Connolly SJ, Ezekowitz M, Healey JS, Oldgren J, et al. Risk of bleeding with 2 doses of dabigatran compared with warfarin in older and younger patients with atrial fibrillation: An analysis of the randomized evaluation of long-term anticoagulant therapy (re-ly) trial. Circulation 2011;123:2363-2372.
[Article] [PubMed]47. Okumura K, Akao M, Yoshida T, Kawata M, Okazaki O, Akashi S, et al. Low-dose edoxaban in very elderly patients with atrial fibrillation. N Engl J Med 2020;383:1735-1745.
[Article] [PubMed]48. Park CS, Choi EK, Kim HM, Lee SR, Cha MJ, Oh S. Increased risk of major bleeding in underweight patients with atrial fibrillation who were prescribed non-vitamin K antagonist oral anticoagulants. Heart Rhythm 2017;14:501-507.
[Article] [PubMed]49. Boriani G, Ruff CT, Kuder JF, Shi M, Lanz HJ, Rutman H, et al. Relationship between body mass index and outcomes in patients with atrial fibrillation treated with edoxaban or warfarin in the engage af-timi 48 trial. Eur Heart J 2019;40:1541-1550.
[Article] [PubMed]50. Hohnloser SH, Fudim M, Alexander JH, Wojdyla DM, Ezekowitz JA, Hanna M, et al. Efficacy and safety of apixaban versus warfarin in patients with atrial fibrillation and extremes in body weight. Circulation 2019;139:2292-2300.
[Article] [PubMed]51. Lee SR, Choi EK, Park CS, Han KD, Jung JH, Oh S, et al. Direct oral anticoagulants in patients with nonvalvular atrial fibrillation and low body weight. J Am Coll Cardiol 2019;73:919-931.
[Article] [PubMed]52. Steffel J, Collins R, Antz M, Cornu P, Desteghe L, Haeusler KG, et al. 2021 European Heart Rhythm Assocaition Practical Guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation. Eurospace 2021;23:1612-1676.53. Ruff CT, Giugliano RP, Braunwald E, Hoffman EB, Deenadayalu N, Ezekowitz MD, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials. Lancet 2014;383:955-962.
[Article] [PubMed]54. Burr N, Lummis K, Sood R, Kane JS, Corp A, Subramanian V. Risk of gastrointestinal bleeding with direct oral anticoagulants: a systematic review and network meta-analysis. Lancet Gastroenterol Hepatol 2017;2:85-93.
[Article] [PubMed]55. Graham DJ, Reichman ME, Wernecke M, Hsueh YH, Izem R, Southworth MR, et al. Stroke, bleeding, and mortality risks in elderly medicare beneficiaries treated with dabigatran or rivaroxaban for nonvalvular atrial fibrillation. JAMA Intern Med 2016;176:1662-1671.
[Article] [PubMed]56. Ray WA, Chung CP, Murray KT, Smalley WE, Daugherty JR, Dupont WD, et al. Association of oral anticoagulants and proton pump inhibitor cotherapy with hospitalization for upper gastrointestinal tract bleeding. JAMA 2018;320:2221-2230.
[Article] [PubMed] [PMC]57. Hart RG, Diener HC, Coutts SB, Easton JD, Granger CB, O'Donnell MJ, et al. Embolic strokes of undetermined source: The case for a new clinical construct. Lancet Neurol 2014;13:429-438.
[Article] [PubMed]58. Hart RG, Sharma M, Mundl H, Kasner SE, Bangdiwala SI, Berkowitz SD, et al. Rivaroxaban for stroke prevention after embolic stroke of undetermined source. N Engl J Med 2018;378:2191-2201.
[Article] [PubMed]59. Diener HC, Sacco RL, Easton JD, Granger CB, Bernstein RA, Uchiyama S, et al. Dabigatran for prevention of stroke after embolic stroke of undetermined source. N Engl J Med 2019;380:1906-1917.
[Article] [PubMed]60. Goel N, Jain D, Haddad DB, Shanbhogue D. Anticoagulation in patients with end-stage renal disease and atrial fibrillation: confusion, concerns and consequences. J Stroke 2020;22:306-316.
[Article] [PubMed] [PMC]61. Stanifer JW, Pokorney SD, Chertow GM, Hohnloser SH, Wojdyla DM, Garonzik S, et al. Apixaban versus warfarin in patients with atrial fibrillation and advanced chronic kidney disease. Circulation 2020;141:1384-1392.
[Article] [PubMed]62. Joung B, Lee JM, Lee KH, Kim TH, Choi EK, Lim WH, et al. 2018 korean guideline of atrial fibrillation management. Korean Circ J 2018;48:1033-1080.
[Article] [PubMed] [PMC]63. Siontis KC, Zhang X, Eckard A, Bhave N, Schaubel DE, He K, et al. Outcomes associated with apixaban use in patients with end-stage kidney disease and atrial fibrillation in the united states. Circulation 2018;138:1519-1529.
[Article] [PubMed] [PMC]64. Kuno T, Takagi H, Ando T, Sugiyama T, Miyashita S, Valentin N, et al. Oral anticoagulation for patients with atrial fibrillation on long-term hemodialysis. J Am Coll Cardiol 2020;75:273-285.
[Article] [PubMed]65. Qamar A, Vaduganathan M, Greenberger NJ, Giugliano RP. Oral anticoagulation in patients with liver disease. J Am Coll Cardiol 2018;71:2162-2175.
[Article] [PubMed]66. Lee SR, Lee HJ, Choi EK, Han KD, Jung JH, Cha MJ, et al. Direct oral anticoagulants in patients with atrial fibrillation and liver disease. J Am Coll Cardiol 2019;73:3295-3308.
[Article] [PubMed]67. Navi BB, Howard G, Howard VJ, Zhao H, Judd SE, Elkind MSV, et al. New diagnosis of cancer and the risk of subsequent cerebrovascular events. Neurology 2018;90:e2025-e2033.
[Article] [PubMed] [PMC]68. Bang OY, Chung JW, Lee MJ, Seo WK, Kim GM, Ahn MJ. Cancer-related stroke: an emerging subtype of ischemic stroke with unique pathomechanisms. J Stroke 2020;22:1-10.
[Article] [PubMed] [PMC]69. Powers WJ, Rabinstein AA, Ackerson T, Adeoye OM, Bambakidis NC, Becker K, et al. Guidelines for the early management of patients with acute ischemic stroke: 2019 update to the 2018 guidelines for the early management of acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2019;50:e344-e418.
[Article] [PubMed]70. Raskob GE, van Es N, Verhamme P, Carrier M, Di Nisio M, Garcia D, et al. Edoxaban for the treatment of cancer-associated venous thromboembolism. N Engl J Med 2018;378:615-624.
[Article] [PubMed]71. Young AM, Marshall A, Thirlwall J, Chapman O, Lokare A, Hill C, et al. Comparison of an oral factor xa inhibitor with low molecular weight heparin in patients with cancer with venous thromboembolism: Results of a randomized trial (select-d). J Clin Oncol 2018;36:2017-2023.
[Article] [PubMed]
