경증 급성 뇌경색 환자에서 정맥내혈전용해술 및 혈관내혈전제거술
Intravenous Thrombolysis and Endovascular Thrombectomy in Acute Ischemic Stroke with Minor Symptom
Article information
Trans Abstract
More than 50% of all patients with ischemic stroke initially present with mild symptoms. Despite the mild clinical presentation, a high percentage of these patients develop stroke progression with consequent disability, recurrent stroke, or death at follow-up. Intravenous thrombolysis with recombinant tissue plasminogen activator within 4.5 hours has been proven to be an effective treatment for acute ischemic stroke, but the risk-benefit ratio of this therapeutic approach remains still unclear in patients with mild stroke. Many patients with mild stroke are frequently excluded from thrombolysis. Large artery occlusion is an important predictor of early neurological deterioration or poor outcomes in patients with mild ischemic stroke. However, current guidelines do not recommend endovascular thrombectomy in patients with National Institutes of Health Stroke Scale score of <6 points. Some previous retrospective cohort studies have reported that endovascular thrombectomy showed promising results in cases of acute mild ischemic stroke with large vessel occlusion. Treatment decisions in patients with mild ischemic stroke should be individualized depending on clinical and radiological features. In this review, we discuss the prognosis of mild strokes, efficacy of intravenous thrombolysis and endovascular thrombectomy, and the role of neurovascular imaging in treatment decision making in this patient population.
서 론
뇌졸중은 뇌출혈과 뇌경색으로 분류되는데 뇌출혈에 비해 뇌경색 환자수가 더 많다. 급성 뇌경색 환자 중 50% 이상에서 경한 신경계장애를 보인다[1-3]. 따라서 경증 뇌경색(mild ischemic stroke)은 진료현장에서 가장 흔하게 접하는 뇌졸중 유형이라고 할 수 있다. 국내 15개 뇌졸중센터의 Clinical Research Center for Stroke in Korea (CRCS-K) 뇌졸중 등록자료에서 증상 발생 7일 이내에 입원한 뇌경색 환자 중 58.4%가 NIH뇌졸중척도(National Institutes of Health Stroke Scale, NIHSS) 4점 이하의 경증 뇌경색이었다(Fig. 1) [3]. 미국 뇌졸중 자료에서도 뇌경색 입원 환자의 초기 NIH뇌졸중척도의 중간값은 3점이었고, 3점 이하의 환자가 50% 이상을 차지하였다[2].
경증 뇌경색 환자들은 중증 뇌경색 환자에 비해 내원 시 구급차 이용률이 낮고 병원 도착시간도 늦다. 또한 내원 후 뇌 영상촬영, 조직플라스미노겐활성제(tissue plasminogen activator, tPA) 투여까지 시간도 더 늦다고 알려져 있다[4]. 이것은 경증 뇌경색 환자는 병원전단계에서 뇌졸중에 대한 인식도가 낮고 입원 후 의료진의 신속한 혈전용해제 투여와 효과에 대한 믿음이 부족함을 의미한다.
뇌경색 환자가 발병 초기에 경한 증상을 보인다고 하더라도 약 30% 환자에서 3개월 후 좋지 못한 예후를 보인다고 알려져 있어서[5-8] 급성기 치료가 매우 중요하다. 그러나 현재까지 경증 뇌경색 환자에서 정맥내혈전용해술과 기계적혈전제거술 치료에 대한 명확한 기준이 확립되어 있지 않아서 치료 결정에 많은 고민을 하기도 한다. 본 논문에서는 경증 뇌경색 환자의 정맥내혈전용해술과 혈관내혈전제거술에 대한 효과와 근거에 대해 살펴보고자 한다.
본 론
1. 경증 뇌경색의 정의
NIH뇌졸중척도는 뇌경색 환자에서 초기 경중도를 평가하기 위해 가장 많이 사용되는 도구이고 예후와 밀접한 상관관계를 보인다. 그러나 경증 뇌경색의 명확한 정의와 NIH뇌졸중척도 기준점은 잘 알려져 있지 않다. 기존 임상 연구들은 NIH뇌졸중척도 기준으로 3-10점까지 다양한 정의를 사용하고 있는데, 많은 연구들이 3점 또는 5점 이하를 경증 뇌경색으로 정의하였다[9-13]. 한 연구에서 내원 시 NIH뇌졸중척도 1, 3, 9점 또는 유일한 운동장애, 열공증후군(lacunar syndrome) 등 여러 가지 기준을 이용해서 퇴원 당시 수정 Rankin척도(modified Rankin Scale, mRS) 2점 이하이거나 집으로 퇴원하는 것을 얼마나 잘 예측하는지 조사하였는데 NIH뇌졸중척도 3점 이하인 경우가 경증 뇌경색과 가장 잘 일치하였다[9]. 따라서 경증 뇌경색 환자의 범위를 좀 더 좁게 생각해야 할 수도 있다.
한편, 같은 NIH뇌졸중척도 점수를 보이는 환자에서도 신경계장애의 종류에 따라 일상생활에 미치는 영향이 다를 수 있다. 예를 들어 같은 NIH뇌졸중척도를 보이는 환자에서도 감각장애 증상과 언어장애가 환자에게 미치는 영향은 다르다. 따라서 경증 뇌경색에서 일상생활에 장애를 줄 만한 증상을 기준으로 장애성과 비장애성 경증 뇌졸중(mild disabling, nondisabling stroke)으로 분류하기도 하는데 이에 대한 명확한 기준은 없다. 일반적으로 장애성 뇌경색은 언어장애, 손위약, 보행장애, 시야장애 등을 의미하고 혈전용해제 투여기준으로 삼기도 한다[5,10]. 다른 연구에서는 목욕, 보행, 위생, 식사 등과 같은 기본 일상생활 가능 유무와 직장복귀 가능성을 판단하여 장애성 뇌경색의 기준으로 정의하였다[11]. 그러나 NIH 뇌졸중척도 평가항목 15개 중 대부분의 항목들이 경증 뇌경색 환자의 예후와 밀접한 관련이 있다고 하여 특정 증상 유무만으로 tPA 투여를 배제하거나 예후를 평가할 수 없다는 의견도 있다[8].
2. 경증 뇌경색 환자의 예후와 예측인자
증상 발생 후 4.5시간 이내에 내원한 경증 뇌경색 환자에서 출혈 위험성 등을 고려하여 혈전용해제 치료나 혈관내혈전제거술과 같은 적극적 치료보다 항혈소판제나 항응고제를 투여하는 경우가 많다. 그러나 경증 환자의 7-14.6%에서 조기신경계증상악화(early neurological deterioration)가 발생하는데 주로 초기 뇌졸중 진행 또는 재발, 내과 합병증, 뇌세포 부종 등이 원인이다[6,13]. 또한 경증 뇌경색 환자의 약 30%가 3개월 후 좋지 못한 예후를 보이는데[5-7], 국내 CRCS-K 자료에서 26.6% 환자들이 3개월째 예후가 mRS 2-6에 해당하였다[8]. 혈전용해제를 투여받지 않은 경증 환자에서 여성, 고령, 초기 높은 NIH뇌졸중척도 점수, 당뇨병, 하지마비 등이 좋지 못한 예후와 관련이 있었다[12,14].
초기 영상 소견을 이용해서 경증 뇌경색 환자의 예후를 예측하기도 하는데 대뇌혈관병과 뇌경색병변 위치가 중요하다. 급성 뇌경색 환자에서 대뇌혈관에 50% 이상의 협착이나 폐색이 있으면 조기 증상악화와 나쁜 예후를 보일 가능성이 높다[12-14]. 국내 연구에서 증상 발생 후 6시간 이내에 NIH뇌졸중척도 3점 이하로 내원한 경증 뇌경색 환자에서 NIH뇌졸중척도 2점 이상의 조기신경계 증상악화 빈도는 14.6%였고, 대뇌혈관 폐색이 유일한 예측인자였다[13]. 또 다른 연구에서 초기 NIH뇌졸중척도 3점 이하의 뇌경색 환자에서 대뇌혈관의 협착이나 폐색이 있는 경우 3개월째 mRS 2점 이상의 나쁜 예후를 보일 확률이 2.9배 정도 높았다[14]. 따라서 대뇌혈관의 협착이나 폐색이 있는 환자에서 좀 더 세심한 모니터링과 적극적 치료가 필요하다.
병변의 위치도 경증 뇌경색 예후에 중요한데 피질하 또는 뇌간을 침범하는 경우 그렇지 않은 환자에 비해 예후가 좋지 못하였다[15]. 그 이유는 피질하 또는 뇌간 경색은 운동신경을 담당하는 피질척수로를 침범하여 편측 상하지마비, 삼킴곤란 등을 일으킬 가능성이 많고, 뇌경색 초기에 관통동맥 기시부 혈전증에 의해 뇌병변 크기 증가와 증상 악화를 일으키는 경우가 흔하기 때문으로 생각한다[15,16].
3. 정맥내혈전용해술(intravenous thrombolysis)
많은 임상 연구를 통해서 뇌경색 발생 후 4.5시간 이내에 정맥내 tPA 효과는 충분히 입증되었지만, tPA 투여 제외사유 중 가장 흔한 것은 경증 뇌경색이었다. 경증 뇌경색에서 혈전용해제 사용을 주저하는 것은 tPA 연구들이 경증 뇌경색 환자들을 대부분 제외하여 tPA 효과에 대한 의문이 남아있고 출혈 발생에 대한 부담 때문이다[7].
1) 후향 관찰 연구
경증 뇌경색에 대한 tPA 관련 관찰 연구들이 발표되었는데[17-20] 대부분의 연구 결과들이 tPA 효과를 지지하고 있다. 국내 CRCS-K 자료를 이용한 후향 관찰 연구에서 증상 발생 후 4.5시간 이내에 NIH뇌졸중척도 5점 이하로 내원한 환자를 대상으로 tPA 투여군과 비투여군에 대한 다변량분석과 propensity matching 분석에서 tPA 투여 시 좋은 예후를 보일 가능성이 각각 1.96배, 1.68배 높았고, 뇌출혈의 발생 빈도는 양 군 간에 차이가 없었다[20]. 오스트리아의 대규모 뇌졸중 등록체계(registry)를 이용한 연구에서도 경증 뇌경색 환자에서 tPA를 투여한 경우 3개월째 좋은 예후를 보일 가능성이 1.49배 정도 더 높았다[19].
tPA 투여 전 대뇌동맥 폐색이 있는 경우 폐색이 없는 환자에 비해 tPA 효과가 좀 더 좋다고 알려져 있는데[21] 대뇌동맥 폐색이 동반된 경증 뇌경색 환자 연구에서도 tPA 투여 시에 조기신경계증상악화가 적고 3개월째 좋은 예후를 보일 가능성이 3배 정도 높았다[22]. 한편 액체감쇠역전회복(fluid attenuated inversion recovery, FLAIR)영상에서 지주막하공간에 고신호강도의 혈관신호는 측부혈류의 존재를 의미하는데 FLAIR 고혈관신호가 관찰되는 환자에서 4.1배 정도 tPA 효과가 더 좋았다[23]. 하위그룹분석에서 FLAIR 고혈관신호를 보이는 환자 중 대뇌혈관 폐색이 없었던 환자군에서 NIH뇌졸중척도 점수가 좀 더 낮고 tPA 효과가 더 우수하다고 하여[23] 경증 뇌경색 환자에서 tPA가 도움이 될 만한 환자 선정에 도움이 될 가능성이 있다.
2) 무작위 배정 임상 연구 및 하위그룹분석
과거 무작위 배정 임상 연구에서 경증 뇌경색에 대한 정의는 다르지만 대부분의 경증 환자들이 연구에서 제외되었다. 이 중 9개 연구를 종합한 메타분석에서 NIH뇌졸중척도 4점 이하 환자 중 3개월째 좋은 예후는 위약군에 비해 tPA 투여군이 1.48배 정도 더 높았고[24], tPA 투여 후 치명적 뇌출혈은 0.9%였다.
상기 결과를 바탕으로 장애를 남길 만한 경증 뇌경색 환자에 대해 tPA 투여 빈도가 갈수록 늘어나고 있지만[25], 비장애성 뇌경색 환자를 대상으로 진행한 연구는 없었다. 최근에 증상 발생 3시간 이내에 NIH뇌졸중척도 5점 이하의 비장애성 경증 뇌경색 환자를 대상으로 tPA와 아스피린을 비교한 무작위 배정 임상 연구(Potential of rtPA for Ischemic Strokes With Mild Symptoms [PRISMS] trial)가 진행되었다. 장애성 환자는 증상이 고착될 경우에 기본적 일상생활 또는 직장 복귀 가능성이 낮은 환자로 정의하였고 등록기준에서 제외되었다. 이 연구는 환자등록이 지연되어 예상환자의 1/3인 300명 정도만 등록된 후 조기종료되었는데 종료시점에서 3개월째 좋은 예후를 보이는 환자 비율은 각각 81.5%, 78.2%로 양 군 간에 차이가 없었고, tPA 투여 환자 가운데 3.2%에서 증후성 뇌출혈이 발생하였다[11]. 따라서 NIH뇌졸중척도 5점 이하의 경증 뇌경색 환자에서 비장애성 증상을 보이는 경우에 tPA가 도움이 된다는 근거는 아직 부족하다.
현재 증상 발생 4.5시간 이내에 NIH뇌졸중척도 5점 이하(단, 시야, 언어, 무시증후군, 상하지마비 중 최소 한 항목에서 NIH뇌졸중척도 1점 포함)의 뇌경색 환자를 대상으로 tPA 투여 후 24시간째 항혈소판제를 투여한 경우와 tPA 투여 없이 처음부터 아스피린과 클로피도그렐을 14일간 투여한 경우 3개월째 예후를 비교하는 Antiplatelet vs R-tPA for Acute Mild Ischemic Stroke (ARAMIS trial; ClinicalTrials.gov, NCT03661411) 연구를 진행하고 있어 결과를 기다려 볼 필요가 있다[26].
3) 진료지침
상기 연구 결과를 바탕으로 2019년 미국 급성 뇌경색 치료지침에서 증상 발생 4.5시간 이내에 내원한 경증 뇌경색 환자에서 장애를 남길 만한 가능성이 있는 경우에 tPA 치료를 권고하고 있다. 반대로 NIH뇌졸중척도 0-5점의 경증 뇌경색 환자라고 하더라도 비장애성인 경우에는 tPA 사용 시 얻는 이득이 크지 않아서 권고하지 않는다고 하였다(Table 1) [27]. 유럽 뇌졸중 치료권고안에서는 장애성 경증 뇌경색에서는 tPA를 고려할 수 있고 비장애성 뇌경색에는 tPA가 권고되지 않고 증상악화의 위험성이 높은 경우에 tPA를 고려한다고 한다(Table 2) [28]. 그러나 지금까지 경증, 장애성 뇌경색의 정의는 명확하지 않고 tPA 투여는 각 치료자의 선택에 의해 결정되고 있는 실정이다.
4) 진료현장에서 혈전용해제 치료의 결정인자
최근까지 국내외에서 경증 뇌경색에서 tPA 사용은 꾸준히 증가하고 있지만[25] tPA 투여율은 각 병원이나 치료자에 따라 매우 다르다. 최근 미국 다기관 뇌졸중 등록체계 연구에서 증상 발생 후 4시간 이내에 병원에 도착한 NIH뇌졸중척도 5점 이하의 뇌경색 환자 6,826명 중 18.7% 환자가 tPA 투여를 받았다. tPA 사용과 관련된 인자로는 2시간 이내에 병원 도착, 언어장애 동반, 높은 NIH뇌졸중척도 점수, 뇌졸중센터로 입원 등이었다[25].
경증 뇌경색 환자에서 상황별 tPA 치료에 대한 미국의사들의 의견조사에 따르면 주로 뇌출혈 위험성과 관련된 뇌출혈 과거력, 항응고제 사용, NIH뇌졸중척도 점수, 뇌경색 과거력 등을 중요한 변수로 고려하였다[29]. 반대로 대뇌혈관 폐색이 동반된 환자는 조기신경계증상악화 가능성 때문에 tPA 사용을 좀 더 적극적으로 고려하는 것 같다[4]. 한편 실제 치료현장에서 뇌영상에 극소량의 뇌출혈이 있는 경우 경증 뇌경색과 비슷한 증상을 보일 수 있다. 따라서 tPA 투여 전 세심한 뇌 영상 확인이 선행되어야 하고 tPA 투여 중 지속적 혈압 감시가 필요하다.
저자는 경증 뇌경색 환자에서 NIH뇌졸중척도 점수와 무관하게 향후 기능장애로 일상생활에 장애를 줄 수 있는 상하지마비, 언어장애, 시야장애가 동반되는 환자와 조기 증상악화와 가장 관련이 높은 대뇌혈관협착 또는 폐색이 동반되는 경우에는 증상 발생 후 4.5시간 이내에 혈전용해제를 투여하더라도 출혈의 위험성이 낮아서 적극적인 혈전용해제 치료를 고려하고 있다.
5) 혈전용해제 치료 후 예후 및 관련인자
전체 뇌경색 환자 중 tPA 투여 후 약 13.8%에서 24시간 이내에 NIH뇌졸중척도 4점 이상 조기 신경계증상악화를 보이는데, 주로 NIH뇌졸중척도 점수가 높은 환자에서 뇌부종이나 출혈변환에 의해 발생한다[30]. 그러나 일부 연구에서 초기 NIH뇌졸중척도 점수가 낮은 경증 환자에서 조기악화를 보이는 경우가 더 많다고 보고하였다[31]. 이것은 뇌 관통동맥 폐색에 의한 경증 뇌경색으로 발병하였다가 이웃한 혈관 기시부의 혈전증으로 인해 진행(progression)하는 경우가 흔하기 때문일 수 있다[16]. 한편 대뇌동맥 폐색이 동반된 NIH 뇌졸중척도 7점 이하의 뇌경색 환자에게 tPA를 투여해도 34.6%에서 24시간 이내에 신경계증상악화가 발생하였다[32]. 따라서 뇌경색 기전이나 중증도와 관련 없이 모든 경증 뇌경색 환자에서 tPA를 투여하더라도 증상악화에 대한 철저한 모니터링이 필요하다.
경증 뇌경색에서 tPA 사용 후 3개월째 좋지 못한 예후를 보이는 경우는 약 30% 정도로 비교적 흔한데[5,10,16,33] 당뇨병, 초기 높은 NIH뇌졸중척도 점수, 피질하 뇌경색, 뇌출혈 발생 등과 연관성이 있었다[16,34]. 대신 경증 뇌경색에서 tPA 관련 뇌출혈 빈도는 낮아서 증후성 뇌출혈이 2.6% 미만이고[4,11,19,24,33,34], 무작위 배정 임상 연구에서 tPA 사용 후 치명적 뇌출혈은 345명 중 3명(0.9%)으로 매우 낮다[24].
경증 뇌경색에서 tPA 투여 전 뇌 자기공명영상을 이용하면 뇌출혈 위험성을 줄여줄 가능성도 있지만[35] 뇌 자기공명영상 촬영을 위해 tPA 치료를 지연시켜서는 안 된다[27]. 뇌 자기공명영상에서 미세출혈이 10개 이상 있는 경우는 뇌출혈의 위험성을 높일 수도 있지만 안정성 대비 효과는 아직 불확실하다[27].
6) 새로운 혈전용해제 치료
최근 tPA 외에 새로운 혈전용해제 테넥테플라제(tenecteplase, TNK)가 개발되었다. TNK는 3세대 혈전용해제로, 2세대인 tPA보다 반감기가 길고 혈전의 주요 성분인 피브린에 대한 선택성이 더 좋아서 tPA보다 좀 더 효과적이고 안전할 것으로 기대되는 약물이다. 또한 1시간 동안 주사가 필요한 tPA와 달리 TNK는 1회 주사로 충분한 효과를 기대할 수 있다.
근래에 경증 뇌경색 환자들 대상으로 시행한 TNK–Tissue-Type Plasminogen Activator Evaluation for Minor Ischemic Stroke With Proven Occlusion (TEMPO-1) 연구가 발표되었다[36]. 이 연구는 증상 발생 12시간 이내의 대뇌혈관 폐색이 동반된 NIH뇌졸중 척도 5점 이하의 경증 뇌경색 환자를 두 군으로 나누어 TNK 0.1 mg/kg과 0.25 mg/kg을 각각 투여한 후 효과와 안전성을 비교하였다. NIH뇌졸중척도 중간값은 2.5점이었고 0.25 mg/kg 투여 시 재관류율은 61% (완전재관류 52%, 부분재관류 9%)였다. 완전재관류를 보인 환자들은 입원 기간 중 증상악화나 재발이 없었고 좋은 예후를 보이는 경우가 더 많았다[36].
현재 동일한 기준의 환자군을 대상으로 TNK와 항혈소판제 투여 환자군에 대해 3개월 예후를 평가하는 TEMPO-2 연구가 진행되고 있어 향후 대뇌혈관 폐색이 동반된 경증 뇌경색 환자에서 혈전용해제 치료효과와 안전성을 확인할 수 있을 것이다.
4. 대뇌혈관 폐색에서 혈관내혈전제거술(endovascular thrombectomy)
경증 뇌경색 환자의 조기신경계증상악화의 예측인자는 대뇌혈관 폐색이고[13], tPA 투여 후 증상악화와 관련된 인자도 대뇌혈관 재개통이 이루어지지 않은 경우로 알려져 있다[30,37]. 경증 뇌경색 환자에서 대뇌혈관 폐색이 동반되는 경우를 흔히 볼 수 있다. 증상 발생 6시간 이내에 내원한 경증 뇌경색 환자에서 대뇌혈관 폐색이 동반된 경우는 약 5-10% 정도이고 초기 대뇌혈관 폐색이 있는 뇌경색 환자에서 NIH뇌졸중척도 5점 이하인 경우는 약 10% 정도이다[38,39].
대뇌혈관 폐색이 동반된 경증 뇌경색 환자에서 조기 증상악화 가능성을 고려하여 적극적인 혈관내혈전제거술을 시행할 것인지, 시술과정 중 발생할 수 있는 혈전의 원위부 이동, 뇌출혈 등의 합병증 위험성 때문에 내과적 치료를 할지에 대한 판단이 쉽지 않고 이에 대한 명확한 진료지침도 알려져 있지 않다. 따라서 각 병원의 진료환경, 치료의사의 견해에 따라 혈관내혈전제거술 유무가 결정되고 있는 실정이다.
1) 후향 관찰 연구
대뇌혈관 폐색이 동반한 경증 뇌경색 환자들 대상으로 한 후향 관찰 연구에서 혈전제거술은 안전하며 효과적이라는 연구와[40,41] 내과적 치료에 비해 차이가 없고 뇌출혈의 위험성만 증가시킨다[42,43] 등 정반대의 결과들이 보고되었다. 최근 NIH뇌졸중척도 6점 이하의 전순환 대뇌혈관 폐색을 가진 뇌경색 환자들을 분석한 메타분석에서는 혈관내혈전제거술군과 내과적 치료군에서 예후 차이가 없었고 증후성 뇌출혈의 빈도를 증가시키지 않았다[44]. 그러나 모든 연구들이 후향분석이고 선택바이어스가 있어 무작위 배정 연구가 필요하다.
최근에는 뇌경색 발생 6시간 이후라도 16시간 또는 24시간까지 뇌 자기공명영상을 이용하여 선택적으로 혈전제거술을 시행할 수 있다[27]. 따라서 대뇌혈관 폐색이 동반된 경증 뇌경색에서 초기 경과 관찰 후 6시간 이후에 증상이 악화될 경우 혈관내혈전제거술의 적응증을 고려하여 시술을 하는 경우도 있다. 뇌경색 초기 내과적 치료만 받던 NIH뇌졸중척도 5 또는 8점 이하인 대뇌혈관 폐색 환자 중 증상악화 후 혈전제거술을 시행한 경우 시술받지 않은 환자에 비해 퇴원 시 신경계예후가 더 좋았고[45] 심지어 입원 시 혈전제거술을 시행한 군과 비교해도 예후가 나쁘지 않다는 연구 결과가 발표되었다[46]. 따라서 입원 후 철저한 모니터링을 하다가 증상악화를 보이는 환자에게 응급 혈전제거술을 시행하는 것도 치료의 선택이 될 수 있을 것이다(Fig. 2).
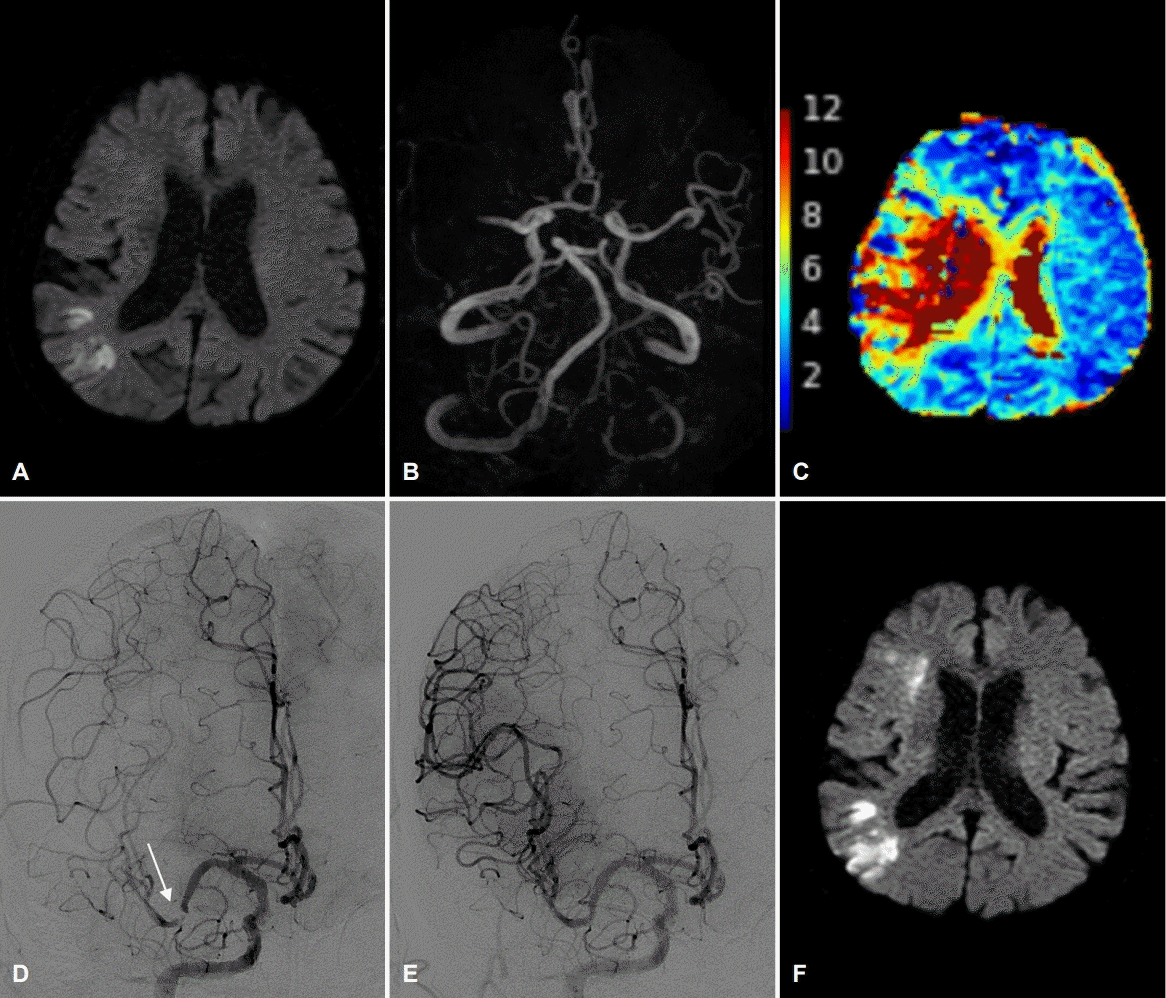
Initial and follow-up MRI with cerebral angiography. Sixty-nine-year-old man was admitted to stroke care unit 4 hours after acute onset of left hemiparesis and disabling symptoms (NIHSS 4). DWI, PWI, and MRA on admission show lesions in the right MCA territory (A) and DWI-PWI (Tmax <6 seconds) mismatch pattern (B) with right MCA occlusion (C). Thrombolysis with intravenous tissue plasminogen activator was started. On next day, symptoms were deteriorated from NIHSS 4 to NIHSS 11. Urgent cerebral angiography shows complete occlusion in the midportion of right MCA. He received endovascular treatment including mechanical thrombectomy and intracranial stenting (E) for residual stenosis (white arrow) (D). His symptoms improved to the same extent as before exacerbation after endovascular treatment. The follow-up DWI on day 3 reveals slight lesion growth (F). MRI; magnetic resonance image, NIHSS; National Institutes of Health Stroke Scale, DWI; diffusion-weighted image, PWI; perfusion-weighted image, MRA; MR angiography, MCA; middle cerebral artery
2) 무작위 배정 임상 연구
최근 혈전제거술에 대한 5개 대규모 임상 연구를 종합하면 대뇌혈관 폐색이 있는 환자에게 혈관내혈전제거술을 시행하였을 때 대조군에 비해 3개월째 좋은 예후를 보일 가능성이 2.49배 정도 높았다[47]. 이 연구를 근거로 현재 뇌졸중 진료지침에서는 증상 발생 6시간 이내에 NIH뇌졸중척도 6점 이상인 대뇌동맥 폐색 뇌경색 환자에게 혈관내혈전제거술을 시행할 것을 권고하고 있다[27,28,48]. 그러나 5개 임상 연구 중 NIH뇌졸중척도 6점 이하의 뇌경색 환자가 포함된 연구는 2개 연구뿐이고 소수의 환자들만 포함되어 있다. 대신 NIH뇌졸중척도 10점 이하인 환자 177명을 모아서 분석하였을 때 혈전제거술의 효과를 입증하지 못하였다[47]. 현재까지 경증 뇌경색에 대한 혈관내혈전제거술에 대한 무작위 배정 임상 연구는 없는 실정이다.
3) 진료현장에서 혈전제거술에 대한 치료의사의 의견
경증 뇌경색에서 혈전제거술에 대한 진료지침이 없는 상황에서 전 세계 뇌졸중전담의사 607명에게 혈전제거술에 대한 의견을 조사한 결과가 발표되었다. 뇌경색 발생 3시간 만에 NIH뇌졸중척도 2점으로 내원한 근위부 중뇌동맥 폐색 환자에 대한 치료계획 설문에서 60.4%의 의사들이 혈전제거술을 시행할 것이라고 응답하였다[49]. 초기 경증 뇌경색 환자도 신경계증상의 악화를 일으킬 위험성이 높아서 혈전제거술이 좀 더 효과적이고 안전하다고 생각하는 것 같다. 향후 경증 뇌경색 환자에서 혈관내혈전제거술의 적응증 마련과 대규모 임상 연구가 필요하다.
4) 뇌 영상 소견을 통한 혈전제거술 시행 환자의 선정
대뇌동맥 폐색 환자에서 확산강조영상(diffusion-weighted image, DWI), 뇌관류영상(perfusion-weighted image), FLAIR영상 등을 이용하여 혈전제거술에 도움이 될 만한 환자를 선정하려는 노력이 있어 왔다. 그러나 경증 뇌경색 환자는 대부분 제외되었다. 최근 대뇌혈관 폐색이 동반된 경증 뇌경색 환자에서 뇌영상을 이용한 예후평가에 대한 연구가 발표되었다. 대뇌동맥 폐색이 동반된 경증 뇌경색 환자에서 컴퓨터단층혈관촬영영상에서 측부순환이 부족하거나[50], DWI-PWI 불일치(mismatch) [51] 또는 FLAIR 측부 고신호혈관영역-DWI 불일치[52] 등이 있는 경우 혈전제거술을 시행하지 않았을 때 뇌병변의 크기가 증가하고 예후가 좋지 못한 경우가 많아서 혈전제거술이 도움이 될 가능성이 많다.
최근 후향 관찰 연구에서 혈전제거술의 효과를 증명하지는 못하였지만 대뇌혈관 폐색 위치에 따라 혈전제거술의 효과가 다를 수 있음을 보고하였다. 전체 대뇌혈관 폐색 경증 뇌경색 환자 중 내경동맥과 근위부 중뇌동맥 폐색 시 혈전제거술을 시행한 경우에는 2.67배, 3.26배 정도 좋은 예후를 보일 가능성이 더 높았다. 반대로 M2 이하의 원위부 폐색에서 혈관내혈전제거술은 예후가 더 좋지 못하거나 비슷하였고 오히려 뇌출혈의 위험성만 증가시켰다[42,53]. 따라서 근위부 중뇌동맥과 경동맥 폐색의 경우에는 혈전제거술의 효과가 있을 가능성이 있다. 급성기에 이런 다양한 뇌 영상을 이용하면 혈전제거술이 필요한 환자를 선정하는 데 도움이 될 수 있을 것이다. 그러나 이에 대한 무작위 배정 연구는 아직 발표되지 않았다.
저자는 급성 경증 뇌경색 환자에서 내경동맥이나 중뇌동맥 폐색이 동반된 경우에 DWI-PWI 불일치가 크면 적극적 혈전제거술을 고려하고 그렇지 않은 경우는 뇌졸중 집중치료실에서 충분한 모니터링 후에 증상 악화가 발생하는 즉시 혈전제거술을 시도하고 있다.
결 론
경증 뇌경색은 전체 뇌경색의 50% 이상을 차지할 정도로 흔한데, 30% 정도의 환자는 조기신경계증상악화나 3개월째 좋지 못한 예후를 보인다. 따라서 급성기에 항혈소판제만 투약하는 것보다 좀 더 적극적 치료가 필요할 수 있다. 현재 발병 4.5시간 이내의 장애성 경증 뇌경색 환자에게 tPA 투여를 권고하고 있다. 그러나 경증 뇌경색의 정의와 함께 비장애성 경증 뇌경색에서 tPA 사용, 발병 4.5시간 이후 tPA 투여, 대뇌동맥 폐색 시 혈관내 혈전제거술 시행 등에 대한 명확한 효과가 증명되지 않아서 치료의사나 병원사정을 감안하여 환자 특성에 맞는 치료를 시행하여야 한다. 경증 뇌경색에서 새로운 혈전용해제와 혈관내혈전제거술에 대한 임상연구가 진행되고 있어 향후 이에 대한 결과를 지켜볼 필요가 있다.


