| J Korean Neurol Assoc > Volume 38(1); 2020 > Article |
|
Abstract
Jumping stump syndrome is considered to be a peripherally induced movement disorder due to damage to peripheral nerves leading to dystonia or myoclonus. Anti-leucine-rich glioma-inactivated 1 antibody (anti-LGI 1 Ab) encephalitis is clinically characterized with progressive cognitive dysfunction and seizure including facial brachial dystonic seizure. We report a case of a woman with a history of intractable involuntary movement on amputated forearm diagnosed as anti-LGI 1 Ab encephalitis, mimicking symptoms of jumping stump syndrome.
항-leucine-rich glioma inactivated1 (LGI1)항체뇌염은 급속한 진행성 인지저하와 함께 반복적인 안면상완근긴장이상경련(facial brachial dystonic seizure, FBDS)이 특징이며 전압작동 칼륨통로복합체(voltage gated potassium channel complex, VGKC)와 상호작용하는 LGI1단백질의 자가항체로 인하여 발생하는 자가면역뇌염이다[1]. 본 증례는 우측 상지 잘린끝에서 지속되는 비자발적인 경련운동을 보이는 환자에서 혈청 및 뇌척수액 자가항체 검사 결과에 의하여 항-LGI1항체뇌염으로 진단된 사례이다. 사지 절단 후 남은 잘린끝의 비자발적인 무도병 또는 경련성 운동을 보이는 도약잘린끝증후군(jumping stump syndrome)과 유사한 특이증상을 보였던 사례로 이에 대하여 보고하고자 한다.
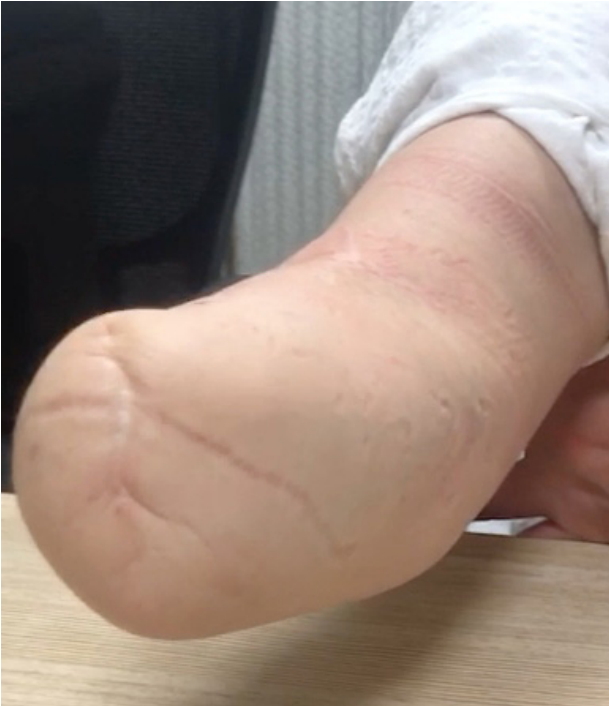
58세 여자가 급격한 진행성 인지저하와 우측 위팔에 국한된 통증을 동반한 반복적인 근경련으로 외래에 왔다. 환자는 천식 외에 다른 병력은 없었으며 최근 증상이 조절되어 간헐적으로 경구 스테로이드 흡입기를 사용하고 있었다. 5년 전 작업 중 분쇄기에 오른손이 끼이는 사고로 팔꿈치 아래부터 절단 수술을 받았고 수개월 후 헛통증이 발생하였다(Fig. 1). 여러 차례 타 병원에서 신경차단술을 받았지만 호전이 없었고 한 달 전부터는 잘린끝 떨림증상이 시작되었다. 첫 진료 당시 신경학적 검진에서 잘린끝에서 고빈도의 안정시 떨림이 시작되어 우측 위팔과 우측 입꼬리가 올라가는 확산성의 발작적인 근간대경련이 관찰되었으며 수초 이내로 소실되었다. 환자는 하루에도 3-4차례 이상 같은 증상이 반복되었으며 의식 소실은 없었다. 함께 온 남편은 부인이 최근 눈에 띄게 기억력이 떨어지고 자주 화를 내는 성격 변화가 있다고 진술하였다. 근경련에 대한 대사질환 감별을 위한 온혈구계산(complete blood count), 전해질(Na, K, Cl), 신장기능(혈액요소질소[blood urea nitrogen], 크레아티닌[creatinine]), 요산(uric acid), 간기능(알라닌 아미노전달효소[alanine aminotransferase], 아스파르테이트 아미노전달효소[aspartate aminotransferase]), 크레아틴키나아제(creatine kinase), 적혈구침강속도(erythrocyte sedimentation rate), C-반응단백질(C-reactive protein), 매독혈청검사(venereal disease research laboratory), 류마티스인자(rheumatoid factor), 혈당, 갑상선호르몬(갑상선자극호르몬[thyroid stimulating hormone]), 유리티록신(free thyroxine)을 포함한 초기 검사실검사는 경미한 저나트륨혈증(Na 134 mEq/L) 외에 모두 정상이었다. 뇌파검사에서 과호흡유발자극 후 우측 위팔 및 얼굴 경련과 함께 좌측 측두부에서 시작되어 전체적으로 진행하는 발작방전(ictal discharge)이 관찰되었고 이에 대하여 레비티라세탐 1,000 mg/day가 투여되었다(Fig. 2). 한국형 간이정신상태검사(Korean Mini-Mental Status Examination, K-MMSE)는 30점 만점에 24점으로 주의 집중과 기억 회상에 장애를 보였으며 임상치매평가(clinical dementia rating, CDR)는 0.5점이었다. 초기 뇌 자기공명영상(magnetic resonance imaging, MRI)은 T2액체감쇠역전회복(fluid-attenuated inversion recovery) 영상에서 뇌염 또는 경련발작과 연관된 구조적인 변화를 시사하는 양측 내측 측두엽의 고강도 신호변화가 관찰되었다(Fig. 3-A). 뇌척수액(cerebrospinal fluid) 분석 결과 white blood cell 4/mm3, red blood cell 0/mm3, 단백질 33 mg/dL, 포도당 93 mg/dL (뇌척수액과 혈청 포도당비 93/126)였고, 중추신경계감염 원인 감별을 위한 그람염색, 세균배양검사 및 단순헤르페스바이러스(herpes simplex), 수두대상포진바이러스(varicella zoster), 거대세포바이러스(cytomegalovirus), 엡스타인-바바이러스(Epstein-Barr virus), 미코박테륨(Mycobacterium)에 대한 중합효소연쇄반응검사(polymerase chain reaction tests)는 모두 음성이었다. 신생물딸림증후군(paraneoplastic syndrome) 및 자가면역뇌염을 감별하기 위한 자가면역시냅스항체검사(항NMDA, 항AMPA1, 항AMPA2, 항 CASPR2, 항GABA-B 항체)와 항신생물딸림증후군항체인 항Hu, 항Yo, 항Ri, 항 Ma2, 항CV2/CRMP5, 항amphiphysin 항체 역시 모두 음성이었으나 혈액 및 뇌척수액에서 항-LGI1항체가 발견되었다. 뇌 영상 검사 및 환자의 임상적 특징을 고려하여 항-LGI1항체뇌염으로 최종 진단되었으며, 동반될 수 있는 악성 종양의 감별을 위하여 시행한 유방촬영술, 유방초음파, 복부 및 골반 컴퓨터단층촬영(computed tomography), 흉부 컴퓨터단층촬영검사에서 특이 소견은 관찰되지 않았다. 이후 면역 치료(메틸프레드니솔론 1 g 정맥내 주사 5일 요법 후 면역글로불린 정맥내 주사[intravenous immunoglobulin, IVIG] 0.4 g/kg/day 5일 요법)를 시행하였으며 스테로이드는 경구요법으로 대체하여 2개월간 프레드니솔론 60 mg/day 투여 후 30 mg/day로 감량하였다. 면역 치료 시행 결과 FBDS는 완전히 소실되었으며 인지기능 저하는 병전과 비슷한 정도로 회복되었다. 하지만 3개월 뒤, 간헐적인 잘린끝 근긴장이상운동과 통증이 다시 악화되어 방문하였고 추적검사로 시행한 뇌 MRI에서 양측 측두엽의 고강도 신호변화가 지속적으로 관찰되었다(Fig. 3-B). 이에 추가적으로 IVIG 5일 요법과 정맥내 주사 메틸프레드니솔론 1 g 3일 요법을 시행하였고, 첫 번째 면역 치료 후처럼 완전히 근긴장이상운동이 호전되지 않아 레비티라세탐 2,000 mg/day, 옥스카바제핀 900 mg/day, 발프로산 1,000 mg/day로 항경련제를 추가하였으며 통증 조절을 위하여 가바펜틴 200 mg/day을 처방하였다. 경구 스테로이드 치료 및 상기 항경련제 유지 후 근긴장이상운동의 빈도가 일주일에 1, 2차례의 빈도로 감소되었지만 완전히 소실되지는 않았다. 추적 신경인지검사에서 K-MMSE 25점, CDR 0.5점을 기록하였으며 주관적인 인지장애의 호전을 보였다.
도약잘린끝증후군은 사지 절단 후 발생하는 운동장애로 정의되며 이러한 현상은 절단 수술 후 몇 주 또는 몇 개월 후에 주로 시작되고 치료에 불응하기도 한다. 근간대경련, 무도증, 근긴장이상 또는 발작적인 떨림증상 등 다양한 운동장애를 보이며 통증에 유발되거나 밀접하게 연관성이 있는 것으로 알려져 있지만 헛통증 또는 신경통이 동반되지 않는 사례도 보고된다. 아직까지 정확한 병리적 원인은 확인되지 않았으나 일반적으로 잘린끝의 심한 통증과 관련이 있기 때문에 헛팔다리가 발생하는 말초 기원의 중추민감화현상과 유사하게 유발되는 것으로 추정되며 구심로 차단 및 구심성 정보의 손실로 운동회로의 변화가 나타나 운동 출력을 강화하고 대뇌피질을 재배치시키는 것으로 설명된다[2,3]. 불수의적인 근경련운동이 주로 절단된 환측 팔과 관련되어 있었기 때문에 본 사례보고서의 환자는 초기 헛통증을 동반한 도약잘린끝증후군으로 진단되었다.
진행하는 인지장애, 성격 변화, 불면증, 근경련 및 근섬유다발수축 등 변연뇌염의 증상과 신경근육긴장이상증(neuromyotonia)을 동시에 보이는 환자에서 VGKC 복합체 이상이 원인으로 밝혀졌고 이러한 VGKC 복합체는 중추신경뿐만 아니라 말초신경에도 광범위하게 분포하여 활동전위 이후 세포막 안정화에 중요한 기능을 갖는다[4]. 근래 VGKC 복합체와 상호작용을 하는 LGI1와 Caspr2 단백질에 대한 자가항체가 발견되었고 항-LGI1항체는 주로 중추신경계의 해마와 측두엽에 분포하여 경련발작과 변연뇌염을 일으키며 항-Caspr2항체는 중추신경계와 말초신경계에 모두 분포하며 말초신경계에서 과활성화를 유발하여 근섬유다발수축과 근육경련을 일으킨다[4]. 본 사례는 항-LGI1항체뇌염에서 흔히 보이는 경련발작과는 다르게 주된 증상으로 도약잘린끝증후군으로 오인된 절단 끝의 말초 근위부의 불수의운동을 보였으며 이전 보고된 유사 사례가 없어 주목할 만하다.
항-LGI1항체뇌염은 임상적으로 의식저하, 저나트륨혈증 및 FBDS의 3가지 특성을 보이며 주로 41-78세 가량에서 발생하며 4:3의 성비로 남성에서 더 높은 빈도를 보인다. 모든 환자에서 어깨, 팔, 손목 및 손가락과 함께 얼굴의 변형을 포함하는 FBDS가 나타나지는 않지만 질병에 매우 특이적이며 3초 미만으로 짧게 발생하여 하루에도 수십 번 증상이 반복되기도 한다[5]. FBDS가 경련의 일종인지 피라미드바깥길증상의 하나인지는 아직까지 논란의 여지가 있으며 증상이 있는 동안 뇌파는 다양한 양상을 보이는데 저명한 이상 소견이 없는 경우도 있다[6,7]. 최근 103명의 FBDS를 가진 항-LGI항체뇌염의 환자들에서 인지기능 저하의 유무에 따라 두 군으로 나누어 임상적, 치료적 차이에 대하여 비교한 연구가 발표되었다. 이 연구에서는 인지기능 저하 없이 FBDS만을 보이는 환자들이 약 21%였다. 이전 다른 소규모의 연구 결과들과 동일하게 항뇌전증 약물만으로는 FBDS의 호전율이 낮았고, 면역 치료 중에서도 특히 스테로이드에 반응이 좋았다[8]. 본 사례의 환자의 경우도 항뇌전증 약물에는 호전이 잘 되지 않았으나 고용량 스테로이드 치료에 급격한 호전 반응을 보였다. 또한 이들 연구에서는 FBDS를 조기에 조절하는 것이 인지기능의 저하로 발전되는 것을 막는 중요한 요인이라고 설명하고 있다. 항-LGI1항체뇌염의 자연 경과는 18%의 재발률을 보이며 면역 치료를 하지 않은 소아에서 자발적인 완화를 보인 보고가 있지만 성인에서는 경증에서 중등도의 인지저하를 남길 수 있다[5,9]. 조기 면역 요법 치료 시 항뇌전증 약물에 불응하는 FBDS가 호전되고 진행성 인지기능 저하 및 뇌병증에 효과가 있는 것으로 밝혀져 빠른 진단과 치료 시작이 매우 중요하다[1,7].
본 사례는 우측 상완 절단 끝에서 시작한 근경련과 기억장애로 온 환자의 사례로, 헛통증이 오랜 기간 선행되어 환자의 증상이 도약잘린끝증후군과 유사하게 보였다. 우측 위팔과 동반되는 우측 안면부의 경련이 감별할 수 있는 점이었고, 최종적으로 혈액 및 뇌척수액에서 자가항체가 발견되어 항-LGI1항체뇌염으로 진단할 수 있었다. 본 사례를 통하여 항-LGI1항체 뇌염에서 FBDS의 증상이 지니는 임상적 진단의 중요성을 다시 한 번 강조하고자 한다.
REFERENCES
1. van Sonderen A, Thijs RD, Coenders EC, Jiskoot LC, Sanchez E, De Bruijn MA, et al. Anti-LGI1 encephalitis: clinical syndrome and long-term follow-up. Neurology 2016;87:1449-1456.


2. Ozbek SE, Zarifoglu M, Karli N. A case of involuntary spasm movements in amputation stump. Int J Med Med Sci 2013;3:361-362.
3. Kulisevsky J, Martí-Fàbregas J, Grau JM. Spasms of amputation stumps. J Neurol Neurosurg Psychiatry 1992;55:626-627.



4. Bastiaansen AEM, van Sonderen A, Titulaer MJ. Autoimmune encephalitis with anti-leucine-rich glioma-inactivated 1 or anti-contactin-associated protein-like 2 antibodies (formerly called voltage-gated potassium channel-complex antibodies). Curr Opin Neurol 2017;30:302-309.


5. Casault C, Alikhani K, Pillay N, Koch M. Jerking & confused: leucine-rich glioma inactivated 1 receptor encephalitis. J Neuroimmunol 2015;289:84-86.


6. Li LH, Ma CH, Zhang HH, Lian YJ. Clinical and electrographic characteristics of seizures in LGI1-antibody encephalitis. Epilepsy Behav 2018;88:277-282.


7. Gao L, Liu A, Zhan S, Wang L, Li L, Guan L, et al. Clinical characterization of autoimmune LGI1 antibody limbic encephalitis. Epilepsy Behav 2016;56:165-169.


Figure 2.
Initial electroencephalogram show background slowing, and ictal discharges starting from the left temporal lobe evolving into the generalized seizure are found after hyperventilation. Orange arrow indicates the onset of the ictal discharge.
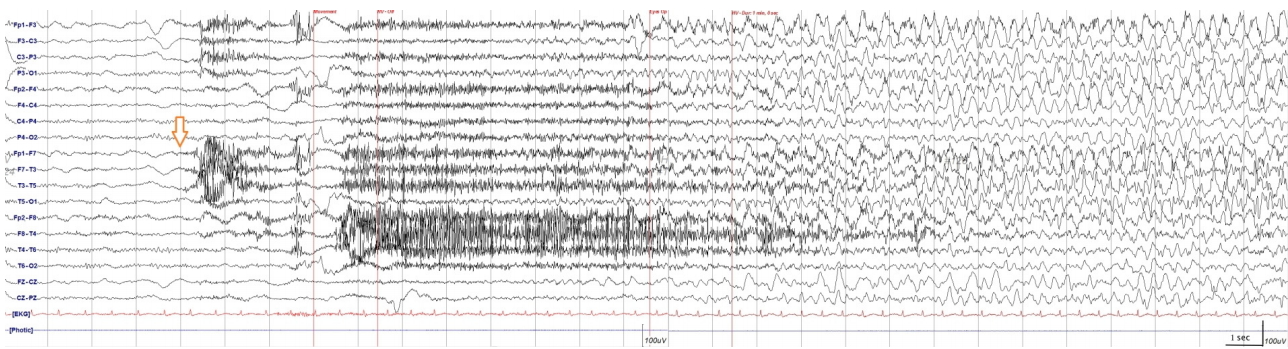
Figure 3.
(A) Early brain MR T2 FLAIR images show high signal intensity at bilateral medial temporal lobes. Solid arrows indicate hyperintensities. (B) The follow-up brain MR T2 FLAIR images 3 months after the initial immunotherapy. Persistent high signal intensities in bilateral temporal lobes are observed. MR; magnetic resonance, FLAIR; fluid-attenuated inversion recovery

- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 2,898 View
- 59 Download
- Related articles
-
Anti-LGI1 Antibody Limbic Encephalitis Associated with Hepatocellular Carcinoma2020 November;38(4)
Cefepime Induced Encephalopathy Mimicking Acute Stroke2019 November;37(4)
Anti-LGI1 Antibody Autoimmune Encephalitis Which Manifests Faciobrachial Dystonic Seizure2014 ;32(1)
Renal Tubular Acidosis Mimicking Guillain Barre Syndrome1996 ;14(4)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



