전신홍반루푸스와 전신경화증 중복증후군 환자에서 발생한 가역적후뇌병증후군
Posterior Reversible Encephalopathy Syndrome in a Patient with Systemic Lupus Erythematosus and Systemic Sclerosis Overlap Syndrome
Article information
Trans Abstract
Posterior reversible encephalopathy syndrome (PRES) is characterized by neurotoxic symptoms and neuroimaging finding of reversible cerebral edema in association with various conditions including hypertension, eclampsia, and autoimmune diseases. The author experienced a 47-year-old woman with systemic lupus erythematosus and systemic sclerosis overlap syndrome who developed PRES. The patient presented with alteration of consciousness in association with hypertension and increased autoimmune activity. Magnetic resonance imaging revealed vasogenic edema in the bilateral cerebral cortex, subcortical white matter, basal ganglia, brainstem, and cerebellum.
가역적후뇌병증후군(posterior reversible encephalopathy syndrome, PRES)은 주로 고혈압 환자에서 두통, 의식저하, 경련, 시각 및 시야장애 등의 신경계 증상과 함께 뇌 영상에서 후방순환계의 영역에 뇌부종이 발생하는 증후군으로 환자는 대부분 회복되고 뇌병변도 사라지지만 원인에 대한 적절한 치료가 지연되면 영구적인 뇌손상도 초래할 수 있는 질환이다[1-4]. PRES는 1996년 Hinchey 등[1]이 처음으로 보고한 이후 고혈압 이외에도 자간, 면역억제제, 항암제, 자가면역질환 등 다양한 원인이 보고되었으나 아직 발생기전이 명확히 밝혀지지 않았다[1-4]. 국내에도 PRES와 연관된 다양한 질환이 보고되었으며 이 중 자가면역질환이 동반된 경우도 드물게 보고되었다. 국내에 보고된 자가면역질환으로는 전신홍반루푸스, 신장염, 타카야수혈관염 등이 있으나 전신홍반루푸스와 전신경화증 중복증후군 환자에서 발생한 예는 아직 보고된 바 없다. 저자는 전신홍반루푸스와 전신경화증의 중복증후군 환자에서 PRES가 발생한 예를 경험하였기에 이를 보고하는 바이다.
증 례
47세 여자가 전일 발생한 혼동과 두통을 주소로 응급실로 왔다. 환자는 전날 저녁부터 남편과 대화가 잘 되지 않았다고 하며 좌측 머리의 통증을 호소하였으나 통증의 양상이나 경과 등에 대한 구체적인 질문에는 계속 “아프다”라고만 표현하였다. 과거력상 15년 전에 레이노현상, 피부경화증이 나타났으며 14년 전에 식도운동이상증, 간질성폐질환, 항DNA항체, 항동원체(centromere)항체, 항scl-70항체 양성 등이 발견되어 전신경화증을 진단받고 스테로이드(prednisolone)와 면역억제제(cyclosporine) 치료를 받았다. 3년 전에는 복통과 설사를 주소로 내원하여 장염, 신장염, 가슴막삼출, 심장막삼출, 항이중가닥DNA항체, 항핵항체, 항카디오리핀항체, C3 및 C4 감소 등의 소견으로 전신홍반루푸스를 진단받았다. 신장조직검사에서는 혈관사이질증식 루푸스신장염이 관찰되었다. 이후로 3년간 내원 당시까지 스테로이드(methyl prednisolone 16 mg/일)와 면역억제제(mycophenolate mofetil 500 mg/일) 등의 치료를 받았으나 약물 순응도는 좋지 않아서 자의로 복용하지 않는 경우가 많았다. 한 달 전부터는 혈압이 상승하여 고혈압약을 추가하였으나 혈압이 잘 조절되지 않았다.
내원 당시 혈압은 180/120 mmHg으로 높았고, 맥박 70회/분, 체온은 36.8℃였다. 신경학적 진찰에서 의식은 각성 상태였으나 시간 및 장소에 대한 지남력이 떨어져 있었고, 묻는 말에 적절한 대답을 하지 못하였으며, 명령 수행도 잘 못하였다. 뇌신경의 이상은 없었으며 운동 및 감각기능도 정상이었다. 실조증은 없었고 심부건반사도 정상적이었으며, 바빈스키징후도 나타나지 않았다.
혈액검사에서 백혈구는 5,200/mm3, 혈색소는 13.8g/dL로 정상범위였으나 혈소판은 94,000/mm3로 감소되어 있었고 적혈구침강속도는 61 mm/hr (정상 0-30 mm/hr)로 상승되어 있었다. 생화학검사에서 혈액요소질소(17.0 mg/dL)와 크레아티닌(0.67 mg/dL)은 정상범위였으나 C-반응단백은 7.01 mg/dL (정상 0-0.5 mg/dL)로 상승되어 있었고, C3 (63.7 mg/dL; 정상 90-180 mg/dL)는 감소되었으며 C4 (19.2 mg/dL; 정상 10-40 mg/dL)는 정상이었다. 소변검사에서 요단백은 2+로 검출되었고 그 농도는 49.7 mg/dL (정상 0-12 mg/dL)로 증가되어 있었다. 면역학적검사에서 항핵항체는 1:1280 이상 양성(homogenous type)이었고, 항이중가닥DNA항체는 14.61 U/mL (정상 0-7 U/mL)로 증가되었으며, 루푸스항응고인자와 항카디오리핀 항체는 모두 양성이었다.
내원 당일 시행한 뇌 자기공명영상검사에서는 양측 전두엽, 두정엽, 후두엽, 측두엽의 피질과 피질하 백질, 기저핵, 시상, 소뇌, 뇌줄기를 광범위하게 침범하는 고신호강도의 병변이 T2강조영상 및 액체감쇠역전회복(fluid attenuated inversion recovery, FLAIR)영상에서 관찰되었다(Fig. A, B). 이 병변은 확산강조영상에서는 동신호강도로 보였으며 겉보기확산계수지도(apparent diffusion coefficient map)에서는 고신호강도로 보여서 혈관성 부종을 시사하였다(Fig. C, D). 뇌척수액검사에서는 백혈구 4개, 적혈구 0개, 단백질 91 mg/dL, 포도당 37 mg/dL였고, 뇌압은 25 mmHg로 증가되어 있었다.
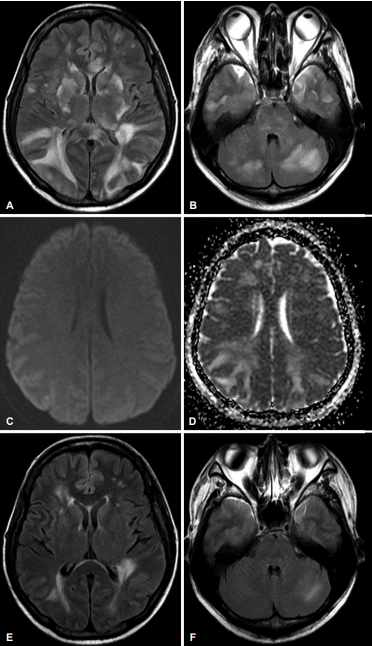
Brain MRI. (A) FLAIR imaging shows multiple hyperintense lesions in the bilateral cerebral cortex, subcortical white matter, basal ganglia, thalamus, and corpus callosum. (B) Brainstem and cerebellum are also involved. (C) Diffusion-weighted imaging reveals normal signal intensity. (D) The hyperintense lesions on the FLAIR imaging show high signal intensities on afferent diffusion coefficient map imaging, suggesting vasogenic edema. (E, F) Follow-up MRI, which was performed 3 weeks after symptom onset, shows marked resolution of the previous lesions. MRI; magnetic resonance imaging, FLAIR; fluid attenuated inversion recovery.
치료로 면역억제제(mycophenolate mofetil 500 mg/일)와 스테로이드 충격요법(solumedrol 1 g/일, 3일)을 시행하였고 고혈압약(정맥내 labetalol 10 mg과 경구 amlodipine 5 mg/일)을 투약하여 혈압을 조절하였다. 환자는 입원 초기에는 졸린 상태로 의식이 악화되면서 묻는 말에 이름만 대답할 뿐 다른 말은 하지 않았으나 4일째부터 의식이 호전되면서 명료해졌으며 지남력 및 언어기능 등도 정상적으로 회복되어 7일째 퇴원하였다. 퇴원 2주 후 촬영한 뇌 자기공명영상에서는 전반적으로 부종성 병변이 현저히 감소한 것을 확인하였다(Fig. E, F).
고 찰
PRES의 원인질환으로는 고혈압이 가장 흔하며 PRES 환자의 약 75%에서 고혈압이 관찰된다. 그 외의 원인으로는 자간증, 감염 및 패혈증, 신장질환, 면역억제제, 항암제 등이 있고 드물게 전신홍반루푸스, 전신경화증, Wegener 육아종증, 결절다발동맥염 등의 자가면역질환도 보고되었다[1-4]. 본 증례는 전신홍반루푸스와 전신경화증 중복증후군과 연관되어 PRES가 발생한 예로 이러한 증례는 세계적으로 3예만이 보고되었다[5].
PRES는 임상경과 및 뇌병변이 항상 가역적이지 않고 뇌병변도 후두부에만 국한되지 않기 때문에 PRES라는 명칭이 적합한지에 대해서는 논란이 있다[4]. PRES의 병태생리는 아직 명확히 밝혀져 있지 않으나 이에 대한 몇 가지 가설이 제기되었다. 한 가지 가설은 갑작스런 혈압 상승으로 인하여 뇌혈관의 자동조절능이 상실되어서 세동맥이 확장되어 과혈류가 발생하고 혈액뇌장벽이 손상되어 혈관성부종이 발생한다는 것이다[1]. PRES의 호발 부위인 후두부는 교감신경이 상대적으로 덜 분포되어 있어서 자동조절능의 이상으로 인한 부종의 발생에 취약한 부위일 수 있다.
다른 하나는 독성 물질이나 면역반응에 의한 혈관내피 손상으로 혈액뇌장벽이 파괴되어 부종이 발생한다는 가설이다[6,7]. 항암제와 같은 독성 물질에 노출되거나 자가면역질환에 의하여 혈관내피의 기능이 저하되면 뇌혈관을 수축시켜 혈압을 상승시키고 조직의 허혈을 유발할 수 있다. 또한 조직의 허혈 및 혈관내피의 기능 이상으로 인하여 분비되는 혈관내피성장인자에 의하여 혈액뇌장벽의 치밀이음부를 약화시켜서 부종을 일으킨다. 이 가설에서는 고혈압이 PRES의 원인이라기보다는 PRES의 발생 중 나타날 수 있는 현상 중의 하나이기 때문에 고혈압이 반드시 나타나지 않을 수도 있어서 고혈압 없이 발생하는 PRES도 설명할 수 있다.
이 환자에서는 고혈압과 자가면역질환의 활성도 증가가 PRES의 발병기전으로 작용하였을 것으로 추정하며, 면역억제제 치료도 받기는 하였지만 면역억제제는 발병 원인이 아닐 것으로 생각한다. 왜냐하면 환자의 면역억제제에 대한 약물 순응도가 좋지 않았으며, 발병 시에 자가면역 활성도가 증가되어 있었기 때문이다. 그래서 환자에 대한 치료로 혈압 조절과 함께 스테로이드 충격요법과 면역억제제를 사용하였으며, 이러한 치료 후에 환자의 상태가 호전된 점도 이러한 추론을 뒷받침해준다.
PRES의 주요 증상에는 급성 또는 아급성으로 발생하는 심한 두통, 의식장애, 경련, 시력저하 또는 시야장애 등이 있다[1-3]. 고혈압은 PRES 환자의 66-85%의 환자에서 발견되나 이전에 고혈압의 과거력이 없는 경우도 흔하다[1,7,8]. 전신홍반루푸스 환자에서는 루푸스 활성도가 대부분 상승되어 있고 고혈압과 신장애가 나타나는 경우가 많다[9]. 본 환자에서도 루푸스 활성도가 상승되어 있었고 고혈압과 신장염이 있었다. 본 환자에서는 뇌압상승 소견도 관찰되었는데, 이는 PRES의 일부 환자에서 나타날 수 있으며 심한 뇌부종에 의하여 발생한다.
PRES 급성기의 영상 소견은 전산화단층촬영에서는 저음영의 병변이 양측의 후두엽과 두정엽의 피질, 피질하백질에 대칭 또는 비대칭으로 나타나며 전두엽과 측두엽에까지 나타날 수 있다. 또한 기저핵, 소뇌, 뇌줄기도 침범할 수 있다[8]. 자기공명영상에서는 T2강조영상 및 FLAIR 영상에서 고신호강도의 병변으로 나타난다. 이 병변은 확산강조영상에서는 확산제한을 보이지 않으나 겉보기확산계수지도에서는 고신호강도를 보여서 혈관성부종을 시사한다[6]. 적절히 치료하면 병변의 신호변화가 호전된다. 이러한 가역적 소견은 다른 질환과의 감별에 도움이 된다. 본 환자에서는 혈관성 부종이 후두부에 국한되지 않고 전두엽과 측두엽, 기저핵, 소뇌, 뇌줄기까지 광범위하게 퍼져있었다. 이렇게 뇌줄기까지 침범하는 광범위한 병변 분포는 PRES 환자의 약 30% 이내에서 발견되지만 병변 부위 및 분포의 양상과 특정 원인질환과의 연관성은 아직 명확하게 밝혀지지 않았다[7]. 이전에 보고된 중복증후군 환자에서는 PRES의 병변 부위가 전두엽과 후두부에만 국한되어 본 증례와 차이가 있었다[5]. 광범위한 병변 부위에도 불구하고 환자의 상태는 수일만에 완전히 회복되어서 병변의 범위가 크더라도 예후가 나쁘지 않다는 것을 보여주었다.
PRES의 치료는 원인이 되는 항암제나 면역억제제의 사용을 중단하고 고혈압이 있는 경우 혈압을 낮추는 것이다[4]. 혈압 조절은 환자 내원 후 1-2시간 이내에 평균 혈압의 20-25%를 낮추고, 6시간 이내에 160/100 mmHg으로 낮추어야 하며, 24-48시간 이내에 정상 혈압으로 낮추어야 한다[10]. 이보다 더 급격한 혈압 강하는 뇌관류압을 저하시켜서 뇌허혈을 일으킬 수 있기 때문에 권장되지 않는다. 고혈압약은 정맥내 투여가 필요하며 labetalol이나 nicardipine 등의 약제가 추천된다[10]. 자가면역질환의 활성도가 증가되어 있는 경우는 스테로이드 약제를 사용한다[9]. PRES의 예후는 일반적으로 양호하여 신경계 증상은 대부분 1주 이내에 회복되지만 치료가 지연되면 이차적으로 뇌경색이나 뇌출혈을 일으켜서 영구적인 후유증 또는 사망을 초래할 수 있다[1-4].
본 증례는 전신홍반루푸스와 전신경화증 중복증후군 환자에서 PRES가 발생한 예이다. 중복증후군은 PRES의 드문 동반질환이지만 그 임상양상과 뇌영상 소견은 다른 원인에 의한 PRES와 유사하였다. 자가면역질환 환자에서 두통, 의식이상, 경련, 시야장애 등의 신경학적 증상이 나타난 경우 감별진단으로 PRES를 고려해야 한다. PRES는 다양한 원인에 의하여 발생하고 증상이 비특이적이지만 특징적인 영상 소견을 보여주기 때문에 신속한 진단과 치료를 통하여 영구적인 뇌손상을 막을 수 있다.