파킨슨병에서 기립저혈압과 인지 기능의 관계
Orthostatic Hypotension and Cognitive Function in Parkinson’s Disease
Article information
Trans Abstract
Background
Although orthostatic hypotension (OH) and cognitive impairment (CI) are common non- motor symptoms of Parkinson’s disease (PD), the relationship between OH and CI remains to be clarified. This study was aimed to investigate the relationship between OH and CI in PD.
Methods
We recruited 192 patients who were diagnosed as PD based on the UK Brain Bank diagnostic criteria. The Hoehn & Yahr stages were ranged I to III and patients underwent extensive clinical evaluation, including brain magnetic resonance imaging (MRI) for cerebral white matter hyperintensity (WMH), tilt table test, the Korean version of Montreal Cognitive Assessments and the Korean version of Mini-Mental Status Examination in one month from the first clinic visit. The participants were divided into two groups according to the presence of OH (OH+ vs. OH-) and cognitive function (cognitive normal, CN vs. CI), respectively.
Results
Significant relationship between OH and cognitive function (p=0.04) was found in our patients. The patients with OH+ had higher risk of CI by 2.6 times than that of OH- patients. Maximum heart rate change during tilt table test was correlated with cognitive function and white matter changes, whereas blood pressure change during tilt table test showed no correlation with those parameters.
Conclusions
There was significant relationship between OH and CI in PD. Therefore, PD patients with either symptom may need periodic evaluation and proper management for OH and cognitive functions.
서 론
파킨슨병은 65세 이상에서 약 2%의 유병률을 보이는 두 번째로 흔한 신경퇴행질환으로 안정시떨림, 운동완만, 경축, 자세불안정을 포함하는 운동장애가 특징이다[1]. 특징적인 운동증상 이외에도 인지저하와 우울감, 수면장애, 기립저혈압을 포함하는 자율신경기능장애, 후각저하 그리고 위장관 운동장애와 같은 비운동증상이 동반되어 파킨슨병 환자의 삶의 질을 저하시킨다. 파킨슨병에서 비운동증상이 운동증상에 선행하여 나타날 수 있으며 이러한 증상을 조기에 발견하고 관리 및 치료를 하는 것이 삶의 질을 향상시키고 합병증 예방에 도움이 된다.
정상인에서 기립저혈압 유병률은 약 12.5%인데 반하여, 파킨슨병에서는 약 53%로 매우 높다[2]. 기립저혈압의 유병률이 파킨슨병에서 높은 이유는 두 가지로 설명할 수 있는데 첫 번째, 치료제로 사용하는 도파민이 기립저혈압을 유도하거나 악화시킬 수 있고[3] 두 번째, 파킨슨병 자체가 말초자율신경계의 기능장애를 수반하는 일차 자율신경이상을 초래할 수 있기 때문이다[4]. 기립저혈압으로 낙상 위험이 높아지며 외상으로 인한 골절, 뇌출혈 같은 합병증 발생이 증가하기 때문에 독립적인 생활능력을 떨어뜨릴 수 있다.
새로 진단받은 파킨슨병 환자에서 인지저하가 나타나는 경우는 약 40%이며 이 중 대다수는 경도인지장애(mild cognitive impairment)이다[5]. 파킨슨병에서는 계획 수립, 결정, 개념 형성과 같은 전두엽수행기능(frontal executive function)장애가 주로 나타나고 이러한 증상은 도파민 약물 치료로 도움이 된다고 알려져 있다[6]. 파킨슨병 환자는 같은 연령의 정상인에 비하여 치매 발생 위험률이 2-6배 높으며[7] 치매는 대소변실금, 낙상, 욕창, 폐렴 같은 감염의 발생 빈도를 높이므로 파킨슨병 환자에서 인지저하 또는 치매의 조기진단과 관리가 매우 중요하다.
파킨슨병에서 인지저하와 기립저혈압을 동시에 가지고 있는 경우는 약 21%이며[8] 두 증상의 연관성에 대한 기전으로 삽화저혈압이 뇌에 반복적으로 저관류를 일으키고 이것이 뇌의 취약한 구역에 저산소허혈손상을 초래하여 인지기능장애가 생긴다는 혈관가설(vascular hypothesis, cerebral cortex-subcortex disconnection)이 제시되었으나 아직까지 명확하게 밝혀진 것은 없다[9].
본 논문에서는 이러한 가설을 뒷받침하기 위하여 체위혈압변화와 뇌 자기공명영상(brain magnetic resonance imaging)의 백질변성 그리고 인지기능을 평가하여 파킨슨병에서 기립저혈압과 인지기능의 연관성에 대하여 알아보고자 한다.
대상과 방법
1. 대상
2012년 1월부터 2016년 12월까지 충남대학교병원 신경과에 내원한 환자 중 UK Brain bank 진단기준에 합당하고 Hoehn & Yahr (H&Y) 단계 III 이하에 해당하는 파킨슨병 환자 192명을 대상으로 기립경사검사 시행 전후 1개월 이내에 인지기능 선별검사와 뇌자기공명영상을 시행하였으며 후향적으로 자료를 분석하였다. 제외기준에는 환자의 혈역학적 상태와 자율신경기능에 영향을 줄 수 있는 약제(tricyclic antidepressants, phenothiazine, nitrates, hydralazine, barbiturate, opiate, etc.)를 복용 중인 경우는 분석에서 제외하였다.
2. 기립경사검사
최소 20분 이상 누워서 안정을 취한 후 혈압을 측정하여 최소 3분 이상 수축기와 이완기혈압이 일정하게 유지되면 검사를 시작하였다. 기립경사대를 70도로 세운 후 10분 동안 매 1분마다 수축기, 이완기혈압과 심박수를 측정하였다. 기립 후 3분 이내에 수축기혈압 ≥20 mmHg 또는 이완기혈압 ≥10 mmHg가 저하되면 고전기립저혈압(classic orthostatic hypotension)으로 정의하였고, 기립 3분 후 10분 이내에 수축기혈압 ≥20 mmHg 또는 이완기혈압 ≥10 mmHg가 저하되면 지연기립저혈압(delayed orthostatic hypotension)으로 정의하였다. 고전기립저혈압 또는 지연기립저혈압이 있으면 기립저혈압이 있는 군으로 분류하였다.
3. 인지기능 평가
인지기능은 한국판간이정신상태검사(K-Mini Mental Status Examination)와 한국판몬트리올인지평가(K-Montreal Cognitive assessments)로 평가하였다. 한국판간이정신상태검사는 ‘한국판 Modified Mini-Mental State Examination의 타당도(2003)’에서의 연령과 교육수준을 보정한 정상규준을 참고하였고[10] 몬트리올인지평가는 ‘혈관인지장애 선별검사로서 Korean-Montreal Cognitive Assessment의 신뢰도, 타당도 및 규준 연구(2009)’를 참고하여 학력, 연령에 따라 보정한 정상규준에 비하여 점수가 낮은 경우를 인지저하군(cognitive impairment, CI), 그렇지 않은 경우를 인지정상군(cognitive normal, CN)으로 분류하였다.
4. 뇌백질변성 평가
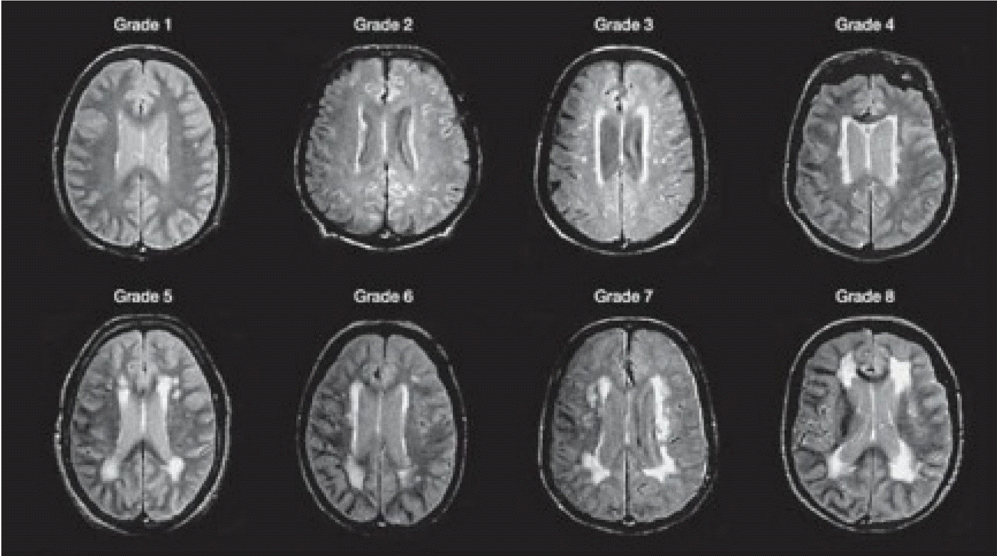
뇌백질변성 정도는 뇌 자기공명영상(Achieva 3.0T X, Philips, Eindhoven, the Netherland; 1.5-T scanner, General Electric, Milwaukee, WI, USA)의 T2 강조영상 또는 액체감쇠회복역전영상(fluid attenuated inversion recovery)을 환자의 임상정보를 알지 못하는 2명의 신경과 의사가 각각 평가하였다. 뇌백질변성의 중증도는 Cardiovascular Health Study 척도를 이용하여 1-8점으로 나누어 평가하였다(Fig. 1) [11].
5. 통계방법
대상자 특성 분석에 Student t-test와 chi-square test를 이용하였고 파킨슨병에서 기립저혈압과 인지저하와의 관계를 분석하기 위하여 chi-square test와 상관분석(correlation analysis)을 이용하였다. 인지기능과 뇌 자기공명영상의 뇌백질고신호강도 간의 관계에 대한 분석에는 Student t-test와 correlation analysis를 이용하였으며 위험도는 logistic regression을 통하여 평가하였다. SPSS version 20 for Windows (SPSS Inc., Chicago, IL, USA)로 분석하였으며 통계적 유의성은 p-value <0.05로 하였다.
결 과
1. 임상 특성
대상자는 평균 68.8세, H&Y 단계 2.3, 통합파킨슨병척도(Unified Parkinson's disease rating scale, UPDRS) 21.5점이었으며, 전체 192명의 파킨슨병 환자 모두 기립경사검사를 시행하였으며 이 중 45명(23.4%)에서 기립저혈압이 있었다. 기립저혈압 양성군(orthostatic hypotension, OH+)과 기립저혈압 음성군(OH-) 사이에 평균 연령, 교육 정도, 파킨슨병 진행 정도(H&Y 단계, UPDRS), 질병 이환 기간, 약물 용량, 혈관위험인자에 의미 있는 차이는 없었다. 기립저혈압 양성군은 수축기혈압이 평균 37 mmHg, 이완기혈압이 15.8 mmHg 떨어졌다.
한국판간이정신상태검사를 시행한 환자는 총 192명이었고, 몬트리올인지평가를 시행한 환자는 192명 중 152명이었다. 한국판간이정신상태검사에서 기립저혈압 양성군은 23.9점, 기립저혈압 음성군은 24.3점으로 기립저혈압이 있는 군이 더 낮았지만 통계적으로 유의한 차이는 없었다. 몬트리올인지평가 점수를 적용하였을 때 기립저혈압 양성군에서 통계적으로 유의하게 인지저하자의 비율이 높았다(43.2% vs. 25.2%, p-valve=0.04). 192명의 환자 모두 기립경사검사 전후 1개월 이내에 뇌 자기공명영상을 시행하였고 기립저혈압 유무로 분류한 양 군에서 뇌백질변성 정도에 차이는 없었다(Table 1).
파킨슨병의 진행 정도에 따라 인지기능과 기립저혈압의 관계를 확인하기 위하여 H&Y 단계별로 기립저혈압이 있는 군과 없는 군 간의 임상정보, 인지기능검사 결과, 뇌백질변성 정도를 비교하였다. H&Y 단계 I과 II에서는 기립저혈압이 있는 군과 없는 군 사이에 통계적으로 의미 있는 차이는 없었지만 H&Y 단계 III에서 기립저혈압이 있는 군에서 기립저혈압이 없는 군에 비하여 인지기능저하가 있는 비율이 높았으며, 이는 통계적으로 의미 있는 차이를 보였다(Table 2).
2. 기립경사검사와 인지기능의 상관관계
수축기혈압과 이완기혈압의 최대 변화량(maximum change)은 한국판간이정신상태검사와 몬트리올인지평가 모두 통계적으로 유의한 상관관계가 없었으나 심박수 최대 변화량은 두 가지 인지기능검사와 통계적으로 유의한 양의 상관관계를 보였다(Table 3).
3. 뇌백질변성과 인지기능, 기립저혈압 사이의 상관관계
뇌백질변성이 심할수록 한국판간이정신상태검사와 몬트리올인지평가로 분석한 인지기능 점수가 낮았다. 백질변성은 기립 시 수축기와 이완기혈압 최대 변화량과 유의한 관련성은 없었고 심박수 최대 변화량과 음의 상관관계를 보였다(Table 4).
4. 기립저혈압과 인지저하의 위험도 평가
인지기능에 영향을 미칠 수 있는 인자를 단변량 로지스틱 회귀분석을 통하여 확인하였고 의미 있는 인자를 다중 로지스틱 회귀분석하였다(Table 5). 192명의 파킨슨병 환자 전체를 대상으로 연령, 교육수준을 보정하여 로지스틱 회귀분석한 결과 기립저혈압 양성군이 음성군에 비하여 인지저하가 있을 위험도는 2.6배 높았고 이는 통계적으로 유의하였다(p-value=0.04, 95% confidence interval [CI] 1.03-6.55). 파킨슨병의 진행 정도가 뚜렷한 H&Y 단계 III의 환자 81명을 대상으로 위험도를 평가하였을 때 기립저혈압 양성군이 음성군에 비하여 인지저하가 있을 위험도는 5.8배로 전체군에 비하여 더 높았다(p-value=0.03, 95% CI 1.18-28.90). 그러나 H&Y 단계 I과 II에서는 기립저혈압 양성군과 기립저혈압 음성의 위험도에 통계적으로 유의한 차이가 없었다.
고 찰
본 연구에서 기립저혈압이 있는 대상자는 192명 중 45명으로 전체의 23.4%였고 이 중 몬트리올인지평가로 분석한 인지저하자는 43.2%였다. 파킨슨병 환자에서 기립저혈압과 인지저하 사이에 연관성이 있었고 이는 한국판간이정신상태검사에서는 통계적 유의성이 없었으나 몬트리올인지평가에서는 유의성을 보였다. 몬트리올인지평가는 파킨슨병과 같이 초기에 인지장애가 경미한 질환에서 한국판간이정신상태검사보다 더 민감하다고 알려져 있고[12] 본 연구의 결과는 이런 몬트리올인지평가의 특성을 반영한 것으로 판단할 수 있다. 몬트리올인지평가는 간이정신상태검사에 비하여 전두엽수행기능과 추상적 사고에 대한 평가가 가능하며 변별력과 민감도가 높다. 한 연구에서는 간이정신상태검사가 정상이었던 파킨슨병 환자의 52%에서 몬트리올인지평가로 평가하였을 때 인지저하가 있었다[13].
간이정신상태검사는 인지저하가 있어도 정상으로 평가되는 천정효과(ceiling effect)나 인지저하가 매우 심할 때 이를 정확히 평가할 수 없는 바닥효과(floor effect)가 나타날 수 있다. 또한 몬트리올 인지평가는 간이정신상태검사에 비하여 동일 평가자에 의한 재검사와 서로 다른 평가자 사이 일치도가 더 높았다[14]. 그러나 몬트리올인지평가는 경도인지장애를 구별하기 위하여 간이정신상태검사보다 난이도가 높은 문항이 있어 글을 읽고 쓰지 못하는 대상자에게 적용하기 어렵다[15].
파킨슨병 환자는 떨림, 보행장애를 포함한 운동증상 외에 기립저혈압, 인지기능저하를 포함한 다양한 비운동증상을 보인다. 이는 기저핵으로부터 도파민과 콜린 투사(projection)가 시상뿐 아니라 뇌피질의 광범위한 부위에 영향을 미치기 때문인 것으로 알려져 있다[16-20]. 파킨슨병의 다양한 비운동증상 중 기립저혈압과 인지저하의 연관성에 대한 병리학 기전으로 알파시누클레인(α-synuclein) 침착이 점진적으로 진행하여 나타난 자율신경기능장애가 인지기능저하를 초래한다는 가설을 들 수 있다. 초기 병변은 후각신경핵과 설인신경, 미주신경의 배측 운동신경핵에 알파시누클레인 침착으로 시작하는데 시간이 흐름에 따라 뇌간에서 뇌피질로 상행하는 특성을 보인다[21]. 병변이 대상피질 앞쪽(anterior cingulate cortex)까지 진행하면 이에 해당하는 증상으로 교감신경의 긴장(tone)을 조절하는 자율신경계 기능장애를 보일 수 있고 또한 주의 집중, 동기 부여와 같은 인지기능장애가 나타날 수 있다[22]. 대상피질 앞쪽을 침범하는 경우에도 자율신경기능장애가 발생하지만 상행하기 전 뇌간에 알파시누클레인 침착 역시 자율신경계 이상을 유발할 수 있다. 따라서 파킨슨병에서 운동증상이나 인지저하 발생 전 초기 증상으로 기립저혈압이 먼저 나타나는 경우가 많으며 질환이 진행함에 따라 피질까지 침범되면서 운동증상이나 인지저하가 발현한다[4].
본 연구에서는 기립시 심박수의 변화가 큰 군이 인지기능 평가에서 더 높은 점수를 보였으며 이는 통계적으로 유의하였다. 파킨슨병에서 중추자율신경조절기능(central autonomic regulation)이 저하되면서 정상인에 비하여 혈압 변화에 대한 조절작용(compensation)이 저하되는 것도 인지장애에 영향을 미칠 수 있다[23]. 알파시누클레인의 침착이 중추자율신경망(central autonomic network)을 침범하면 교감신경과 부교감신경을 관장하는 압력반사(baroreflex)조절에 장애가 생긴다. 중추자율신경망은 대상피질 앞쪽, 뇌섬엽(insula), 안와전두피질(orbitofrontal cortex), 복내측 전두전엽피질(ventromedial prefrontal cortex), 편도체 중심핵(central nucleus of amygdala), 시상하부(hypothalamus), 수도관주위회색질(periaqueductal gray matter), 고립로(solitary tract)핵, 의핵(nucleus ambiguus), 연수(medulla)를 포함한다. 중추자율신경망은 성상신경절(stellate ganglia)과 미주신경(vagus nerve)을 통하여 심장기능을 조절하는데 이는 교감신경과 부교감신경의 신호를 매개로 한다. 선 자세에서 혈압이 저하되면 중추자율신경망의 상호작용으로 교감신경이 활성화되고 심박수가 증가한다. 이러한 기전으로 심박수 변화는 중추신경계-자율신경계 되먹임(feedback)작용의 표지자라 할 수 있다(Fig. 2) [24,25]. 심박수 변화와 인지기능에 대한 한 연구에서 50세 이상에서 심박수 변화가 낮으면 인지기능이 저하되었다[26]. 이는 자율신경계의 적절한 보상 작용을 통하여 인지기능이 보존될 수 있음을 설명할 수 있는 근거이다[27]. 본 연구에서는 심박수 최대 변화량이 인지검사 점수와 상관관계가 있었으나 혈압 최대 변화량과는 상관관계가 없었다.

A composite schematic diagram showing the pathways by which the central autonomic networks influence control of heart rate. NTS; nucleus tractus solitarius, DVN; dorsal vagal nucleus, NA; nucleus ambiguous, RVLM; rostral ventrolateral medulla, IML Column; intermediolateral cell column. Adapted from reference 25.
본 연구에서 뇌 자기공명영상을 분석한 결과 백질변성 정도는 인지저하와 밀접한 상관관계를 보였고 이는 백질변성이 심할수록 인지저하가 나타난다는 기존 연구의 결과와 일치하였다[28,29]. 또한 뇌백질변성은 기립경사검사에서 심박수 최대 변화량과 상관관계가 있었다. 이에 대한 기전으로 삽화저혈압이 뇌의 관류를 반복적으로 저하시키고 이것이 저산소허혈손상을 초래하여 인지저하가 생긴다는 혈관가설(vascular hypothesis)을 들 수 있다. 본 연구처럼 혈관가설에 기초한 한 연구에서는 기립저혈압이 있는 군이 없는 군에 비하여 인지저하가 나타났으나 뇌 자기공명영상에서 가설을 설명할 만한 허혈병변은 없었다[30]. 본 연구에서는 기립저혈압이 있는 군이 없는 군에 비하여 인지저하가 심하였고 뇌백질변성이 인지저하와 연관이 있었으며 인지저하가 기립경사검사시 심박수 최대 변화량과 상관관계가 있었으므로 혈관가설에 더 합당하였다. 2017년 파킨슨병 환자를 대상으로 한 연구에서는 누운 자세와 60도 세운 자세에서 기립저혈압이 나타나는지 확인하고 각각의 자세에서 인지기능을 평가하였다. 60도 세운 자세에서 기립저혈압이 있는 군에서 시공간능력, 전두엽수행기능, 기억력에 저하를 보였으며 이는 가역적이었다[9]. 자세에 따른 인지기능의 차이를 평가하였다는 점이 본 연구와 방법적으로 다르지만 혈관가설을 바탕으로 기립저혈압과 인지저하의 관련성을 설명하였다는 점은 동일하였다.
따라서 파킨슨병에서 기립저혈압과 인지기능의 상호연관성은 병리 소견인 알파시누클레인 침착이 중추자율신경망을 손상시켜 자율신경조절장애가 발생하여 인지저하가 나타나는 기전과 기립저혈압으로 인한 반복적인 뇌관류저하로 뇌백질변성이 생기고 이로 인하여 인지기능 저하가 발생하는 두 기전을 생각할 수 있다.
본 연구의 제한점은 첫째로, 의무기록을 기초로 한 후향적 단면 연구로 진행하였다는 점이다. 따라서 장기간 환자의 자율신경기능장애와 인지기능의 변화를 확인하며 두 요인 사이의 인과관계를 확인하기 어렵다는 단점이 있다. 둘째로, 인지기능을 간이정신상태검사나 몬트리올인지평가와 같은 선별검사가 아닌 더 자세하고 종합적인 인지기능검사를 통하여 평가하였다면 기립저혈압이 어떤 인지영역에 영향을 미치는지와 기립저혈압과 해당 인지영역의 기능 사이의 연관성을 확인할 수 있었을 것이라고 생각한다.
기립저혈압과 인지저하는 삶의 질을 저하시키는 파킨슨병의 흔한 동반 증상이다. 기립저혈압이 있으면 인지장애의 위험도가 높지만 심박수 변화가 클수록 인지저하와 뇌영상검사상 백질변성정도가 더 적었다. 따라서 질환의 초기부터 기립저혈압과 인지기능에 대한 주기적인 평가가 필요하며 파킨슨병 환자에서 기립저혈압의 적절한 관리와 치료를 하는 것이 환자의 삶의 질 개선과 예후에 도움이 될 것이다.