S. aureus 괴사성 폐렴에 동반된 항 아쿠아포린-4 항체 양성 종단광범위 횡단성척수염
An Anti-aquaporin 4 Positive Longitudinally Extensive Transverse Myelitis with Antecedent Necrotizing Pneumonia Associated with S. aureus
Article information
Trans Abstract
A 53-year-old male patient presented with quadriparesis during pulmonological hospitalization for the treatment of S. aureus associated necrotizing pneumonia. He was diagnosed with the aquaporin-4 (AQP4) positive longitudinally extensive transverse myelitis from pons to T3 level. Despite the administration of intravenous methylprednisolone and plasma exchange with appropriate antibiotics, the patient’s neurological condition deteriorated and he died. Our case implies that an S. aureus associated necrotizing pneumonia can trigger an AQP4 positive neuromyelitis optica spectrum disorder and contribute to the devastating course.
종단광범위 횡단성척수염(longitudinally extensive transverse myelitis)은 척수분절 3개 이상을 침범하는 중추성 탈수초질환으로, 시신경척수염(neuromyelitis optica, NMO) 및 시신경척수염범주질환(neuromyelitis optica spectrum disotder, NMOSD)의 특징적 소견이다[1]. 항아쿠아포린-4 항체(aquaporin-4 antibody, AQP4 immunoglobulin G)의 발견은 시신경척수염 및 시신경척수염범주질환에 대한 병의 이해도를 높여주는 동시에 진단의 중요한 역할을 하기 시작하였다[2]. 한편, 괴사성 폐렴은 세균성 지역사회획득폐렴(community acquired pneumonia)의 드물지만 심각한 합병증으로 알려져 있으며, 기관지 및 폐의 혈류 공급 장애로 인한 폐실질의 괴사를 특징으로 한다[3]. 최근 바이러스 혹은 세균감염과 관련된 시신경척수염 및 시신경척수염범주질환이 보고되고 있으며, 다양한 병인론이 제기되고 있다[2,4,5]. 저자들은 괴사성 폐렴(necrotizing pneumonia) 및 항아쿠아포린-4 항체 양성 시신경척수염범주질환이라는 두 개의 드문 질환을 동시에 가진 환자의 증례를 보고하고자 한다.
증 례
53세 남자가 기침, 각혈 및 근육통으로 괴사성 폐렴을 진단받고 호흡기내과 외래에서 amoxicillin, clavulanate 및 azithromycin 항생제 치료를 한 달간 시행하였으나 호전되지 않아 입원 후 meropenem 항생제 치료를 받았다. 입원 2일째, 환자는 양측 하지 근력저하를 호소하였으며, 입원 3일째 근력저하가 상지로 진행하여 입원 4일째 본과에 의뢰되었다. 신경학적 검사에서 좌측 상지 및 양측 하지는 Medical Research Council (MRC) 등급 2, 우측 상지는 MRC등급 3의 근력저하가 있었고, T4 척수분절 이하의 통각감각저하 및 양측 이두근과 무릎의 심부건반사 저하가 확인되었다.
혈액검사에서 아스파르테이트아미노전달효소(aspartate aminotransferase) 194 U/L, 알라닌아미노전달효소(alanine aminotransferse) 159 U/L로 증가되어 있었다. 뇌척수액검사에서는 백혈구는 관찰되지 않았고(white blood cell count 0/μL), 단백 68.0 mg/dL (normal range; 12-60 mg/dL)로 경미하게 증가되어 있었다. 뇌척수액검사 및 혈청검사 결과에서 S. aureus를 포함한 바이러스 감염(단순헤르페스바이러스, 수두대상포진바이러스, 거대세포바이러스, 홍역, 풍진, 사람면역결핍바이러스, 사람T세포림프친화바이러스 1형 및 2형) 및 다른 감염병(매독, 세균, 미코박테륨)의 이상 소견은 관찰되지 않았다. 흉부전산화단층촬영에서 폐의 우측 중간엽에서 내부에는 저음영이, 주변부에는 조영증강되는 폐경결이 확인되었다. 신경전도검사(nerve conduction study)에서 양측 척골신경 원위부의 복합신경활동전위(compound nerve action potentials)의 감소 및 좌측 척골신경에서 H-반사의 연장과 함께 전도차단(conduction block)이 확인되었다. 척수자기공명영상의 T2 강조영상에서 교뇌부터 흉추 3번까지 고신호 강도가 확인되었다(Fig.).
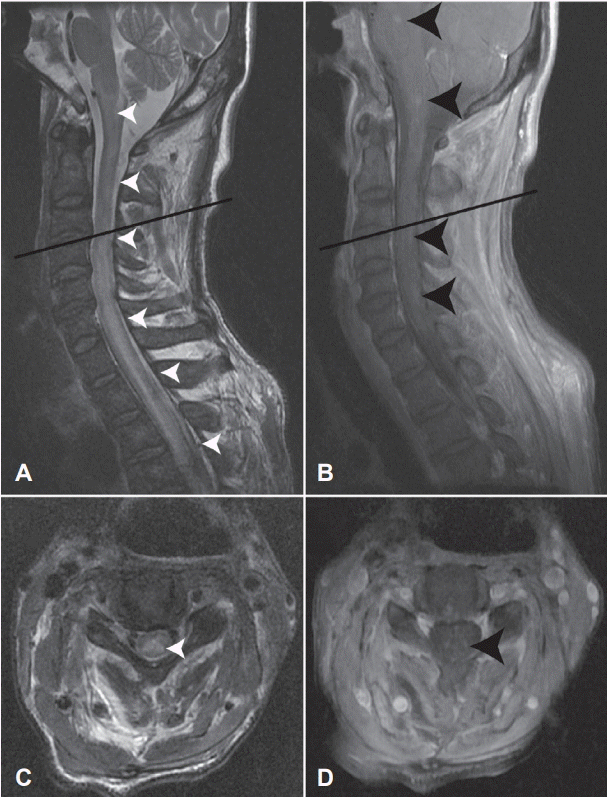
Spine MRI of the patient. T2-weighted sagittal image shows hyperintensities from pons to T3 vertebral level (A, white arrow heads). Scattered lesions are identified in a gadolinium-enhanced T1-weighted sagittal image (B, black arrow heads). Identical lesions are revealed in T2-weighted and gadolinium-enhanced T1-weighted axial images at the C3/4 vertebral level (C, white arrows head and D, black arrow head). Black lines in A and B are scout lines of C and D, respectively. MRI; magnetic resonance imaging.
비록 신경전도검사상 이상 소견을 보였지만, 급성염증성탈수초다발성신경병증(acute inflammatory demyelinating polyradiculoneuropathy)보다는 척수병증(myelopathy)으로 진단하고 5일간 고용량 스테로이드(methylprednisolone 1 g/day) 정주 투여를 하였다. 고용량 스테로이드 치료를 시작한 다음날 급성 심정지가 발생하였고 심폐소생술 시행 후 소생되었다. 소생 후 사지 근력저하가 진행하여 우측 상지의 근력은 MRC등급 2로, 이외 부분은 완전마비가 관찰되었으며, 호흡근의 약화로 인한 호흡부전이 확인되어 인공호흡기 치료를 시작하였다.
당시 급성염증성탈수초다발성신경병증의 가능성을 완전히 배제하기 어려워 정맥면역글로불린(intravenous immunoglobulin) 0.4 g/kg을 5일간 투여하였다. 면역글로불린 치료가 끝난 후, 본과에 협진 의뢰된 시점에 채혈한 혈청에서 세포기반간접면역형광측정법(cell-based indirect immunofluorescence assay, EUROIMMUN, Lübeck, Germany)으로 시행한 항아쿠아포린-4 항체가 약양성(1:10)으로 확인되어 NMOSD로 진단할 수 있었다. 또한, 객담배양검사에서 S. aureus가 확인되어 meropenem에서 vancomycin으로 항생제를 변경하였다. 이후에도 환자의 근력은 호전되지 않아, 면역글로불린 치료가 끝난 후 5일째, 치료적 혈장분리교환술을 이틀에 한번씩 총 5회 시행하였다. 혈장분리교환술이 끝난 이후에도 신경학적 증상은 호전이 없었으며, 환자는 2주 후 괴사성 폐렴의 악화로 사망하였다.
고 찰
본 증례에서 환자는 척수자기공명영상의 종단광범위 횡단성척수염과 항아쿠아포린-4 항체 양성 소견의 확인으로 2015년 개정된 NMOSD 진단기준에 따라 항아쿠아포린-4 항체 양성 시신경척수염범주질환(AQP4-positive NMOSD)으로 진단되었다[1]. 동시에 선행한 괴사성 폐렴은 흉부전산화단층촬영의 소견과 배양된 균주를 통하여 확인할 수 있었다. 이 소견들을 종합할 때, 이 증례는 선행하는 괴사성 폐렴에 동반된 시신경척수염범주질환으로 진단할 수 있으며, 지금까지 알려진 바는 없다고 저자들은 판단하고 있다.
현재까지 감염질환과 연관된 시신경척수염 또는 시신경척수염범주질환 증례가 보고되고 있다[4]. 비록 정확한 기전은 아직 밝혀지지 않았지만, 숙주 면역계의 방관자활성화(bystander activation), 항원의 분자적유사성(molecular mimicry) 그리고 병원체직접공격(direct attack of pathogen)와 같이 병인론이 제기되고 있다[2,4]. 방관자활성화 이론은 감염질환이 염증 반응을 통하여 아쿠아포린-4 손상을 가하며, 아쿠아포린-4 항원 제시 및 아쿠아포린-4 특이적인 B세포 활성화를 일으키는 일련의 면역학적 연쇄반응을 유발할 수 있다는 기전으로 설명하고 있다. 분자적유사성(molecular mimicry)은 감염원의 항원결정기(epitope)와 숙주 단백질의 항원적 유사성(antigenic similarity)으로 인하여 면역 반응이 발생할 수 있다고 설명하고 있다[4]. 미코박테륨 및 미코플라즈마 종에 발현되는 단백질과 아쿠아포린-4의 상동성이 이 가설을 뒷받침하고 있다[4]. 본 증례에서는 괴사성 폐렴 이후 시간적 차이를 두고 신경학적 증상이 발생하였고, 적절한 항생제를 사용하는 중에도 신경학적 증상이 악화된 것으로 볼 때, 병원체의 직접 공격보다 방관자활성화 또는 분자적유사성에 의한 자가면역 기전을 통하여 시신경척수염범주질환으로 발전하였을 가능성이 높다.
바이러스와 연관된 시신경척수염 혹은 시신경척수염범주질환의 원인 감염은 수두대상포진바이러스가 가장 많았으며, 이외 사람면역결핍바이러스, 거대세포바이러스, 뎅기열바이러스, A형간염 그리고 엡스타인-바바이러스가 보고되고 있다[4,5]. 세균감염의 경우에는 결핵균(Mycobacterium tuberculosis)이 가장 많았으며, 폐렴미코플라즈마(Mycoplasma Pneumoniae)와 매독균(Treponema pallidum)의 사례도 보고되었다[4]. 신경학적 증상의 경과는 바이러스 감염과 연관된 11명의 환자 중 4명이 완전 회복을, 5명은 일부 회복을 보인 반면, 세균과 연관된 5명의 환자 중 1명만이 증상 호전을 보였다[4]. 특히 세균 감염과 연관된 시신경척수염 혹은 시신경척수염범주질환의 경우, 단상성(monophasic)의 경과에도 불구하고 신경학적 증상이 악화되거나 지속된다고 보고되고 있다[4]. 본 증례는 이전에 보고된 세균성 감염 연관 시신경척수염의 증례와 유사하게 진행성 예후를 보였을 뿐만 아니라, 이전 보고에서는 관찰되지 않았던 혈청 아쿠아포린-4 항체가 발견되어, 의미가 있다고 판단된다(Table).

Demographics, clinical and laboratory findings, and outcome in cases with bacteria-associated neuromyelitis optica or neuromyelitis optica spectrum disorder
본 증례는 선행한 S. aureus 괴사성 폐렴이 항아쿠아포린-4 항체 양성 시신경척수염범주질환을 유도할 수 있으며, 동반된 세균성 감염이 시신경척수염범주질환 환자의 나쁜 예후에 일조함을 보여주었다. 본 증례와 유사한 증례가 추가적으로 발견된다면, 시신경척수염범주질환의 병리기전에서 동반 감염증의 역할을 도출 가능하리라 생각한다.