비케톤성 고혈당증 유발발작의 임상양상과 예후
The Clinical Presentations and Prognosis of Non-Ketotic Hyperglycemia Induced Seizure
Article information
Trans Abstract
Background
Seizure can be triggered by the non-ketotic hyperglycemia (NKH). Recently we analysed 18 cases of NKH induced seizure to identify the causes for NKH, seizure types, prognosis, and the differences of clinical presentation between the patient with chronic brain structural lesion (CBSL) and the patient without.
Methods
Eighteen patients with NKH induced seizure were selected from the database. Data regarding brain images, clinical symptoms, co-morbid illnesses, blood laboratories, and prognosis were collected. Patients were divided into two groups according to the presence of CBSL.
Results
The patients with CBSL showed more generalized tonic-clonic seizure (GTCS) than without. Focal seizures in this group appeared to be originated from the pre-existing lesion in many situations. The poor compliance to anti-diabetic treatment and physical stresses were most common causes for NKH. One year seizure remission without anti-epileptic drug treatment was achieved in 17 of 18 patients.
Conclusions
The patients with CBSL might have more GTCS than without. The impairment of inhibitory mechanism surrounding the focal irritative zone might be one of plausible explanation for this phenomenon. The prognosis was favorable. Further large studies are required.
서 론
고혈당은 뇌경색, 이상운동, 발작, 뇌신경마비와 같은 다양한 신경계질환이나 증상의 원인이 된다. 고혈당에 의한 발작은 1965년의 문헌보고 이후 여러 후속 보고를 통하여 잘 알려졌는데, 당뇨병성 케톤산증(diabetic ketoacidosis)에 비하여 비케톤성 고혈당증(non-ketotic hyperglycemia)이 발작을 잘 유발하며, 다른 대사 이상으로 유발된 발작에 비하여 상대적으로 국소발작이 빈번하고, 국소운동발작지속증(epilepsia partialis continua)이 잘 생길 수 있다는 점이 특징이다[1,2]. 이외에도 후두엽발작, 비발작성 뇌전증 지속상태, 복합부분발작, 실어증발작 등의 다양한 발작 양상이 보고되어 있다[3-13].
여러 문헌보고에도 불구하고 증례보고가 많고, 대규모 환자를 대상으로 한 연구를 찾기 어려워, 진료에 참고할 만한 사항이 제한적일 수 밖에 없다는 점이 현재 문헌자료들의 취약점이라 할 수 있다. 또한 당뇨병을 앓고 있는 환자들의 경우 동반질환이 있는 경우가 많으며, 특히 뇌경색과 같은 뇌질환의 과거력이 있는 비율이 일반인에 비하여 높을 것으로 기대되는데, 상대적으로 다수의 환자를 대상으로 진행된 연구일지라도 연구설계 단계에서 뇌병변이 있는 환자는 제외된 경우도 있어, 진료에 도움이 될 수 있는 문헌자료를 찾는데 어려움이 있다[14]. 이러한 사항들을 보완하고자 저자들은 본원에서 치료하였던 18예의 고혈당 유발발작 환자들을 분석하였으며, 특히 뇌병변이 있는 환자와 없는 환자의 임상적인 차이를 알아보고자 본 연구를 진행하였다.
대상과 방법
1. 환자 선별과 의무기록 분석
2001년 1월 1일부터 2016년 12월 31일까지 강릉아산병원의 신경과, 신경외과, 가정의학과, 또는 내분비내과에서 치료받은 환자 가운데 진단명에 발작과 당뇨병 또는 발작과 고혈당이 있는 135명의 환자를 대상으로 하였다. 이 중에서, 한 달 이내에 허혈성 뇌경색, 출혈성 뇌경색, 두개강내출혈, 저산소성 뇌손상과 같은 급성 뇌질환을 앓았거나, 뇌종양, 뇌수막염과 같은 활동성 중추신경계 질환을 앓고 있어서 급성증상발작(acute symptomatic seizure)의 가능성을 배제하지 못하는 경우, 발작의 과거력이 있는 경우, 항경련제를 복용하고 있는 경우, 발작 발생 당시에 고혈당 상태가 아니었던 경우, 멜라스증후군을 앓고 있는 경우, 알코올금단이나 요독증, 간성혼수, 전해질이상, 후두부가역성뇌병증증후군 등에 의하여 발작이 발생하였을 가능성을 배제하기 어려운 경우, 발작양상에 대한 의무기록 기술이 없는 경우, 내분비내과 전문의와 신경과 전문의의 진료를 받지 않은 경우, 뇌영상검사를 하지 않은 경우, 뇌파검사를 하지 않은 경우 등은 제외하였다. 발작이 신경과 전문의에 의하여 규명되고, 혈당조절 후에 발작이 조절되고, 이후 1년 이상의 추적 관찰 기록이 있는 경우는 포함하였다. 이에 따라 최종적으로 18명의 환자가 선별되었다(Fig. 1).
선별된 환자들의 나이, 성별, 기저질환, 당뇨병 투병력, 기존에 복용하던 당뇨병 치료 약물의 종류, 뇌영상 소견, 뇌파 소견, 발작의 종류, 빈도, 처방된 항경련제의 종류와 용량, 발작 발생 당시의 혈당, 당화혈색소, 혈중오스몰농도, 고혈당의 원인 등을 파악하였다. 18명의 환자 중에서 과거력과 뇌영상검사에서 비진행성-만성 뇌피질병변이 확인된 환자는 모두 8명이었다. 이들을 1그룹이라 하였으며, 나머지 뇌병변이 없는 10명의 환자를 2그룹으로 하였다.
2. 통계분석
통계분석은 윈도우용 SPSS (version 20, IBM Corp., Armonk, NY, USA)를 이용하였다. 만-휘트니U검정(Mann-Whitney U test)과 카이제곱검정 (Chi square test)을 사용하였으며, 통계적인 유의성은 p값이 0.05 미만일 때 유의한 것으로 해석하였다.
결 과
총 18명의 환자들 중 남성은 12명, 여성은 6명이었으며, 평균 연령은 63.4세(43-88세)였다. 이 중에서 새롭게 당뇨병으로 진단된 환자는 5명이었으며, 나머지 13명은 평균 9.9년(1-20년) 전부터 당뇨병을 진단받아 치료를 받던 환자들이었다. 모두 제2형 당뇨병으로 조사되었다. 평균 혈당은 448.1±88.4 mg/dL였으며, 비케톤성 고혈당증이었다. 발작 발생 당시 당화혈색소 수치는 15명에서 조사되었는데, 평균 10.2±3.0% (5.2-14.7%)였다. 혈청오스몰농도는 13명에서 조사되었고, 평균 309±22.4 mOsm/kg (281-359 mOsm/kg)였다. 고혈당의 원인으로서 당뇨병 치료에 대한 순응도가 나빠서 투약을 게을리한 경우가 7명, 새롭게 당뇨병으로 진단된 경우가 5명, 감염이나 외상으로 인하여 악화된 경우가 5명, 저혈당 때문에 약을 감량하였다가 고혈당이 발생한 경우가 1명이었다(Table 1).
발작의 경우, 전신강직간대발작(generalized tonic clonic seizure, GTCS)이 11명(1, 2, 3, 4, 6, 7, 8, 9, 10, 14, 18번)에서 발생하였다. 11명 중 3명(1, 8, 18번)은 국소발작이 이차 GTCS로 발전한 경우였으며, 1명(3번)은 GTCS 이후 비발작성뇌전증 지속상태가 되었다. 국소운동발작은 7명(8, 11, 12, 13, 15, 16, 17번)에서 발생하였다. 이 중에서 1명(16번)은 부분뇌전증지속증(epilepsia partialis continua) 상태였다. 3명(1, 5, 18번)은 시야발작(visual seizure)을 경험하였으며, 이 중에서 1명(18번)은 발작성 흑암시지속증(ictal amaurosis status) 상태로 내원하였다. 발작빈도에 대한 조사는 12명에서 가능하였는데, 발작 지속상태로 내원한 3명의 환자(3, 16, 18번)를 제외할 경우, 첫 발작 발생 당일에 최소 1회에서 최대 12회까지 집중적으로 발생하였다. 모든 환자에서 혈당조절을 위하여 인슐린이 사용되었으며, 16명의 환자에게 발작조절 목적으로 로라제팜 정맥주사가 입원 당일부터 입원 기간 3일 동안에, 각각의 환자에게 최소 1회에서 최대 4회까지 사용되었다. 항경련제는 8명의 환자(1, 3, 5, 8, 9, 15, 16, 18번)에게 사용되었으며, 각각의 환자가 1주에서 4주까지 복용하였다(Table 2).
18명 모두 통상적인 두피뇌파검사(routine scalp EEG recording)를 40분에서 1시간씩 하였다. 15명에서는 비특이적인 서파와 전반적인 뇌기능저하 소견을 보였으나, 3명의 환자(3, 8, 16번)에서는 발작뇌파(ictal discharges)가 기록되었다. 이 3명의 환자는 모두 병원 도착 4시간 이내에 뇌파검사를 받은 환자들이었다. 3번 환자는 비발작성뇌전증 지속상태로서 뇌파에서 전반적인 1 Hz의 주기적 뇌정증모양파(generalized periodic epileptiform discharges)가 지속적으로 관찰되었고, 8번 환자는 우측 전두엽에서 율동성 쎄타파가 발생하고 이와 함께 좌측 팔이 강직되는 것이 확인되었으며, 16번 환자의 경우 우측 중심관측두영역에서 반복적으로 예서파 복합체(sharp wave complexes)가 발생하고, 임상적으로는 좌측 하지에 국소운동발작이 지속되는 상태였다. 뇌영상검사의 경우, 뇌 컴퓨터단층촬영(computed tomography, CT)을 검사한 환자가 8명, 뇌 자기공명영상(magnetic resonance image, MRI)을 한 환자가 10명이었다. CT 또는 MRI에서 뇌병변이 확인된 환자는 모두 8명(1그룹)이었다. 과거력에서 허혈뇌경색이 4명, 자발성 뇌출혈이 1명, 두경부 외상을 겪은 환자는 1명이었다. 2명의 환자(1번, 7번)는 뇌질환의 과거력은 없었으나, 뇌영상에서 무증상 뇌경색 흔적으로 추정되는 뇌피질 부위 연화증 소견이 발견되었다. 이들과 뇌병변이 없는 환자들(2그룹, 10명) 간의 연령, 혈당, 당화혈색소, 혈청오스몰, 발작양상, GTCS빈도 등을 비교하였다(Table 3). 평균 연령, 당뇨병 투병 기간, 혈당 수치, 당화혈색소 수치, 혈청오스몰 수치에서는 통계적으로 의미 있는 차이가 없었으나, 발작양상에서는 차이가 있었다. GTCS는 1그룹 환자 중 7명(87.5%)에서 발생하였으며, 2그룹 환자 중에서는 4명(40%)에서 발생하였다. 국소운동발작은 1그룹 환자에서 1명(12.5%), 2그룹 환자에서는 6명(60%)에서 발생하였다. 1그룹 환자 중 총 3명(1, 5, 8번)에서 국소발작이 발생하였다. 우측 측두엽 후부에 뇌연화증이 있는 1번 환자와 우측 측두엽 기저부와 후두엽에 걸쳐 피질위축과 헤모시데린 침착이 있는 5번 환자의 경우 시야발작이 있었으며, 우측 전두엽 내측에 뇌연화증이 있는 8번 환자의 경우, 좌측 팔에 국소운동발작이 발생하였고, 뇌파검사에서 발작파가 우측 전두엽에서 발생하는 것이 확인되었다(Fig. 2). 모든 환자는 내원 후 24시간에서 7일 이내에 발작 완화(remission) 상태가 되었으며, 이후에도 항경련제 복용 없이 최소 1년 이상 발작이 재발하지 않은 것으로 조사되었다. 환자 중 한 명(14번)은 혈당이 조절되면서 발작이 완화되었으나, 3개월 후에 급성 담낭염에 의한 패혈증이 발생하여 사망하였다.
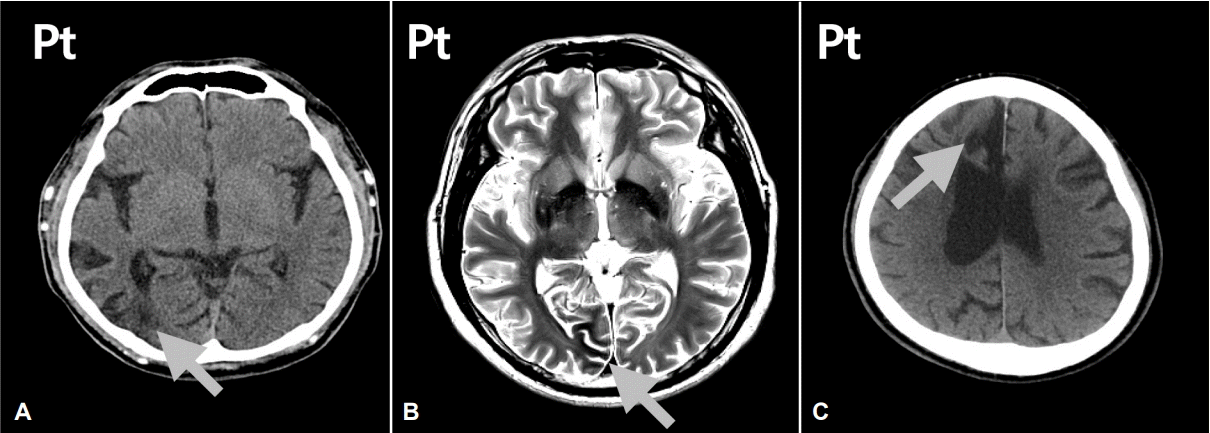
Brain images of three patients (patient 1, 5, and 8) with partial seizure in the group 1. The grey arrow indicates the cortical lesion. (A) Pt 1; The cortical atrophy in the right posterior temporal lobe. (B) Pt 5; The hemosiderin rim and cortical atrophy in the right posterior temporo-occipital area. (C) Pt 8; The cortical atrophy and passive dilatation of adjacent ventricle in the right frontal region. Pt; patient.
고 찰
본 연구의 결과는 다음과 같다. 첫째, 비진행성 만성 뇌병변이 있는 환자에서 비케톤성 고혈당증에 의하여 발작이 유발될 경우, 발작이 뇌병변 부위에서 시작될 가능성이 다른 뇌부위에서 시작될 가능성보다 상대적으로 높을 것으로 추정된다. 8번 환자의 경우에는 발작이 뇌병변 부위에서 발생하는 것이 뇌파와 발작 양상에서 확인되었으며, 시야발작을 한 2명의 환자(1, 5번)의 경우 뇌병변이 시각피질에 인접해 있다는 점이 이를 뒷받침 한다. 이 환자들(1, 5, 8번)은 원위성먼증상발작(remote symptomatic seizure)이 고혈당에 의하여 유발된 것으로 여겨진다. 뇌의 구조적인 병변이 있을 경우, 고혈당에 의하여 발작이 더 잘 유발될 수 있다는 여러 실험 및 임상 근거가 있다. 동물실험 연구에서 살아있는 생쥐의 뇌에 일시적인 허혈을 일으킨 후 발작 발생을 관찰하였을 때, 고혈당 상태의 생쥐에서 정상 혈당 상태의 생쥐에 비하여 더 이른 시기에 발작이 관찰되었다[15]. 급성기 뇌경색 환자에서 발생한 발작을 분석한 연구에서 고혈당이 있을 경우, 급성증상발작이 발생할 위험도는 2.77배였다[16]. 2013년에 보고된 핀란드 연구에서는 허혈뇌경색을 앓은 환자의 경우, 혈당이 높을 때 먼증상발작을 경험할 위험도는 약 1.6배라고 보고하였다[17]. 상기 연구들이 동물연구이거나, 후향 분석연구라는 점을 감안하여야 하며, 기존의 뇌병변이 없더라도 고혈당에 의하여 시야발작이 발생할 수 있는 점과 뇌병변이 있더라도 고혈당에 의한 발작은 다른 뇌부위에서 발생하는 경우도 있다는 점을 고려하여야 한다[3,18]. 1992년에 보고된 고혈당 유발발작 증례보고의 경우, 7명의 환자 중 2명이 뇌 컴퓨터단층촬영에서 뇌피질 병변이 있는 것으로 확인되었다. 1명은 우측 실비우스틈새 주위에 뇌경색 흔적이 있었으며, 좌측 상지의 불수의적인 움직임과 함께 좌측으로 목이 돌아가는 발작을 하였다. 다른 1명의 경우, 우측 두정-전두엽에 뇌경색이 발견되었으나, 임상발작은 우측 상하지에서 발생한 것으로 보고하였다[19].
둘째, 뇌병변이 있는 환자의 경우, 뇌병변이 없는 환자에 비하여 고혈당에 의한 GTCS가 더 잘 유발될 가능성이 있는 것으로 추정된다. 고혈당은 뇌의 감마아미노부티르산(gamma-aminobutyric acid, GABA)의 대사를 증가시키고, 이로 인하여 GABA 농도가 감소하여 발작의 문턱이 낮아져서 발작이 발생할 수 있는 것으로 설명된다[20]. 당뇨병성 케톤산증의 경우에는 반대로 GABA의 이용효율이 증가되기 때문에 발작억제 효과가 증가하는 것으로 알려져 있다[21]. 고양이의 뇌피질에 페니실린을 주사하여 국소발작 초점을 만든 후 발작 초점과 그 주변 부위의 전위 변화를 조사하였는데, 발작 초점 주변에서 억제시냅스이후전위(inhibitory post-synaptic potential, IPSP)활동이 활발한 것이 관찰되었다. 국소발작 초점 주위에는, 국소발작이 뇌의 다른 부위로 퍼지는 것을 억누르는 강력한 주위억제 기전(surround inhibition)이 존재할 가능성을 보여준 실험이다[22]. GABA는 포유류 뇌의 IPSP에 매우 중요한 신경전달물질이다[23]. 측두엽 뇌전증 환자를 대상으로 한 연구결과를 보면, 발작 직전에 발작의 발생을 인지하여 대응할 수 있거나, 발작 당시에도 주변 자극에 반응할 수 있는 정도의 발작을 경험하는 환자일수록 이차 GTCS를 경험하는 빈도가 적은 것으로 조사된 바 있으며, 다른 연구에서는 비록 통계적인 차이는 없었으나 내측 측두엽에 발작 초점이 있고, 이에 더하여 동측의 인접 피질에 발작 초점이 추가로 있을 가능성이 높은 환자일수록 이차 GTCS가 빈번한 경향을 보인 연구가 있다[24,25]. 측두엽 뇌전증 환자의 경우, 국소발작의 전파를 억제하는 억제기전의 활성 정도에 따라 GTCS의 빈도가 다를 수 있다는 점을 시사하는 결과일 것이다. 동물실험 결과와 임상연구 결과를 종합하면 고혈당에 의하여 GABA 억제가 약화되고, 이 때문에 국소발작 초점의 주위 억제가 약해짐으로 인하여, 발작파가 쉽게 전파되어 GTCS가 더 빈번할 것으로 보인다.
이외의 연구결과들은 다음과 같다. 고혈당의 원인으로는 당뇨병 치료에 대한 순응도가 낮거나, 당뇨병 환자에게 다른 질환이 발병하고, 이로 인하여 이차적으로 혈당이 상승한 경우가 많은 것을 확인하였다. 당뇨병 환자의 경우 감염에 취약하고, 동반질환이 있는 경우가 많으며, 장기간 투약하는 약물이 많다. 발작이 심하거나 지속될 경우, 신경계 후유증이 남거나 사망할 수도 있다. 항경련제 치료의 경우 부작용이 발생할 가능성이 높고, 혈당 조절보다 치료 효과가 적다. 따라서 치료 순응도를 높게 유지하고, 혈당 관리법을 숙지시키는 것은 매우 중요하다. 추가적으로, 새롭게 당뇨병으로 진단되는 경우가 많았다. 본 연구에서 새롭게 당뇨병이 진단되는 비율은 27.8% (5/18)였다. 1980년 미국에서 조사된 보고에서는 21명의 환자 중 9명(9/21, 42.9%)에서 발작이 당뇨병의 첫 증상이었다[2]. 2003년의 태국의 보고에 의하면 발작이 당뇨병의 첫 증상이었던 경우가 71.4%였다[26]. 시대별, 국가별로 의료 환경이 다른 점을 고려하더라도, 전국민을 대상으로 한 건강검진이 정착되어 있는 국내 사정을 감안 한다면 무시할 수 없는 비율이라 판단된다.
예후는 양호하였다. 발작과 관련성이 적은 질병으로 사망한 증례를 제외하면, 모든 환자에서 장기적인 항경련제 치료가 불필요하였다. 일반적으로 대사 이상으로 인하여 발작이 유발된 경우, 원인 인자가 조절될 경우에는 발작의 예후는 양호하며, 만성적인 뇌전증으로 이행되는 경우는 적은 것으로 알려져 있다. 고혈당 유발발작의 경우, 2009년 문헌에서는 뇌병변이 없는 21명의 환자 모두 장기적으로 항경련제 투약 없이 발작이 재발하지 않은 것으로 보고되었다[14]. 1992년의 보고의 경우, 뇌병변이 있는 환자가 2명, 뇌병변이 없는 환자가 2명, 뇌영상검사를 하지 않은 환자가 3명이었으며, 이들 중에서 장기적인 항경련제 치료를 받은 환자는 없었다[19].
이 연구의 제한점은 다음과 같다. 첫째, 전적으로 의무기록의 정확성에 의존하여야 하는 후향의무기록분석연구로서의 한계점이 있으며, 이와 함께 증례 선별 과정에서 선택편향이 있을 수 있다는 점이다. 135명의 대상자 중에서 의무기록이 부실하거나, 뇌영상 검사, 뇌파검사를 하지 않은 환자가 23명(23/135, 17.0%)이었다. 임상적으로 발작 또는 고혈당 증세가 심하지 않은 증례가 누락됐을 가능성이 있다. 둘째, CT 검사 비중이 높다(8/18, 44.4%). MRI에 비하여 CT 검사의 민감도가 낮은 점을 고려하여야 한다. 셋째, 발작 사이의 기간에 뇌파검사가 시행된 경우가 많고(15/18, 83.3%), 발작 초점을 가늠하기 위한 기능적 뇌영상검사가 시행되지 않았다. 발작 사이의 뇌파와 발작양상, 영상 소견만으로는 정확한 발작 초점을 추정하기 어려운 점을 고려하여야 한다. 3번 환자의 경우, 뇌파에서 전반주기방전(generalized periodic discharges)이 확인되었으나, 전반주기방전의 경우 주파수가 낮을 수록 발작과의 연관성이 적다는 보고도 있다[27]. 넷째, 상대적으로 다수의 증례를 분석하였으나, 여전히 대상의 수가 적으므로, 결과에 대하여 확고한 의미를 부여하기 힘들다. 추후 더 대규모의 증례 분석, 또는 전향적인 증례 수집을 통하여 상기 사항을 보완하여야 할 것으로 생각한다.
본 연구결과의 의미는 다음과 같다. 기존의 만성 뇌병변이 있는 환자와 없는 환자의 임상양상을 비교하였으며, 뇌병변이 있을 경우 뇌병변과 관련된 먼증상발작을 경험할 확률이 높다는 점과 GTCS가 발생할 위험성이 높다는 점을 제시한 것이다. 또한, 발작을 유발한 고혈당의 원인을 조사하였다는 점에서 의미가 있으며, 비케톤성 고혈당에 의한 먼증상발작일 경우 예후는 양호하다는 점을 확인하였다는 점이다. 보강 연구가 이루어 진다면, 실제 임상 진료에 유용한 근거가 될 수 있을 것으로 사료된다.