문맥전신션트가 동반된 비경화성 고암모니아뇌병증
Non-cirrhotic Hyperammonemic Encephalopathy with Portosystemic Shunt
Article information
Trans Abstract
Hyperammonemic encephalopathy commonly occur in patients with liver disease, but it can also occur due to other causes. A portosystemic shunt without liver cirrhosis is one of the causes of non-cirrhotic hyperammonemic encephalopathy. Herein, we present a case of a 78-year-old male patient with hyperammonemic encephalopathy resulting from portosystemic shunts without liver cirrhosis, which was successfully treated with endovascular shunt closure.
고암모니아뇌병증은 암모니아가 과도하게 생성되거나 충분히 제거되지 않아 혈중 암모니아 농도가 상승하여 발생한다[1]. 암모니아의 신경 독성으로 인하여 가벼운 인지기능장애부터 혼미, 혼수, 심각한 뇌부종 발생으로 인한 뇌탈출까지 발생할 수 있다.[2]. 주로 간경화증과 같은 간질환으로 암모니아가 간에서 분해되지 못하고 전신 순환이 될 때 발생하는 것으로 알려져 있으나 간질환 이외에도 다양한 원인에 의해 고암모니아뇌병증이 발생할 수 있다[1]. 이번 증례에서는 고암모니아뇌병증 환자에게서 발견된 문맥전신션트를 혈관 내 시술을 통해 폐색한 후 환자의 뇌병증이 호전된 사례를 보고한다.
증 례
과거 당뇨, 심방세동, 치매의 과거력이 있는 78세 남자 환자가 약 3주 전부터 발생한 의식 저하로 응급실에 내원하였다. 3년 전부터 인지기능 저하가 시작되어 1년 전부터 치매로 진단받고 주간 보호센터에 다니고 있었다. 20일 전부터 자려고만 하고 물어도 대답이 없는 상태로 의식이 떨어져 있다가 다시 회복되는 일이 반복되었다. 응급실 방문 전 전신을 떠는 듯한 증상이 있어 내원하였다. 환자는 월 2회 소주 반 병 정도를 마셨다고 하며 흡연은 하지 않았다. 특이한 가족력은 없었다. 기저질환으로 메트포르민(metformin), 제미글립틴(gemigliptin), 아픽사반(apixaban), 도네페질(donepezil), 둘록세틴(duloxetine), 쿠에티아핀(quetiapnine)을 복용하고 있었다. 내원 시 혈압은 수축기 123 mmHg, 이완기 61 mmHg 였으며 심박수는 91회/분, 호흡수는 20회/분, 체온은 36.1℃ 였다. 신경계진찰 시 혼미한 의식 수준이었으며 동공 크기와 빛반사는 양쪽 모두 정상이었다. 순회눈운동(roving eye movement)이 보이고 있었으며 각막반사도 양쪽 모두 정상이었다. 통증 자극 시 양쪽 상하지 모두 Medical Research Council 척도 1 정도의 반응을 보였다. 건반사는 대칭적이였고 양쪽 상하지 모두 정상 범위었다. 바뱅스키징후 등의 병적 반사는 보이지 않았다. 혈액 검사에서는 백혈구 4,900/μL, 혈색소 13.1 g/dL, 혈소판 143,000/μL, 아스파트산아미노기전달효소/알라닌아미노기전달효소 80/44 IU/L, 총 빌리루빈 0.9 mg/dL, 감마글루타밀전이효소 17 IU/L, 프로트롬빈 국제 표준화 비율 1.23, 암모니아 274 μg/dL (정상 범위, 12-66), 총 단백질 5.7 g/dL, 알부민 3.1 g/dL, 혈액요소질소(blood urea nitrogen) 15.2 mg/dL, 크레아티닌 0.56 mg/dL, 크레아틴인산화효소(creatine phosphokinase) 1,754 U/L였다. B형간염바이러스 표면 항원과 C형간염바이러스항체는 음성이었다. 소변 검사에서 백혈구 증가는 없었고 아질산염도 검출되지 않았다. 뇌 magnetic resonance imaging (MRI)에서 환자의 의식 저하를 설명할 만한 이상은 보이지 않았다. 뇌파에서도 전반적으로 배경파가 느려져 있었으나 뇌전증모양방전은 관찰되지 않았다. 뇌척수액 검사에서는 압력이 12 cmCSF, 백혈구 0/mm3, 적혈구 0/mm3, 단백질 51 mg/dL, 당 93 mg/dL, 혈당 138 mg/dL로 정상 범위였다. 이를 통해 환자의 증상을 고암모니아혈증으로 발생한 뇌병증으로 판단하였다. 암모니아를 낮추기 위해 락툴로스 관장을 8시간마다 시행하였고, 리팍시민 400 mg 3회, L-아르지닌 30 g, L-오니틴-L-아스파르트산을 6 g 2회를 매일 투여하였다. 고암모니아혈증의 원인을 감별하기 위해 시행한 복부 computed tomography (CT)와 간 초음파에서 간 병변은 보이지 않았으나 비장정맥-신장정맥션트, 상장간막정맥-하대정맥션트 2개의 문맥전신션트가 확인되었다(Fig. 1). 암모니아를 낮추기 위해 관장과 약물을 투여하였으나 암모니아는 조절되지 않았다. 환자의 뇌병증이 고암모니아혈증 때문임을 확실히 하기 위해 신대체 요법을 통해 암모니아를 낮추어 보았고, 신대체 요법 시행 7일째 암모니아 수치가 58 μg/dL까지 감소하면서 환자 의식도 기면 상태로 회복되었다. 이에 고암모니아의 원인으로 판단한 2개의 문맥전신션트를 Amplatzer II vascular plug (St. Jude Medical, Inc., St. Paul, Minnesota, MO, USA), 분리형 코일(Boston Scientific/Target, Fremont, CA, USA), 젤라틴 스펀지(Cutanplast; mascia-brunelli SPA, Milano, Italy)를 이용 한 혈관 내 치료를 통해 폐쇄하였고(Fig. 2) 이후 암모니아 수치는 100 μg/dL 미만으로 유지되었다. 환자는 의식의 변동은 남아 있으나 경미한 기면 상태로 유지되었고 재활의학과로 전과되었다. 2주 뒤 시행한 복부 CT에서 간문맥혈전증이나 문맥고혈압을 시사하는 복수나 결장 부종 등의 소견은 보이지 않았다. 2개월 뒤 경미한 기면 상태로 재활의학과에서 퇴원하였다.
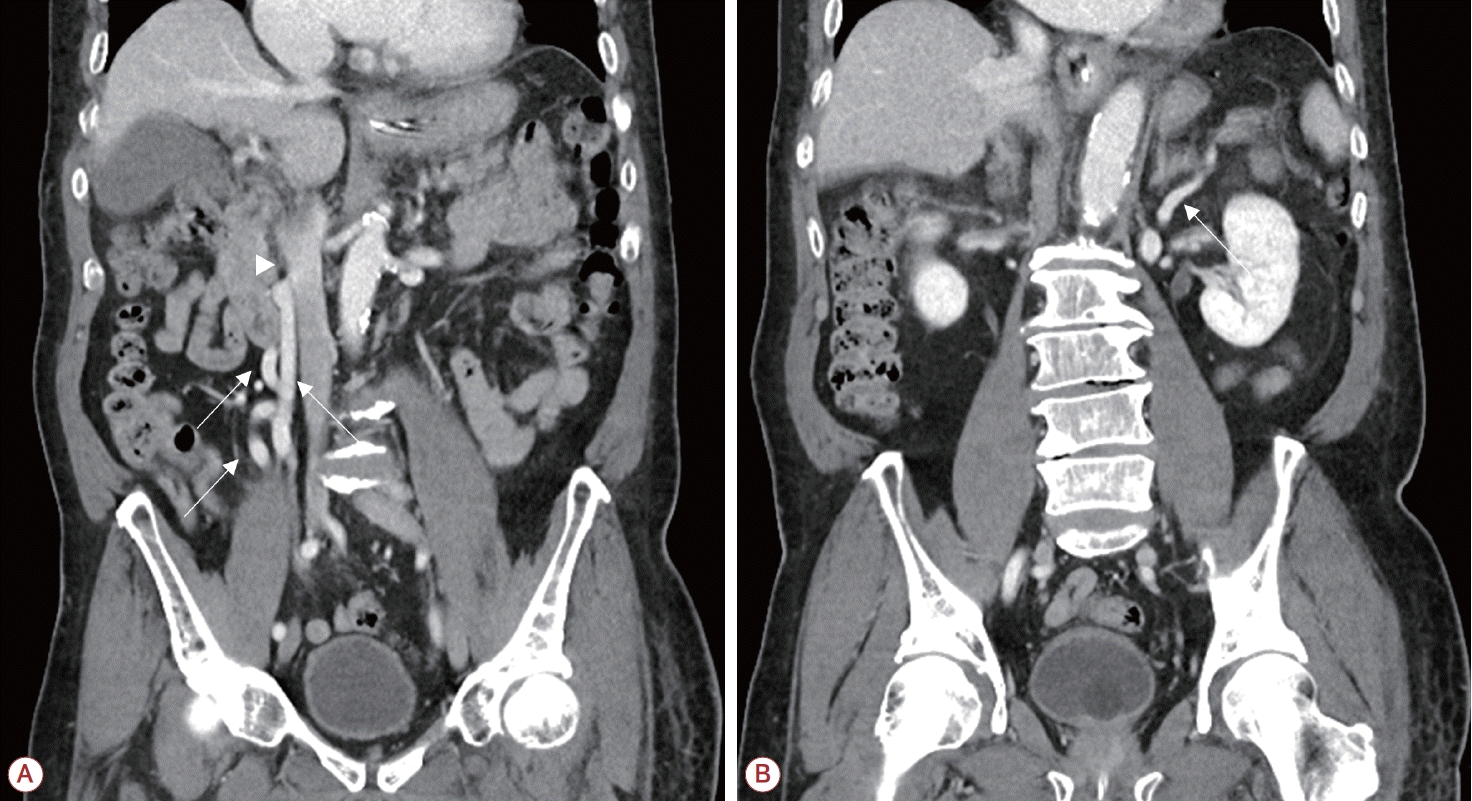
(A) Abdominal CT shows portosystemic shunt (arrows) between SMV and IVC (arrowhead). (B) Abdominal CT shows portosystemic shunt (arrow) between splenic vein and renal vein. Surface and parenchymal nodularity of liver and ascites that suggest liver cirrhosis are not present. CT; computed tomography, SMV; superior mesenteric vein, IVC; inferior vena cava.
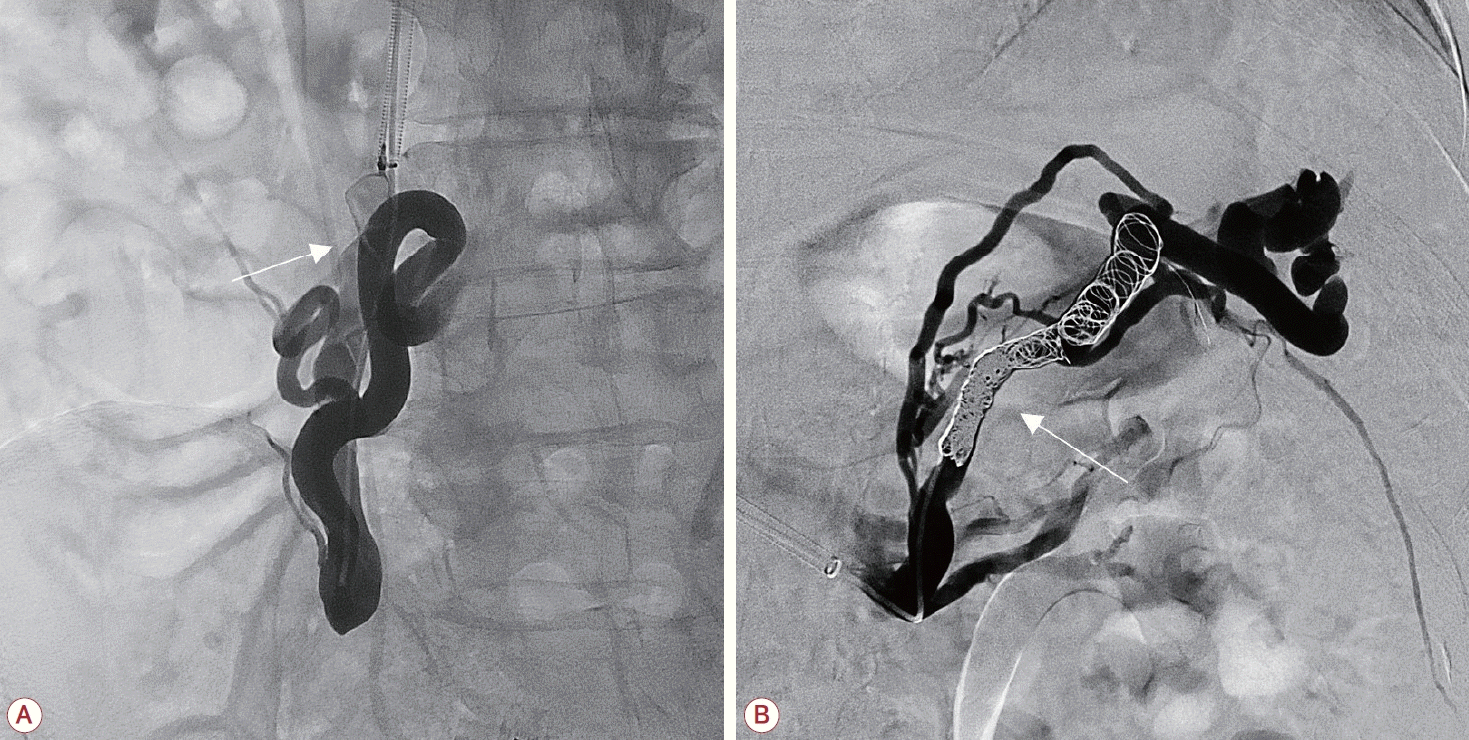
(A) Venography, performed after shunt outflow was occluded by Amplatzer vascular plug (arrow), shows portosystemic shunt between SMV and IVC and ectopic varices. (B) Venography performed after occlusion of shunt outflow with detachable coils (arrow) shows splenorenal shunt and ectopic varices. Residual varices were embolized with gelatin sponge. SMV; superior mesenteric vein, IVC; inferior vena cava.
고 찰
위장관에서 생성된 암모니아는 문맥 순환으로 들어와서 간으로 이동하고 간세포의 요소회로를 통해 요소로 만들어져 대변이나 소변으로 배출된다[2]. 주로 간경화와 같은 간질환에서 암모니아의 제거에 이상이 생기면서 고암모니아혈증이 발생한다고 알려져 있지만 그 외에도 다양한 원인에 의해 암모니아가 제거되지 못하거나 암모니아의 생성이 증가하면 고암모니아혈증이 나타날 수 있다[1]. 암모니아가 제거되지 못하는 상황으로는 자발 문맥전신션트, 요소회로장애 등의 선천대사장애, 발프로산 등의 약물 복용 등이 있다. 암모니아의 생성이 증가되는 경우로는 경련발작, 외상 등으로 인한 근육 이화의 증가, 경정맥영양, 요로감염, 항암제 투여 등이 있다[3].
문맥전신션트가 있는 경우 위장관에서 문맥 순환으로 흡수 된 암모니아가 간에서 대사되지 못하고 전신 순환으로 흘러들어 가면서 고암모니아혈증을 발생시킨다[4]. 이번 증례의 환자에게서 문맥전신션트가 발생한 원인은 불분명하다. 혈액 검사에서 경미한 아스파트산아미노기전달효소의 증가, 혈소판의 감소가 있었지만 간경화를 의심할 정도의 이상은 없었으며, 간초음파나 복부 CT에서도 간질환이나 문맥고혈압을 유발할 만한 이상 소견은 보이지 않았다. 다만 간경화 진단의 최적 표준인 간 생검은 시행하지 않았다. 선천 문맥전신션트가 있는 경우도 있을 수 있다. 선천 문맥전신션트가 점차 커지거나, 감염, 고단백 식이, 약물 등의 원인으로 암모니아가 증가하는 상황에서 고암모니아뇌병증이 발생한 증례 보고도 있다[5]. 하지만 환자 이전 시행된 영상이 없어 환자가 선천 문맥전신션트를 가지고 있었는지 여부는 확인하기 어려웠다.
혈중 암모니아를 낮추기 위해 다양한 여러 약제와 방법이 사용된다. 락툴로스는 흡수되지 않는 이당류로 대장에서 세균에 의해 대사되어 장내를 산성화시킨다. 산성 환경에서 요소 분해효소를 생성하는 장내 세균은 억제되어 요소의 암모니아로 전환이 감소된다. 또한 생성된 산은 삼투압을 증가시켜 설사를 유발하여 암모니아를 배출시킨다[6]. 리팍시민은 흡수되지 않는 항생제로 장내 세균의 리보핵산 합성을 억제하여 암모니아 형성을 억제한다[7]. L-아르지닌과 L-오니틴-L-아스파르트산은 요소회로를 활성화시켜 암모니아의 제거에 도움을 주는 것으로 알려져 있다[6]. 신대체 요법도 혈중 암모니아를 낮출 수 있다. 암모니아는 분자량이 17 g/mol로 크지 않고 알부민 등 단백질에 결합하는 정도가 낮아 투석을 통해 제거할 수 있다. 아직까지 신대체 요법의 시작 시점에 대한 근거는 부족하지만, 정상 상한치의 3배 이상 증가했을 때 고려해 보아야 한다는 주장이 있다[8].
비경화성 문맥전신션트로 발생한 고암모니아뇌병증의 치료로 비정상적 션트의 폐쇄가 도움이 되는지에 대해서는 현재로서는 근거가 부족하다. 하지만 내과 치료에도 불구하고 회복되지 않는 고암모니아뇌병증 환자에게서 수술 또는 혈관 내 치료로 문맥전신션트를 폐쇄하고 난 후 뇌병증이 호전되었다고 보고한 여러 증례들이 있다[4,9,10].
본 증례에서는 문맥전신션트로 발생한 비경화성 고암모니아뇌 병증 환자를 혈관 내 치료를 통해 비정상 션트를 폐쇄하여 치료한 환자를 경험하여 보고하였다. 고암모니아뇌병증은 간경변 환자에게서 주로 나타나지만, 간경변이 없는 경우 다른 원인의 감별이 필요하다. 고암모니아뇌병증의 원인 중 하나인 문맥전신션트를 확인하기 위해서는 조영증강 복부 CT 시행이 필요하다. 문맥전신션트로 발생한 고암모니아뇌병증이 관장이나 약물 치료로 효과가 없는 경우 문맥전신션트의 폐쇄도 한 가지 치료 방법으로 고려해 보아야 한다.