쿠에티아핀 과다 복용 후 발생한 가역적 후뇌 병증
Posterior Reversible Encephalopathy after Quetiapine Overdose
Article information
Trans Abstract
Quetiapine is an atypical antipsychotic drug that can cause sinus tachycardia, hypotension, coma, etc. with overdose, and rarely convulsions, rhabdomyolysis and neuroleptic malignant syndrome. Posterior reversible encephalopathy syndrome usually occurs in association with hypertension, but can occur rarely in rhabdomyolysis accompanied by acute kidney injury and arginine vasopressin axis hyperstimulation. We report the experience of a patient hospitalized with a quetiapine overdose who developed drug-induced rhabdomyolysis and reversible encephalopathy without hypertension after acute renal injury.
쿠에티아핀(quetiapine)은 비정형 항정신병제로 조현병, 섬망 등 다양한 적응증에 널리 사용되고 있다. 쿠에티아핀 과다 복용으로 동빈맥, 저혈압, 혼수 등이 발생할 수 있고 드물게는 경련, 횡문근융해증(rhabdomyolysis), 신경이완제악성증후군(neuroleptic malignant syndrome)이 발생할 수 있다[1,2]. 가역적 후뇌 병증(posterior reversible encephalopathy syndrome, PRES)은 급성 신손상(acute kidney injury, AKI)을 동반한 횡문근융해증에서 드물게 발생할 수 있으며, 한국에서는 PRES로 AKI를 동반한 운동 유발 횡문근융해증이 합병증으로 발생한 사례가 일부 보고되었다[2]. 저자들은 쿠에티아핀 과다 복용으로 입원하여 약물 유발 횡문근융해증과 AKI 이후 PRES가 발병한 환자를 경험하여 이를 보고하고자 한다.
증 례
38세 여자 환자가 의식 저하로 응급실을 방문하였다. 환자는 환각과 피해망상 증상이 있어 3년 전 조현병(schizophrenia)을 진단받아 매일 쿠에티아핀 400 mg을 단독 복용 중이었다. 환자는 응급실 내원 전날 정상적으로 언니와 통화하였으나 내원 당일 연락이 안 돼서 119에 신고하였다. 119 구조대가 환자의 집에 방문하였을 때 비어 있는 쿠에티아핀 약봉지가 있어서 14,400 mg을 한꺼번에 복용하여 자살 시도를 한 것으로 추정되었다.
응급실 검사에서 확인된 생체징후는 혈압 107/86 mmHg, 맥박수 114회/분, 호흡수 19회/분, 체온 37.4℃였고, 심전도(electrocardiogram)에서는 동빈맥(sinus tachycardia)이 확인되었다. 의식은 혼미(stupor)하였고 글래스고 혼수 척도(Glasgow coma scale)는 E2M4V5이었다. 신경계진찰에서 빛반사, 각막반사는 정상이었고 근경직, 떨림 등 다른 국소 신경계이상은 보이지 않았다.
동맥혈기체 분석에서 pH는 7.41, 이산화탄소 분압은 34 mmHg, 산소 분압은 186 mmHg, 중탄산염은 21.6 mmol/L로 특이 사항은 보이지 않았다. 소변독성 검사(urine toxicologic screening tests)에서 벤조디아제핀(benzodiazepine), 바르비투르산염(barbiturate) 등 총 9가지 약물에 대해 분석한 결과 모두 음성으로 확인되었다. 전체 혈구 검사와 전해질 검사는 정상이었으나 생화학 검사에서 크레아틴 인산화효소(creatine phosphokinase)는 >15,000 U/L, 젖산탈수소효소(lactate dehydrogenase)는 945 U/L, 아스파테이트트랜스아미나아제(aspartate transaminase)는 193 U/L, 알라닌전이효소는 65 U/L, 혈액요소질소(blood urea nitrogen)는 19.3 mg/dL, 크레아티닌(creatinine)은 1.53 mg/dL, 아밀라아제(amylase)는 2,279 U/L로 횡문근융해증에 합당한 소견을 보여 수액 투여와 소변 알칼리화를 시행하면서 위세척을 하는 중 한 차례 1분 동안 전신강직간대발작(generalized tonic clonic seizure, GTCS)을 보였다. 당시 생체징후는 혈압 129/100 mmHg, 맥박수 109회/분, 호흡수 15회/분, 체온 36.9℃였으며 미다졸람 3 mg 정주 후 기면 상태로 중환자실에 입원하였다. 뇌 자기공명영상은 촬영하지 않았으며 뇌 컴퓨터단층촬영에서 특이 소견은 보이지 않았다(Fig. 1). 응급실 내원 1일 후 시행한 뇌파 검사에서는 배경 리듬이 느려진(background slow) 소견 외에는 이상 소견이 관찰되지 않았다. 의식 수준은 초조(agitation) 없이 기면(drowsy) 상태에서 내원 3일째 의식 수준이 명료(alert)로 호전되었다. 혈청 크레아틴인산화효소는 3일째까지 >15,000 U/L로 측정되었으나 4일째 13,266 U/L, 6일째 6,551 U/L로 지속적으로 감소하였고 크레아티닌은 내원 당일 1.53 mg/dL에서 내원 6일째 4.21 mg/dL로 상승하여 AKI를 보였지만 소변량은 유지되어 기존 보존 치료를 유지하였다. 내원 기간 동안 생체징후는 혈압 160/105 mmHg 이하로 확인되었으며 그 외 특별한 문제는 없었다.

Initial brain computed tomography (CT). Brain CT performed after convulsions at the time of admission to the emergency room showed no definite abnormal findings including edematous change.
내원 7일째 환자 의식 소실과 함께 30초 동안 GTCS를 보였으며 이후 의식은 명료하였으나 간단한 지시사항에 따르지 못하며 질문에 부적절한 대답을 하는 등 지남력장애가 확인되었다. 생체징후는 혈압 150/95 mmHg, 맥박수 108회/분, 호흡수 20회/분, 체온 37.6℃였으며 시행한 뇌 자기공명영상의 확산강조영상(diffusion-weighted image) 및 액체감쇠역전회복영상(fluid-attenuated inversion recovery imaging)에서 다발성의 양측 전두엽과 두정-후두엽에서 고신호 강도의 병변이 관찰되었으며 겉보기확산계수 지도(apparent diffusion coefficient map)에서도 고신호강도로 나타나 혈관성부종(vasogenic edema)을 시사하였고 PRES를 의심하였다(Fig. 2-A).
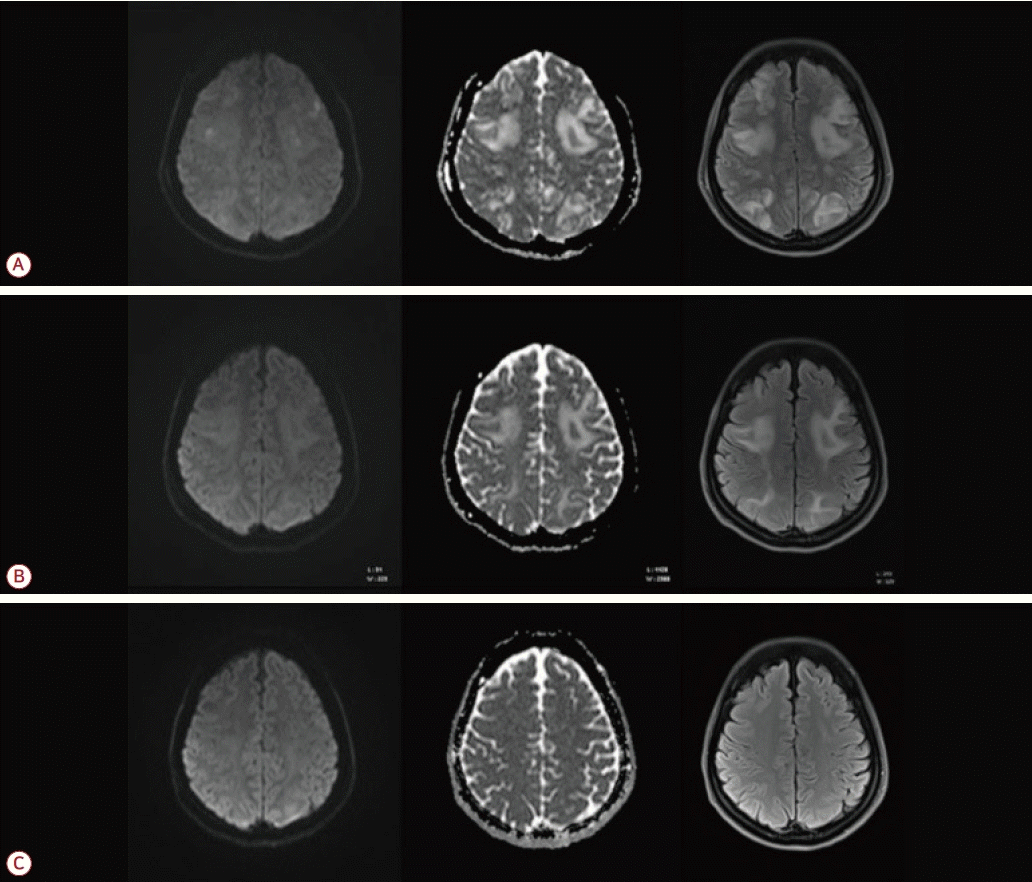
(A) Initial diffusion-weighted images, apparent diffusion coefficient and fluid attenuated inversion recovery showing hyperdensities in the both cerebral hemispheres, especially parieto-occipital areas. (B) Six days later after second seizure, follow-up magnetic resonance imaging (MRI) brain shows partially resolution. (C) follow-up MRI (after 2 months) is normal.
환자 경련에 대해 발프로산(valproate) 900 mg/day를 투여하였고 혈압 140/90 mmHg를 목표로 혈압 조절을 위해 항고혈압제(nicardipine hydrochloride)를 정맥 투여하였으며 벤조디아제핀(benzodiazepine) 등 다른 약제는 처방되지 않았다. 입원 8일째부터 혈압은 정상화되었으나 환자는 혼동 상태를 지속적으로 보이고 있었고 입원 10일째부터는 점차 지남력이 회복되어 11일째에 객관적인 신경계증상은 모두 회복되었다.
입원 후 14일째에 시행한 뇌 자기공명영상에서 이전 영상에서 확인된 고음영 병변의 범위는 감소되었고(Fig. 2-B) 신경계 증상의 재발도 없었으며 크레아티닌은 1.70 mg/dL로 감소되어 AKI도 호전된 것으로 판단하여 퇴원하였다. 이후로도 지속적으로 신경계증상은 없었으며 퇴원 두 달 후 시행한 추적 검사에서 입원 당시 확인된 고음영 병변은 사라졌고(Fig. 2-C) 따라서 항경련제도 중단하였다.
고 찰
쿠에티아핀은 비정형 항정신병제로 다른 항정신병제에 비해 추체외로 증상 발생률이 낮으며 항콜린 활성이 없어 조현병, 섬망 등 다양한 적응증에 널리 사용되고 있다[3]. 쿠에티아핀 과다 복용 환자는 중추 신경계 억제, 동빈맥, QTc 간격 연장, 저혈압, 혼수 및 드물게 발작을 나타낼 수 있다. 쿠에티아핀 과다 복용 환자 945명 중 22명에서 경련이 발생한 것으로 확인되었으며, 발작은 쿠에티아핀 과다 복용 후 4-8시간에 발생하는 것으로 보고되었다[4]. 본 증례의 응급실 도착 당시 환자는 의식 소실 상태로 발견되어 응급실 대기 중 GTCS가 한 차례 있어 뇌전증지속상태(status epilepticus)로 인한 횡문근융해증의 가능성을 고려하였으나 응급실에서 발생한 발작의 경우 지속 시간이 1분으로 5분 이상 지속된 발작이 아니었으며 항뇌전증제를 투여하지 않은 상태로 PRES를 의심하기 전까지 환자가 의식 회복 없이 반복되는 2회 이상 발작을 보이지 않아 뇌전증지속상태 가능성은 낮을 것으로 보았으며, 쿠에티아핀 과다 복용으로 인한 횡문근융해증으로 생각된다.
쿠에티아핀을 포함한 항정신병제의 과다 복용은 횡문근융해증, 신경이완제악성증후군(neuroleptic malignant syndrome)과 같은 일부 심각한 부작용과 관련이 있다. 횡문근융해증이 발생한 673명의 환자 중 71명(10.5%)이 쿠에티아핀 및 클로자핀(clozapine) 등의 항정신병제를 복용 중이었으며 이를 토대로 항정신병제로 인한 횡문근융해증의 발생 가능성에 대해 보고하였다[1]. 횡문근융해증은 근육 괴사와 세포 내 근육 성분이 혈류로 방출되는 것을 특징으로 하는 질환으로 이러한 변화의 대부분은 급성 신기능 저하 및 신부전을 유발할 수 있고, 상태가 심각한 경우 투석까지 필요할 수 있다. 대표적인 원인으로 약물 남용, 외상, 경련 등이 있으며 현재까지 쿠에티아핀 관련 횡문근융해증에 대한 명확한 설명은 없으나 과다 복용 시 발생하는 횡문근융해증은 직접적인 약물 독성 또는 약물 독성으로 유발된 경련에 의해 나타날 수 있으며 장시간 진정 작용에 의한 근육압박에 의해 발생할 수 있다[2]. 신경이완제 악성증후군은 도파민수용체길항제 사용 또는 도파민 약물의 급속한 중단으로 인해 발생하는 질환으로 4가지 기본 징후로 초조(agitation) 등 의식 변화, 근경직, 38℃ 이상의 고열, 빈맥, 빈호흡 등 자율신경 이상을 일으키며 크레아틴인산화효소 상승을 보인다[5]. 1세대 항정신병제가 주로 신경이완제악성증후군을 유발하는 것으로 알려졌으나 2세대 비정형 항정신병제인 쿠에티아핀 복용으로 유발된 사례가 19건 보고되었다. 이들 환자의 100%에서 빈맥, 빈호흡, 발한 및 떨림을 보였으며 92.3%에서 고열 및 강직, 90%에서 자율신경이상증, 85.7%에서 의식 변화를 보였다. 쿠에티아핀을 포함한 2세대 항정신병제에 의해 발생한 신경이완제악성증후군의 경우 고열이나 근경직이 나타나지 않는 경우도 있는데, 4가지 기본 징후 중 3가지를 보이면 비정형 신경이완제악성증후군으로 간주한다. 쿠에티아핀 과다 복용으로 근경직, 크레아틴인산화효소 상승, 의식 변화와 자율신경 이상을 보였으나 고열은 없었던 사례도 보고되었다[5]. 본 증례에서는 응급실 내원 시 4가지 기본 징후 중 의식 변화, 크레아틴인산화효소 상승만 관찰되었으며 뇌 컴퓨터단층촬영에서 이상 소견을 보이지 않아 비정형 신경이완제 악성증후군을 배제할 수 없었으나 이후 GTCS를 보여 시행한 뇌 자기공명영상에서 다발혈관성부종 소견을 통해 PRES가 진단되어 신경이완제악성증후군 가능성은 낮을 것으로 보았다.
PRES는 일반적으로 두통, 시각장애, 경련 및 의식장애 등으로 임상 증상이 나타난다. 병태 생리 기전은 아직 완전히 밝혀지지 않았으나 가장 일반적으로 받아들여지는 가설은 조절되지 않는 고혈압으로 인한 대뇌 혈류의 자동 조절 상실이며, 이외에도 패혈증, 자간증이나 자가면역 질환 등에 의한 혈관 내피 기능장애 그리고 아르기닌 바소프레신(arginine vasopressin) 축 과다 자극 등의 가설이 제시되고 있다[6]. 동맥성 고혈압은 대부분의 PRES 사례에서 동반되어 있고 신기능 장애는 PRES 사례의 약 절반에서 관찰되고 있어, 손상된 신장 기능 자체가 PRES의 주요 유발 요인인지 또는 PRES와 무관한 동맥성 고혈압에 의한 이차적 변화인지는 확실하지 않다. 다만 PRES 환자의 최대 수축기혈압은 일반적으로 170-190 mmHg이지만, 10-30%에서는 혈압이 정상이거나 약간만 상승하여 동맥성 고혈압 외의 다른 요인도 관여할 것으로 생각된다[7]. 심한 고혈압이 동반되지 않은 급성 신기능 저하와 관련된 PRES에 대한 증례 4건이 문헌으로 보고되었는데 각각 급성 A형간염, 운동으로 유발된 급성 신기능 저하, 저혈량성 급성 신기능 저하, 반코마이신 치료 후 급성 신기능 저하 환자에서 보고되었고, 해당 논문에서는 고혈압이 없는 AKI 환자에서 발생한 PRES의 원인으로 내피 기능장애를 제시하였다[8]. 아르기닌 바소프레신 축 과다 자극 가설은 쿠에티아핀, 둘록세틴 등 항정신병제가 아르기닌 바소프레신 축 과다 자극을 통해 별아교세포 이온채널 기능장애와 뇌부종을 일으켜 PRES를 발생시킬 수 있다고 보는 가설이다[9]. 본 증례 환자의 경우 쿠에티아핀 과다 복용에 의한 횡문근융해증과 그로 인한 급성 신기능 저하가 발생하였으며 입원 당시 혈압은 수축기혈압 130-160 mmHg로 유지된 점으로 볼 때 횡문근융해증 및 급성 신기능 저하로 인한 내피 기능장애 혹은 쿠에티아핀 약물에 의한 아르기닌 바소프레신 축 과다 자극으로 인하여 PRES가 발생한 것으로 추정할 수 있다.
본 증례는 쿠에티아핀 과다 복용 환자에서 AKI를 동반한 횡문근융해증을 동반한 경우, 고혈압이 없이 의식 소실 및 경련 등의 신경계증상이 발생하더라도 약제에 의한 기본적인 중추신경계 억제 작용 이외에도 PRES를 감별 진단으로 고려해야 함을 시사한다.