세프트리악손과 세팔렉신 투약 후 연속적으로 발생한 가역뇌병증
Ceftriaxone- and Cephalexin-Induced Acute Reversible Encephalopathy
Article information
Trans Abstract
Cephalosporin is widely used in clinical practice due to its broad anti-bacterial activity. However, some serious side effects have been reported. Here, we report a 79-year-old male who repeatedly experienced toxic encephalopathy after consecutive administration of third and first generation cephalosporins. This case demonstrated that various type of cephalosporin may cause toxic encephalopathy and emphasized the importance of staying vigilance for the rare but potentially curable side effects of one of the most widely prescribed antibiotics.
세팔로스포린(cephalosporin)은 그람양성균과 음성균에 대한 광범위한 항균력으로 인해 임상에서 가장 널리 사용되는 항생제 중 하나이다. 특히 3세대 세팔로스포린, 세프트라이악손(ceftriaxone)은 광범위균에 작용하며 신기능장애가 있더라도, 용량 조절을 요하지 않아 만성 신부전 환자에게 유용하게 쓰일 수 있다[1]. 그러나 드물게 세팔로스포린, 특히 4세대 항생제인 세페핌(cefepime) 투여 후 독성 뇌병증과 같은 심각한 부작용이 보고되었으며[2], 국내에서도 뇌경색과 같은 증상을 보인 cefepime 뇌병증 환자가 보고된 바 있다[3]. 그러나 뇌병증은 다양한 유형의 세팔로스포린에서 발생할 수 있다[2]. 저자들은 3세대 세팔로스포린인 세프트리악손 그리고 1세대 세팔로스포린인 세팔렉신(cephalexin)을 투여 후 연속적으로 발생한 세팔로스포린뇌병증 환자를 경험하여 이를 보고하고자 한다.
증 례
1. 첫번째 이벤트(first event)
79세 남자가 호흡곤란을 주소로 병원에 내원하였다. 환자는 고혈압, 당뇨병, 만성신부전의 과거력이 있고 투석을 계획 중에 있었다. 내원하여 시행한 혈액검사에서 백혈구 9,290/mL (정상치: 4,000-10,000/mL), 나트륨 136 mmol/L (136-145 mmol/L), 혈액요소질소/크레아티닌 58.3 mg/dL (6-20 mg/dL) 5.26 mg/dL (0.7-1.2 mg/dL), 사구체여과율 10.6 mL/min/1.73 m2, 총빌리루빈 0.1 (0.2-1.3 mg/dL), C-반응단백 5.02 mg/L (0-0.5 mg/dL)로 측정되었다. 흉부 X-ray에서는 폐렴 소견을 보였고 이에 대해 24시간마다 정맥내(intravenous, IV) 세프트리악손 2 g과 아지트로마이신(azithromycin) 500 mg을 투약하였다. 입원 3일 후 폐렴은 호전되었으나, 환자는 기면상태로 의식저하를 보였고 시간 그리고 장소에 대한 지남력장애를 보였다. 신경계진찰에서 의식저하외 국소신경학적결손은 없었다. 혈액검사에서 혈액요소질소/크레아티닌 31.1 mg/dL/3.38 mg/dL, 사구체여과율 17.7 mL/min/1.73 m2로 입원 당시와 비교하여 의식저하를 일으킬 만한 신장기능 악화 소견은 없었고 비조영증강 뇌 (magnetic resonance imaging (MRI)에서도 이상은 없었다(Fig. 1-A). 비경련발작을 감별하기 위해 시행한 뇌파(electroencephalogram, EEG)에서 삼상파(triphasic waves)가 관찰되었지만 뇌전증모양방전은 없었다(Fig. 1-B). 그러나 비경련뇌전증지속상태를 배제할 수 없었기에 항뇌전증제, 라코사미드(lacosamide) 50 mg을 하루 두 번 그리고 페람파넬(perampanel) 4 mg을 하루 한 번 투여하였으나 EEG 및 증상의 호전은 없었다. 세프트리악손뇌병증을 의심하여 항생제를 중단하였고, 중단 후 48시간 만에 EEG (Fig. 1-C) 및 증상은 모두 정상으로 회복되었다.

Brain MRI and EEG during the first event. (A) Non contrast MRI didn’t show acute lesion. (B) EEG showed continuous generalized theta to delta slowing with triphasic waves (black arrows) at admission and (C) improvement after cessation of an antibiotic. DWI; diffusion weighted image, ADC; afferent diffusion coefficient image, MRI; magnetic resonance imaging, EEG; electroencephalogram.
2. 두번째 이벤트(second event)
퇴원 후 2주 뒤 환자는 실수로 넘어져서 눈썹 열상이 생겼고 봉합술과 함께 cephalexin 1 g을 하루 네 번 경구 복용하였다. 투약 후 24시간 뒤 환자는 우측 상지의 불수의운동과 의식저하로 입원하였다. 당일 시행한 혈액검사에서 혈액요소질소/크레아티닌 19.7/4.16 mg/dL과 사구체여과율이 13.9 mL/min/1.73 m2로 10일 전 시행한 혈액요소질소/크레아티닌 수치(13.6/4.18 mg/dL) 그리고 사구체여과율(13.8 mL/min/1.73 m2)과 비교하여 신장기능의 악화는 없었다. 신경계진찰에서 환자는 우측 상지에서 근간대경련이 있었고 기면상태의 의식저하를 보였다. 뇌 MRI에서 좌측 측두엽에 작은 대뇌피질경색이 보였으나,(Fig. 2-A) 환자 증상과는 연관성이 없었다. EEG에서 많은 양의 혼합서파활동(large amount of mixed slow activity)을 보였고(Fig. 2-B) 비경련발작의 가능성을 염두에 두어 IV 로라제팜(lorazepam) 2 mg을 투여하였으나 EEG 및 임상증상의 호전은 없었다. Cephalexin에 의한 뇌병증 의심 하에 항생제 중단 후 경과 관찰하였고 투약 중단 후 36시간만에 의식 및 불수의운동은 모두 호전되었고 EEG에서도 호전을 보였다(Fig. 2-C). 항생제 투약 후 발생한 가역뇌병증 가능성을 고려하여 외래에서 항뇌전증제를 감량하고 있으며 추후 재발은 없었다.
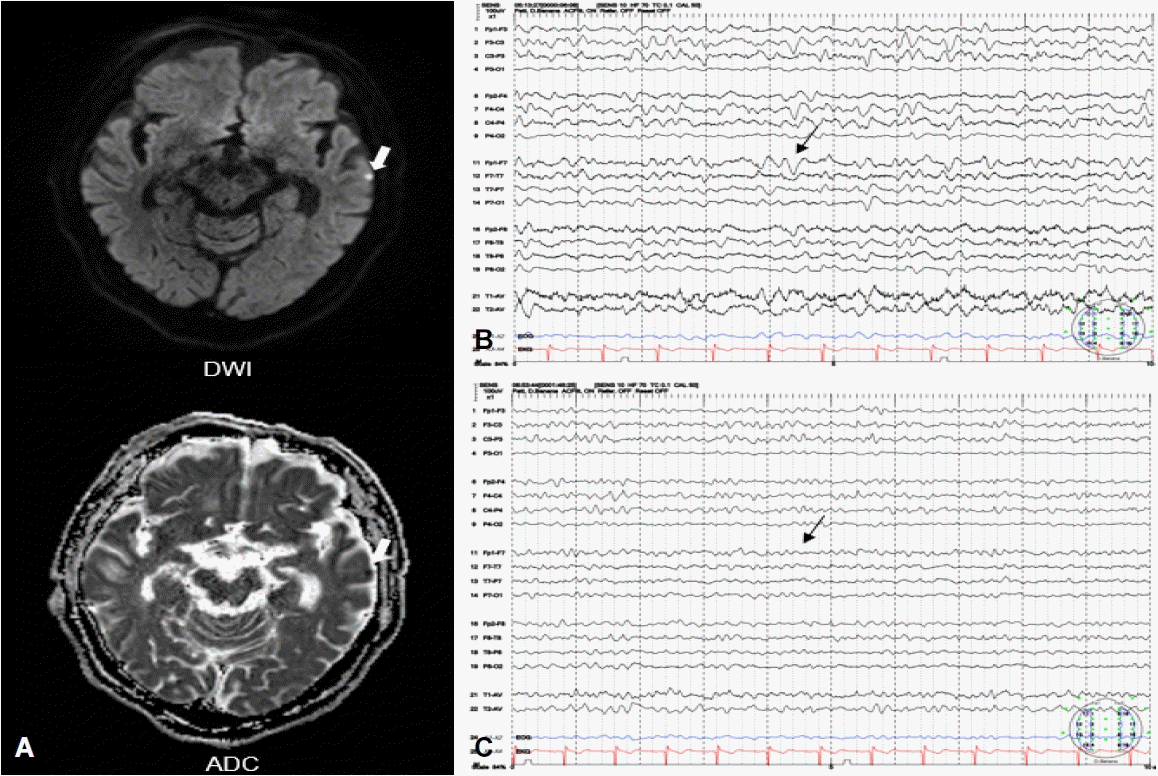
Brain MRI and EEG during the second event. (A) MRI showed acute diffusion restriction lesion (white arrow) in DWI and ADC images. (B) EEG showed large amount of diffuse theta to delta slowing (black arrow) at admission and (C) improvement (small amount of generalized theta activity) (black arrow) after cessation of an antibiotic. DWI; diffusion weighted image, ADC; afferent diffusion coefficient image, EEG; electroencephalogram, MRI; magnetic resonance imaging.
고 찰
본 저자들은 3세대 그리고 1세대 세팔로스포린투약 후 차례로 발생한 뇌병증을 보고하였다(Fig. 3). 다른 세대의 세팔로스포린 항생제를 투약 후 뇌병증이 재발했다는 점이 이 증례에서 주목해야 할 점이며, 특히 1세대 세팔로스포린을 경구 투약 후 뇌병증이 재발한 드문 사례로 보고 가치가 있다.
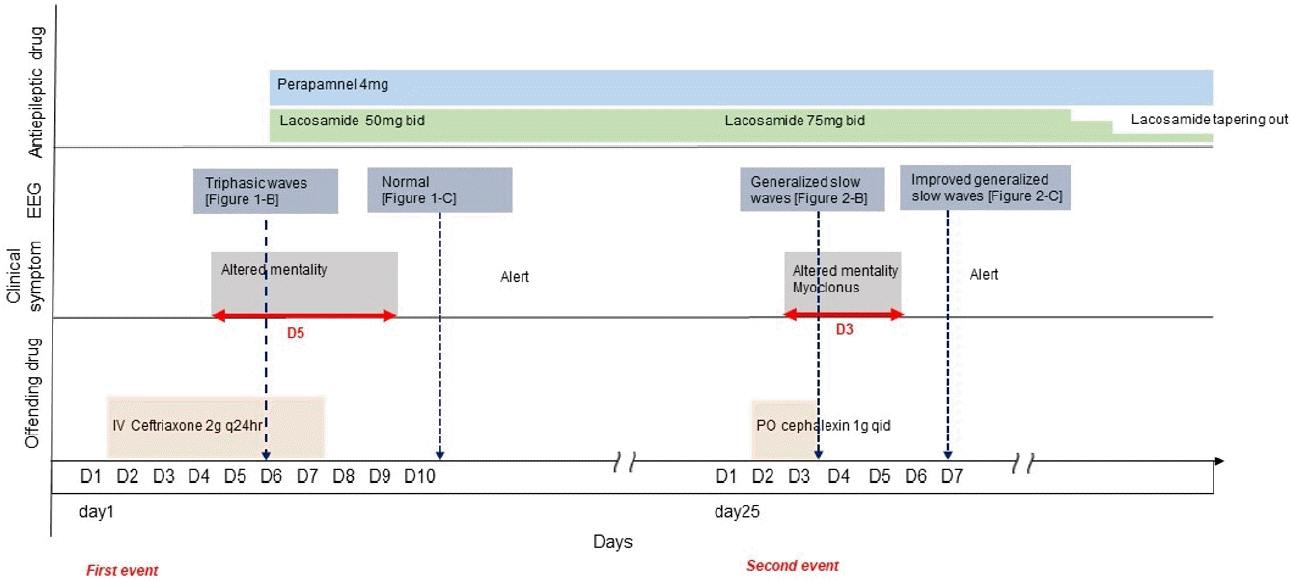
Clinical course of this case. Recurrent altered mental status appeared with consecutive administration of various generation of cephalosporin. After discontinuation of antibiotics, the clinical symptoms disappeared. EEG; electroencephalogram, IV; intravenous, PO; per os.
세팔로스포린 투여 후 신경독성에 의한 증상으로는 구음장애, 떨림, 뇌병증 그리고 발작 등이 있으며[2], 저알부민혈증 그리고 신장 기능저하 시에 자유약물의 농도가 높아지며 혈액뇌장벽 투과성이 증가하여 신경독성 위험은 높아지게 된다. [4]. 후향 연구에 따르면 4세대 세팔로스포린인 cefepime 투약한 100명의 환자군 중 15%에서 cefepime 연관뇌병증이 보고되었다.5 123명의 cefepime 연관 뇌병증을 분석한 한 연구에서는 약물 중단 후 평균 2일 뒤에 증상이 모두 호전되었고 응급투석을 시행한 경우 임상 개선시간을 하루 단축시켰다[6]. 한편 48명의 환자가 항뇌전증제를 처방받았고 26명의 환자에서 증상의 개선이 있었다.6 과거 4세대 그리고 3세대 세팔로스포린을 차례로 투약 후 뇌병증이 재발한 보고가 있었으나[7], 본 증례와 같이 1세대 세팔로스포린을 경구 투약 후 발생한 뇌병증의 보고는 매우 드물다[8,9].
세팔로스포린뇌병증의 발생 기전으로는 대뇌에서 증가된 세팔로스포린이 gamma-aminobutyric acid (GABA)-A 수용체 억제를 통한 신경독성[4], 사이토카인 방출로 인한 대뇌 손상[4] 그리고 내독소의 유도로 인한 대뇌 손상이 알려져 있다[2]. 흥미롭게도 본 증례의 환자는 두 차례의 이벤트에서 뇌병증이 발생할 때 걸리는 시간에 차이가 있었다. 환자는 세프트리악손은 투약 4일 이후 뇌병증이 발생했고 cephalexin의 경우 투약 1일 이후 뇌병증이 발생하였다. 증상 발생시간을 고려했을 때 세프트리악손의 경우 GABA-A 수용체 억제를 통한 신경독성 그리고 cephalexin의 경우 사이토카인 또는 내독소 유도를 통한 신경독성을 뇌병증의 발생 기전으로 생각해 볼 수 있다. 한편 세프트리악손의 경우 환자의 신기능을 고려했을 때 적정 용량이 투약되었으나 신장기능저하 환자의 경우 혈액뇌장벽의 투과성이 증가되어 신경독성이 일어날 수 있어[4], 뇌병증이 발생한 것으로 생각된다. cephalexin은 세프트리악손과 달리 뇌척수액의 농도가 낮아 뇌병증을 잘 일으키지 않는다[10]. 하지만 본 증례에서 cephalexin은 환자의 신기능을 고려했을 때 적정 용량보다 약 4배 이상 많게 투여되었으며 이 때문에 뇌병증이 발생한 것으로 생각된다.
저자들은 다음의 이유로 본 증례를 세팔로스포린에 의한 뇌병증이라고 판단하였다. 첫째, 환자의 혈액검사에서 요독뇌병증을 일으킬 정도의 신장기능의 악화는 없었다. 둘째, lorazepam 및 항뇌전증제 투여 후에도 뇌파 및 임상 증상의 호전이 없었다. 셋째, 뇌 MRI에서 발견된 병변으로 환자의 의식저하를 설명할 수 없었다. 넷째, 항생제 중단 후 모든 증상이 호전되었고 이후로 재발이 없었다.
그러나 환자의 신기능을 고려했을 때 요독뇌병증의 가능성을 배제할 수 없으며 이를 염두에 두어 환자는 항생제 중단과 함께 정기적으로 투석을 시행받고 있다.
항생제는 입원 및 외래 환자에게 자주 사용되는 의약품 중 하나이다. 항생제의 일반적인 부작용은 알려져 있지만 신경계에 대한 독성 효과는 잘 알려져 있지 않다. 특히 입원 환자의 의식 변화는 다양한 원인에서 기인한 경우가 많아 항생제의 신경독성을 의심하지 않을 경우 쉽게 간과될 수 있다. 저자들은 본 증례를 통해 세프트리악손을 포함한 다른 유형의 세팔로스포린 투약력이 있는 환자에서 의식 변화가 발생했을 시에 항생제와 관련된 뇌병증을 의심해야 함을 말해주며 세팔로스포린뇌병증이 드물지만 항생제 중단만으로 치료가 가능하다는 점에서 이를 항상 염두에 두어야 한다고 생각한다. 또한 항생제를 투여할 때는 반드시 신장기능을 고려하여 정확한 용량을 투여하는 것이 필요하다.