급성뇌경색과 동반된 고혈압뇌간뇌병증
Hypertensive Brainstem Encephalopathy Combined with Acute Ischemic Stroke
Article information
Trans Abstract
Posterior reversible encephalopathy syndrome is a clinicoradiological syndrome characterized by a unique reversible pattern on imaging and total regression of clinical symptoms and signs. Hypertensive brainstem encephalopathy (HBE), a brainstem variant of posterior reversible encephalopathy syndrome, is rare. In addition, a concomitant occurrence of acute ischemic stroke and HBE is even more rare. We here report three patients with HBE accompanied by acute cerebral infarction detected by brain magnetic resonance imaging and the importance of initial blood pressure control.
고혈압뇌병증은 급격한 혈압 상승과 함께 두통, 구역감, 구토, 시력장애, 경련 및 의식 변화 등의 증상이 나타나고 뇌 영상검사에서 주로 양측 두정엽과 후두엽에 혈관성부종(vasogenic edema) 병변이 관찰되는 질환이다. 초기에 혈압을 적절히 조절할 경우 신경계증상과 영상 소견이 빠르게 호전을 보여서 가역적후뇌병증(posterior reversible encephalopathy syndrome)으로도 알려져 있다[1,2]. 고혈압뇌병증이 뇌간을 침범하는 빈도가 낮고, 뇌간에만 국한 되어 나타나는 고립고혈압뇌간뇌병증(isolated hypertensive brainstem encephalopathy)은 드물다[3].
고혈압뇌간뇌병증이 급성뇌경색과 동반되어 나타나는 경우는 더욱 드물고[4], 고혈압뇌병증의 치료는 초기 혈압 조절이 중요한데 비해 급성뇌경색에는 혈압 강하를 시도하지 않거나 오히려 높게 유지하는 경우가 많기 때문에 치료적으로 상충되는 점이 있다[1,5]. 그렇지만 이에 대한 적절한 치료는 잘 알려져 있지 않다.
저자들은 급성뇌경색 환자에서 뇌간을 침범한 고혈압뇌병증을 동반한 증례를 경험하여 초기 혈압 조절에 대한 문제점과 함께 이를 보고하고자 한다.
증 례
1. 증례 1
58세 남자가 내원 30분 전에 발생한 우측 위약감과 구음장애로 응급실에 왔다. 과거 조현병과 고혈압을 진단받고 약물 복용 중이었으나 4개월 전부터 자의적으로 모든 약제를 중단하였고, 음주 및 흡연력이 있었다. 내원 당시 혈압은 220/100 mmHg였고, 심박수는 96회/분, 체온은 36.5℃였다. 신경계진찰에서 의식은 명료하였고 우측 중추안면마비가 관찰되었으며, 우측 상하지 근력 모두 Medical Research Council (MRC) 등급 4로 감소되어 있었다. 그 외 안구운동장애, 복시, 감각 및 소뇌기능장애는 관찰되지 않았다. 혈액검사상 전해질 수치는 정상이었으나 혈액요소질소 23 mg/dL, 크레아티닌 2.36 mg/dL, 사구체여과율 30.4 mL/min/1.73 m2로 신부전 소견이 있었고, 혈당은 237 mg/dL였으며, 심전도는 정상이었다. 뇌 computed tomography (CT)에서 출혈 병변은 관찰되지 않아 혈압을 180/100 mmHg 이하로 낮춘 후 조직플라스미노겐활성제(tissue plasminogen activator, tPA)를 정맥주사하였다.
뇌 자기공명영상(magnetic resonance imaging, MRI)의 확산강조영상(diffusion weighted image, DWI)에서 고신호강도병변, 현성확산계수지도(apparent diffusion coefficient [ADC] map)에서 저신호강도 병변은 관찰되지 않았다(Fig. 1-A, B). 액체감쇠역전회복영상(fluid attenuated inversion recovery images, FLAIR)에서 대뇌백질 고신호강도는 Fazeka 척도로 3점이었고, 양측 교뇌 전반에 광범위한 고신호강도의 병변이 관찰되었으며(Fig. 1-C), 대뇌 피질하백질에도 일부 병변이 관찰되었다. 경사에코영상(gradient echo image, GRE)에서는 우측 교뇌에 미세출혈 흔적이 관찰되었고(Fig. 1-D), 자기공명혈관조영(magnetic resonance angiography, MRA)에서 의미 있는 협착은 없었다. 뇌간의 고혈압뇌병증이 동반된 급성뇌경색으로 진단 후 니카르디핀(nicardipine)을 지속 정맥주사하여 수축기 혈압을 140 mmHg 이하로 조절하였으나, 일시적으로 180 mmHg로 상승한 경우가 있었고 신경계증상 변화는 없었다.

Brain MRI of the patient 1. Initial DWI and ADC showed no significant signal change (A, B). The initial FLAIR images showed diffuse hyperintense signals in bilateral pons (C) with right pontine microbleed in GRE image (D). His systolic blood pressure was stabilized to 140 mmHg after antihypertensive therapy. The next day after tPA administration, GRE image showed bilateral pontine hemorrhage (E). A follow-up FLAIR image obtained on hospital day 10 showed marked improvement of the pons lesion (F). MRI; magnetic resonance imaging, DWI; diffusion weighted image, ADC; apparent diffusion coefficient, FLAIR; fluid attenuated inversion recovery images, GRE; gradient echo image, tPA; tissue plasminogen activator.
입원 2일째 시행한 뇌의 DWI에서 뇌경색 소견은 관찰되지 않았으나, 뇌 CT와 GRE에서 양측 교뇌출혈이 발견되었다(Fig. 1-E). 입원 4일째 환자는 갑자기 혼미(stupor) 상태로 의식수준저하 및 호흡부전으로 인한 심정지 발생하여 심폐소생술을 시행하였다. 입원 10일째 시행한 뇌 MRI의 FLAIR에서 양측 교뇌의 출혈 및 혈관성부종이 호전된 것을 확인하였다(Fig. 1-F).
2. 증례 2
4세 여자가 내원 전날부터 가정 측정 혈압이 측정 불가능할 정도로 높고 불안해서 응급실에 왔다. 평소 고혈압이 있었으나 항고혈압제는 복용하지 않았고 내원 당시 혈압은 220/180 mmHg였으나 다른 활력징후는 정상이었다. 응급실 내원 6시간 후에 갑자기 좌측 위약감을 호소하여, 즉시 신경계진찰을 시행하였는데 의식은 명료하였고 좌측 중추안면마비와 좌측 상하지 근력 모두 MRC 등급 4로 감소되어 있었다.
뇌 CT에서 출혈 병변은 관찰되지 않아 혈압을 170/100 mmHg로 조절 후 tPA를 정맥주사하였다. 뇌 DWI에서 우측 대뇌부챗살과 기저핵의 고신호강도 병변이 관찰되었고(Fig. 2-A), ADC map에서 같은 부위 저신호강도 병변이 관찰되었다(Fig. 2-B). FLAIR에서 백질 고신호강도는 Fazeka 척도로 3점이었고, 교뇌, 소뇌에 걸친 광범위한 고신호강도의 병변이 관찰되었으며(Fig. 2-C) 동일 부위의 DWI에서는 고신호강도가 관찰되지 않았다(Fig. 2-A). GRE에서는 양측 교뇌, 시상, 기저핵에 다발성 미세출혈 병변이 관찰되었고(Fig. 2-D), MRA에서 우측 중대뇌동맥이 폐쇄되어 있었다(Fig. 2-E). 환자는 뇌간, 소뇌의 고혈압뇌병증이 동반된 급성뇌경색으로 진단되었으나, 수축기 혈압이 200 mmHg 이상으로 조절되지 않고, 출혈 위험성 때문에 tPA는 30분만에 주입 중단하였다.
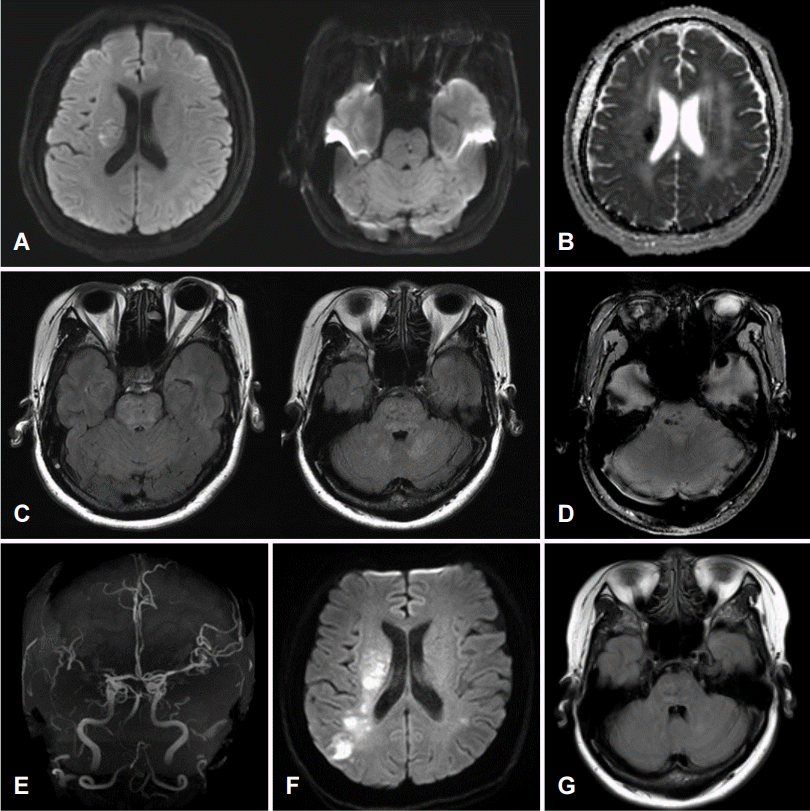
Brain MRI and MRA of the patient 2. Initial DWI showed significant high signal intensities in right corona radiata and basal ganglia (A). ADC showed significant low signal intensities in same region (B). On the FLAIR image, there were diffuse hyperintense lesions in bilateral pons and cerebellum (C). There were multiple microbleeds in bilateral basal ganglia, thalamus and pons (D). MRA revealed occlusion of right middle cerebral artery (E). The extent of the existing cerebral infarction increased in the DWI image performed after symptom worsening (F). Twelve days after admission, the brainstem lesion was markedly improved in the follow up FLAIR image (G). MRI; magnetic resonance imaging, MRA; magnetic resonance angiography, DWI; diffusion weighted image, ADC; apparent diffusion coefficient, FLAIR; fluid attenuated inversion recovery images.
입원 후 수축기 혈압 160 mmHg 이하로 조절하였으며, 입원 3일째 환자는 좌측 상하지 MRC 등급 3으로 악화되었고 DWI에서 기존 뇌경색 범위가 증가하였다(Fig. 2-F). 입원 12일째 시행한 뇌 FLAIR에서 양측 교뇌, 소뇌의 고신호강도 병변은 사라졌다(Fig. 2-G).
3. 증례 3
62세 남자가 내원 전날 발생한 복시와 오심을 주소로 응급실에 왔다. 최근 고혈압을 진단받고 약물 치료 중이었으나 혈압 조절이 잘 되지 않았다. 환자는 3주 전부터 양안이 흐릿하게 보이는 증상이 있어서 2주 전에 개인안과에 내원하여 좌안 망막출혈을 진단받고 수술하였고 당시 혈압이 매우 높았다고 하였다. 내원 당시 혈압은 180/100 mmHg로 높았으나 다른 활력징후는 정상이었다.
신경계진찰에서 좌안에서 우측으로 바라볼 때 복시를 호소하였으며, 내측주시 마비가 있었고 그 외 다른 이상 소견은 관찰되지 않았다. 안저검사에서 시신경 유두부종 및 망막출혈을 동반한 급성 고혈압망막병증 소견이 관찰되었다. DWI에서 좌측 후방 교뇌에 뇌경색 소견이 관찰되었다(Fig. 3-A, B). FLAIR에서 백질 고신호강도는 Fazeka 척도로 3점이었고, 양측 교뇌에 국한된 광범위한 고신호강도 병변이 관찰되었으며(Fig. 3-C), GRE에서는 양측 교뇌에 다발성 미세출혈 병변이 관찰되었다(Fig. 3-D).
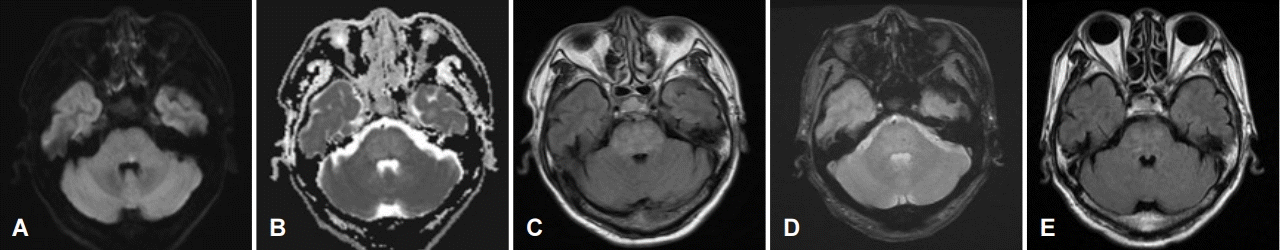
Brain MRI of the patient 3. Brain MRI showed left pontine infarction in DWI and ADC (A, B) accompanied by diffuse hyperintense lesions in bilateral pons and cerebellum on FLAIR image (C) and bilateral pontine multiple microbleeds on GRE image (D). One month later, follow-up brain MRI showed disappearance of hyperintense lesions in FLAIR image (E). MRI; magnetic resonance imaging, DWI; diffusion weighted image, ADC; apparent diffusion coefficient, FLAIR; fluid attenuated inversion recovery images, GRE; gradient echo image.
입원하여 혈압 조절 후 시력저하가 호전을 보여 퇴원하였다. 퇴원 한 달 뒤 외래에서 시행한 신경계진찰에서 복시는 모두 회복되었고, FLAIR에서 입원시 관찰되던 교뇌의 광범위한 고신호강도 병변은 모두 소실되어 있었다(Fig. 3-E).
고 찰
고혈압뇌병증의 발병기전은 명확하게 밝혀져 있지 않았으나 급격한 혈압 상승에 의해 혈압이 뇌혈관 자동 조절의 범위를 벗어나면 대뇌 소동맥의 과관류와 혈관내피손상에 의해 대뇌혈관에서 세포 외 공간으로 체액이 유출되어 혈관성부종이 생긴다고 설명한다[1,2].
본 증례처럼 갑작스런 국소신경계증상이 발생한 경우 뇌혈관질환을 가장 먼저 감별해야 하겠지만, 선행하는 두통, 시야장애 및 발작 등의 증상 또는 조절되지 않는 고혈압 과거력이 있거나 내원 시 극심한 혈압 상승이 있는 경우에는 고혈압뇌병증이 동반되었을 가능성도 함께 고려해야 하겠다. 고혈압뇌병증은 FLAIR에서 고신호강도 병변이 관찰되고 DWI에서는 해당 부위가 정상으로 보이는 혈관성부종이 관찰되는 경우에 진단할 수 있고, 뇌경색과 같은 세포독성부종과 쉽게 감별된다[1,2,6]. 그러나 고혈압뇌병증을 의심할 만한 증상이 동반되지 않거나 병력청취가 부족한 경우에 MRI를 통해서 뒤늦게 진단을 내리는 경우도 있을 수 있다. 따라서 자세한 병력청취 및 신경영상검사를 통해 정확한 진단이 필요할 것이다.
고혈압뇌병증 환자의 95% 이상에서 두정엽과 후두엽에 병변이 관찰되는데[2] 후뇌영역에 병변이 많이 발생하는 이유는 과관류를 막아주는 역할을 하는 교감신경이 이 부위에 적게 분포하기 때문에 혈관내피세포 이상으로 상대적으로 혈관성부종이 잘 생기는 것으로 추정하고 있다[1,2]. 본 증례들은 모두 FLAIR에서 양측 교뇌에 광범위하게 고혈압뇌병증 소견이 있다가 혈압 조절 후에 모두 사라진 경우로 첫 번째 증례는 대뇌 피질하백질도 함께 침범하였지만 상대적으로 교뇌 침범이 더 광범위했던 환자이고 나머지 두 증례는 양측 교뇌에만 국한된 고혈압뇌병증 환자였다. 비전형적으로 뇌실주위 백질, 기저핵, 시상, 뇌간, 소뇌에 병변이 발생하는 경우가 있지만[6,7], 뇌간을 단독으로 침범하는 경우는 드물고[3], 특히 급성뇌경색과 동반된 보고는 더욱 드물다[4].
본 증례처럼 뇌간, 소뇌를 침범한 고혈압뇌병증은 대뇌피질하 영역에 국한된 병변을 가진 환자에 비해 혈압 상승 속도가 빠르고 혈압이 더 높게 올라가는 경우가 많다는 주장이 있지만[8], 소뇌와 뇌간 부위에 고혈압뇌병증이 드물게 나타나는 원인은 명확하지 않다. 또한 고혈압뇌병증과 뇌경색이 동반되어 나타나는 기전도 알려져 있지 않지만 혈관성부종에 의한 혈관내피손상, 혈관연축, 혈관뇌장벽파괴 등으로 인해 뇌혈류장애를 유발하면 뇌경색을 일으킬 수 있을 것으로 추정한다[6,9]. 본 증례에서는 대뇌 피질하변성과 미세출혈을 동반하는 특징을 가지고 있어서 대뇌 소혈관에 지속적인 손상이 있음을 의미하고 이런 환자에서 뇌경색과 고혈압뇌병증이 같이 동반될 가능성이 좀 더 높을 것으로 추정한다.
고혈압뇌병증 환자에서 뇌출혈의 발생빈도는 10-25% 정도로 비교적 흔한 것으로 알려져 있어서[1,10] 신속히 혈압을 조절해야 이런 합병증을 예방할 수 있고 증상 및 영상이상 소견도 호전시킬 수 있다[1]. 반대로 급성뇌경색 치료에서 혈압을 과도하게 낮추는 것은 뇌관류압저하로 증상 악화를 초래할 수 있어서 권고되지 않고 있다[5]. 그렇지만 두 질환이 동반된 경우에 대한 치료 기준은 알려져 있지 않다. 첫 번째 증례는 tPA 투여 후 교뇌출혈이 발생한 경우로 고혈압뇌병증 합병증 방지를 위해 좀 더 적극적 혈압관리가 필요할 수도 있었을 것으로 생각한다. 두 번째 대뇌혈관 폐색 환자에서 비교적 급속한 혈압저하 후 뇌경색이 악화되어 과도한 혈압 조절이 뇌경색을 악화시킬 수도 있었을 것이다. 따라서 고혈압뇌병증을 동반한 급성뇌경색에서 초기 혈압 조절에 의한 뇌경색의 조기 신경계증상 악화 또는 고혈압에 의한 뇌출혈 합병증 모두 발생할 수 있기 때문에 뇌경색 발병 기전을 고려하여 지속적 혈압 모니터링과 적절한 혈압 조절을 위한 전략을 세우는 것이 중요할 것으로 생각한다.
저자들은 광범위하게 교뇌를 침범한 고혈압뇌간뇌병증과 급성뇌경색이 동반된 증례에서 뇌출혈과 뇌경색 악화를 일으킨 증례들을 경험하여 이를 보고하며 적절한 혈압 치료에 대한 기준 마련이 필요할 것으로 생각한다.