호산구수막뇌염 및 다발초점뇌경색을 동반한 신경개회충증
A Neurotoxocariasis Case Manifesting Multiple Cerebral Infarction and Eosinophilic Meningoencephalitis
Article information
Trans Abstract
Although Toxocara canis is known to cross the blood-brain barrier, central nervous system involvement is uncommon. Clinical manifestations vary and include cerebral infarction, meningoencephalitis, myelitis, vasculitis or seizure. However cerebral infarction and meningoencephalitis rarely occur simultaneously. We report a case of multiple cerebral infarction combined with eosinophilic meningoencephalitis in a patient with neurotoxocariasis. After control of increased intracranial pressure and treatment with albendazole and steroid, the patient’s clinical symptoms improved markedly.
개회충은 혈액뇌장벽을 통과하는 것으로 알려져 있으나 중추신경계를 침범하는 신경개회충증(neurotoxocariasis)은 흔하지 않다. 신경개회충증은 열과 두통 등의 비특이적 증상을 유발하며, 뇌경색, 수막뇌염, 척수염, 시신경염, 혈관염 또는 경련발작 등이 발생할 수 있다[1-3]. 그러나 뇌경색과 수막뇌염이 동시에 발생하는 경우는 드물다. 저자들은 다발초점뇌경색과 호산구수막뇌염을 동시에 모두 보인 신경개회충증을 두개내압 조절과 알벤다졸 및 스테로이드로 치료한 증례를 경험하여 보고한다.
증 례
82세 남자가 4일 전 발생한 갑작스러운 운동우세 혼합실어증으로 내원하였다. 10년 전 고혈압을 진단받았고, 5개월 전 호산구 증가가 있었으나(8.9%, 810/mm3) 증상이 없어 치료 없이 경과 관찰 중이었다. 환자는 평소 지팡이를 짚고 거동하며 최소한의 도움으로 일상생활수행이 가능하였으며 고졸학력에 2개월 전 시행한 한국판 간이정신상태검사(Korea Mini-Mental State Examination, K-MMSE)는 22점이었다. 혈압은 164/74 mmHg이었고 체온은 정상이었다. 의식은 명료하였으나 질문에 본인 이름만 대답 가능하였고, 지남력이 감소되어 있었다. 근력은 양측 상지에서 Medical Research Council (MRC)척도 5단계, 우측 하지에서 3단계, 좌측 하지에서 4단계였으며 뇌신경과 다른 신경학적결손은 없었다. 일반혈액검사에서 혈색소 12.7 g/dL, 백혈구 8,250/mm3, 혈소판 153,000/mm3로 정상이었고, 호산구가 7.9%, 650/mm3 (참고치: 1-5%, 0-500/mm3)로 호산구 증가가 확인되었다. 일반화학검사는 정상이었으나 적혈구침강속도가 19 mm/hr (참고치: <9 mm/hr), 고감도C반응단백은 1.42 mg/dL (참고치: <0.3 mg/dL)로 상승되어 있었다. D이합체 0.55 mg/L (참고치: 0-0.55 mg/L), 총콜레스테롤 149 mg/dL, 저밀도콜레스테롤 82 mg/dL, 중성지방 44 mg/dL였고, 심전도에서 심박동수 60회/분이며 정상 리듬이었다.
뇌 컴퓨터단층촬영에서 좌측 전두엽 피질의 뇌경색과 함께 경도 내지 중등도의 소혈관성 병변을 동반한 경도의 뇌위축이 확인되었다. 뇌 확산강조자기공명영상에서는 양쪽 전두엽과 좌측 두정엽, 우측 측두엽 및 소뇌에 다발성 급성뇌경색이 확인되었다(Fig. 1-A-C). 뇌혈관자기공명영상에서는 양측 원위부 내경동맥과 중대뇌동맥의 협착이 보였다(Fig. 1-D). 경동맥조영증강자기공명 영상에서 총경동맥 및 내경동맥에서 유의한 협착은 없었고, 경동맥초음파에서 불안정성 죽상경화반은 없었다. 아스피린 300 mg, 클로피도그렐 75 mg, 아토르바스타틴 20 mg을 투약하였고 이후 아스피린 100 mg 및 클로피도그렐 75 mg의 이중 항혈소판제요법 및 아토르바스타틴 20 mg을 유지하였다.

Diffusion-weighted image shows high signal intensity on bilateral frontal, left parietal lobes (A), right temporal lobe (B) and left cerebellum (C), suggesting acute ischemic stroke. Magnetic resonance angiography reveals stenosis on bilateral distal internal carotid arteries and M1 segment of middle cerebral arteries (D).
다발초점뇌경색의 원인 평가를 위한 경흉부심장초음파, 24시간 심전도홀터는 정상이었다. 경식도심장초음파에서도 감염심내막염 및 우좌션트 등의 소견이 확인되지 않아 심장색전성 뇌경색의 원인은 찾을 수 없었다. 발견되지 않은 종양을 찾기 위한 흉복부 컴퓨터단층촬영 및 종양표지자(알파태아단백질, 암배아항원, 전립샘 특이항원, 암항원19-9, 암항원125, 암항원72-4)는 정상이었다. 혈관염, 결체조직질환 연관 검사인 항핵항체 역가는 1:160이었고, 시트룰린항체, 항쇼그렌증후군A항체, 이중나선DNA항체, 항베타2당 단백I항체, 항인지질항체, 항카디오리핀항체, 루푸스항응고인자검사, 올리고클론띠, 혈청매독검사는 정상이었다.
다음날 우측 상지 근력이 MRC척도 1단계로 급격한 악화를 보였으며, 전실어증을 보이며 명령 및 지시에 거의 반응하지 않는 무운동무언증과 함께 기면상태로 평가되었고 K-MMSE 0점이었다. 뇌 확산강조자기공명영상과 뇌 조영증강자기공명영상에서 좌측 전두엽과 양측 두정엽의 뇌고랑에서 조영증강이 있었고 양쪽 전두엽과 후두엽 및 소뇌에 뇌경색이 더욱 진행하면서 출혈변환 및 피질부위 출혈이 동반된 것으로 확인되었다(Fig. 2). 기면상태뇌파검사에서 뇌전증량 방전 소견 없이 양 대뇌반구에 걸쳐 중등도에서 고도의 기능저하 양상이 확인되어 비경련성 뇌전증지속상태 가능성은 낮았다. 호산구 증가와 함께 뇌 전체 영역에 발생한 뇌경색이 있어 기생충 감염에 의한 뇌경색 발생 가능성을 염두에 두고 개회충, 간흡충, 폐흡충, 유구낭미충, 스파르가눔, 고래회충유충, 선모충, 방광주혈흡충, 간질, 만손주혈흡충, 연충, 원충에 대한 혈청항체검사를 시행하였다.

Diffusion-weighted image shows newly developed acute ischemic stroke on bilateral occipital lobes and left parietal lobe (A) and bilateral cerebellum (B). Contrast-enhanced T1-weighted image demonstrates enhancement on left frontal and both parietal lobe sulci (C). T2-weighted gradient echo image shows cortical hemorrhages on bilateral cerebral hemispheres (D).
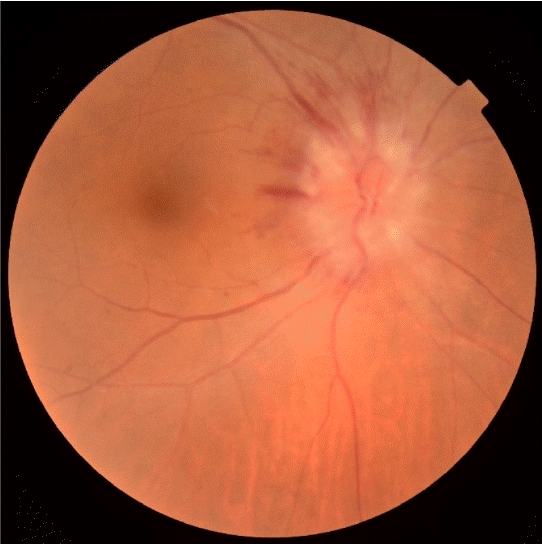
감염에 의한 두개뇌압상승 가능성을 배제하기 위해 시행한 요추천자검사에서 뇌척수압 56 cmH2O, 백혈구 43/mm3, 호산구 54%, 단백질 111.6 mg/dL, 아데노신탈아미노화효소 1 IU/I로 확인되었다. 일반혈액검사에서는 백혈구 10,290/mm3, 호산구 14.2%로 호산구 증가가 악화되었으며, 적혈구침강속도 24 mm/hr, 고감도C반응단백은 2.82 mg/dL로 상승되었다. 안저 촬영검사에서는 우안의 유두부종 및 출혈 병변이 확인되었다(Fig. 3). 환자는 두개뇌압 조절을 위해 만니톨 90 g과 덱사메타손 20 mg을 투약하였고 결핵수막염을 완전히 배제하지 못하여 에탐부톨 1,000 mg, 이소니아지드 200 mg, 피라진아마이드 1,600 mg, 리팜핀 600 mg을 우선적으로 투약하였다. 입원 7일차에는 의식이 명료하고 대답이 가능한 상태로 호전되었고 추적 요추천자검사에서 뇌척수압 39 cmH2O, 백혈구 21/mm3, 호산구 22%, 단백질 139.4 mg/dL로 확인되었고 뇌척수액을 30 mL 배액하였다.
입원 11일째에 사람에 대한 지남력이 회복되며 한 단어 이상의 대답이 가능하였다. 혈청 개회충항체검사에서 1.42로 양성이 확인되어 알벤다졸 400 mg을 하루 2회 투여하였고, 호산구 증가(0.5%)가 호전되어 덱사메타손을 중단하였으나 13일째에 무운동무언증을 동반하며 인식이 악화되었다. 추적 요추천자검사에서 뇌척수압 33.5 cmH2O, 백혈구 14/mm3, 호산구는 확인되지 않았으며 단백질 46.6 mg/dL로 뇌척수액을 40 mL 배액하였다. 입원 15일째 일반혈액검사에서 호산구 증가(7%)가 다시 확인되었고 추적 혈청 개회충항체검사에서 1.14로 양성이 재확인되었다. 프레드니솔론 60 mg을 1주일간 투약하고 알벤다졸 800 mg을 2주간 투약하면서 근력은 MRC척도로 우상지 4점, 우하지 3점 및 좌상하지 5점으로 호전되었다. 추적 혈청 개회충항체검사는 0.02로 음성이 확인되었고, K-MMSE 10점으로 퇴원하였다.
고 찰
개회충의 인체 감염은 동물의 배설물 속 충란, 유충으로 오염된 흙이나 채소를 경구로 섭취하거나 감염된 숙주조직의 유충을 섭취함으로써 발생할 수 있다. 개회충은 체내 감염 이후 수년간에 거쳐 이행하는 것으로 알려져 있다[1]. 개회충의 유충은 간, 폐, 심장, 눈, 중추신경계를 침범할 수 있으며 개회충증의 임상적인 증상은 침범되는 장기와 관련이 있다[1]. 그중에서도 신경개회충증은 매우 드문 형태로, 유충의 신경계이환에 의해 발생하며 수막염, 뇌염, 척수염, 뇌혈관염, 뇌경색, 경련, 행동장애 등의 증상이 보고되었다[3].
개회충증에 의한 뇌졸중의 발생기전은 명확히 알려진 바 없다. 일부 연구에 따르면 개회충에 의해 일차적으로 뇌졸중이 발생할 가능성보다는 개회충 감염에 의한 호산구 증가가 생기고 이에 따라 활성산소, 염증성 싸이토카인 등이 분비됨으로써 동맥혈관내피에 세포독성을 일으켜 이차적인 혈액응고장애를 유발한다고 알려져 있다[2,4]. 또한 호산구 증가로 심내막 손상 이후 심내막근 섬유화로 미세색전이 발생하며 뇌경색이 유발될 가능성이 있다[5]. 본 환자에서는 혈액응고인자는 정상이었으며, 심장검사에서 색전의 원인이 확인되지 않았으나 염증성 색전의 가능성은 완전히 배제할 수 없었다. 또한 혈관염이 동반된 경우에는 두개내혈관의 협착을 유발할 수 있으므로 양측 원위부 내경동맥과 중대뇌동맥 협착이 혈관염에 의한 것인지도 고려해야 한다. 그러나 3년 전에 시행한 뇌혈관자기공명영상에서 해당 부위의 경미한 협착이 있었으며, 치료 이후 추적검사에서 협착의 뚜렷한 차이가 보이지 않아 혈관염이 원인일 가능성은 높지 않다고 판단하였다. 발생 초기에 고해상도혈관벽자기공명영상을 시행하여 혈관염에서 보이는 동심형(concentric) 조영증강이나 혈관벽두꺼워짐이 확인되었다면 치우쳐진 죽상경화반과 구분하는 데 도움이 되었을 것으로 판단된다. 본 환자에서는 잠복개회충증(covert toxocariasis)에 의해 혈액검사에서 호산구 증가를 보이다가 개회충의 신경계 이행이 발생하여 신경개회충증(neurotoxocariasis)으로 다발초점뇌경색과 호산구수막뇌염이 발생한 것으로 보인다.
개회충증의 확진은 조직학적으로 유충을 증명하는 것이지만 임상적으로 유충을 발견할 수 없는 경우가 많다. 이에 실제 임상에서는 혈청ELISA검사를 통해 개회충 항체를 검출하는 방법이 민감도 92%, 특이도 92%로 높아 진단에 활용되고 있다[6]. 하지만 혈청 양성 소견만으로는 과거 감염을 배제할 수 없어, 웨스턴블롯검사를 통해 확진하게 된다[4]. 또한 신경개회충증에 의한 뇌경색은 뇌 자기공명영상에서 단일 병터나 다발 병터로 나타날 수 있으며 T2강조 영상 및 액체감쇠역전회복영상에서 대뇌피질과 백질에 고신호강도를 보이며, T1강조영상에서는 대개 등신호 강도 내지는 저신호강도로 확인된다[7]. 그러나 의식장애 증상이 발현한 개회충증 환자의 뇌 영상에서 확인되지 않는 보고도 있어 영상검사만으로 개회충증을 배제할 수 없다[8].
신경개회충증의 경우 본 환자와 같이 각성과 인식의 변화로 병력청취가 어려울 수 있어 주의를 요한다. 국내에 호산구 증가 환자 중 개회충 항체반응검사 결과 양성이 68%에 이른다는 보고가 있다[9]. 따라서 각성과 인식을 포함한 의식 변화와 함께 호산구 증가를 동반한 경우에 개회충 감염에 의한 신경개회충증을 감별하는 것이 중요하다. 본 증례의 경우 갑자기 발생한 운동우세 혼합실어증으로 내원하였고 양측 전두엽 뇌경색이 확인되었으므로, 초기에는 뇌경색에 의한 실어증으로 판단하였다. 그러나 출혈변환이 동반되고 뇌수막이 조영증강되는 비전형적인 다발초점뇌경색이 확인되며 비경련뇌전증지속상태가 아님에도 불구하고 무운동무언증 및 의식 변화를 보여서 개회충에 의한 수막뇌염을 진단할 수 있었고, 적절한 구충제 및 스테로이드 투여와 두개뇌압 조절을 통해 증상을 회복시킬 수 있었다.
호산구 증가 및 전형적인 다발초점뇌경색을 동반하는 신경개회충증과는 다르게 본 증례처럼 의식 변화를 수반하며 뇌경색의 경계가 불분명하거나 뇌수막이 조영증강되는 경우에는 뇌척수액검사가 반드시 필요하겠다. 빠른 진단과 치료가 예후에 큰 영향을 줄 수 있으므로 신경개회충증에서는 뇌경색과 수막뇌염의 동반 가능성도 염두에 두어야 한다.