주요 근육병리 소견을 바탕으로 한 근육병의 진단
Diagnostic Approaches to Various Muscle Diseases Based on Muscle Pathology
Article information
Trans Abstract
Muscle pathology can give much information to reach the diagnosis of neuromuscular disorders. Major pathological changes occurred in skeletal muscles include muscle fiber atrophy/hypertrophy, necrosis/regeneration, inflammation, myofibrillar disorganization, abnormal inclusions, and disruptions in cellular organelles. Physicians should be able to understand what each of these findings indicates. However, these are not always specific to a certain disease, and instead most of them are commonly found in many of muscle diseases. Thus, muscle pathological findings should be carefully interpreted under the given clinical settings.
서 론
근육병은 근육조직에서 나타나는 다양한 변화로부터 기인한다. 근육은 수축과 이완을 통해 근력을 생성하는 기관이므로 근육조직의 이상은 궁극적으로 근력을 약화시킨다. 따라서 모든 근육병은 근쇠약과 근위축이라는 공통적인 증상과 징후를 나타낸다. 임상적으로 근쇠약이 발생하는 부위와 양상에 따라 근육병의 감별진단이 가능한 경우도 있으나 많은 경우에는 근육의 조직 소견을 관찰하는 것이 진단을 위해 필요하다. 최근 유전자검사의 발달로 근생검을 생략하기도 하지만, 이는 대부분 임상 소견을 바탕으로 원인유전자를 쉽게 한정할 수 있는 경우에 국한된다. 한편, 수많은 후보유전자를 한꺼번에 분석할 수 있는 검사 방법인 차세대염기서열분석은 근육병의 유전진단을 매우 향상시켰으나 이를 통해 얻은 광범위한 유전 정보들 중에서 원인이 되는 변이를 정확하게 찾아내기 위해서는 임상정보와 더불어 근육의 조직 소견이 중요한 단서가 될 수 있다.
근육병이 의심되는 환자에서 근생검을 하였을 때 주로 관찰할 수 있는 소견은 근섬유의 괴사와 재생, 근섬유의 크기와 모양의 변화, 염증세포의 침윤, 근원섬유의 이상과 사립체의 변화 그리고 근섬유내 구조이상 등이다. 이러한 소견들은 특정 질환에 국한되어 관찰되기보다는 여러 질환에서 공통적으로 관찰되는 경우가 대부분이다. 따라서, 본문에서는 근육조직에서 이러한 소견들을 관찰하였을 때 어떻게 해석하고 진단에 응용할 것인지에 대해 다루어 볼 것이다.
본 론
1. 근생검과 조직염색
서론에서 기술한 바와 같이 근육병의 공통된 임상 증상은 근쇠약이므로 신경계진찰, 신경전도검사와 침근전도검사, 혈액검사를 통해 먼저 근쇠약이 근육에서 기인하는지를 판단하는 것이 중요하다. 근생검을 결정한 후에는 생검할 근육을 선택해야 하는데, 이 때 근육영상검사가 도움이 된다. 근육의 컴퓨터단층촬영 또는 자기공명영상검사를 시행하여 근위축이 아주 경미하거나 너무 심한 근육을 배제하는 것이 좋다. 그렇지 않으면 근생검을 통해 얻을 수 있는 정보가 제한되기 때문이다. 또한, 침근전도검사를 시행한 근육은 검사에 의한 이차적인 변화가 발생할 수 있으므로 역시 배제하는 것이 좋다. 이러한 조건을 만족할 경우 위팔두갈래근(biceps brachii)을 선택하는 것이 가장 좋은데 이 근육은 근섬유의 주행방향이 평행하고 근섬유의 비율이 잘 알려져 있어 질환에 의한 변화를 판단하기 용이하며, 체중의 부담이 적어 생검 후 불편감을 최소화할 수 있기 때문이다.
생검한 근육조직은 액화질소에 의해 냉각된 이소펜탄(isopentane)을 이용하여 급속 냉각을 해야 조직 내에 얼음결정(ice crystal)이 생기는 것을 막을 수 있다. 냉각된 조직은 -80℃ 이하의 급속냉동고(deep freezer)에 보관하고 -20℃ 이하의 저온유지장치(cryostat) 내에서 절단하여 염색에 필요한 절편(section)을 만든다[1].
근육조직의 변화를 관찰하기 위한 염색법은 크게 조직염색(histological stain), 조직화학염색(histochemical stain)과 면역조직화학염색(immunohistochemical stain)으로 나눈다[1]. 헤마톡실린-에오신염색(hematoxylin and eosin stain)과 고모리-트라이크롬염색(Gomori-trichrome stain)이 조직염색에 해당하며 근육조직에서 나타나는 기본적인 구조의 변화를 확인할 수 있는 가장 중요한 염색법이다. 조직화학염색은 근섬유 내에 존재하는 물질들의 화학 변화를 이용한 염색이며, 근원섬유의 그물망조직을 반영하는 니코틴아마이드탈수소효소테트라졸륨환원효소(nicotinamide dehydrogenase tetrazolium-reductase, NADH-TR)염색, 사립체의 변화를 반영하는 석신산염탈수소효소(succinate dehydrogenase, SDH)와 사이토크롬c산화효소(cytochrome c oxidase, COX)염색, 시약의 수소이온농도(pH)에 따라 근섬유의 유형을 구별할 수 있는 아데노신인산염분해효소(adenosine phosphatase, ATPase)염색이 이에 해당한다. 이외에 산성인산염(acid phosphatase)염색은 대식세포의 활성을 반영하며, 과아이오드산시프(periodic acid schiff, PAS)염색은 근섬유 내 당원의 축적을, 그리고 oil red O염색은 지방질의 축적을 반영한다. 면역조직화학염색은 근육조직 내에 존재하는 특정 단백항원에 대한 항원-항체 반응을 이용한 염색이며, 주로 항원이 되는 단백질에는 염증에 관여하는 주조직적합복합체(major histocompatibility complex, MHC), 사람백혈구항원(human leukocyte antigen, HLA)과 막공격복합체(membrane attack complex, MAC) 그리고 근육세포막(sarcolemma)이나 세포바깥바탕질(extracellular matrix)에 존재하는 단백질로서 디스트로핀(dystrophin), 디스펄린(dysferlin), 메로신(merosin) 등이 있다. 염증 관련 항원에 대한 면역조직화학염색은 특발염증근육병(idiopathic inflammatory myopathy)의 진단에 도움이 된다. 세포막과 세포바깥바탕질의 단백질은 주로 근디스트로피(muscular dystrophy)의 원인이 되는 단백질이므로 이에 대한 면역조직화학염색은 근디스트로피의 감별진단에 큰 역할을 하게 된다[1,2].
2. 정상 근육의 구조
하나의 근섬유는 근육속막(endomysium)에 둘러싸여 있으며, 여러 개의 근섬유가 모여 하나의 근육다발(fascicle)을 이루는데 이는 근육다발막(perimysium)에 의해 구분된다. 하나의 근육은 여러 개의 근육다발로 구성되며 근육바깥막(epimysium)에 의해 둘러싸여 있다. 보통 하나의 근육 절편에서는 근섬유와 근육속막을 주로 관찰할 수 있으며 근육다발막과 근육다발막에 포함된 혈관, 신경 등이 함께 관찰되기도 한다. 정상 근섬유의 크기는 성인에서 40-80 μm이며, 다각형 모양에 근섬유 가장자리에 위치한 여러 개의 핵을 가지고 있다. 각각의 근섬유 사이의 공간을 결합조직이 채우고 있는데 정상 근육에서는 그 양이 매우 적다[3]. 이와 같은 근섬유의 기본적인 구조는 헤마톡실린-에오신염색과 고모리-트라이크롬염색에서 가장 잘 관찰할 수 있다(Fig. 1-A, B). 정상 근육세포질(sarcoplasm)은 NADH-TR, SDH 그리고 COX염색에서 균질하게 염색이 된다. 정상 근육에서는 1형과 2형 근섬유가 일정한 비율을 유지하며, 같은 섬유형끼리 서로 인접하지 않고 바둑판모양으로 배열된다. 이 형태는 ATPase염색에서 잘 나타난다. ATPase염색은 pH 4.3에서 1형 근섬유를 진하게 염색하고 pH 9.4에서는 2형 근섬유를 진하게 염색한다(Fig. 1-C, D). 이것은 1형 근섬유가 산화대사(oxidative metabolism)를 하고 2형 근섬유는 당분해대사(glycolytic metabolism)를 하기 때문이다. 2형 근섬유는 다시 2A형과 2B형으로 나누는데 2B형은 당분해활성과 더불어 부분적인 산화활성을 가지므로 pH 4.6에서는 진하게 염색되는 1형 근섬유와 밝게 염색되는 2A형 근섬유 사이에 중간 정도로 염색되는 2B형을 관찰할 수 있다[3]. 각 근육마다 1형과 2형 근섬유의 비율이 일정하게 유지되는데 병적 상황에서는 이러한 비율에도 변화가 나타날 수 있다.

Normal muscle pathology. (A, B) Normal muscle fibers are polygonal shaped and have multiple nuclei in the periphery (A: hematoxylin and eosin stain, ×200; B: modified Gomori-Trichrome stain, ×200). (C) Darkly stained fibers are type 1 fibers while type 2 fibers are lightly stained in pH 4.3 of adenosine triphosphatase (ATPase) stain (ATPase, pH 4.3, ×200). (D) At pH 9.4 of ATPase stain, fibers are inversely stained; type 1 fibers are light, and type 2 are dark (ATPase, pH 9.4, ×200).
3. 근섬유 크기와 모양의 변화
1) 조직 소견
정상 범위(40-80 μm)에 비해 직경이 작아진 근섬유를 위축근섬유(atrophic fiber), 정상보다 큰 섬유를 비대근섬유(hypertrophic fiber)라고 한다. 근섬유의 크기는 단순히 불용(disuse) 또는 과용(overuse)에 의해서도 작아지거나 커질 수 있으며 근육병뿐만 아니라 신경병에서도 나타날 수 있다. 근육병에서는 위축근섬유가 둥근 모양이며 정상 크기의 근섬유나 비대근섬유와 혼재되어 있는 경우가 많다. 반면, 신경병에 의한 위축근섬유는 각이 진 형태(angulated fiber)이다. 근육병과 달리 신경병에서는 위축근섬유가 군집해 있는 경우가 많으며 이를 집단위축(group atrophy)이라고 하고, 나아가 근육다발 전체가 위축되는 것을 다발위축(fascicular atrophy)이라고 한다. 이러한 차이를 바탕으로 근육병과 신경병에 의한 변화를 구분할 수 있다[4].
2) 흔히 관찰할 수 있는 질환
(1) 근디스트로피(muscular dystrophies)
근디스트로피는 가장 유병률이 높은 뒤센느/베커근디스트로피(Duchenne/Becker muscular dystrophies)와 사지대근디스트로피(limb-girdle muscular dystrophies, LGMD), 선천근디스트로피(congenital muscular dystrophies) 그리고 얼굴어깨위팔근디스트로피(facioscapulohumeral dystrophy), 근긴장근디스트로피(myotonic dystrophy), 눈인두근디스트로피(oculopharyngeal muscular dystrophy), Emery-Dreifuss 근디스트로피 등 다양한 질환을 포함한다. 선천근디스트로피는 출생 시부터 저긴장증을 나타내고 운동발달지연을 보이는 질환이지만, 이를 제외한 대부분의 근디스트로피는 소아기부터 성인기에 이르기까지 발병 연령이 다양하다. 질환에 따라 차이가 있으나 임상적으로 사지 몸쪽근육의 근력저하와 근위축이 두드러지며 혈청 크레아틴키나아제(creatine kinase)가 증가한다.
근디스트로피의 조직 소견에서 위축근섬유는 비대근섬유와 무작위로 혼재되어 있는 경우가 많다(Fig. 2-A). 따라서 근섬유의 크기의 다양성이 증가하며 유병 기간이 길어질수록 이 다양성은 훨씬 더 증가하게 된다[4,5]. 비대근섬유는 다시 작은 크기로 분리되어 가는 과정을 거치면서 분리근섬유(splitting fiber)가 되기도 한다[4]. 근섬유가 다각형에서 둥근 모양으로 변함에 따라 근섬유 사이의 공간이 넓어지게 되고 이 공간은 결합조직으로 채워지므로 세포사이질의 섬유화(fibrosis)를 흔히 관찰할 수 있다(Fig. 2-A). 후에 기술하게 될 근섬유의 괴사와 재생과 더불어 이와 같은 근섬유의 위축과 비대, 세포사이질 섬유화는 근디스트로피를 대표하는 조직 소견이다[5].

Changes in fiber size and types. (A) In muscular dystrophies, atrophic and hypertrophic fibers are randomly mixed. Muscle fibers are round-shaped and interstitial connective tissues are markedly increased (hematoxylin and eosin [H&E], ×100). (B) Most of muscle fibers are small-sized and round-shaped in congenital myopathies (H&E, ×100). (C) At pH 4.3 of adenosine triphosphatase (ATPase) stain, darkly stained type 1 fibers are small-sized and predominant in number (congenital fiber type disproportion, ×100). (D) Muscle fibers in the periphery of fascicles are relatively smaller than the others, which is defined as perifascicular atrophy (nicotinamide dehydrogenase-tetrazolium reductase stain, ×100). (E) Atrophic fibers are angular shaped, and the same type of fibers are grouped (fiber type grouping) (ATPase, pH 4.3, ×100). (F) Small-sized fibers are clustered forming a group, which is called as ‘grouped atrophy’ (H&E, ×100).
(2) 선천근육병(congenital myopathies)
선천근육병은 출생 직후나 유아기에 발병하며 사지의 근력저하가 천천히 진행하거나 진행을 거의 하지 않는 경과를 보이지만 일부에서는 발병 초기부터 운동발달의 지연이 심각하여 독립보행을 하지 못하는 경우도 있다[6]. 안면근육과 외안근의 마비가 흔히 동반되며 심한 경우 조기에 호흡근의 약화를 보이기도 한다. 혈청 크레아틴키나아제는 약간 상승하거나 정상인 경우가 많다.
선천근육병에서는 근디스트로피와 달리 비대근섬유가 관찰되는 경우는 드물며 크기가 작고 둥근 모양의 위축근섬유가 주로 관찰된다(Fig. 2-B). 특징적으로 근섬유의 위축은 주로 1형 근섬유에서 더욱 두드러지며, 1형 근섬유의 수가 많아지는 것 또한 선천근육병의 공통적인 특징이다. 선천근육병에 속하는 대부분의 질환들은 이와 같은 근섬유의 크기 변화뿐만 아니라 각 질환마다 특징적인 조직 소견이 관찰되므로 근생검이 진단에 중요한 역할을 한다[6]. 그러나 선천근육병 중 다른 조직학적 특징 없이 단순히 수가 많고 크기가 작은 1형 근섬유와 비교적 수가 적고 크기가 큰 2형 근섬유가 이정점분포(bimodal distribution)를 보이는 선천섬유형불균형(congenital fiber type disproportion)과 같은 질환도 있다(Fig. 2-C).
(3) 특발염증근육병(idiopathic inflammatory myopathies)
특발염증근육병은 자가면역기전에 의해 발생하는 염증 반응으로 인해 근섬유의 파괴가 진행하며 수개월에 걸쳐 점차적인 근쇠약이 발생하는 질환이다. 전통적으로는 Bohan and Peter가 제시한 기준에 근거하여 다발근염(polymyositis)과 피부근염(dermatomyositis)으로만 분류되어 왔으나 진단과 병리기전을 이해하는 데 한계가 있었다. 최근 새롭게 제시된 병리기준과 다양한 근염특이항체(myositis-specific antibodies)의 발견으로 새로운 진단 및 분류를 하게 되었으며, 특발염증근육병을 면역매개괴사근육병(immune-mediated necrotizing myopathy), 피부근염(dermatomyositis), 봉입체근염(inclusion body myositis), 다발근염(polymyositis)으로 구분한다. 이와 더불어, 다른 근염의 특징이 배제되면서 비특이적인 근육다발막 주변과 혈관 주변의 염증세포 침윤만 관찰되는 비특이근염(nonspecific myositis)을 포함한다.
특발염증근육병에서는 염증 반응에 의해 괴사와 재생이 반복되는 결과로 둥근 모양의 위축근섬유가 관찰된다. 근디스트로피에 비해 비대근섬유는 상대적으로 드물게 나타나지만, 염증근육병의 유병 기간이 긴 경우에는 비대근섬유가 관찰되기도 한다. 특히 피부근염에서는 근육다발의 가장자리에 위치한 근섬유에서 위축이 두드러지게 나타나는 것을 관찰할 수 있는데 이를 다발주변위축(perifascicular atrophy)이라고 하며[7] 피부근염의 질병특유징후(pathognomonic sign)라고 할 수 있다(Fig. 2-D). 또한, 봉입체근염은 위축근섬유가 특히 자주 관찰되는 질환이다. 위축근섬유가 특징적인 분포를 보이지는 않으나 10-20 μm 정도의 매우 작은 근섬유를 자주 관찰할 수 있다[7].
(4) 운동신경세포병(motor neuron diseases)
운동신경세포병은 운동신경세포의 퇴화로 인해 근섬유의 탈신경화가 일어나고 결과적으로 근력저하와 근위축이 진행하는 만성 질환이다. 운동신경세포병에서 위축근섬유는 대부분 각진 형태를 보인다(Fig. 2-E). 운동신경세포병의 초기에 일부 운동단위(motor unit)의 탈신경화(denervation)가 먼저 일어나면서 해당되는 운동단위에 속하는 근섬유의 위축이 일어나고 이후에 신경재분포(reinnervation) 과정을 거치고 다시 탈신경화가 일어나는 과정을 반복하면서 위축 근섬유는 점차 군집하게 된다. 이러한 결과로 운동신경세포병의 근육조직에서는 집단위축과 다발위축을 쉽게 관찰할 수 있다(Fig. 2-F). 뿐만 아니라, 운동신경세포병을 포함한 만성 신경병에서는 탈신경 및 신경재분포 과정을 통해 같은 섬유형끼리 군집하는 ‘근섬유형집단화(fiber type grouping)’도 함께 관찰할 수 있다(Fig. 2-E). 조직 소견에서 집단위축, 다발위축 및 근섬유형집단화를 관찰한다면 신경병에 의한 근육조직의 변화로 진단할 수 있다.
4. 근섬유의 괴사와 재생
1) 조직 소견
근섬유의 괴사와 재생은 다양한 근육병에서 관찰할 수 있는 비특이적인 소견이다. 근섬유의 손상을 수반하는 모든 종류의 근육병뿐만 아니라 외상, 횡문근융해증(rhabdomyolysis)에서도 관찰할 수 있다. 괴사된 근섬유는 헤마톡실린-에오신염색에서 세포질이 옅어진 형태로 관찰되므로 액화섬유(liquefied fiber) 또는 유리질섬유(hyaline fiber)로 불리기도 한다(Fig. 3-A, arrows). 괴사된 근섬유는 주변에 대식세포가 자주 관찰되며(Fig. 3-B, arrowhead) 따라서 acid phosphatase염색에서 활성도가 높게 나타나 붉게 염색된다. 재생섬유는 근섬유 괴사 후 재생과정에 있는 세포를 일컬으며 활발한 단백질 합성으로 인해 세포질이 호염기성을 띠므로 헤마톡실린-에오신염색에 의해 짙게 염색되고 내부에는 크기가 커진 핵이 관찰된다(Fig. 3-B, arrows). 이러한 소견들은 질환에 관계없이 매우 유사하므로 감별진단을 위해서는 임상정보와 동반되는 다른 조직 소견을 함께 고려할 필요가 있다[4,5].
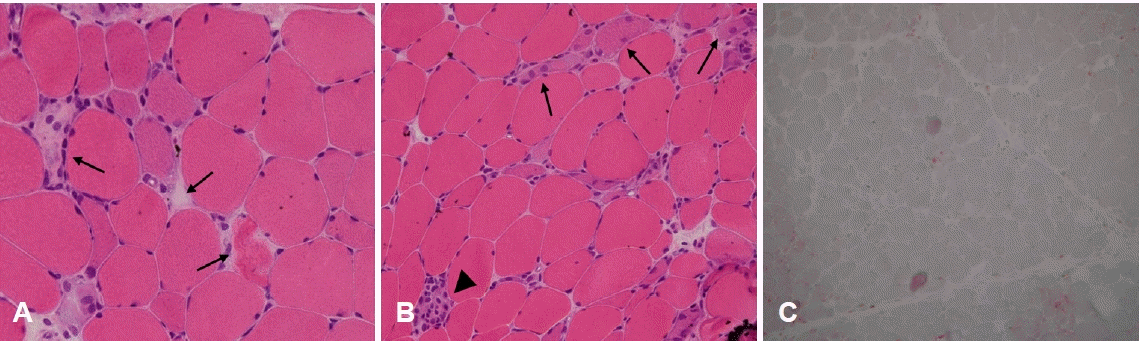
Muscle fiber necrosis and regeneration. (A) In necrotic fibers sarcoplasm is faintly stained (arrows), which is why they are called as ‘hyaline’ or ‘liquefied’ fibers (hematoxylin and eosin [H&E], ×200). (B) A necrotic fiber is phagocytosed by macrophages (arrowhead), and regenerating fibers have basophilic sarcoplasm with enlarged nuclei (arrows) (H&E, ×200) (C) Activities of acid phosphatase appear highly elevated in immune-mediated necrotizing myopathy (acid phosphatase, ×100).
2) 흔히 관찰할 수 있는 근육질환
(1) 근디스트로피
근디스트로피는 근섬유의 괴사와 재생이 관찰되는 대표적인 근육질환이다. 대부분의 근디스트로피는 근섬유의 구조에 관여하는 세포막 단백질의 결핍에 의해 발생한다. 뒤센느/베커근디스트로피가 가장 대표적인데 원인이 되는 디스트로핀 단백질은 세포막과 세포내 골격을 연결하는 지지대 역할을 한다. 따라서 X염색체에 존재하는 디스트로핀 단백질을 암호화하는 DMD 유전자에 돌연변이가 있게 되면 디스트로핀 단백질이 완전히 소실되고 이로 인한 구조적 취약성 때문에 수축 및 이완과 같은 생리적 자극에 의해서도 근섬유가 쉽게 파괴된다[5,8]. 이러한 이유로 뒤센느/베커근디스트로피와 함께, 기전이 유사한 사지대근디스트로피에서는 근섬유의 괴사와 재생이 빈번하게 관찰된다[9]. 근섬유의 구조적 취약은 근섬유막단백질뿐만 아니라, 핵막단백질(nuclear membrane proteins)과 세포바깥바탕질단백질(extracellular matrix protein)의 결핍에 의해서도 초래될 수 있으므로 이들 모두가 다양한 근디스트로피의 원인단백질이 될 수 있다[10,11]. 근디스트로피는 근섬유의 괴사와 재생 과정이 장기간에 걸쳐 반복적으로 일어나게 되므로 근섬유가 전반적으로 둥근 모양이 되고 근섬유 사이 결합조직이 증가하며, 위축근섬유와 비대근섬유가 동시에 나타나 근섬유 크기의 다양성 증가가 동반된다(Fig. 3-A, B).
이와 같은 소견들은 근디스트로피를 진단하기 위한 중요한 조직 소견이지만[5,8], 원인유전자와 관계없이 대부분의 근디스트로피에서 공통적으로 관찰되므로 구체적인 진단을 위해서는 면역조직화학 염색을 추가로 시행하거나 유전자진단이 필요하다. 특히, 뒤센느근디스트로피의 경우 출생 남아 3,500명 중 한 명이라는 비교적 높은 발생률을 보이므로 3-5세에 근력저하가 진행하고 장딴지의 거짓비대(pseudohypertrophy)를 보이는 등 임상 소견으로 이 질환이 의심될 때 대부분 근생검을 시행하지 않고 먼저 DMD 유전자검사를 시행하게 된다.
(2) 특발염증근육병
특발염증근육병에서는 근디스트로피와 마찬가지로 다양한 정도의 근섬유 괴사와 재생이 관찰되며 괴사근섬유의 주변에 대식세포의 침윤이 관찰되기도 한다. 그러나 특발염증근육병은 근디스트로 피에 비해 질환의 경과가 짧으므로 괴사와 재생에 수반되는 결합조직의 증가나 근섬유 크기의 변화 폭이 상대적으로 적다[7]. 괴사와 재생은 특히 면역매개괴사근육병에서 가장 두드러지게 나타나며 동시에 산성인산염분해효소(acid phosphatase)의 활성도가 상당히 증가된다(Fig. 3-C). 다발근염과 피부근염에서도 다양한 정도의 괴사 및 재생근섬유를 관찰할 수 있으나 봉입체근염에서는 이러한 소견이 상대적으로 드물게 관찰된다[12]. 특발염증근육병에서는 근섬유의 괴사와 재생보다 염증세포의 침윤이 더 특징적인 소견이며 염증과 관련한 내용은 이후에 다루도록 한다.
5. 염증세포의 침윤
1) 조직 소견
염증세포는 괴사근섬유의 주변에서 흔히 관찰할 수 있다. 이는 파괴된 근섬유의 포식작용을 위해 대식세포(macrophage)가 침윤되기 때문이며, 따라서 근섬유의 괴사를 수반하는 대부분의 근육병에서 이를 관찰할 수 있다. 그러나 염증세포의 침윤은 특발염증 근육병의 가장 특징적인 조직 소견이며 괴사근섬유의 주변뿐만 아니라 근육속막, 근육다발막 그리고 혈관 주위에서 염증세포의 침윤을 관찰할 수 있다. 이외에 일부 근디스트로피에서도 특징적인 염증 반응을 관찰할 수 있으므로 감별진단에 유의해야 한다[11]. 염증세포는 헤마톡실린-에오신염색에서 쉽게 확인이 되지만 주조직 적합복합체나 사람백혈구항원, 막공격복합체 등 면역 반응에 대한 특이 항체를 이용하여 면역조직화학염색을 함으로써 보다 민감하게 염증세포의 침윤을 확인할 수 있다[2].
2) 흔히 관찰할 수 있는 근육질환
(1) 특발염증근육병
염증세포의 침윤을 관찰할 수 있는 가장 대표적인 질환이다. 괴사근섬유의 주위에 대식세포가 침윤되어 있는 모습이 공통적으로 관찰되지만 질환에 따라 염증세포가 주로 침윤되는 장소가 다르다. 피부근염에서 염증세포는 근육다발막과 혈관 주변에 주로 침윤되며(Fig. 4-A), 근육속막에는 침윤되지 않는다. 이와 달리 다발근염에서는 염증세포가 근육속막에 침윤되며 특징적으로 비괴사근섬유(non-necrotic fibers) 속으로 염증세포가 침투하거나 또는 그 주변을 둘러싸는 양상을 보인다(Fig. 4-B). 봉입체근염에서도 다발근염과 같은 양상의 염증세포 침윤이 관찰되는데(Fig. 4-C, arrows), 이와 함께 테두리공포(rimmed vacuoles)가 관찰되는 것이 또한 특징이다. 그러나 테두리공포가 두드러지지 않는 경우 염증세포 침윤의 유사성으로 인해 봉입체근염이 다발근염으로 오인될 수 있으므로 손가락굽힘근과 무릎폄근의 쇠약과 같은 봉입체근염의 특징적인 임상 증상을 고려하여 감별진단에 유의할 필요가 있다. 다른 질환들의 특징들이 배제되고 염증세포가 비특이적으로 근육다발막과 혈관 주변에 침윤되는 경우 비특이근염으로 분류한다. 반면, 면역 매개괴사근육병에서는 염증세포의 침윤이 거의 없거나 매우 드물게 관찰된다[12]. 이러한 염증세포 침윤 양상은 특발염증근육병의 새로운 병리학적 분류기준으로 포함되어 있다[12]. 주로 침윤되는 염증 세포는 림프구, 형질세포(plasma cell), 조직구(histiocyte) 등이며 호산구가 침윤되는 경우는 거의 없다[7].

Inflammatory infiltration. (A) Inflammatory cells are infiltrated in perimysium and around vessels (dermatomyositis, hematoxylin and eosin [H&E], ×100). (B) Inflammatory infiltration is highlighted in endomysial spaces (polymyositis, H&E, ×200). (C) Inflammatory cells are surrounding non-necrotic fibers (arrows) (inclusion body myositis, H&E, ×100).
(2) 근디스트로피
근디스트로피에서도 괴사근섬유의 주변에 대식세포가 침윤되는 것을 흔히 관찰할 수 있다. 반면 특발염증근육병에서와 같은 림프구, 형질세포, 조직구 등이 근육속막이나 근육다발막에 침윤되는 것은 매우 드물다. 특징적으로 얼굴어깨위팔근디스트로피와 디스펄린 단백질 결핍에 의해 발생하는 사지대근디스트로피2B형(LGMD2B, or LGMDR2 in new nomenclature)과 이의 맞섬유전자질환(allelic disorder)로써 원위근육병 중 하나인 미요시근육병(Miyoshi myopathy)에서는 대식세포 외의 염증세포의 침윤이 매우 두드러지게 나타나는 것을 관찰할 수 있는데 이 때문에 간혹 염증근육병으로 오인되기도 한다[13,14]. 따라서 조직 소견에서 염증세포가 관찰되더라도 섣불리 염증근육병으로 진단하기보다는 임상 증상과 경과를 고려하여 이와 같은 질환을 감별하는 것이 매우 중요하다. 얼굴어깨위팔근디스트로피의 경우, 최근 특징적인 임상 증상에 근거하여 근생검을 생략하고 유전자진단을 먼저 하게 되는 경우가 많아 병리 소견에 의한 감별진단의 중요도는 다소 감소하였다. 칼페인3 (calpain-3) 단백질 결핍에 의한 사지대근디스트로피 2A형(LGMD2A, or LGMDR1 in new nomenclature)에서는 특징적으로 호산구의 침윤이 관찰되기도 한다[9].
6. 핵의 변화
1) 조직 소견
정상 근섬유에서 핵은 하나의 근섬유에 다수로 존재하며 근섬유막 바로 아래, 근섬유의 가장자리에 위치한다. 이와 구분하여 핵이 근섬유의 내부 또는 중앙에서 관찰되는 경우 내핵(internal nuclei) 또는 중심핵(central nuclei)이라고 한다(Fig. 5-A). 정상 근육조직에서도 내핵은 1-3% 정도의 근섬유에서 관찰할 수 있다. 내핵은 병적인 상황에서 증가하는데 대표적인 경우가 재생근섬유이다. 재생근섬유에서는 핵이 내부에 위치하며 활발한 단백질 합성으로 인해 크기가 커져 있다. 한편, 여러 개의 핵이 덩어리를 이루고 있는 것을 핵응괴(nuclear clumps)라고 한다(Fig. 5-B, arrows). 이는 근섬유의 극단적인 위축으로 인해 세포질이 거의 소실되고 핵들만 남아있는 상태에서 관찰되는 현상이다. 근육조직의 세로단면(longitudinal section)에서 여러 개의 핵이 일렬로 줄을 지어 나타나는 것을 핵사슬(nuclear chains)이라고 한다(Fig. 5-C). 이는 내핵이 증가되는 경우에 함께 나타나는 소견이다.

Nuclear changes and related findings. (A) Many of muscle fibers have nuclei internally (centronuclear myopathy, hematoxylin and eosin [H&E], ×100). (B) Severely atrophied fibers have clustered nuclei with minimal sarcoplasm, which is called as ‘nuclear clumps’ (arrows) (H&E, ×200). (C) In a longitudinal section, nuclei are serially arranged forming a chain (H&E, ×200). (D) Almost all fibers have a single nucleus in the center of muscle fibers. Centronuclear myopathy (H&E, ×200). (E) Sarcoplasmic strands are radially arranged from the center where the nucleus is located (centronuclear myopathy, nicotinamide dehydrogenase tetrazolium-reductase [NADH-TR], ×200). (F) The peripheries of muscle fibers are faintly stained in NADH-TR stain, which is called as ‘peripheral halo’ (myotubular myopathy, NADH-TR, ×400).
2) 흔히 관찰할 수 있는 근육질환
(1) 중심핵근육병(centronuclear myopathy)과 근세관근육병(myotubular myopathy)
중심핵근육병과 근세관근육병은 선천근육병에 속하는 질환이다. 대부분의 선천근육병에서 내핵의 수는 정상에 비해 증가되어 있지만, 내핵 또는 중심핵이 가장 두드러지게 나타나는 질환은 중심핵근육병과 근세관근육병이다. 중심핵근육병은 유아기에서 성인에 이르기까지 발병 연령이 다양하며 사지의 근력저하뿐만 아니라 안면근육의 쇠약과 외안근마비가 임상적 특징이다. 원인으로 dynamin-2 유전자(DNM2)와 ryanodine receptor 1 유전자(RYR1), bridging integrator 1 유전자(BIN1)가 잘 알려져 있다. 특히, DNM2 돌연변이에 의한 중심핵근육병에서는 거의 모든 근섬유에서 하나의 핵이 근섬유의 정중앙에 위치하는 것을 관찰할 수 있다(Fig. 5-D) [15]. 이와 연관하여 이 질환의 NADH-TR염색에서는 근육세포질가닥(sarcoplasmic strand)의 방사성 배열을 관찰할 수 있다(Fig. 5-E). X-염색체에 존재하는 myotubularin 1 유전자(MTM1)의 돌연변이에 의해 발생하는 근세관근육병은 출생시 근긴장저하와 호흡곤란, 운동발달지연 등을 보이는 심각한 질환이며 이 질환 역시 근섬유의 중앙에 단일 핵이 위치해 있는 것이 중요한 조직 특징이다. 이 질환에서는 중심핵근육병에 비해 근섬유가 매우 작고 둥근 모양인데 이러한 모양이 발생 과정 중에 있는 근세관(myotubule)과 유사하다는 점 때문에 질환의 이름이 붙여졌다. 또한 이 질환의 NADH-TR염색에서는 근섬유의 가장자리에 염색이 결핍되는 주변달무리(peripheral halo)가 관찰되는 것이 특징이다(Fig. 5-F) [16].
(2) 근디스트로피
근디스트로피에서도 일반적으로 내핵을 가진 근섬유의 빈도가 증가한다. 그중에서도 근긴장근디스트로피에서 내핵의 빈도가 특히 증가하며 세로단면에서는 핵사슬도 흔히 관찰할 수 있다. 근긴장디스트로피 중 출생 직후부터 근긴장저하와 호흡곤란 등의 증상이 나타나는 선천근긴장디스트로피의 조직 소견은 매우 작은 근섬유의 중앙에 내핵 또는 중심핵이 관찰되므로 앞서 기술한 근세관 근육병과 매우 유사하고 출생시 보이는 임상 증상 또한 매우 유사하므로 감별진단에 유의할 필요가 있다[17]. 근긴장디스트로피는 근세관근육병과 달리 보통염색체 우성유전을 하며 모계유전일 경우 선천형의 발생 가능성이 높으므로 가족력을 확인하는 것이 진단에 도움이 될 수 있다. 최근에는 출생시 선천근긴장근디스트로피가 의심되고 가족력이 있는 경우 DMPK 유전자의 CTG반복염기서열 확장(CTG repeat expansion)을 확인하는 유전자검사를 먼저 하게 된다.
7. 사립체의 변화
1) 불균일적색근섬유(ragged-red fiber)
근육병에서는 근섬유 내에 존재하는 사립체의 크기와 모양이 변화할 수 있다. 사립체의 변화는 고모리-트라이크롬염색에서 쉽게 관찰할 수 있으며 SDH와 COX염색에서도 잘 구분된다. 가장 대표적인 이상은 불균일적색근섬유(ragged-red fiber)이다(Fig. 6-A). 이것은 비정상적인 사립체가 증가함에 따라 고모리-트라이크롬 염색에서 세포질이 붉은 빛을 띠고 너덜너덜해진 모양을 보이는 것을 비유하여 붙여진 이름이다[18]. 불균일적색근섬유는 SDH염색에서 정상 근섬유에 비해 짙게 염색되므로 불균일청색근섬유(ragged-blue fiber)라고 부른다(Fig. 6-B). 한편, COX염색의 이상 유무는 사립체근육병에 속하는 각 질환에 따라 다양하게 나타날 수 있다. 불균일적색근섬유는 사립체근육병에서 매우 빈번하게 나타나지만 질환과 관계없이 고령 환자의 근육조직에서도 가끔 관찰할 수 있으므로 이를 관찰하였을 때 해석에 유의할 필요가 있다.

Mitochondrial changes and related findings. (A) Ragged red fibers have red-colored sarcoplasm because abnormal mitochondria are highlighted in modified Gomori-Trichrome (mGT) stain (chronic progressive external ophthalmoplegia [CPEO], mGT, ×200). (B) More bluish colored fibers are ragged-blue fibers, which are corresponding to ragged red fibers (CPEO, succinate dehydrogenase stain, ×200). (C) Many fibers indicated by asterisks are deficient for cytochrome c oxidase (COX) stain (CPEO, COX, ×200). (D) The peripheries of fibers are darkly stained in lobulated fibers (chronic myopathy, nicotinamide dehydrogenase tetrazolium-reductase stain, ×200).
(1) 사립체근육병(mitochondrial myopathy)
사립체근육병은 사립체의 대사이상에 의해 발생하는 유전근육병을 통칭한다. 일부에서는 핵유전자의 돌연변이가 사립체질환의 원인이 되기도 하나 독립적으로 존재하는 사립체유전자의 돌연변이에 의해 발생하는 경우가 많다. 대표적인 질환이 만성진행외안근마비(chronic progressive external ophthalmoplegia, CPEO), 머프(myoclonic epilepsy with ragged-red fibers, MERRF) 그리고 멜라스(mitochondrial myopathy, encephalopathy, lactic acidosis and stroke-like episodes, MELAS)이다. 이들 질환에서는 근육조직에서 공통적으로 불균일적색근섬유가 나타나는데 CPEO와 MERRF에서는 불균일적색근섬유의 COX염색이 결핍되고, MELAS에서는 정상으로 염색되기도 하고 결핍되기도 한다[18]. 이를 확인하기 위해서 SDH와 COX염색을 동시에 시행하기도 한다. 또한, CPEO와 MERRF에서는 불균일적색근섬유가 아닌 근섬유에서도 COX 염색의 결핍이 광범위하게 나타난다(Fig. 6-C, asterisks). 따라서, 불균일적색근섬유가 빈번하게 나타나는 경우 사립체근육병을 고려할 수 있으며 SDH와 COX의 염색 양상을 함께 고려하여 사립체 근육병 각각을 감별진단할 수 있다.
(2) 약물유발근육병
Human immunodeficiency virus (HIV) 감염의 치료제로 사용되는 zidovudine이나 B형 간염 치료제로 개발된 바 있는 clevudine과 같은 약제는 사립체를 손상시키므로 이 약제들과 연관된 근육병의 조직 소견에서는 불균일적색근섬유를 쉽게 관찰할 수 있다[19]. 병력에서 이러한 약물복용력이 있다면 근육조직에서 불균일 적색근섬유를 관찰할 가능성이 높다.
2) 소엽근섬유(lobulated fiber)
소엽근섬유(lobulated fiber)는 NADH-TR염색에서 근섬유의 가장자리가 짙게 염색되면서 마치 소엽(lobule) 모양을 보이는 것을 일컫는다(Fig. 6-D). 이는 주로 근섬유 가장자리에 사립체가 축적되면서 생기는 비특이적인 현상이다[4]. 소엽근섬유(lobulated fiber)가 특징적으로 나타나는 질환으로 칼페인3 (calpain-3) 단백질 결핍에 의한 사지대근디스트로피 2A형이 대표적이지만[7] 다양한 근육병이 만성적으로 진행할 때 소엽근섬유(lobulated fiber)를 자주 관찰할 수 있다.
8. 근원섬유(myofibril)의 이상
1) 중심핵심(central cores)
근원섬유는 근섬유 내에서 규칙적인 망조직(network)을 형성하고 있는데 다양한 근육병에서 망구조의 근원섬유조직이 다양한 형태로 손상되거나 붕괴될 수 있다. 이러한 소견은 NADH-TR염색과 같은 산화효소염색에 의해 가장 잘 드러난다. 대표적으로 중심핵심(central core)은 근섬유 내부에 산화효소염색이 결핍된 둥근 모양의 영역을 일컫는다(Fig. 7-A). 중심핵심을 전자현미경으로 관찰하면 해당 영역에서 근원섬유의 배열이 어긋나 있는 것을 관찰할 수 있으며 근원섬유 배열 사이에 존재하는 사립체 역시 소실되어 있다[20]. 중심핵심이 가장 잘 관찰되는 질환이 중심핵심병(central core disease)이다. 선천근육병 중 하나에 속하며 이 질환의 대부분이 RYR1 유전자의 돌연변이에 의해 발생한다. 중심핵심병의 근육 조직에서는 관찰되는 거의 모든 근섬유가 내부에 중심핵심을 가지고 있다(Fig. 7-A). 따라서, 임상적으로 선천근육병이 의심되는 환자의 근육조직 소견에서 중심핵심이 높은 빈도로 관찰된다면 일차적으로 RYR1 유전자를 검사해 볼 수 있다[20].
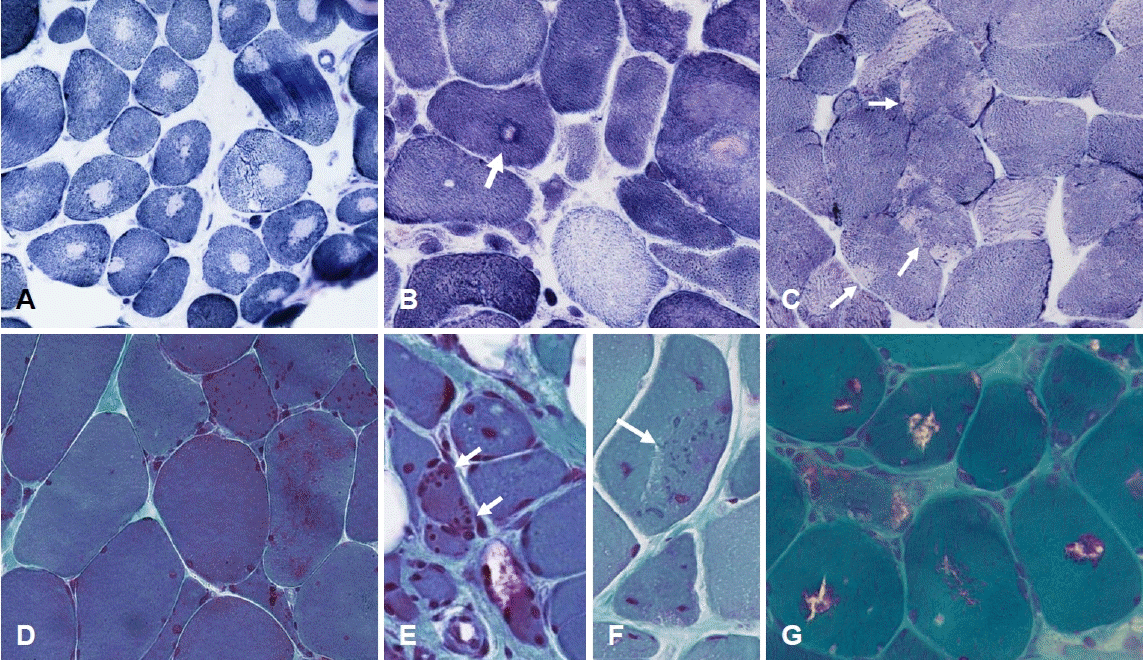
Myofibrillar changes and abnormal inclusions. (A) Round-shaped zones in the center of fibers are deficient for nicotinamide dehydrogenase tetrazolium-reductase (NADH-TR) stain, which is called as ‘central core’ (central core disease, NADH-TR, ×200). (B) A core indicated by an arrow is surrounded by darkly stained intermediate zone. This fiber is called as ‘target fiber’ (neurogenic change, NADH-TR, ×200). (C) In several muscle fibers, sarcoplasm is partially defective, which is called as ‘moth-eaten appearance’ (arrows; inflammatory myopathy, NADH-TR, ×200). (D) Nemaline bodies are appeared as red-colored, dot-like shape, and scattered in sarcoplasm (nemaline myopathy, modified Gomori-Trichrome [mGT], ×200). (E) Compact, red-colored inclusions (cytoplasmic bodies) are distributed in a muscle fiber (arrows) (myofibrillar myopathy, mGT, ×200). (F) Green-colored, amorphous inclusions (spheroid bodies) are shown (arrow; myofibrillar myopathy, mGT, ×200). (G) Vacuoles with red-colored rims (rimmed vacuoles) are present in scattered fibers (GNE myopathy, mGT, ×200).
2) 표적/표적모양 근섬유(target/targetoid fiber)
표적(target) 또는 표적모양 근섬유(targetoid fiber)는 대체로 중심핵심과 유사하게 보이지만 산화효소염색이 결핍된 영역의 가장자리에 염색이 오히려 짙은 테두리 영역이 있는 것이 차이점이며 이 모양이 표적(target)과 유사하여 이름 붙여졌다(Fig. 7-B, arrow). 근육병보다는 만성적인 신경병에 의해 나타난 변화로 해석한다.
3) 좀먹은 모양(moth-eaten appearance)
근원섬유의 배열이 부분적으로 손상되어 첩포 형태의 염색 소실이 나타나는 양상을 좀먹은 모양(moth-eaten appearance)이라고 한다(Fig. 7-C, arrows). 이것은 염증근육병에서 가장 흔히 관찰되지만 대체로 비특이적인 변화이다. 다른 종류의 근육병에서도 관찰할 수 있으며 류마티스다발근육통(polymyalgia rheumatica)과 같은 근육병 이외의 질환에서도 관찰할 수 있다.
9. 근섬유내 비정상 구조물
근섬유의 세포질은 대체로 균질하며 핵 이외의 근섬유 내부에 세포소기관은 광학현미경을 통해서는 거의 관찰되지 않는다. 균질한 세포질은 근원섬유의 규칙적인 배열이 유지되는 것을 시사하므로 세포질 내에 비정상구조물이 관찰되는 것은 대개 병적인 변화가 있음을 의미한다. 비정상구조물은 종류에 따라 특정 질환에서 두드러지게 관찰되는 경향을 보이기도 하나 많은 경우 비특이적이며 따라서 이러한 변화들을 관찰하였을 때 가능성이 있는 여러 질환들에 대한 감별진단 또한 중요하다.
1) 네말린체(nemaline bodies)
네말린체는 고모리-트라이크롬염색에서 관찰되는 대표적인 근섬유내 비정상구조물이다. 붉은 색의 작은 점이나 작은 막대 모양으로 보이며 하나의 근섬유 내에 다수로 존재한다(Fig. 7-D). 전자현미경에서 네말린체는 Z-disk와 유사한 높은 전자밀도를 보이므로 보통 Z-disk에서 유래한 것으로 생각한다.
(1) 네말린근육병
네말린체가 관찰되는 대표적인 질환은 네말린근육병(nemaline myopathy)이다. 다수의 근섬유가 내부에 네말린체를 보유하고 있으며 이들은 근섬유막 아래에 군집해 있거나 근섬유 내에서 불규칙적으로 흩어져 관찰된다. 네말린근육병의 조직 소견은 고모리트라이크롬에서 네말린체가 관찰되는 것 외에 크기가 작고 둥근 모양의 근섬유가 주로 관찰되며 특히 네말린체를 가지고 있는 근섬유는 NADH-TR염색이 불균일하다. ATPase염색에서는 1형의 근섬유가 수적으로 우세하며 2형에 비해 상대적으로 크기가 작다.
네말린근육병은 선천근육병 중 가장 유병률이 높으며, 현재까지 모두 9개의 원인유전자가 보고된 바 있다[21]. 원인유전자에 따라 다양한 임상형을 보이지만, 가장 전형적인 임상형은 유아기에 운동 발달이 지연되며 사지의 근력저하가 안면근의 쇠약과 외안근마비와 동반하여 나타난다[6]. 임상적으로 선천근육병이 의심되는 환자의 조직 소견에서 네말린체가 두드러지게 관찰된다면 네말린근육병을 진단할 수 있다.
네말린근육병과 달리 늦은 나이에 발생하여 아급성 경과로 진행하고 사지 먼쪽근육의 쇠약과 호흡곤란, 삼킴곤란을 동반하는 산발늦은발병네말린근육병(sporadic late onset nemaline myopathy, SLONM)이 있어 감별이 필요하다. 주로 의미미결정단세포군감마글로불린병증(monoclonal gammopathy of undetermined significance, MGUS)이나 HIV 감염과 연관된다[22]. 조직 소견은 네말린근육병과 마찬가지로 고모리-트라이크롬염색에서 네말린체가 다수 관찰되는 것이 특징이다.
네말린체가 관찰되는 또 다른 질환으로 중심부막대(core-rod)근육병이 있다. 선천근육병 중의 하나로 매우 드문 질환이지만, NADH-TR염색에서는 중심핵심이 그리고 고모리-트라이크롬염색에서는 네말린체가 동시에 관찰되는 조직 소견이 특징이다[23]. 발병 연령은 소아기부터 성인에 이르기까지 다양하며 임상적으로는 주로 먼쪽근육의 쇠약을 보인다. 원인유전자로는 RYR1, NEB, KBTBD13, TPM2가 보고된 바 있는데 이들은 중심핵심병과 네말린근육병의 원인유전자와 겹친다.
2) 세포질체(cytoplasmic body)와 구형체(spheroid body)
세포질체(cytoplasmic body)는 네말린체와 마찬가지로 고모리-트라이크롬염색에서 붉은색으로 염색되지만 이에 비해 크기가 크고 단독으로 존재하는 경우도 많다(Fig. 7-E, arrows). 구형체(spheroid body)는 고모리-트라이크롬염색에서 짙은 녹색으로 보이며 네말린체나 세포질체에 비해 크기가 크다(Fig. 7-F, arrow). 두 구조물 모두 비특이적 소견으로 특정 질환을 시사하지는 않으며 다양한 근육병 또는 신경병에서도 관찰할 수 있다. 특히 구형체는 표적/표적모양 근섬유(target/targetoid fiber)의 중앙에서 관찰되는 경우가 많다.
(1) 근원섬유근육병(myofibrillar myopathy)
근원섬유근육병은 세포질체, 구형체와 같은 다양한 세포질내 비정상 구조물들의 축적을 특징적인 조직 소견으로 보이는 질환들을 일컫는다[24]. 이러한 질환들은 공통적으로 단백질의 응집을 수반하는데 대표적인 응집 단백질이 데스민(desmin)이다. 분자유전학적 관점에서 근원섬유근육병은 주로 Z-disk와 연관된 단백질의 이상을 초래하는 유전자들이 원인이 된다. DES (desmin 유전자), CRYAB (αB-crystallin 유전자), MYOT (myotilin 유전자), FLNC (filamin C 유전자)와 FHL1 (FHL1 유전자) 등이 알려져 있다[24]. 조직 소견으로 고모리-트라이크롬염색에서 세포질체나 구형체가 다수 관찰되며 이 외에도 테두리를 가지거나 가지지 않는 다양한 형태의 공포가 관찰된다. 또한, 헤마톡실린-에오신 또는 고모리-트라이크롬염색에서 세포질 내에 주변보다 더 짙게 염색되는 영역이 흔히 관찰된다. 생검한 근육조직에서 비특이적 근육병 변화와 더불어 이와 같은 소견들이 두드러지게 관찰된다면 근원섬유근육병을 의심해 볼 수 있다.
3) 테두리공포(rimmed vacuoles)
테두리공포는 고모리-트라이크롬염색에서 공포(vacuole)의 내부에 염색이 소실되며 가장자리에 붉은 테두리가 있는 형태이다(Fig. 7-G). 가장자리의 붉은 테두리는 전자현미경에서 자가포식공포(autophagic vacuole)가 무리지어 있는 형태로 관찰되므로 자가포식작용과 연관된 병리기전이 있는 것으로 생각한다. 테두리공포는 비교적 다양한 근육병에서 관찰할 수 있으므로 임상 증상 등을 고려하여 진단에 유의할 필요가 있다.
(1) GNE근육병
GNE근육병은 사지의 먼쪽근육에서 근쇠약과 위축이 나타나는 원위근육병 중의 하나로 GNE 유전자의 돌연변이에 의해 발생하는 보통염색체 열성질환이다. GNE근육병의 가장 중요한 병리 소견은 테두리공포이다. 비정형적인 임상형도 일부에서 보고되고 있으나 대부분의 환자에서는 앞정강근의 쇠약과 위축이 가장 먼저 나타나므로 초기에 발처짐을 보이는 것이 특징이다[25]. 이에 비해, 원위근육병에 속하는 또 다른 질환인 미요시근육병은 장딴지근육의 위축이 먼저 나타나 발바닥쪽굽힘(plantar flexion)이 초기에 약화되므로 임상 증상을 통한 구별이 가능하다. 이러한 임상적 특징과 연관하여 근생검 역시 앞정강근에서 시행하였을 때 전형적인 테두리공포를 잘 관찰할 수 있다. 상대적으로 보존되어 있는 넓적다리네갈래근이나 위팔두갈래근에서 근생검을 시행하는 경우 특징적인 테두리공포를 관찰하지 못할 수 있으므로 근생검 대상 근육을 선택할 때 유의할 필요가 있다. GNE근육병은 먼쪽근육의 쇠약을 보이는 임상 증상으로 인해 테두리공포원위근육병(distal myopathy with rimmed vacuoles), 조직 소견이 봉입체근염과 유사하여 유전 봉입체근육병(hereditary inclusion body myopathy) 그리고 질환의 후기에 이르기까지 넓적다리네갈래근이 보존되는 특징에 근거하여 넓적다리네갈래근보존근육병(quadriceps sparing myopathy) 이라고 불리기도 하였으나 현재는 GNE근육병으로 통칭하고 있다.
(2) 봉입체근염
봉입체근염은 앞서 기술한 특발염증근육병 중 하나이다. 조직 소견에서는 특징적인 테두리공포와 함께 근육속막의 염증세포 침윤이 관찰되는데 염증세포가 비괴사근섬유를 둘러싸거나 침투하는 것이 또한 특징이다[12]. 임상적으로 봉입체근염은 비교적 늦은 나이인 55세 이상에서 발병하며 앞서 기술한 바와 같이 초기에 손가락굽힘근(finger flexors)과 넓적다리네갈래근(quadriceps)의 쇠약이 먼저 나타나는 것이 특징이다. 테두리공포가 유사하게 관찰되는 GNE근육병 환자에서 넓적다리네갈래근이 상대적으로 보존되는 것과는 대조적이라고 할 수 있다.
(3) 눈인두근디스트로피(oculopharyngeal muscular dystrophy)/눈인두원위근육병(oculopharyngeal distal myopathy)
두 질환은 눈꺼풀처짐, 외안근의 마비, 삼킴곤란 증상을 공통적으로 보이며 눈인두근디스트로피의 경우 사지의 몸쪽근력저하가 두드러지고 눈인두원위근육병은 먼쪽 근육이 먼저 침범되는 것이 특징이다. 두 질환 모두 근육조직의 고모리-트라이크롬염색에서 테두리공포가 특징적으로 관찰된다. 두 질환은 임상 증상과 조직 소견이 매우 유사하지만 유전적으로는 서로 구별된다. 눈인두근디스트로피는 PABPN1 유전자에서 CGG 염기서열반복의 확장이 원인이 되며[26] 눈인두원위근육병은 최근 LRP12, NOTCH2NLC, GIPC1 등이 원인유전자로 보고되고 있다[27]. 특징적인 임상양상과 더불어 테두리공포를 관찰한다면 이들 질환을 의심할 수 있다.
4) 세포내 당원축적 및 지방축적
골격근의 에너지 대사에 가장 중요한 것은 당원분해와 지방분해이다. 따라서, 이들 대사과정에서 수반되는 효소가 결핍되는 경우 대사근육병(metabolic myopathy)이 발생하게 된다.
먼저 당원분해와 관련하여 근육병을 유발하는 효소는 매우 다양한데, 이 중 용해소체효소(lysosomal enzyme)인 산성알파포도당화물분해효소(acid-alpha-glucosidase)가 가장 대표적이며 폼페병(Pompe disease)의 원인이 된다. 폼페병은 발병 연령에 따라 영아형(infantile form)과 경도 임상형(mild form)으로 나누는데, 영아형은 출생시 근긴장저하, 근력저하 및 심장비대와 간비대를 동반하며, 소아와 성인에서 발병하는 경도 임상형의 경우 사지의 근력 저하와 함께 호흡근의 약화가 동반되는 것이 특징이다. 조직 소견으로 헤마톡실린-에오신염색에서 다수의 공포가 관찰되며(Fig. 8-A), 산성인산염분해효소(acid phosphatase)염색에서 높은 활성도를 보이고, PAS염색에서 매우 짙게 염색되는 당원침착(glycogen deposition)을 확인할 수 있다(Fig. 8-B) [28]. 하지만 경도 임상형에서는 공포가 두드러지게 관찰되지 않을 수도 있으므로 판단에 유의해야 한다. 뿐만 아니라, 폼페병은 효소대체요법을 통해 치료가 가능해진 질환이므로 근육병의 진단에서 항상 염두에 두어야 한다.
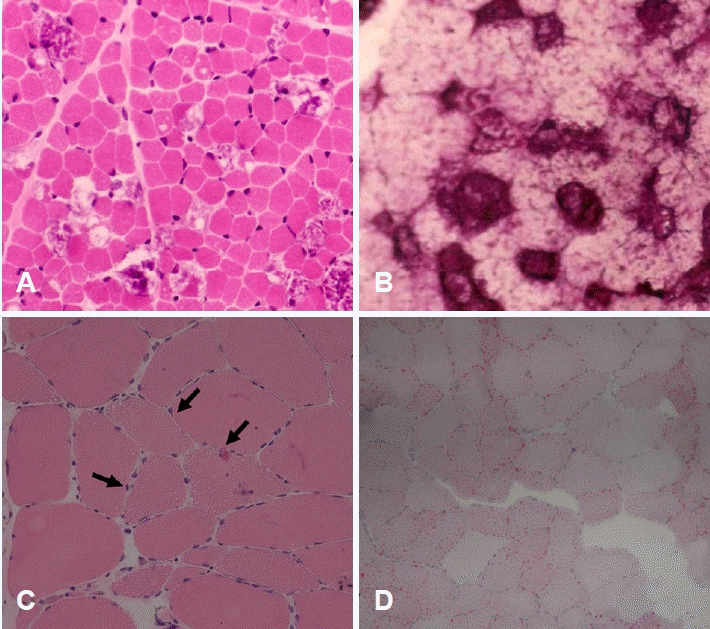
Metabolic myopathies. (A) Many fibers have vacuoles inside, which are positive for PAS (B) (pompe disease; A: hematoxylin and eosin [H&E], ×200; B: PAS, ×200). (C) Multiple tiny droplets are observed in scattered fibers (arrows) (neutral lipid storage disease, H&E, ×200). (D) Lipid accumulation is highlighted in oil red O stain (neutral lipid storage disease, oil red O, ×100).
지방대사에 수반되는 다양한 효소의 결핍은 지질축적병(lipid storage disease)을 야기하는데 조직 소견에서 다수의 공포가 관찰되며(Fig. 8-C, arrows) oil red O염색에서 공포에 축적된 지질성분을 확인할 수 있다(Fig. 8-D) [18]. 카니틴결핍병(carnitine deficiency)과 PNPLA2 유전자 돌연변이에 의해 지방트라이글리세라이드지방 분해효소(adipose triglyceride lipase, ATGL) 결핍이 초래되어 발생하는 중성지질축적병(neutral lipid storage disease)이 이러한 조직 소견을 볼 수 있는 대표적인 질환이다.
고 찰
근육은 해부학적 접근이 용이하여 생검이 어렵지 않으며 생검 후에도 기능적인 결함을 남기지 않으므로 근육병의 진단을 위해 근생검을 비교적 쉽게 결정할 수 있다. 그러나 침습적인 처치를 필요로 하며 진단과정이 불충분한 경우 근생검을 하더라도 유용한 정보를 얻지 못하는 경우가 있으므로 근생검을 결정하기에 앞서 신중해야 한다. 살펴본 바와 같이 근생검을 통해 얻을 수 있는 조직 소견과 그에 따른 정보는 매우 광범위하므로 정상적인 근육조직과 병적인 상황에서 나타나는 조직 소견에 대한 깊은 이해가 필요하다. 또한 비정상 조직 소견은 비특이적인 변화인 경우가 많으므로 각각의 병리 소견이 가지는 의미를 해석하는 데 있어 주어진 병력과 신체진찰을 통해 얻은 임상정보를 잘 활용해야 한다.
다양한 근육질환을 진단하는 데 있어 근생검이 가지는 고유의 역할은 반드시 존재하므로 이를 간과하지 않아야 하며 한편 그 역할이 과장되어서도 안 된다. 근육질환을 진단하는 여러 가지 도구 중 하나로써 근병리를 잘 이해하고 이러한 이해를 바탕으로 근생검을 잘 활용한다면 다양한 근육질환을 진단하는 데 많은 도움이 될 것이다.