고해상도혈관벽MRI에서 확인된 교모세포종의 혈관침범에 의한 뇌경색
Cerebral Infarction Secondary to Vascular Infiltration of Glioblastoma Confirmed in High-Resolution Vessel Wall MRI
Article information
Trans Abstract
Acute cerebral infarction secondary to glioblastoma is rarely reported, and its mechanism is still controversial. Vascular infiltration of malignant cell, direct mass effect and local procoagulant effect were considered as main pathophysiology. We report a case of glioblastoma-related cerebral infarction documented by high resolution vessel wall magnetic resonance imaging, which reveals concentric enhancement of arterial wall and intraluminal thrombus without direct compression. These findings suggest tumor cell infiltration of intracranial vessels is one of the important mechanisms of glioblastoma-related cerebral infarction.
교모세포종(glioblastoma)은 World Health Organization 분류 4등급에 해당하는 악성 교세포종으로, 가장 흔한 뇌의 원발 악성 종양이다. 교모세포종의 예후는 매우 불량하며, 경련, 급성 뇌출혈, 급성 뇌경색 등 이차적인 신경계합병증을 동반할 수 있다. 교모세포종에 의해 이차적으로 급성 뇌경색이 발생하는 경우는 국내에서는 아직 보고된 바 없으며, 해외에서 수차례 보고되었지만 그 자세한 기전에 대해서는 아직 논란의 여지가 있다. 저자들은 좌측 중대뇌동맥영역의 뇌경색이 발생한 교모세포종 환자를 대상으로 고해 상도혈관벽 magnetic resonance imaging (MRI)을 촬영한 증례를 경험하여 이를 국내외 처음으로 보고하면서, 뇌경색의 발생 기전에 대해 고찰해 보고자 한다.
증 례
85세 여자가 2주 전부터 점점 진행하는 언어장애와 우측 위약감으로 응급실에 왔다. 환자는 4개월 전 뇌 MRI에서 좌측 전두엽의 종괴가 관찰되어 개두술을 통한 절제를 받았고, 조직검사에서 교모세포종이 진단되어 추가 방사선 치료 후에 추적 관찰하던 중이었다. 1개월 전 종양 진행이 확인되어 테모졸로마이드(temozolomide) 항암 치료를 시작하였다. 환자는 뇌종양으로 인해 Medical Research Council (MRC) 4등급의 우측 마비와 중등도의 운동실어증(motor aphasia)이 있었는데, 2주 전부터 우측 마비가 MRC 3등급으로 악화되어 걷지 못하게 되었다. 실어증은 3일 전부터 전혀 지시에 따르지 못하고, 간단한 대답도 할 수 없는 정도로 악화되었으며, 1일 전부터는 삼킴곤란이 발생하였다. 환자는 고혈압, 당뇨, 고지혈증 및 심장질환의 과거력이 없었으며 음주와 흡연도 하지 않았다.
응급의료센터에서 측정한 혈압은 127/87 mmHg, 맥박수는 147회/분, 호흡수는 20회/분, 체온은 38.5℃였고, 산소포화도는 94%였으며, 양측 폐하부에서 수포음이 들렸다. 신경계진찰에서 의식수준은 기면 상태였고, 완전실어증 소견과 함께 우측 상지에서 MRC 1등급, 하지에서 4등급의 편마비가 관찰되었다.
심전도는 동성빈맥(sinus tachycardia) 소견이었다. 뇌확산강조영상(diffusion-weighted image, DWI)에서 새로 발생한 좌측 중대뇌동맥 영역의 다초점 병변이 확인되었고 MR혈관조영술에서는 4개월 전과 비교하여 새롭게 발생한 좌측 중대뇌동맥의 심한 협착이 있었다(Fig. 1). 환자의 증상에는 뇌경색보다는 종양의 뇌실질 침범 및 부종이 기여하는 바가 클 것으로 생각되며, 완치가 어려운 단계의 교모세포종임을 고려하여 적극적인 재관류 치료는 시행하지 않았다. 폐 computed tomography에서 양측 폐하부에 흡인폐렴, 양측 폐동맥에 폐혈전색전증(pulmonary thromboembolism)이 확인되었고 C-반응단백은 16.41 mg/dL, D-이합체(D-dimer)는 10.43 μg/mL로 확인되었다. 환자는 달테파린(dalteparin) 200 IU/kg 1일 1회, 세프트리악손(ceftriaxone) 2 g 1일 1회 사용하면서 뇌졸중집중치료실로 입원하였다.
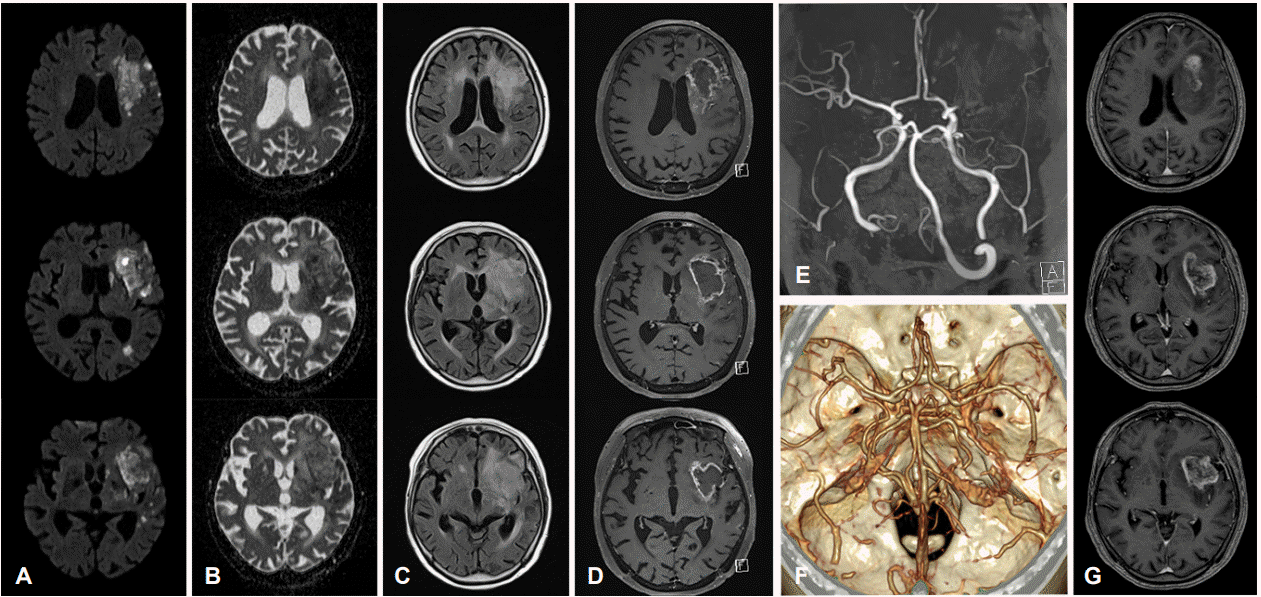
MRI at the time of admission, compared to previous MRI and CT angiography from 4 months ago. (A-E) Day of admission. (F, G) Four months ago. (A) Multiple scattered diffusion-restricted lesions were observed in the left MCA territory with (B) heterogeneous apparent diffusion coefficient (ADC) values. Rim-enhancing mass overleaping the infarction with vasogenic edema and prominent leptomeningeal vessels were observed from (C) fluid attenuated inversion recovery (FLAIR) image and (D) gadolinium-enhanced T1-weighted MRI. (E) MR and (F) CT angiography demonstrate newly developed left MCA occlusion. (G) During the 4 months interval, there was no significant size reduction of the mass. MRI; magnetic resonance imaging, CT; computed tomography, MCA; middle cerebral artery.
입원 3일 후 시행한 고해상도혈관벽MRI에서 1개월 전에 비해 크기가 늘어난 교모세포종이 좌측 실비우스열 위쪽에 위치하면서 중대뇌동맥 상부가지(superior branch)를 둘러싸고 있었고, 중대뇌동맥 M1분절에는 T1강조영상에서 동신호-고신호강도(iso to hyperintensity)를 보이고 T1조영증강영상에서 균일하게 조영증강되면서, T2강조영상에서 저신호강도를 보이는 초기 아급성단계(early subacute stage)의 혈관내 혈전(intraluminal thrombus)이 관찰되었다(Fig. 2). 환자의 기저 수행도(performance status) 및 기대여명을 고려하여 적극적인 혈전용해 또는 감압 치료는 시행하지 않기로 하였고 보호자들은 기관삽관 및 심폐소생술을 시행하지 않는 연명의료중단에 동의하였다. 입원 5일 후 환자는 38.0℃ 이상의 고열이 지속되면서 수축기혈압 80 mmHg 이하로 감소하고, 동맥혈가스검사에서는 젖산(lactic acid)이 10.0 mmol/L까지 상승하였다. 폐렴 악화에 의한 패혈쇼크(septic shock)로 진단하였고, 입원 6일째 되는 날 환자는 사망하였다.

High resolution vessel wall magnetic resonance imaging. (A, B) M1 occlusion by intraluminal thrombus (red arrowheads) is observed in sagittal images. Note that there is no significant mass effect of tumor to compress left MCA. (C, D) Concentric vessel wall enhancement of MCA superior branch (white arrowheads) adjacent to the glioblastoma is observed in sagittal images, which is compatible with vasculitis due to tumor cell infiltration. These findings suggest vasculitis of the left MCA is a main cause of thrombogenesis and acute cerebral infarctions. (E, F) Two axial T1 enhanced images at the bottom of the figure demonstrate sagittal section lines of (A-D). MCA; middle cerebral artery.
고 찰
뇌종양 환자에서 급성 뇌경색이 발생하는 경우는 대부분 치료와 연관된 것으로 알려져 있다. 이전 연구에서 68명의 환자들을 대상으로 수행한 후향 조사에 따르면 가장 흔한 것은 수술 후 뇌경색으로 약 절반 정도를 차지하고, 그 다음으로는 방사선 치료 후 발생한 뇌경색이 25% 정도로 흔하게 보고된다[1]. 방사선 치료 후 발생하는 뇌경색의 경우 치료 후 2년 이상 경과한 뒤에 발생하는 것이 일반적이고 50 Gy 이상 조사받은 경우 위험도가 올라가며, 방사선에 의한 혈관병증(radiat ion vasculopathy) 때문에 동맥경화와 소혈관질환이 진행하는 것을 원인으로 생각한다. 또한 최근에는 교모세포종에서 베바시주맘(bevacizumab) 등 항혈관생성 치료를 적용하는 경우가 많아지면서 그 합병증으로 뇌경색이 발생하는 경우가 있다[2]. 다만 본 증례의 경우 수술 시점은 뇌경색 발생으로부터 4개월 전이고, 방사선 치료 시점은 1개월 전이며, 항혈관생성 치료를 받은 적도 없어서 치료와 연관된 뇌경색으로 보기는 어려웠다.
교모세포종 환자에서 치료와 연관되지 않는 뇌경색이 발생하는 경우는 지금까지 국외에서 몇 차례의 증례가 발표되어 있으며, 모든 증례에서 종양과 뇌경색이 동일 대뇌반구(hemisphere)에 발생하였다[2-10]. 지금까지의 보고에서 언급되는 뇌경색 발생의 주요 기전은 종양세포의 혈관 침윤, 직접적인 혈관압박으로 인한 폐색, 국소 응혈촉진효과(procoagulant effect)에 따른 혈전생성의 세 가지로 요약할 수 있다. 증례보고와 함께 조직병리 소견을 제시한 문헌들은 종양과 동측 대뇌반구에 위치한 혈관들에 광범위한 종양세포 침윤이 관찰된다는 점을 근거로 종양세포의 혈관 침범으로 인해 이차적인 폐색이나 혈전생성(thrombosis)이 유발되어 뇌경색이 발생한다고 주장하였다[3-6]. 한편 종양의 종괴효과(mass effect)가 심한 경우 직접적인 혈관압박이 뇌허혈의 원인이 되었을 것으로 생각하거나[2], 교모세포종이 조직인자(tissue factor)를 잘 발현한다는 점을 고려하여 국소적인 응혈촉진효과(procoagulant effect)가 뇌경색 발생에 기여할 것으로 추정한 경우도 있었다[7].
본 증례에서는 고해상도혈관벽MRI에서 종괴의 위치가 주로 실비우스열(Sylvian fissure) 상방부에 치우쳐 있었고 실비우스열 아래쪽으로는 좌측 해마곁이랑(parahippocampal gyrus)만 부분적으로 침범하고 있었다. 중대뇌동맥의 M1분절 전체가 초기 아급성 단계(early subacute stage)의 혈전으로 폐색되어 있었고(Fig. 2-A, B), 중대뇌동맥 분기부와 상부가지가 종괴와 맞닿아 있었으나 종양 자체 또는 부종이 혈관을 직접적으로 둘러싸거나 압박할 정도의 종괴효과(mass effect)를 나타내고 있지는 않았다. 종양과 인접하여 주행하는 중대뇌동맥 상부가지는 T1조영증강영상에서 혈관벽이 동심성(concentric)으로 조영증강되어 종양세포의 혈관벽 침윤에 따른 소견으로 판단하였다(Fig. 2-C, D). 또한, 우뇌반구에 비해 좌뇌반구의 연수막혈관(leptomeningeal vessel)들이 뚜렷하게 조영증강되어, 교모세포종과 동측 대뇌반구의 연수막혈관들을 침범하는 종양세포의 파종이 있음을 시사하였다(Fig. 1-D). 상기 소견들을 종합하여 볼 때 좌뇌반구의 뇌혈관에 광범위한 종양세포 침윤이 발생하고, 이로 인한 이차적인 혈전생성으로 근위부 중대 뇌동맥이 폐색되면서 중대뇌동맥 영역의 경계부(borderzone)와 관통동맥(perforating artery) 영역에 뇌경색이 발생하였을 가능성이 있을 것으로 생각하였다. 또한, 앞서 언급한 교모세포종의 국소 응혈촉진효과 역시 혈관내 혈전(intraluminal thrombus) 생성에 기여하였을 수 있겠고, 병원 방문시 C-반응성단백 및 D-이합체 상승을 보였던 점을 고려하면 전신 염증이나 종양에 의한 혈전생성의 가능성도 배제할 수 없었다. 반면, 본 증례에서는 종양의 종괴효과로 인한 직접적인 뇌혈관 압박은 뇌경색 발생과 큰 관련이 없을 것으로 판단하였다.
한편, 종양세포의 혈관벽 침윤을 시사하는 영상근거는 M2분절 이하의 뇌혈관들에 국한되어 있는 것에 비해, 뇌경색 발생의 직접적인 원인으로 추정되는 혈전으로 인한 혈관 폐색은 M1분절에서만 관찰된다는 점은 한 가지 의문점으로 남는다. 이에 대해 병리 소견을 함께 제시한 이전 문헌보고들을 참고하면, 피질내 혈관(intracortical vessel) 또는 연수막혈관(leptomeningeal vessel)과 같은 원위부 혈관들에서만 종양세포 침윤을 확인한 경우에도 영상 소견상으로는 M1, M2분절이나 기저동맥과 같은 근위부 혈관의 협착 또는 폐색이 동반된 경우가 있었고, 이러한 경우 다른 뚜렷한 이유가 없다면 근위부 혈관 협착도 동일하게 종양세포에 의한 혈관벽 침윤이 원인일 것으로 생각하였다[3,5]. 또한, 한 증례보고에서는 중대뇌동맥 M1분절의 혈관내 근육층에 교모세포종의 침범이 있으면서, 혈관 내막(intima)과 근육층 사이에 혈종(hematoma)이 있음을 확인함으로써 종양세포의 중대뇌동맥 침범으로 인한 박리(dissection) 및 벽내혈종(intramural hematoma)을 중대뇌동맥 협착의 원인으로 제시하였다[6]. 이를 참고할 때, 본 증례 역시 좌측 M1분절과 M2분절 이하를 포함한 중대뇌동맥 전반에 걸친 종양세포 침윤이 있어 혈전이 발생하였을 가능성이 있다고 생각된다. 다만 M1분절 전체가 혈전으로 폐색되어 보이는 관계로, 영상 소견만으로는 M1분절의 종양세포 침윤 소견이나 박리 여부 등을 직접적으로 판단하기에는 어려움이 있었다.
본 증례는 교모세포종에 의해 이차적으로 발생한 뇌경색으로는 국내 첫 보고이며, 이러한 환자에서 고해상도혈관벽MRI를 촬영하였다는 점에서는 국내외 첫 보고이다. 특히 그동안 명확하게 밝혀지지 않았던 교모세포종 환자에서의 뇌경색 발생 기전을 탐색하는데 도움이 될 만한 새로운 진단 도구를 제시하였다는 점에서 의미가 있는 증례로 사료된다. 하지만 빠른 속도로 환자의 경과가 악화되어 사망에 이르면서 보호자들과 사전 협의를 거칠 시간이 부족하였던 관계로, 부검(autopsy)을 시행하지는 못하였으며, 조직병리 소견을 확인하지 못하고 영상 소견을 통한 고찰에 그친 점이 중요한 제한점이라 할 수 있겠다. 따라서, 향후 고해상도혈관벽MRI를 포함한 다양한 발전된 영상기법들과 함께, 이를 뒷받침할 만한 조직병리 소견들이 제시된다면 교모세포종과 뇌경색의 관계를 보다 분명하게 밝힐 수 있을 것으로 기대한다.