새로운 CSF1R유전자 돌연변이가 발견된 축삭 회전타원체 및 착색된 교세포를 동반한 성인형 백질뇌병증
Adult-Onset Leukoencephalopathy with Axonal Spheroids and Pigmented Glia (ALSP) with Novel CSF1R Mutation
Article information
Trans Abstract
Adult-onset leukoencephalopathy with axonal spheroids and pigmented glia (ALSP) is a subtype of dominantly inherited leukoencephalopathies caused by novel CSF1R gene mutation predominantly affecting the cerebral white matter. High signal lesions on diffusion weighted image (DWI) are characteristic. Herein, we describe a patent with ALSP with a novel mutation. The patient had persistent DWI lesions, worsening white matter changes associated with rapidly progressive clinical symptoms.
축삭 회전타원체 및 착색된 교세포를 동반한 성인형 백질뇌병증(adult-onset leukoencephalopathy with axonal spheroids and pigmented glia, ALSP)은 상염색체 우성이며, CSF1R (MIM 164770) 유전자의 변이와 연관된다[1,2]. ALSP에서 뇌 자기공명영상(magnetic resonance imaging, MRI) 결과는 양측성 백질고신호강도가 특징적이며, 이것은 전두엽과 두정엽의 뇌실 주위 백질에서 우세하다. 이러한 특징과 같이 잘 발견되는 뇌량의 위축은 거의 항상 백질 고음영과 함께 나타난다[3].
ALSP 환자는 치매, 행동장애, 경련, 추체로증상, 실조증, 파킨슨 증상, 구음장애, 삼킴곤란 그리고 소변과 대변의 실금을 포함한 다양한 임상증상들을 나타낸다[4]. 이러한 다양한 임상, 영상 특징으로 인하여 진행 다발경화증, 전두측두엽 치매, 카다실 그리고 비정형 파킨슨병 등으로 진단되기도 한다[1-4].
국내에서는 성인에서 발생하는 백질뇌병증의 원인으로 CSF1R유전자 돌연변이와 관련된 보고는 매우 드물며 임상 특징과 영상 소견에 대한 설명도 충분하지 않다[5]. 이에 저자들은 새로운 CSF1R유전자 돌연변이의 확인을 통하여 ALSP로 진단된 환자를 통하여 점차적으로 악화되는 임상양상과 영상 소견의 변화를 보고하고자 한다.
증 례
37세 남자가 1년 전부터 서서히 진행하는 보행장애와 구음장애로 첫 번째 외부 병원 신경과를 방문하였다. 환자는 2017년 1월경부터 오른쪽 다리의 근력약화와 구음장애가 있었고, 서서히 근력저하가 심해지며 보행장애도 나타나기 시작하였다. 첫 증상 발생 후 약 8개월 후부터 기억력장애를 호소하기 시작하였고, 약 1년이 지나면서 갑자기 웃음이 터져 나오는 등 감정 조절 장애가 발생하였다. 첫 증상 발생 후 1년째에 실시한 신경학적 진찰에서는 구음장애, 상하지 근력저하(Medical Research Council [MRC] 등급 상지 4+/5-, 하지 4+/5-), 양측 상하지의 강직과 상하지의 심부건반사 항진이 있었고, 강직과 심부건반사 항진은 오른쪽에서 더 심하였다. 환자는 보행장애로 인하여 오래 걷기 힘들었으나 운동완만과 같은 파킨슨 운동증상이나 실조증 등은 관찰되지 않았다. 간이정신상태검사의 점수는 29점이었고, 임상치매척도의 점수는 0.5점, 박스총점은 2점이었다. 첫 번째 종합적인 신경심리검사에서 기억력과 전두엽 집행기능의 장애가 뚜렷하게 관찰되었다. 기억력(언어적 및 시각적)은 인출장애 양상으로 관찰되었다. 그 외 시공간 지각 능력과 계산 능력의 저하가 관찰되었다. 그러나 언어 능력은 적절하였다. 환자와 보호자는 일상생활 능력의 장애에 대해서는 부정하였고, 도구 일상생활 능력 점수는 정상이었다. 과거력에서 외상, 감염, 뇌혈관질환 등의 병력은 없었다. 가족력에서 어머니와 이모가 보행장애와 인지장애가 있다고 하였고, 외할아버지는 뇌졸중, 외할머니는 뇌졸중과 치매의 병력을 가지고 있었다. 환자에게 실시한 뇌 MRI 중 확산강조영상(diffusion weighted image)에서 양측 대뇌부챗살, 반난형백질중심부, 양측 전두엽과 두정엽의 뇌실 주위 백질의 다초점 확산제한 병변이 있었다(Fig. 1-A). 액체감쇠역전회복영상에서는 양측 전두엽과 두정엽의 뇌실 주위 백질에 고음영이 있고, 전두엽과 두정엽의 광범위한 위축을 보였다(Fig. 1-B). 초기 방문한 병원에서 그의 가족력과 뇌 MRI 소견들을 바탕으로 백질뇌병증을 유발할 수 있는 Arylsulfatase A유전자, Notch 3유전자, GLA유전자검사 등을 먼저 실시하여 정상으로 확인되었고, 이후 실시한 CSF1R유전자검사에서 18번째 엑손에서 새로운 유전자 변이인 NM_005211.3 : c.2349 C>A (p.Asn783Lys) 이형접합자 돌연변이가 확인되어(Fig. 2), ALSP로 진단되었다. 환자의 돌연변이는 dbSNP, ClinVar (NCBI) or Exome Aggregation Consortium (ExAC)의 대조군에서 발견되지 않았고, 예측 프로그램에서 돌연변이에 가까운 결과를 보였다(SIFT=0.00, PolyPhen-2=1.000). 본 증례의 경우, ACMG/AMP의 변이 분류지침에 따라서[6] 돌연변이 위치가 돌연변이 민감점(mutational hot spot)에 있고 정상인에서 매우 낮은 빈도로 발견되며, 새로운 돌연변이(de novo mutation)로 추정되어 likely pathogenic으로 분류할 수 있다.
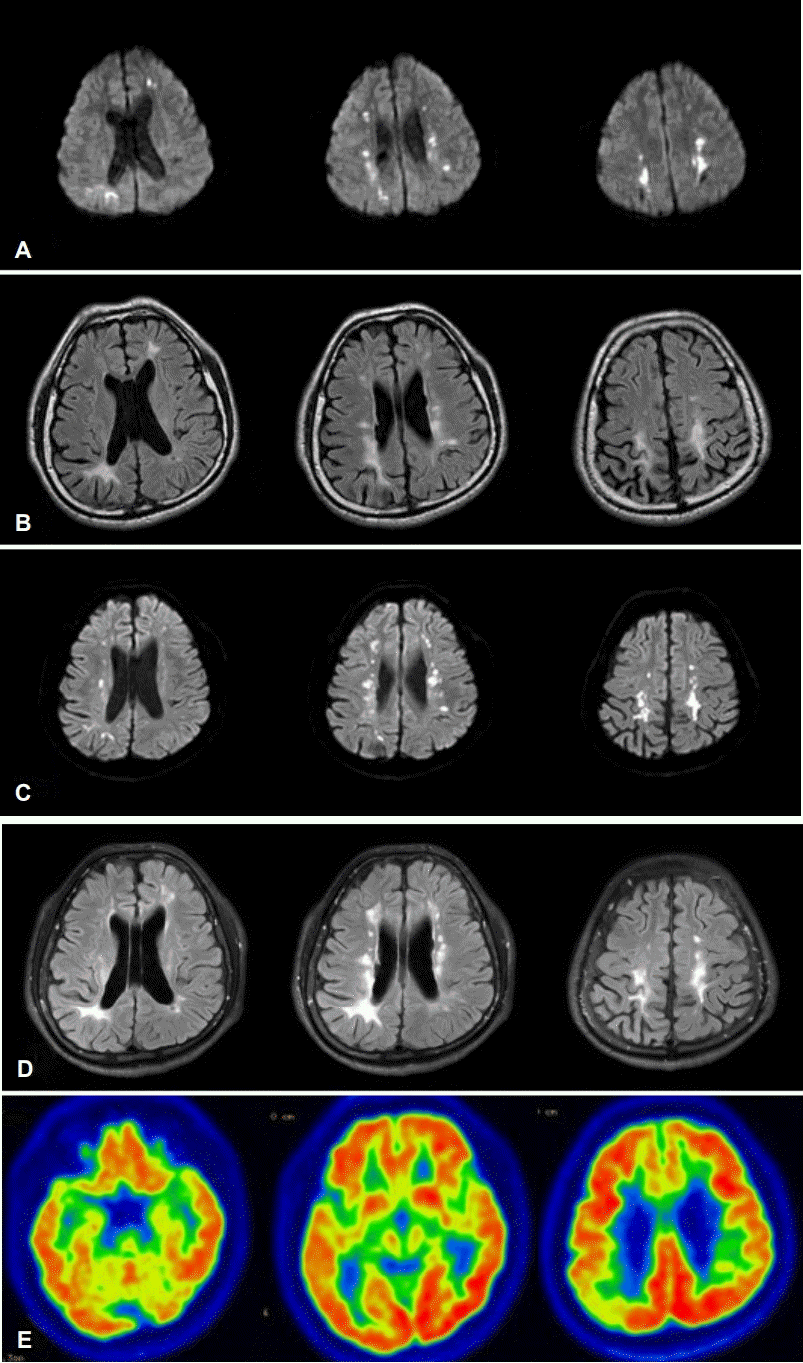
Brain images of the patient. (A) Multifocal diffusion restriction lesions are observed in bilateral corona radiata, centrum semiovale, both frontal and parietal periventricular white matter. (B) Initial FLAIR hyperintense signal alterations in both frontal and parietal periventricular white matter are seen. Diffuse cerebral atrophy, especially frontal and parietal lobes. (C) In the second DWI, multifocal restricted lesion are found in a location similar to bilateral corona radiate, centrum semiovale, both frontal and parietal periventricular white matter, which was previously found. (D) Second FLAIR image reveal more extended and aggravated periventricular white matter changes, especially the posterior part of both lateral ventricles and right parietal subcortical area. (E) 18F-FDG-PET show hypometabolism on right temporal and parietal lobes. FLAIR; fluid attenuated inversion recovery, DWI; diffusion weighted image, 18F-FDG-PET; F-18-fluorodeoxyglucose positron emission tomography.
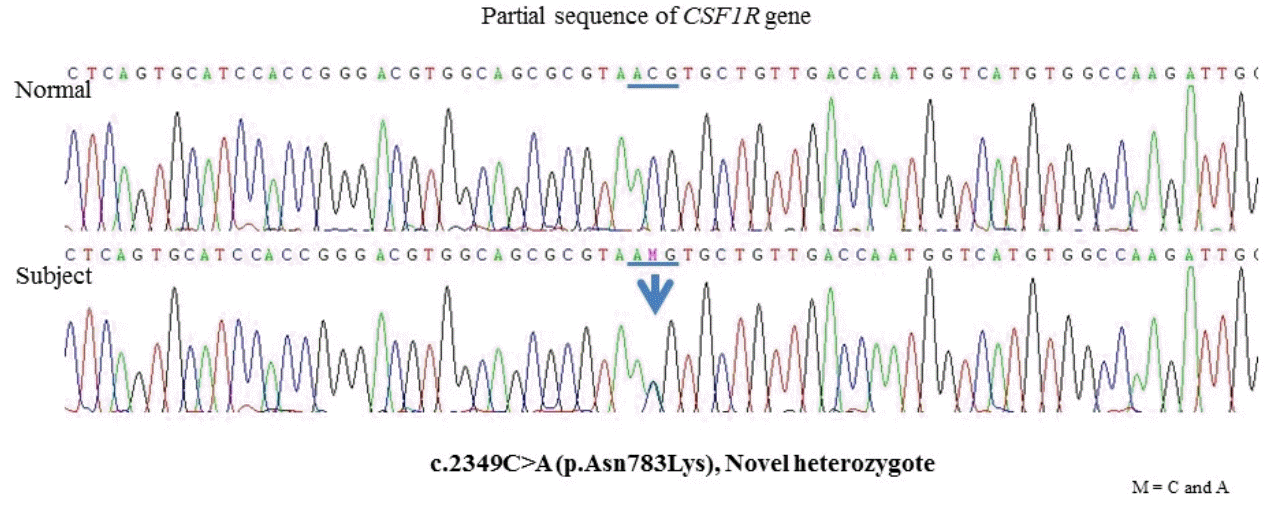
PCR-sequencing analysis showing the heterozygous c.2349 C>A (p.Asn783Lys) mutation in the exon 18 of the CSF1R gene. PCR; polymerase chain reaction.
환자는 퇴원 후 지속적으로 재활 치료를 하였으나 구음장애와 보행장애는 더욱 악화되어 첫 증상 발생 후 2년째에 본원 신경과에 입원하였다. 신경학적 진찰에서 억양과 목소리 크기 및 얼굴 표정은 비정상적으로 감소되어 있었다. 환자는 똑바로 서있지 못하고 구부정한 자세였으며, 전체적으로 행동이 느리며 움직임이 줄어들어 있었다. 양쪽 상하지의 근력저하가 심해져 상지 근력은 MRC등급 4-/4+, 하지 근력은 MRC 등급 3/4로 저하되었다. 양쪽 팔에 중등도의 경직이 있었고, 양쪽 다리와 목에는 반대편의 운동을 시키거나 다른 동작을 할 때 경직이 관찰되었다. 손가락 벌렸다 오므리기, 주먹 쥐었다 펴기, 빠른 손놀림 및 다리의 민첩성검사에서 양쪽 팔과 다리 모두 속도가 느리고 진폭이 감소되어 있었다. 환자는 혼자서 평지 걷기가 매우 힘들었고 종종 앞으로 쏠리는 모습을 보였다. 자세 유지가 되지 않아 잡아주지 않으면 종종 넘어지게 되어 혼자서는 도움 없이 걷기 어려웠고 많은 경우에 휠체어를 통해서만 이동이 가능하였다. 환자는 의자에서 한 번 이상 시도하거나 팔로 몸을 일으켜 세워야 일어났다. 심부건반사는 양측 상하지에서 모두 증가되었으며, Hoffmann징후는 양쪽에서 양성이었다.
더욱 악화되는 기억력 및 인지기능 저하 때문에 첫 증상 발생으로부터 약 2년 후에 시행한 간이정신상태검사의 점수는 약 1년 전과 비교하여 3점 떨어진 26점이었고, 임상치매척도의 점수는 0.5점, 박스총점은 2.5점이었다. 함께 시행된 신경심리검사에서 기억력, 시공간 지각 능력 및 전두엽 집행 기능에서 뚜렷한 장애가 관찰되었다. 기억력의 경우 처음과 달리 언어 기억력은 저장장애를, 시각기억력의 경우는 인출장애 소견을 보였다. 시공간 지각 능력과 전두엽 집행 기능에 대하여 현저한 저하를 보였으며 집중력저하도 관찰되었다. 보호자는 환자의 일상생활 능력을 판단하기 위한 설문지 작성을 수행하지 않았다. 그러나 보호자와의 면담과 환자의 전체 인지장애 정도를 통합하여 일상생활 능력에 장애 가능성이 시사되었다.
첫 증상 발생으로부터 2년 후에 실시한 확산강조영상에서는 이전 병변과 비슷한 범위의 확산제한 병변이 있었고(Fig. 1-C), 액체감쇠역전회복영상에서는 처음보다 뇌실 주위 백질, 특히 양쪽 외측 뇌실과 오른쪽 두정엽 피질하부 백질에서 변성이 악화되었다(Fig. 1-D). F-18 FP-CIT 양전자방출단층촬영(positron emission tomography, PET)에서 양쪽 기저핵은 정상적인 흡수를 보였다. F-18-FDG PET에서 오른쪽 측두엽 및 두정엽에서 포도당 대사저하를 보였다(Fig. 1-E).
고 찰
본 증례는 젊은 나이에 발생한 백질뇌병증에 대한 원인으로 새로운 CSF1R유전자 돌연변이의 발견을 통하여 ALSP로 진단되었다. 본 증례에서 발견된 CSF1R유전자의 c.2349 C>A (p.Asn783Lys) 변이는 기존의 유전자 보고 기록에서 발견되지 않았고, 예측 프로그램의 결과를 통하여 likely pathogenic으로 분류되어[6] 새로운 유전자 돌연변이로 의미를 가질 수 있다. 환자는 37세에 인지장애, 구음장애, 보행장애가 생겼고 가족력에서 그의 어머니와 이모도 상염색체 우성유전을 암시하는 환자와 비슷한 임상증상들을 보였으나 유전자검사를 시행하지 못한 것은 아쉬움으로 생각되며, 추후 가족력의 추적관찰 및 추가 유전자검사를 통하여 새로운 유전자 돌연변이의 병적인 의미를 더 확인할 수 있을 것이다. 외할아버지와 외할머니도 뇌졸중이 있다고 하였으나 동일한 질환인지는 확실치 않다. 결과적으로 환자는 CSF1R유전자에 새로운 돌연변이가 있으며, 임상 특징과 신경영상 특징을 포함하여 ALSP의 명확한 진단기준을 충족한다[7,8].
환자의 인지장애, 보행장애, 구음장애는 최초 진단 후 계속 진행하였고 이에 환자는 두 번째 평가를 위하여 입원하게 되었다. 초기 간이정신상태검사 점수와 비교할 때 두 번째 실시한 검사의 점수가 12개월 동안 3점이 감소되었다. 또한 종합적인 신경심리평가에서는 언어 및 시각 기억력, 시공간 그리고 전두엽 집행 기능을 포함한 전반적인 인지 영역의 두드러진 악화를 보였다. 인지장애의 악화와 함께 초기 뇌 MRI의 백질 병변도 바깥 뇌실의 후측과 오른쪽 두정엽 피질하 영역으로 확장되었다. 초기의 백질 병변은 액체감쇠역전회복영상에서 현저하지는 않았지만 확산강조영상에서 뚜렷하게 관찰되었다. 다른 증례와 비교하여 뇌량의 위축도 뚜렷하지 않다는 점에서 차이를 보였다. 본 증례의 확산강조영상에 보인 소견은 ALSP 환자에서 질병에 특이적인 소견으로 알려져 있다(Table) [2-5,9]. 그러나 아직까지 확산강조영상에서 확산제한 병변이 보이는 이유와 이러한 소견이 얼마나 오래 지속되는지에 대한 연구는 거의 없다. 일반적으로 확산강조영상의 밝은 신호강도는 세포독성 부종과 관련이 있다[9,10]. 확산강조영상은 어떠한 조직의 배향 패턴 변화도 비등방성(aniostropy)의 변화를 일으킴으로써 백질의 미세구조 변화를 매우 민감하게 확인할 수 있다[9]. 이러한 결과를 통하여 ALSP와 같은 백질 병증의 확산강조영상에서의 양성 소견은 전통적인 MRI에서 두드러진 변화가 나타나기 전보다 미세구조의 변화를 미리 확인할 수 있는 검사가 될 것이다. 본 증례에서는 확산제한이 12개월 동안 보였는데, 과거 다른 증례에서 확산강조영상의 비정상 병변이 9개월 동안 지속된 경우도 보고되었다[8]. 이처럼 지속적인 확산강조영상 병변 소견은 급성 뇌졸중을 감별하는 중요한 소견이다[10]. 확산강조영상에서 이상 소견은 ALSP의 백질 병변이 지속적인 세포독성 부종에 의한 가능성이 있지만[8], 장기간 비정상적으로 보이는 이상 소견에 대해서는 다른 요인들에 의한 병리기전도 고려해야 할 것이다. 환자의 두 번째 뇌 MRI에서는 임상증상들이 빠르게 진행되면서 비슷한 시점에 더 악화된 소견들을 보였다. 오른쪽 두정엽 피질하 영역의 더 확장된 백질 변화는 F-18-FDG PET에서도 대사저하를 보였다. PET에서 확인된 대사저하는 신경 퇴행의 근거로 제시될 수 있을 것이다.
결과적으로 ALSP에서 세포독성에 의한 신경 손상은 백질 이상과 인지장애, 보행장애 그리고 구음장애 같은 증상의 악화를 초래하였다. 비록 ALSP에서 비정상 확산강조영상의 정확한 병리기전은 아직 알려지지 않았지만, 이 증례는 특이적인 확산강조영상이 질병의 초기 단계뿐만 아니라 ALSP의 수개월 이상의 진행 과정에서 관찰될 수 있음을 보여주었다. ALSP에서 나타난 확산강조영상의 이상 소견이 증상 악화와의 연관성이 있는지에 대한 여부는 현재까지 알기 어렵기 때문에 추후 후속 연구를 통하여 신경영상 소견과 임상 소견 관계에 대한 설명과 함께 CSF1R유전자의 새로운 돌연변이를 포함한 유전자형과 표현형과의 관계에 대한 연구가 필요할 것이다.
