| J Korean Neurol Assoc > Volume 37(3); 2019 > Article |
|
23세 남자가 간간히 발생하는 의식 손상으로 내원하였다. 11세경 처음 멍해지는 증상이 생겼다고 하며, 기억이 없을 때도 있으나 기억이 나지만 말이 나오지 않는 경우도 있다고 하였다. 특별한 치료를 받지 않다가 4년 뒤 주변인에 의하여 이상하다고 얘기를 듣고 병원에 방문하여 약을 복용하기 시작하였다. 발작의 시작은 멍해지면서 입맛을 다시는 모습이 보이다가 왼손으로 물건을 만지작거리는 듯한 움직임 또는 반복적으로 고개를 왼쪽으로 돌리거나 왼쪽 몸을 들썩이는 등 의미 없는 행동을 반복하는 증상이 있고, 이후 우측 팔이 꼬이고 뻣뻣해지는 증상이 약 1분 가량 지속되며, 심한 경우 전신 경련을 보이기도 한다고 하였다. 가벼운 증상은 주 1-2회 정도, 몸이 굳는 이상의 경련은 월 1-2회 정도 있다고 하였으며 발작 발생 시기에 관하여 수면-각성 주기와의 연관성에 대해서는 부인하였다. 회복 이후에는 본인의 증상을 기억하지 못하며, 혼란스러워하거나 두통 또는 졸림 증상이 10여 분 지속된다고 하였다. 증상은 전날 수면을 잘 취하지 못하거나 몸이 피곤할 때 잘 발생하였다. 발작 전 뱃속에서 치밀어 오르는 느낌이나 기시감과 함께 발작을 할 것 같은 느낌을 경험한다고 하였으며, 이상한 맛이나 냄새, 시각 증상이나 청각 증상 등은 부인하였다. 오른손잡이로 어릴 적 열성 경련의 병력이 있으며 당시 발열과 함께 경련이 수시간 동안 몇 차례 반복되어 치료를 받은 적이 있다고 하였다. 그 외 주산기 문제, 뇌 외상, 뇌염 및 기타 신경계 감염 병력, 뇌전증 및 기타 신경계질환의 가족력은 부인하였다. 내원 당시 환자는 lamotrigine 150 mg 하루 2회, valproic acid 500 mg 하루 2회, topiramate 100 mg 하루 2회, levetiracetam 1,000 mg 하루 2회로 4가지 항경련제를 복용 중이었다. 약을 복용하면서 전신 경련은 6년 전 마지막 이후로 없었으나 약을 빼먹지 않고 잘 복용함에도 간간히 멍해지고 입맛을 다시는 등 발작 증세는 지속되어 추가적 평가 및 치료를 위하여 내원하였다.
이전에 뇌전증 진단을 받았다 하더라도 이를 그대로 받아들여서는 안 되며, 꼼꼼한 병력 청취와 문진이 필요하다. 일부 보고에서는 20-30%가 뇌전증으로 오진된다는 보고도 있으며, 두 가지 이상의 발작 형태가 있을 가능성, 또한 약물난치성뇌전증의 경우 심인성 비뇌전증성 경련(psychogenic non-epileptic seizure)이 동반되어 있거나 약물로 적절한 치료가 되고 있었는지에 대해서도 확인이 필요하다. 조짐을 포함하여 발작 양상에 대한 자세한 문진이 첫 단계로 이루어져야 하며, 발작의 수면-각성 주기와의 연관성 및 유발요인(수면 박탈, 호르몬 변화, 알코올, 빛이나 다른 자극에 의한 유발 등)에 대한 확인을 추가로 한다. 이후 신생아 발작, 열성 경련, 뇌손상, 뇌염이나 중추신경계 감염의 과거력, 뇌졸중, 발달장애나 다른 신경계 및 정신질환 등 과거력과 가족력 등 유전 요인에 대한 조사가 필요하다. 기존 약물 치료를 받고 있는 경우 치료 반응 및 순응도, 부작용 등에 대한 확인도 필요하다. 이후 신체 진찰 및 신경학적 진찰을 통하여 뇌전증과 연관될 수 있는 동반질환이나 질환 증후군, 약물 중독 등의 외부 요인에 대한 평가가 필요하다.
International League Against Epilepsy (ILAE)에서 2017년에 정한 발작 분류에 따르면 발작은 초점 발생(focal onset), 전신 발생(generalized onset), 발생 미상(unknown onset)으로 크게 3가지로 분류된다(Fig. 1) [1]. 행동 정지(behavioral arrest) 그 자체는 초점 발생, 전신 발생, 발생 미상 3가지 모두가 가능하나 이 환자의 경우 인식장애(impaired awareness), 자동증(automatism)과 함께 뇌전증 발작이 뇌의 다른 부위로 전달되면서 전신 발작으로까지 진행하는 양상으로, 초점발생인식장애(focal onset impaired awareness) 발작 및 초점 발생에서 양측 강직-간대(focal to bilateral tonic-clonic) 발작으로 분류할 수 있다.
초점 발생 발작의 경우 발작의 초점이 전두엽, 측두엽, 두정엽, 후두엽 중 어디인지 생각해 보아야 한다. 조짐은 뇌전증 발작의 첫 증상으로 국소화 및 편측화 가치가 있다. 자율신경 조짐, 내장감각 조짐, 정신 조짐 및 경험 조짐은 측두엽 발작에서 흔하며, 몸감각 조짐은 두정엽, 머리 조짐과 확산되는 온감은 전두엽, 시각 조짐은 뒤두정후두엽 발작과 주로 연관되어 발생한다. 본 환자의 경우는 측두엽에서 흔히 나타나는 치밀어 오르는 증상과 함께 발작 전 기시감이 있어 측두엽을 생각해볼 수 있다. 그러나 양측 측두엽 모두 가능한 증상으로 이 증상으로 편측화는 어렵다. 측두엽뇌전증은 초기에 자동증(automatism)이 나타나는 특징이 있으며 입소화계통자동증(oroalimentary automatism) 또는 발작의 초점과 같은 쪽으로 의미 없는 행동을 반복하는 자동증이 나타난다. 환자의 경우 자동증이 좌측으로 나타나 발작의 초점이 왼쪽에 있는 것을 시사한다(Supplementary video). 자동증의 경우 전두엽뇌전증에서도 나타날 수 있으나 지속 시간이 더 짧다. 발작 후 혼동 또한 전두엽에 비하여 측두엽에서 기원한 초점발생인식장애 발작에서 지속 시간이 긴 특징이 있다. 오른손잡이로 의식이 있는 상태에서 언어장애가 동반되었다는 병력은 우세반구인 좌측 뇌로 편측화가 가능한 소견이나, 발작 연관 실어증은 초점의 국소화에는 도움이 되지 않으며 두정후두엽이 측두엽보다는 다소 빈번한 경향이 있다[2]. 발작말하기(ictal speech)의 경우에는 반대로 비우세반구에서 발작이 기원함을 시시한다. 측두엽 내에서 발작의 초점이 내측두엽인지 외측두엽인지 구분은 어려우나 내측두엽의 경우 자율신경, 정신, 내장감각 조짐 및 자동증이 더 흔하고, 외측두엽의 경우 국소운동, 체감각, 시각, 청각 조짐이 좀 더 흔하다. 또한 외측두엽발작이 전신 발작으로 이행이 좀 더 잘 되는 경향이 있다. 이를 종합할 때 이 환자에서 가장 가능성이 높은 발작의 초점은 좌측 내측두엽으로 생각할 수 있다.
뇌전증 진단 및 분류를 위하여 필수적인 검사는 뇌파검사이다. 본 환자의 경우 좌측 내측두엽 뇌전증으로 병력상 의심이 되었으나 발작파가 양측으로 나오지 않는지, 측두엽 외 다른 부위에서 추가적인 발작파가 있는지 여부 등을 확인할 필요가 있다. 발작이 병력으로만 확인되었기 때문에 정확한 발작 양상을 확인하고 심인성 비뇌전증성 경련 확인, 수술적 치료를 같이 고려하여 발작 시작 시 발작파의 발생 부위를 같이 확인하기 위한 평가 목적으로 비디오 뇌파평가를 하는 것이 좋다. 본 환자는 예상하였던 대로 좌측 측두엽 부위로 예파(sharp wave)가 빈번히 관찰되었고(Fig. 2), 비디오 뇌파모니터링 중 발작 시 좌측 측두엽으로부터 짧게 율동성 서파(rhythmic slow activity)가 발생한 이후 좌측 측두엽의 반복적 뇌전증모양방전(repetitive epileptiform discharge)이 따라오는 양상으로 발작의 초점이 좌측 측두엽 주변임을 확인하였다(Fig. 3). 율동성 서파는 내측두엽 발작에서 가장 잘 나타나는 발작 시작 형태이며, 그 외 반복적 뇌전증모양방전으로 시작될 수도 있으나, 돌발성 속파활동(paroxysmal fast activity)은 거의 관찰되지 않는다. 반면, 외측두엽발작 등 신피질 영역에서 시작되는 발작은 돌발성 속파활동이 앞의 두 가지보다 더 자주 나타난다[3]. 율동성 서파만으로 내측두엽임을 알 수는 없지만 돌발성 속파활동으로 시작되는 경우에는 대뇌피질발달기형(malformation of cortical development) 등 신피질 병변을 고려하여야 한다.
Magnetic resonance imaging (MRI)검사는 특발전신뇌전증(idiopathic generalized epilepsy)을 제외한 모든 뇌전증 환자에서 추천된다. MRI를 통하여 발작의 초점이 될 가능성이 있는 해마경화증, 신생물, 혈관기형, 피질발달기형, 뇌연화증 및 뇌졸중, 외상 등에 의한 뇌병변 부위를 확인할 수 있다. 특히 본 환자와 같이 열성 경련의 병력이 있거나 내측두엽 발작이 의심되는 경우 해마경화증을 확인하기 위하여 T2 및 fluid attenuated inversion recovery (FLAIR) 영상에서 해마 부피의 비대칭성과 해마신호증강을 유심히 확인하여야 할 필요가 있다. 본 환자는 좌측 해마의 FLAIR 조영증강과 부피 감소로 해마경화증에 합당한 소견이 관찰되었으며, 추가로 시행한 18F-labeled fluoro-2-deoxyglucose position emission tomography (FDG-PET) 영상에서도 좌측 측두엽의 뚜렷한 대사 감소를 보여 앞선 검사들과 함께 발작의 초점이 좌측 측두엽 내에 있음을 재확인하였다(Fig. 4-A, B).
그 외 기본적인 혈액검사를 통하여 간, 신장질환, 골수기능 억제, 감염 등에 대한 상태 평가와 임신 여부 확인을 할 수 있으며, 이를 바탕으로 약물의 부작용 확인 및 추후 약물 선택에 활용하도록 한다. 발열, 두통, 의식장애, 정신 증상 등으로 뇌수막염, 뇌염이 의심되는 경우 뇌척수액검사를 고려할 수 있다. 암과 관련한 신생물딸림변연뇌염(paraneoplastic limbic encephalitis)이나 자가면역뇌염과 연관된 발작이 의심되는 경우 관련 항체를 혈청 및 뇌척수액에서 검사해볼 수 있다.
약물난치성뇌전증의 정의에 대하여 통일된 기준을 만들기는 어려우나 일반적으로 2-3제 이상의 약제를 적절히 사용함에도 발작이 조절되지 않는 경우 고려한다. ILAE에서 2009년에 정한 약물난치성 뇌전증은 적합하게 선택되고, 견딜 수 있는, 최소 2가지 항뇌전증약물(단일 치료 혹은 복합 치료)의 적절한 치료 시도로 최소 12개월 이상 지속적인 무발작을 달성하는 데 실패한 경우이다[4]. 본 환자의 경우 4제 약제로 유지함에도 발작이 지속되고 있으므로, 약물난치성 뇌전증으로 판단할 수 있다. 두 개 이상의 항경련제에 실패한 경우 4% 이내에서만 추가적 항경련제 사용을 통한 발작 조절이 가능하며[5,6], 이에 다른 가능한 치료 방안을 고려하여야 한다. 치료에 실패한 경우 다른 수술적 치료, 신경자극 치료, 식이요법 등을 고려할 수 있는데 이 중 수술적 치료가 가장 성공 확률이 높다. 본 환자의 경우 앞쪽내측두엽절제술을 시행하였으며, 수술 조직의 병리 소견에서도 해마경화증을 확인하였다(Fig. 4-C, D). 환자는 수술 이후 항경련제를 줄여 levetiracetam 500 mg 하루 2회만 유지하면서 6개월간 무발작 상태를 유지하고 있다.
측두엽뇌전증은 국소뇌전증의 가장 흔한 형태로 내측두엽뇌전증과 외측두엽뇌전증으로 나눌 수 있다. 해마경화증을 동반한 측두엽뇌전증은 약물난치성뇌전증의 가장 흔한 형태이며 난치성내측두엽뇌전증의 약 50-70%의 환자에서 해마경화증을 확인할 수 있다[7]. 해마경화증의 발생기전은 정확히 밝혀져 있지 않으나 초기 유발손상(initial precipitating injury)이 선행하는 경우가 많으며 이러한 손상에는 열성 경련, 외상, 허혈성 뇌손상, 뇌염 등이 있다. 단순 열성 경련과 뇌전증은 관련이 없는 것으로 생각되고 있으나 어릴 때 복합열성경련을 앓은 경우엔 3% 정도에서 해마경화증이 발생하는 것으로 알려져 있으며[8], 해마경화증을 동반한 난치성측두엽뇌전증 환자의 40% 정도에서 열성 경련이 있다[9]. 해마경화증의 신경병리학적 소견은 광범위한 신경교증(gliosis)과 함께 해마의 문 영역(hilar area) 및 CA1, CA3 영역의 세포 소실이며, 미세발생장애(microdysgenesis)와 피질형성이상(cortical dysplasia)이 종종 동반된다[10].
내측두엽뇌전증의 경우 초기 약물에 반응한다 하더라도 시간이 경과하면서 점차 난치성을 보이는 경우가 많다. 이러한 경우 약물치료를 지속하는 것에 비하여 수술적 치료를 하는 것이 장기적인 발작 조절과 삶의 질 측면에 있어 더 나은 결과를 가져오며[11], 특히 해마경화증이 있는 경우 80% 이상의 환자에서 수술 후 12개월 이상 발작 소실을 보이고 장기적 예후도 좋기 때문에[12] 수술적 치료를 적극적으로 고려하여야 한다. 수술은 해마, 편도와 함께 외측두엽신피질의 일부를 같이 절제하는 앞쪽내측두엽절제술(anterior temporal lobectomy)이나 해마곁이랑(parahippocampus)을 선택적으로 절제하는 편도해마절제술(selective amygdalohippocampectomy)을 시행할 수 있다.
본 증례는 열성 경련의 병력, 약물난치성뇌전증과 함께 해마경화증이 확인되었던 전형적인 내측두엽뇌전증 환자이며, 수술적 치료를 통하여 성공적으로 항경련제의 개수를 줄여 효과를 본 경우라 할 수 있겠다. 그러나 측두엽뇌전증 환자의 33-61%에서는 양측 측두엽에서 발작사이뇌전증모양방전(interictal epileptiform discharge)이 관찰되며 특히 해마경화증이 양측으로 오는 경우 수술적 치료가 어렵거나 수술을 하더라도 예후가 좋지 않을 수 있다[13-15]. 따라서, 약물난치성뇌전증의 경우 수술적 치료가 우선적으로 고려되어야 하지만 환자에 따라서는 수술 외의 다른 치료 선택지에 대한 고려 역시 필요하다.
Supplementary Material
Video.
The patient shows complex gestural automatic behavior in the left side with intermittent hyperventilation and sniffing followed by contralateral tonic posturing. (https://doi.org/10.17340/jkna.2019.3.19.v.01)
REFERENCES
1. Fisher RS, Cross JH, D'Souza C, French JA, Haut SR, Higurashi N, et al. Instruction manual for the ILAE 2017 operational classification of seizure types. Epilepsia 2017;58:531-542.


2. Loesch AM, Steger H, Losher C, Hartl E, Remi J, Vollmar C, et al. Seizure-associated aphasia has good lateralizing but poor localizing significance. Epilepsia 2017;58:1551-1555.


3. Tanaka H, Khoo HM, Dubeau F, Gotman J. Association between scalp and intracerebral electroencephalographic seizure-onset patterns: a study in different lesional pathological substrates. Epilepsia 2018;59:420-430.


4. Kwan P, Arzimanoglou A, Berg AT, Brodie MJ, Allen Hauser W, Mathern G, et al. Definition of drug resistant epilepsy: consensus proposal by the ad hoc Task Force of the ILAE Commission on Therapeutic Strategies. Epilepsia 2010;51:1069-1077.


6. Brodie MJ, Barry SJ, Bamagous GA, Norrie JD, Kwan P. Patterns of treatment response in newly diagnosed epilepsy. Neurology 2012;78:1548-1554.



7. Margerison JH, Corsellis JA. Epilepsy and the temporal lobes. A clinical, electroencephalographic and neuropathological study of the brain in epilepsy, with particular reference to the temporal lobes. Brain 1966;89:499-530.


8. Van der Berg BJ, Yerushalmy J. Studies on convulsive disorders in young children. I. Incidence of febrile and nonfebrile convulsions by age and other factors. Pediatr Res 1969;3:298-304.


9. Chungath M, Shorvon S. The mortality and morbidity of febrile seizures. Nat Clin Pract Neurol 2008;4:610-621.


10. Tassi L, Meroni A, Deleo F, Villani F, Mai R, Russo GL, et al. Temporal lobe epilepsy: neuropathological and clinical correlations in 243 surgically treated patients. Epileptic Disord 2009;11:281-292.


11. Wiebe S, Blume WT, Girvin JP, Eliasziw M; Effectiveness and Efficiency of Surgery for Temporal Lobe Epilepsy Study Group. A randomized, controlled trial of surgery for temporal-lobe epilepsy. N Engl J Med 2001;345:311-318.


12. Lowe AJ, David E, Kilpatrick CJ, Matkovic Z, Cook MJ, Kaye A, et al. Epilepsy surgery for pathologically proven hippocampal sclerosis provides long-term seizure control and improved quality of life. Epilepsia 2004;45:237-242.


13. Janszky J, Rasonyi G, Clemens Z, Schulz R, Hoppe M, Barsi P, et al. Clinical differences in patients with unilateral hippocampal sclerosis and unitemporal or bitemporal epileptiform discharges. Seizure 2003;12:550-554.


Figure 1.
ILAE 2017 operational classification of seizure types. Adapted from reference 1. ILAE; International League Against Epilepsy.
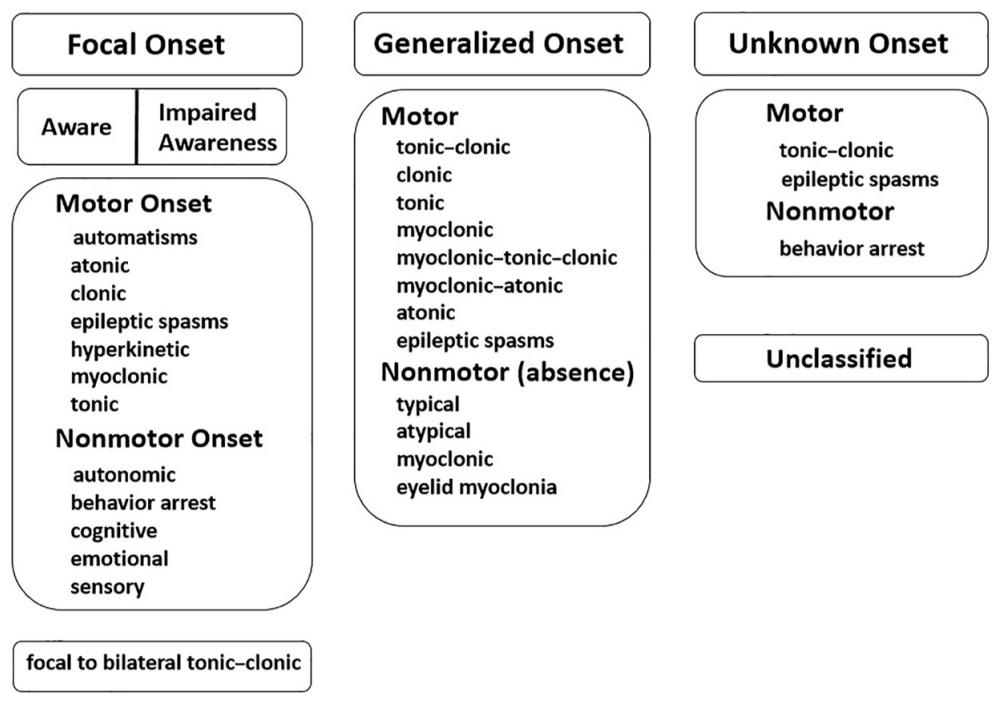
Figure 2.
Interictal epileptiform discharge. An isolated sharp wave in the left temporal area (T7, T9) is observed.
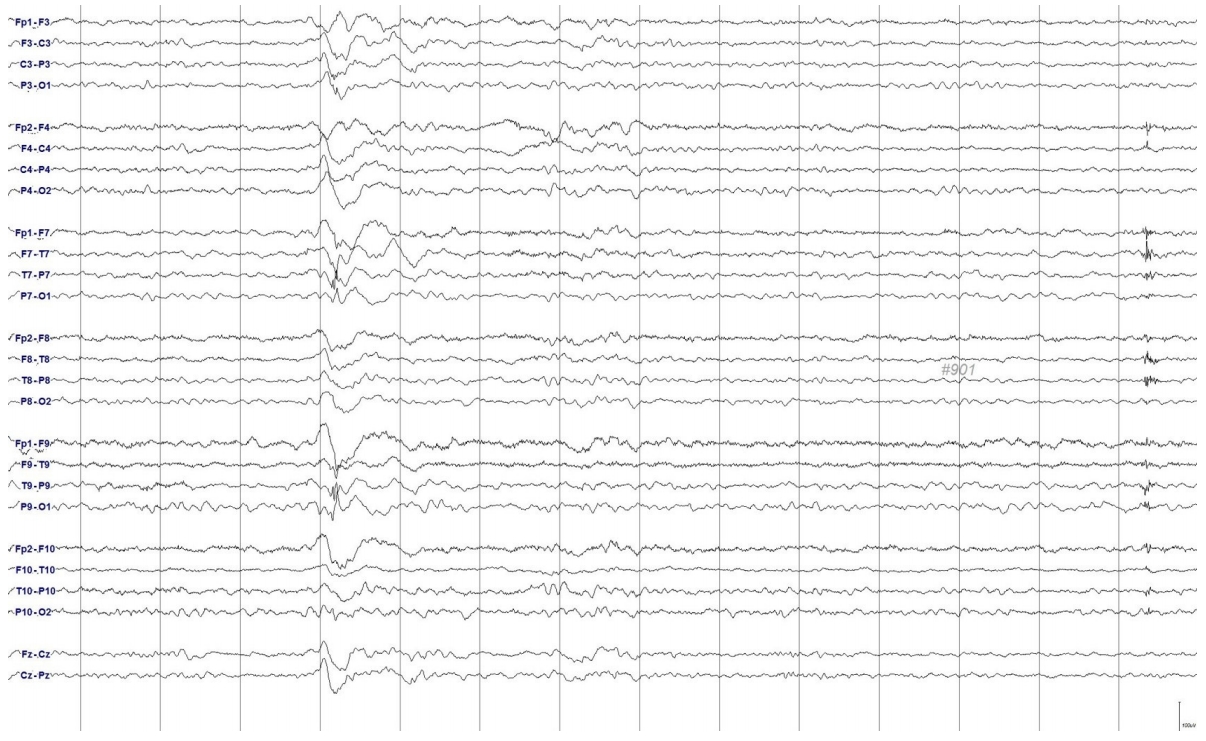
Figure 3.
Ictal discharges at seizure onset. EEG at the beginning of seizure shows rhythmic theta activity in the left temporal area followed by high amplitude repetitive sharp waves. EEG; electroencephalogram.
Figure 4.
Imaging and histological findings left hippocampal sclerosis. (A) In this coronal section, the hippocampus on the left side is relatively small and shows high FLAIR signal intensity. (B) Positron emission tomography brain imaging with 18F-labeled fluoro-2-deoxyglucose shows hypometabolism in the left temporal lobe. (C, D) Neuronal loss and reactive gliosis evaluated by NeuN (C) and GFAP (D) immunoreactivity in the left hippocampus. FLAIR; fluid attenuated inversion recovery, NeuN; neuronal nuclei, GFAP; glial fibrillary acidic protein.

- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 5,835 View
- 246 Download
- Related articles
-
Clinical Reasoning: A 62-year-old Woman Presenting with Ptosis and Diplopia2023 February;41(1)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Supplement
Supplement Print
Print



