증 례
79세 여자가 5년 전부터 서서히 발생한 기억장애로 병원에 왔다. 오른손잡이이고 초등학교 졸업의 학력으로 가족 없이 혼자 살고 있었다. 특이 병력, 흡연력과 음주력은 없었으나, 어머니가 치매를 앓은 가족력이 있었다. 환자는 내원 당시, 방금 전에 한 말도 돌아서면 기억하지 못할 정도로 단기 기억장애가 심하였다. 돈이 없어졌다고 울먹이며 통화를 하고서는 다음 날 전화한 것을 전혀 기억하지 못하였다. 친척이 다녀간 다음날 누가 다녀갔었냐고 물어보면 ‘그랬나?’라고 되묻는 경우가 많았다. 진료를 받으러 온 날에도 보호자인 조카와 함께 택시를 타고 왔는데, 조카의 차를 타고 왔다고 하였다. 20년 전에 사망한 남편의 이름, 생전 직업, 남편의 사망 시기에 대해서도 틀리게 회상하는 등 장기 기억장애도 있었다. 10년 동안 매주 빠짐없이 성당 모임에 나갔었는데, 내원 무렵에는 날짜나 시간이 바뀌면 모임에 나가지 못하였다. 약속을 지키지 못하는 일들이 잦아지면서 교우들이 일주일에 한 번씩 환자의 집을 방문하였는데, 가스 불을 켜놓고 음식은 다 탄 상태로 집에 아무도 없는 경우가 자주 목격되었다. 음식을 항상 태우기 때문에 교우들의 도움을 받아야 하였고 음식을 사서 베란다에 둔 것을 잊어버려 썩어서 버리는 경우가 잦았다. 매일 집 근처 복지관에 점심식사를 하러 가고 성당에 혼자 다니는 것에는 문제가 없었으나, 늘 다니던 곳이 아니면 길을 잃을 가능성이 높았다. 깨끗하지 않은 행주로 바닥을 닦았다가 입을 닦기도 하고, 베란다에 구더기가 버글거리는 등 위생과 집안 청소에 문제가 있었다. 세수와 목욕을 잘하지 않으려 하였고, 옷도 갈아입지 않아 냄새가 났다. 여기저기서 걸레를 주워와 작은 상자 10개 정도에 모아두었고 쓰다 버린 비닐봉투도 주워 와서 쌓아두고, 주위 사람들이 몰래 버리면 싫어하고 화를 냈다.
신경학적 진찰에서 상하지의 심부건반사가 저하된 것 외에 국소신경학적 결손은 없었다. 한국판 간이정신상태검사(Korean-Mini Mental Status Examination, K-MMSE)는 30점 만점에 16점, 임상치매척도(Clinical Dementia Rating, CDR)는 2점, 종합임상치매척도(CDR-Sum of boxes)는 12점이었다. 치매단계평가척도(Global Deterioration Scale)는 6점, 바텔지수(Barthel index)는 18점이었다. 서울신경심리선별종합검사(Seoul Neuropsychological Screening Battery, SNSB)에서 전두엽수행기능, 언어기능, 시공간기능, 계산력과 기억력 항목에서 기능저하 소견이 관찰되었다(
Table 1) [
1].
질문 1. 이 환자의 증상은 치매인가?
2011년 발표된 National Institute of Aging and Alzheimer Association (NIA-AA Criteria) 진단지침[
2]에 따르면 치매는 다음의 4가지 조건을 만족하여야 한다. 1) 일상생활능력의 장애, 2) 섬망 또는 주요 신경정신과질환으로 설명되지 않음, 3) 병력과 객관적인 인지검사에서 인지장애가 확인됨, 4) 기억장애, 추론능력저하/판단력저하/복잡한 업무수행장애, 시공간기능장애, 언어기능장애, 성격변화/이상행동 등의 다섯 가지 중 최소 두 가지 항목에 해당하는 인지 또는 행동장애가 있음. 환자의 경우 병력에서 5년 전부터 서서히 진행하는 기억장애, 길 찾기 장애와 판단력 저하가 있었고 이상행동이 동반되어 있었다. 그리고 치매선별검사인 K-MMSE에서 16점으로 인지기능의 저하가 의심되었고, SNSB에서 여러 인지 영역에 걸쳐 같은 연령대의 기대수준 이하로 기능저하가 확인되었다. 이로 인하여 이전에 잘 수행하던 사회생활(예, 성당 모임 참석)이나 음식 만들기, 집안 청소, 개인 위생 등의 일상생활에도 지장이 있었고, 동반된 섬망 또는 주요 신경정신과질환이 없었으므로 환자는 치매로 진단할 수 있다.
질문 2. 이 환자의 치매원인을 감별하기 위하여 무슨 검사를 시행해야 하는가?
치매는 원인에 따라 치료가 가능한 치매와 치료가 불가능한 치매로 구분할 수 있다. 내분비 이상(갑상선저하증, 저혈당 등), 대사 이상(비타민B결핍, 저나트륨혈증, 간질환 등), 약물, 감염(후천면역결핍증후군, 신경매독 등) 등과 같은 전신질환에 의하여 유발되는 치매와 정상압수두증, 경막하혈종, 뇌종양과 같은 뇌 구조적 손상으로 인하여 발생하는 치매는 그 원인질환을 치료하면 치매 증상이 호전되므로 치료가 가능한 치매에 해당한다. 나머지는 신경퇴행질환에 의한 치매와 뇌혈관질환에 의하여 발생하는 혈관치매가 대부분을 차지하는데 신경퇴행질환에 의한 치매는 치료가 불가능한 비가역치매에 해당하지만 혈관치매는 혈관질환이 재발하지 않을 경우 증상이 진행하지 않고, 일부 호전되기도 하므로 치료 가능한 치매에 포함하기도 한다. 따라서 자세한 문진을 통하여 치매가 의심될 때에는 치매의 원인질환 감별을 위하여 다양한 검사를 시행한다. 신체 진찰과 신경학적 진찰은 물론이고 대사질환, 약물, 감염 등 전신질환을 배제하기 위한 기본 혈액검사를 실시한다. 그리고 뇌의 구조적 변화를 살펴보기 위한 뇌 자기공명영상(brain magnetic resonance imaging, MRI), 뇌의 기능적 변화를 살펴보기 위하여 플루데옥시글루코스 F-18 (FluoroDeoxyGlucose, FDG) 양전자단층촬영(Positron Emission Tomography, PET) 또는 단일광자단층촬영(single photon emission computed tomography)을 진행할 수 있다. 최근에는 알츠하이머병(Alzheimer’s disease, AD)의 주요 병리 소견인 베타아밀로이드(beta-amyloid, Aβ) 단백질 축적과 타우(tau) 단백질 축적을 영상화할 수 있는 PET리간드 개발로 살아있는 상태에서 병리수준의 진단이 가능해졌다. 그 외 치매의 원인이 유전질환으로 추정될 경우, 해당 유전자에 대한 돌연변이검사를 진행할 수 있다[
3].
이 환자의 경우 신체 진찰과 신경학적 진찰에서 이상 소견은 없었고 고혈압이나 당뇨병 등의 혈관 위험인자가 없었다. 평소 복용하던 약물은 없었고 전혈구검사, 일반화학검사, 갑상선기능검사, 혈청 비타민B12는 모두 정상범위였으며 매독혈청검사(venereal disease research laboratory, VDRL)와 매독균혈구응집검사(
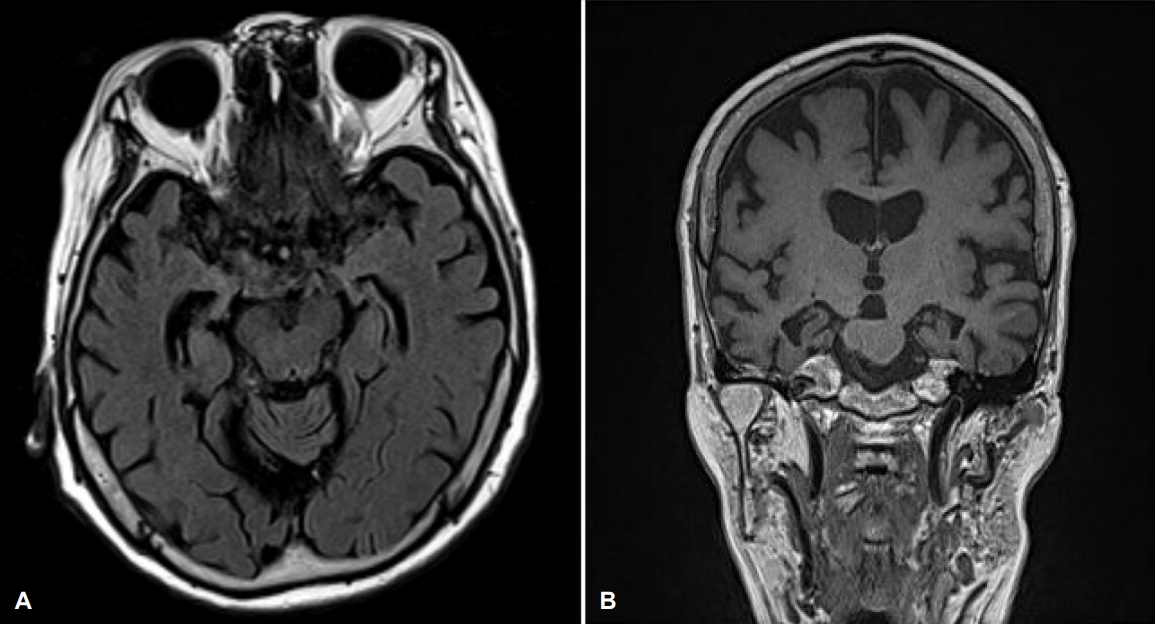
Treponema pallidum hemagglutination assay, TPHA)는 무반응성이었다. 뇌 MRI에서는 양측 내측 측두엽(Schelten’s grading 우측 3, 좌측 2), 해마, 두정엽과 전두엽 전반에 걸친 피질 위축, 뇌실 확장, 경도의 백색질 변성이 확인되었다(
Fig. 1) [
4]. 아포지단백유전자E(Apolipoprotein E)의 형질은 ε4/ε4였다.
질문 3. 이 환자의 임상증후군은?
2011년 발표된 NIA-AA Criteria 진단지침[
2]에 따르면, 가능성 있는 알츠하이머병치매(probable Alzheimer’s disease dementia)는 치매로 진단된 환자 중에서 다음 4가지의 조건들을 충족시킨 경우에 진단할 수 있다. 첫째, 인지저하는 수개월 또는 수년에 걸쳐 서서히 진행하는 경과를 가져야 함. 둘째, 병력에서 인지기능의 악화가 뚜렷해야 함. 셋째, 병력에서 증상 초기, 가장 두드러진 인지기능장애는 다음 중 하나에 해당하여야 함: 1) 기억장애 발현, 2) 비기억장애 발현-언어기능장애, 시공간기능장애, 집행기능장애. 넷째, 다음 5가지를 동반하지 않아야 한다. 1) 뇌혈관질환, 2) 레비소체치매의 핵심 증상, 3) 행동변이전두측두치매의 핵심 증상, 4) 의미변이원발진행실어증 또는 비유창/비문법변이원발진행실어증의 핵심 증상, 5) 진행성 신경질환, 비신경성 내과질환 또는 인지기능에 상당한 영향을 미칠 수 있는 약물 사용의 증거.
이 환자의 경우, 5년에 걸쳐 서서히 진행하는 뚜렷한 인지기능저하가 보호자에 의하여 보고되었고, 초기 증상인 기억장애 외에도 전두엽집행기능, 언어기능, 시공간기능과 계산력 모두에서 기능저하 소견이 관찰되었다. 또한, 증상과 관련된 뇌혈관질환의 과거력이나 영상 증거가 없었고, 레비소체치매, 행동변이전두측두치매, 의미 변이 또는 비유창/비문법변이원발진행실어증의 핵심 증상이 동반되지 않았으며, 다른 질환 또는 약물 사용이 의심되지 않은 상태이므로 probable Alzheimer’s disease dementia로 진단할 수 있다.
질문 4. 치료와 경과는?
Probable Alzheimer’s disease dementia 진단 후 아세틸콜린에스테라제억제제 치료를 시작하였으나 치매 증상은 더욱 나빠졌다. 진단 6개월째, 한겨울에도 얇은 옷만 입고 미사에 참석하였고, 스스로 약을 챙겨 먹지 못할 만큼 기억력이 나빠졌다. 외래 방문하였을 때 보호자가 약을 타러 간 사이, 환자 혼자서 병원을 빠져나가 병원에서 차로 약 15분 거리에 있는 기차역에서 다음날 새벽에 발견되기도 하였다. 진단 16개월 후부터는 집 밖으로 전혀 나가지 않으려 하여, 진단 24개월 무렵 의료진이 환자의 집을 방문하였다. K-MMSE는 18점으로 진단 당시와 큰 차이가 없었으나, SNSB는 협조가 불량하여 검사하지 못하였다. 당시 장소에 대한 지남력은 비교적 양호한 상태였으나 자신의 기본적인 인적 사항에 대하여 말하지 못하였고, 대부분의 질문에 기억이 나지 않는다고 대답을 회피하였다.
진단 약 33개월 경, 계속 누워 있으려고만 하고 누운 자리에서 대소변을 보며 식사도 챙겨주지 않으면 먹지 못하게 되었다. 이후 요양병원에 입원하였고 진단 56개월, 증상 발생 9년만에 84세로 사망하였다.
질문 5. 이 환자의 최종 진단명은 무엇인가?
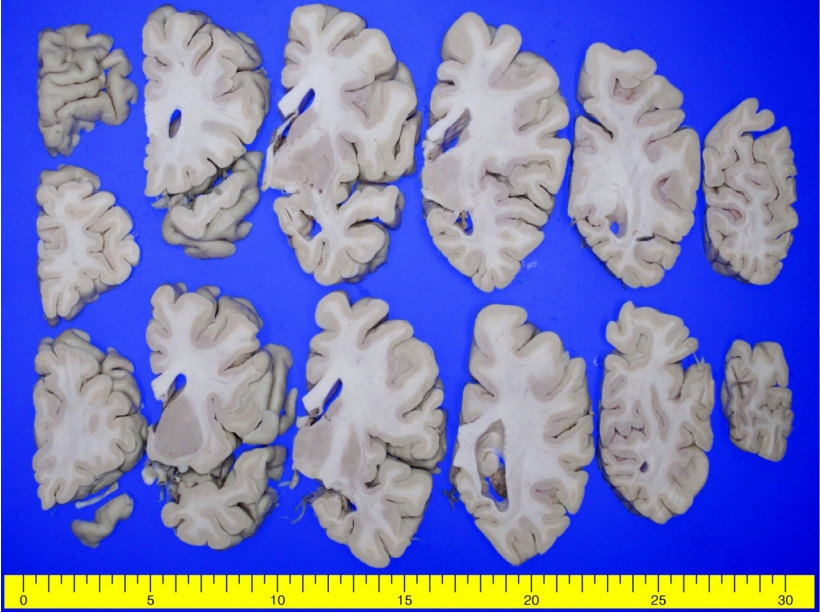
사망 후 환자의 뇌부검을 시행하였다. 대뇌의 무게는 약 930 g (우측: 374 g, 좌측: 398 g)이었고 출혈 또는 경색의 뇌혈관장애 소견은 없었다. 포르말린고정 후 48일째 시행한 육안검사에서 회백질의 두께가 전반적으로 위축되어 있었고, 특히 상측두이랑(superior temporal gyrus), 내후각피질(entorhinal cortex), 모이랑(angular gyrus)의 피질 두께가 감소되어 있었다. 기저핵(basal ganglia), 시상(thalamus)등 피질하핵(subcortical nuclei)은 정상 크기였으나, 해마(hippocampus)와 편도(amygdala)의 위축이 뚜렷하였다(
Fig. 2). 중뇌의 흑색질과 교뇌의 청반(locus ceruleus) 색소가 경도로 감소되어 있었다. 베타아밀로이드 면역조직화학염색에서 대뇌피질 전반에 걸쳐 미만성판(diffuse plaque)이 확인되었고, 뇌간과 소뇌에도 베타아밀로이드 침착(Thal phase 5, A3)이 있었다(
Fig. 3-A). 뿐만 아니라 중전두이랑(middle frontal gyrus), 하측두이랑(inferior temporal gyrus), 해마, 내후각피질, 상측두이랑(superior temporal gyrus), 모이랑에서 다수의 신경판(Consortium to Establish a Registry for AD [CERAD], frequent, C3)과 뇌혈관 아밀로이드 혈관병증(cerebral amyloid angiopathy)이 관찰되었다(
Fig. 3-B). 타우 염색에서는 신경원섬유매듭이 해마에서부터 편도, 신피질, 일차감각피질까지 분포(Braak stage VI, B3)하여(
Fig. 3-C) High Alzheimer’s disease neuropathological change (A3B3C3)에 해당하였다(
Table 2,
3) [
5,
6].알츠하이머병 외 기타 동반된 병리 소견으로 시누클레인염색에서 레비소체와 레비신경돌기가 편도에서만 확인되었다(
Fig. 3-D).
토 의
환자는 서서히 진행하는 기억력을 포함한 다발성인지기능장애, 이상행동과 일상생활능력의 저하를 주소로 내원하였다. 신경심리검사에서는 전반적인 인지기능의 저하가 관찰되었고, 치매의 다른 원인 없이 뇌 MRI에서 양쪽 내측 측두엽의 위축이 두드러져, 임상적으로 probable Alzheimer’s disease dementia가 의심되었다.
1984년 McKahnn 등이 제정한 NICNDS-ADRDA기준에 의한 알츠하이머치매(Alzheimer’s dementia)는 알츠하이머임상증후군과 알츠하이머병(AD)을 동일시한 개념이다. 이후 Alzheimer’s dementia로 진단되었으나 사후 부검에서 AD 병리가 없거나, 인지기능이 정상인 사람에게서도 AD 병리가 보고되는 등 임상진단과 병리진단의 불일치가 지속적으로 보고되자 알츠하이머임상증후군과 AD를 분리하여 보자는 의견이 제시되었다. 뿐만 아니라 살아 생전 AD의 병태생리를 확인할 수 있는 여러 생물표지자(biomarker)들이 최근 개발되면서 이러한 생물표지자들을 접목한 새로운 진단기준도 필요하게 되었다. 2007년 international working group에 의하여 NINCDS-ADRDA criteria를 개정한 연구진단기준(research diagnostic criteria)이 발표된 것을 시작으로(
Table 4) [
7,
8], 2011년 NIA-AA에서 진단지침이 발표되었고(
Table 5) [
2,
8], 2018년 NIA-AA research framework [
9]가 발표되었다(
Table 6). 새로운 진단지침의 공통점은 여태까지 전적으로 의존해 온 임상 표현형(증상 또는 징후)에서 벗어나 생물표지자를 필수 영역으로 편입시키고, AD를 연속체(continuum)로 규정하고, 인지기능의 지속적인 측정을 통하여 각 단계를 정의한 점이라 할 수 있다.
특히 2018년 발표된 NIA-AA research framework에서는 생물표지자를 AT(N) 분류 시스템(아밀로이드, 타우, 신경퇴행)으로 세분화하였다[
9]. 베타아밀로이드플라크(Aβ plaques, A)는 뇌척수액의 Aβ42 또는 Aβ42/Aβ40 비(ratio)의 저하 또는 아밀로이드PET 양성으로 확인할 수 있고, 타우(fibrillar tau, T)는 뇌척수액 내 과인산화타우(phosphorylated tau)의 증가 또는 타우PET의 양성으로 확인할 수 있다. 신경퇴행 또는 신경세포의 손상(Neurodegeneration or neuronal injury, N)의 경우, MRI에서 관찰되는 뇌의 위축, FDG-PET에서의 포도당 대사 저하(hypometabolism), 뇌척수액 내 총 tau의 증가로 확인할 수 있다. N의 경우 괄호로 묶여져 있는데, 이는 AD에 특이적인 생물표지자 AT와 달리, 다양한 신경퇴행성 뇌질환에서도 양성으로 나타날 수 있기 때문이다. 따라서 일부에서는 (N)을 삭제하자는 의견도 있으나, N의 존재는 AD 환자의 추후 인지저하를 좀더 강력하게 예측할 수 있기 때문에 유지하기로 하였다. NIA-AA research framework에서는 우선 이 3개의 생물표지자를 활용한 AT(N) 시스템을 제안하였으나, 추후 새로운 생물표지자의 추가 또는 이를 넘어서는 새로운 생물표지자 그룹이 추가될 수 있다는 시스템의 유연성도 명시하였다. 본 환자를 진단할 무렵인 2008년에는 생물표지자 활용이 보편화되지 않은 시기였으므로, ATN에서 제시하는 AD특이 AT 관련 생물표지자는 측정되지 못하였다. 따라서 우리 환자의 경우, 생전에는 probable Alzheimer’s disease dementia로 임상진단만 하였고, 사후 부검을 통하여 AD로 병리 확정 진단을 내렸다.
현재 가장 널리 쓰이고 있는 AD병리 진단기준은 1997년 발표된 National Institute on Aging (NIA) and the Reagan Institut of Alzheimer Association (AA) criteria, 즉 NIA-Reagan criteria를 업데이트하여 2012년 NIA-AA에서 제시한 것이다[
8,
9]. 기존 NIA-Reagan criteria는 치매 환자의 원인 질환이 AD인가에 대한 질문에 대답하기 위한 목적이 강하였으므로, 치매의 과거력이 AD 진단에 필수조건이었다. 그러나 확장되고 있는 AD스펙트럼, 즉 치매 증상이 없거나 경미한 AD 환자들이 있을 수 있다는 개념이 인식되면서, 임상증상과는 상관없이 AD의 신경병리적 변화 존재 여부가 중요하게 되었다. 따라서 AD의 병리진단에 가장 중요한 특징인 신경판(neuritic plaques)과 신경원섬유매듭(neurofibrillary tangles)의 단계를 통합하여 사용하던 기존 NIA-Reagan criteria에 베타아밀로이드 침착 단계를 추가한 NIA-AA 신경병리진단 가이드라인이 만들어졌다.
베타아밀로이드와 신경원섬유매듭은 AD가 진행하면서 뇌 영역 전반에 걸쳐 일정한 패턴으로 축적된다. 따라서 특정 뇌 영역에서의 베타아밀로이드침착과 신경원섬유매듭의 축적 여부, 베타아밀로이드 플라크의 축적 정도에 따라 AD 신경병리 단계가 결정된다. 먼저 베타아밀로이드 침착은 Thal 단계(Thals phase, A)에 따라 5단계(단계1. 피질, 단계2. 변연계, 단계3. 피질하회백질, 단계4. 뇌간, 단계5. 소뇌)로 평가하고 이를 다시 네 단계로 분류한다(A0: 베타아밀로이드 축적 없음, A1: Thal 1단계와 2단계, A2: Thal 3단계, A3: Thal 4단계와 5단계). 두 번째, 신경원섬유매듭 축적은 Braak & Braak 단계(Braak & Braak stage, B)에 따라 6단계(단계1. 뇌후각피질, 단계2. 해마, 단계3. 편도, 단계4. 변연피질, 단계5. 신피질, 단계6. 일차운동감각피질)로 구분하고 이 역시 네 단계로 다시 분류한다(B0: 신경원섬유매듭축적 없음, B1: Braak & Braak 1-2단계, B2: Braak & Braak 3-4단계, B3: Braak & Braak 5-6단계). 마지막으로 베타아밀로이드플라크의 축적 정도는 피질에 축적된 베타아밀로이드신경판을 저배율에서 반정량적(sparse, moderate, frequent)으로 가늠하여 평가하는 CERAD, C 프로토콜을 사용하며, 이전 NIAReagan criteria에서 사용하던 평가법을 그대로 차용한 것이다(C0: 베타아밀로이드신경판 없음, C1: 베타아밀로이드신경판-sparse, C2: 베타아밀로이드신경과-moderate, C3: 베타아밀로이드신경판-frequent) (
Table 2) [
5,
6].
각 병리 변화, 즉 A, B, C별 단계는 0-3으로 표시되므로 A0B0C0부터 A3B3C3까지 다양하게 구성되며, 이를 “ABC”점수라 한다. AD의 병리 변화의 정도는 “ABC”점수에 따라 “High”, “Intermediate”, “Low”로 구분한다(
Table 3) [
5,
6].
환자는 전형적인 알츠하이머치매의 임상증상과 AD의 병리 소견을 보였으므로 진단에 딱히 어려운 점은 없었다. 그러나 최근 연구에 따르면, 임상적으로 알츠하이머치매로 진단받은 환자 중 약 22%의 환자들이 AD의 병리적 기준에 미치지 못하였고 이들에서 레비소체(29%), 혈관성 병변(13%), 전두측두치매(12%) 그리고 해마경화(hippocampal sclerosis, 8%) 등 다양한 병리 변화들이 관찰되었다[
10]. 뿐만 아니라, 임상적으로 알츠하이머치매를 진단받은 환자 중 약 42%에서만 ‘순수한’ AD병리가 확인되었고, 대다수에서는 혈관성 병변(22%)이나 우리 환자처럼 레비소체병리(10%)가 동시에 존재하였다[
11]. 따라서 분자맞춤형치료약제가 개발될 가까운 미래에 임상에서 정확한 기저 병리를 예측하고 그에 맞는 적절한 약제를 투여하기 위해서는 신경퇴행질환의 부검 증례를 늘리고, 임상진단과 병리진단을 비교, 분석하는 과정을 지속적으로 추진해 나가야 할 것이다.





 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



