고주파전극도자절제술 후 발생한 심방식도샛길과 감염심내막염에 의한 다발색전 뇌경색
Multiple Embolic Infarcts Caused by Infective Endocarditis Associated with Atrioesophageal Fistula after Percutaneous Radiofrequency Catheter Ablation for Atrial Fibrillation
Article information
Trans Abstract
Infective endocarditis (IE) is not a common cause of stroke. Considering the high mortality rates, however, IE should always be considered as a possible cause of stroke even when the chances are low. Atrioesophageal fistula is a life-threatening condition that can cause IE and subsequent stroke, but the diagnosis is often delayed due to its rarity. We report a case of multiple embolic infarcts caused by infective endocarditis associated with atrioesophageal fistula after radiofrequency catheter ablation for atrial fibrillation.
감염심내막염(infective endocarditis)은 중증도에 따라 임상 소견이 다양하여 진단이 어렵고, 합병증이 많으며 치사율이 높은 질환이다. 감염심내막염 환자들에 있어서 뇌농양, 뇌막염, 경련, 두통, 뇌병증과 같은 다양한 신경계 합병증이 동반되는 비율은 30%에 달하며, 이 중 뇌경색과 뇌출혈 등 뇌혈관질환은 20-25%를 차지한다[1-3].
감염심내막염의 발생 원인은 다양한데, 과거에는 치아 시술이나 기저의 판막 혹은 선천심장질환으로부터 발현하는 경우가 많았으나, 최근에는 해당 기왕력이 없는 사람에서도 발생하는 사례들이 보고되고 있다[1]. 최근 의학 기술의 발달로 다양한 심장 시술이 시행되고 있다. 특히 심인성 색전뇌경색의 가장 흔한 위험인자인 심방세동(atrial fibrillation)의 치료를 위하여 고주파전극도자절제술(radiofrequency catheter ablation)이 널리 시행되고 있으며, 비록 침습적 심장 시술 이후 발생한 심내막염의 경우 0.2% 미만으로 상당히 드문 편이나 시술에 의한 의인성 감염심내막염의 보고들이 늘어나고 있다[4]. 저자들은 심방세동 치료를 위하여 시행한 고주파 전극도자절제술의 합병증으로 인하여 형성된 심방식도샛길(atrioesophageal fistula)과 연관된 감염심내막염에 의하여 발생한 다발패혈 색전뇌경색이라는 매우 드문 증례를 경험하여 이를 보고하고자 한다.
증 례
58세 남자가 내원 당일 갑자기 발생한 좌측 상하지의 근력저하를 주소로 내원하였다. 환자는 고혈압과 당뇨병 과거력이 있고, 5년 전 관상동맥질환으로 관상동맥우회로조성술 수술력이 있으며, 20년 전 말기 신장질환으로 신장 이식을 받고 면역억제제를 복용 중이었다. 심방세동으로 edoxaban 15 mg 복용 중이었으며, 내원 3주 전에는 심방세동 치료를 위하여 경피 고주파전극도자절제술을 시행받았다. 내원 1주 전 치과에서 간단한 검진을 받았으나 침습적 치료는 없었음이 확인되었다. 최근에 열이 나거나, 상기도 감염을 시사하는 증상은 없었다. 내원 당시 활력징후는 혈압 173/71 mmHg, 맥박 110회, 체온 37.8도였다. 신경학적 진찰에서 의식은 명료하였고, 좌측 상하지에 medical research council 척도 1-2의 위약을 보이며 NIH 뇌졸중척도(National Institutes of Health Stroke Scale)는 총 6점이었다(운동 항목 상지 3점, 하지 3점). 청진 시 심잡음은 들리지 않았고, 손가락 또는 발가락에서 출혈 병변은 관찰되지 않았다. 일반혈액검사 및 염증표지자를 포함한 기본 혈청검사는 모두 정상 소견을 보였다. 내원 당일 시행한 뇌 전산화단층촬영 혈관조영술에서 뇌출혈이나 뇌혈관폐색 소견은 보이지 않았으나, 뇌 자기공명영상 확산강조영상에서 양측 전두엽과 두정엽의 다발색전 양상의 고신호강도 병변이 보였다(Fig. 1-A).

(A) Diffusion weighted image on the first day of admission shows acute multiple embolic infarction in bilateral frontal and parietal lobes. (B) On the second day of admission, follow-up imaging shows multiple acute infarctions in bilateral frontal, parietal, occipital lobes, right basal ganglia, and cerebellum. Gradient echo image reveals hemorrhagic transformations in the right parietal lobes, cerebellum, and bilateral occipital lobes.
내원 2일째, 고열과 두 차례의 전신강직간대발작이 발생하였고, 의식은 혼미 상태로 저하되었다. C-반응단백질이 27.3 mg/L로 상승하여 경험적 항생제 치료(tazolactam 2.25 g, q8hrs)를 시작하였다. 추적관찰로 시행한 뇌 자기공명영상 확산강조영상에서 이전 검사상 보이지 않았던 새로운 다발성 고신호강도 병변과 출혈변환이 관찰되었다(Fig. 1-B). 가돌리늄T1강조조영증강영상에서 조영증강되는 소견은 관찰되지 않았다. 뇌척수액검사에서 뇌압은 23 cmH2O, 단백질 196.2 mg/dL, 포도당 48 mg/dL (혈청 포도당 94 mg/dL) 소견이 관찰되었으며, 적혈구와 백혈구는 확인되지 않았다. 내원 4일째, 첫 발열 당시 시행한 혈액 배양검사에서 Streptococcus anginosus가 동정되었고, C-반응단백질이 336.9 mg/L로 상승되어 vancomycin (500 mg, q24hr), meropenem (1 g, q12hr)로 항생제를 변경하여 투약하였다.
내원 5일째에 시행한 경흉부심초음파검사(transthoracic echocardiography)에서 전극도자절제술 이전에는 관찰되지 않던 좌심방 후방부의 불규칙한 모양의 증식증(vegetation)이 관찰되었다(Fig. 2). 흉부 컴퓨터단층촬영에서는 좌심방과 식도 사이 샛길로 인한 공기 방울 음영이 좌심방 및 종격동 부위에서 확인되었다(Fig. 3). 환자는 Duke진단기준(diagnostic criteria)상 주진단기준 2개(혈액배양검사 양성, 심초음파상 증식물 양성)와 부진단기준 2개(발열, 선행 심장질환)에 부합하여 감염심내막염으로 진단되었다.
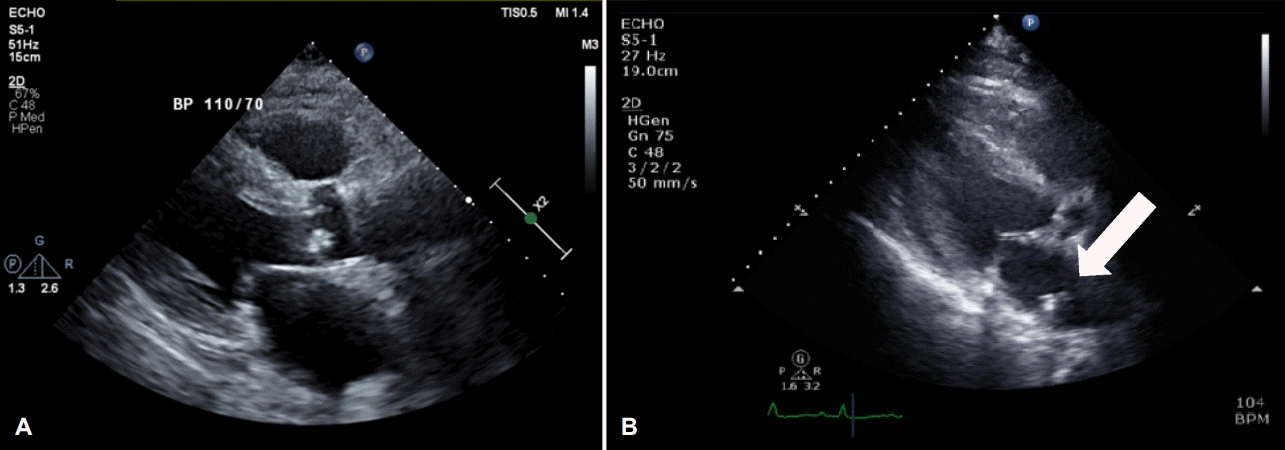
(A) There is no echogenic mass on the transthoracic echocardiography taken three weeks before admission immediately after radiofrequency catheter ablation. (B) On the fourth day of admission, newly detected echogenic mass, possibly vegetation (white arrow) is detected and the lesion was attached on the posterior wall of the left atrium.
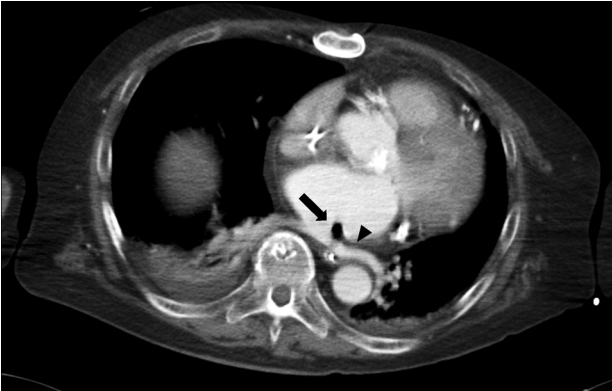
Air bubble in the left atrium (black arrow) and some air in the mediastinum (black arrowhead) on the axial contrast-enhanced chest computed tomography image, consistent with an atrioesophageal fistula.
입원 8일째, 환자는 좌심방 및 식도벽 복구수술과 폐 좌하엽절제술을 시행받았다. 내원 2개월까지 경련의 재발은 없었으나, 환자의 의식은 여전히 혼미 상태로 호전이 없었다. 재시행한 뇌 자기공명영상에서 대뇌, 뇌간 및 소뇌의 새로운 급성뇌경색 병변들이 발견되었다. 환자는 지속적인 광범위 항균제 치료에도 불구하고 회복되지 않는 패혈쇼크(septic shock)의 진행으로 인하여 내원 59일째 사망하였다.
고 찰
본 증례는 심방세동 치료를 위하여 시행한 고주파전극도자절제술 이후 드물게 일어나는 합병증인 심방식도샛길에 기인한 심내막염에 의하여 발생한 뇌경색에 대한 증례보고이다. 체계적 문헌고찰에 따르면, 2015년까지 전 세계적으로 보고된 전극도자절제술 이후 심방식도샛길이 발생한 경우는 총 41증례가 있었고, 이 중 신경계 증상이 동반된 경우는 27예였다. 뇌경색이 발생한 경우는 10예였으며, 이 가운데 심장내 혈전이 확인된 심내막염의 경우는 1예였다[3,5-7]. 국내에서 심방식도샛길과 연관되어 뇌경색이 발생한 증례보고는 1예가 있으며, 해당 증례는 Duke진단기준상 가능감염심내막염(possible infective endocarditis)으로 경흉부심장초음파에서 이상 소견이 발견되지 않았다[8]. 본 증례는 경흉부심장초음파에서 좌심방 후벽에 세균 증식물이 관찰되고 혈액배양검사상 Streptococcus anginosus가 동정되었으며, 발열과 선행 심장질환이 있어 Duke진단기준상 확정감염심내막염(definite infective endocarditis) 진단기준을 만족하여 국내에서는 다발색전경색의 원인으로서 확정 진단된 감염심내막염을 일으킨 심방식도샛길 증례의 첫 보고가 되겠다.
최근 심방세동의 유병률이 증가함에 따라 고주파전극도자절제술의 시행 빈도가 증가하고 있다. 비록 그 발생률은 0.03-0.15%로 매우 낮은 편이나, 심방세동 치료를 위한 심내막절제술시 좌심방 후방부와 가장 가까운 부위인 식도가 손상을 받기 쉬운 것으로 알려져 있으며[9], 이로 인하여 시술과 연관된 의인성 심방식도샛길이 발생할 수 있다[8]. 심방식도샛길 발병 환자의 초기 증상이나 징후는 대부분 비특이적으로 나타나는데, 가장 흔하게는 발열(75%)이 있을 수 있으며, 이 외에도 흉부 불편감, 피로감, 오심, 구토, 연하곤란, 호흡곤란, 객혈 등이 나타날 수 있다. 식도를 통하여 들어간 음식물이나 균이 심장으로 침투하게 될 경우에는 패혈성색전이 심내막염을 일으키게 되고, 이로 인하여 의식저하, 일과성뇌허혈발작, 반신마비, 경련 등과 같은 신경계 증상이 69%에서 나타나는 것으로 알려져 있다. 선행 연구들에 따르면, 심방식도샛길의 발생 시점은 대개 1-4주가 경과한 시기로, 샛길이 시술 과정 중 발생한 직접적 손상으로 인하여 발생한다기보다는 열손상(thermal injury), 절제술 과정에서 종말세동맥(end arteriole)이 폐색되면서 발생하는 허혈 손상 혹은 위산 역류에 따른 손상 악화 등에 의한 간접적인 기전으로 알려져 있고, 그 발생 시기는 증례마다 크게 다르다. 따라서 단순히 임상양상 및 시술 시기로부터의 기간만으로 심방식도샛길 여부를 판단하는 것은 쉽지 않고, 이로 인하여 대개 심방식도샛길의 진단은 이른 시기에 이루어지지 않는 경우가 대부분이다[8,9].
본 환자는 초기에는 편측 마비만 나타났고, 흉통, 호흡곤란 등의 증상이 없었으며 내원 초기에 발열은 37.8도였고, 내원 2일째가 되어서 고열이 발생하였다. 초기 신체검진에서 감염심내막염을 추정할 수 있는 Osler’s node, Roth spot 등과 같은 전형적 소견이 관찰되지 않았으며, 청진상에서 심잡음은 들리지 않았다. 뇌척수액검사를 통하여 중추신경계감염을 배제하였고, 뇌경색에 대한 색전원인을 찾기 위하여 진행한 경흉부심초음파상에서 발견된 심장내 세균증식물과 혈액배양검사상 세균이 동정되었으며, 발열, 선행 심장질환으로 감염성 심내막염을 확정 진단할 수 있었다. 본 환자는 흉부컴퓨터단층영상에서 심방식도샛길이 발견됨으로써, 내원 3주 전 시행받은 심방세동 절제술로 인하여 의인성 합병증으로 심방식도샛길이 발생하여 이것이 심장으로 통하는 감염 경로가 되었을 것으로 추측되었다. 이처럼 감염심내막염은 임상 초기에 심장 관련 증상이 부재하고 청진상 이상 소견이 없을 수 있기 때문에 발병 초기에 진단하는 것은 쉽지 않다. 감염심내막염의 높은 치사율을 고려할 때, 감염 부위가 뚜렷하지 않으면서 발열이 있고 신경계 증상이 있으며, 최근 심장 시술을 받은 병력이 있을 경우 반드시 감염심내막염을 염두에 두어야 한다.
최근까지의 증례보고들에 따르면 전극도자절제술 이후 발생한 심방식도샛길 환자들의 경우에 있어 합병증에 의한 사망률은 80%까지 높게 보고되고 있다[10]. 감염심내막염과 심방식도샛길 모두 다양하고 비특이적으로 나타나는 임상양상들로 인하여 발병 초기에 심장질환임을 잘 인지하지 못할 수 있고, 진단과 치료가 늦어져 사망률을 높일 수 있다[5,8]. 본 환자는 감염심내막염에 우선되는 항생제를 사용하였음에도 불구하고 호전을 보이지 않았는데, 발생 가능성이 낮은 상황이라고 할지라도 임상적 정황이 뚜렷하지 않았던 내원 당일에 보다 적극적인 검사(경흉부초음파, 흉부 컴퓨터단층촬영)가 시행되어 심방식도샛길과 심장내 증식물이 발견되었다면 더 이른 시기에 수술이나 항생제 변경이 고려되었을 수 있었을 것으로 판단된다.
통상적으로 심방식도샛길의 진단에서 경흉부심초음파는 유용한 정보를 주지 못하고, 경식도심초음파의 경우 공기색전증(air embolism)의 발생과 샛길의 크기를 커지게 할 수 있는 위험이 있어 우선적으로 권장되는 진단 도구는 아니다. 단, 경흉부심초음파는 검사의 위험성은 적으면서 감염심내막염의 진단에 직접적 근거인 증식증을 찾음으로써 추가적인 뇌경색을 막을 수 있고, 간접적으로는 심장과 심막 주변 공간의 공기를 발견한다거나 심낭 삼출액을 관찰하게 되어 심방식도샛길의 존재를 의심하고 빠른 치료를 돕게 할 수 있다[10]. 흉부 컴퓨터단층촬영 역시 다발뇌경색 환자에서 일반적으로 권고되는 진단 도구는 아니지만, 본 환자의 경우와 같이 심장 시술의 과거력이 있으나 심방식도샛길을 의심할만한 흉통, 연하장애, 오심, 구토와 같은 위장관 증상이 없는 경우에는 흉부컴퓨터단층촬영이 진단에 있어 중요한 도구가 될 수 있겠다. 실제로 약 90% 이상의 심방식도샛길 환자들이 조영증강 흉부 컴퓨터단층촬영을 통하여 진단되고 있다[8]. 따라서 저자들은 감염 부위가 뚜렷하지 않으면서 발열이 있고, 신경계 증상이 있으며, 최근 심장시술을 받은 병력이 있을 경우 발생 확률은 낮을지라도 반드시 심방 또는 심실과 연관된 샛길에 의한 감염심내막염을 염두에 두어야 하며, 흉부 컴퓨터단층촬영을 통하여 심방식도샛길 여부를 확인하고, 경흉부식도초음파를 통하여 감염심내막염 여부를 확인할 것을 권고한다.
이처럼 심장 시술 이후 발생한 감염심내막염은 중증도에 따라 조기 약물 치료와 수술적 치료가 입원 기간을 단축시키고 생존율을 향상시킬 수 있다. 때문에, 본 증례와 같이 뇌경색으로 내원한 환자에서 비교적 최근의 심장 시술을 받은 병력이 있고 열이 난다면 심방식도샛길의 가능성에 대하여 즉각적인 심초음파 시행 또는 흉부 컴퓨터단층촬영을 통한 이차 의인성 합병증과 감염심내막염의 여부를 확인하는 것이 중요하다.