| J Korean Neurol Assoc > Volume 36(3); 2018 > Article |
|
비후경수막염(hypertrophic pachymeningitis)은 경막의 염증질환으로 주로 두통이나 뇌신경 이상으로 발현되며 뇌영상검사에서 경막이 비후되어 있고 뚜렷하게 조영증강 된다[1]. 결핵균 진균 등에 의한 감염, 임파종 등의 종양, 류마티스관절염 유육종증(sarcoidosis) 등 자가면역질환이 비후경수막염의 주요한 원인이며 원인을 찾기 위한 검사에서 원인을 특정할 수 없는 경우에는 특발성으로 분류된다[1]. 감염이나 종양이 배제되고 항중성구세포질항체(antineutrophil cytoplasmic antibody, ANCA)가 양성인 경우 이 항체와 연관된 혈관염이 비후경수막염의 원인이라고 할 수 있는데 이러한 경우는 증상이 주로 중추신경계나 상기도에 제한되어 나타나고 폐나 신장의 침범은 드문 것으로 알려져 있다[2]. 폐나 신장이 침범되는 경우 신속하게 진단하여 적절한 치료를 하지 않으면 장기가 심각하게 손상될 가능성이 높으므로 주의해야 한다[3]. 저자들은 ANCA와 연관된 비후경수막염 경과중에 소수면역급속진행사구체신염(pauci-immune rapidly progressive glomerulonephritis)이 발생한 환자를 경험하였는데 ANCA와 연관된 비후경수막염은 초치료 후에도 꾸준히 추적관찰하여 다른 장기의 침범 여부를 관찰해야 함을 시사하는 증례라고 생각하여 보고하고자 한다.
64세 남자가 3주 전부터 발생하여 점차 심해지는 두통으로 신경과 외래에 내원하였다. 두통이 발생하기 전 5개월 동안 만성 중이염으로 치료를 받고 있었고 근래에 중이염은 없었다. 뻐근하거나 짓누르는 듯한 두통이 머리 전체에 시각아날로그척도 3-8 정도로 악화와 완화를 반복하면서 거의 하루 종일 지속되었다. 간혹 경미한 구역은 있었으나 구토는 없었으며 진통제를 복용하면 3-4시간은 견딜 만하였지만 내원하기 1주일 전부터는 두통으로 수면 중에 깨어나기도 하였다. 활력징후는 정상 범위였으며 다른 신체검사와 신경학적 진찰은 정상이었다.
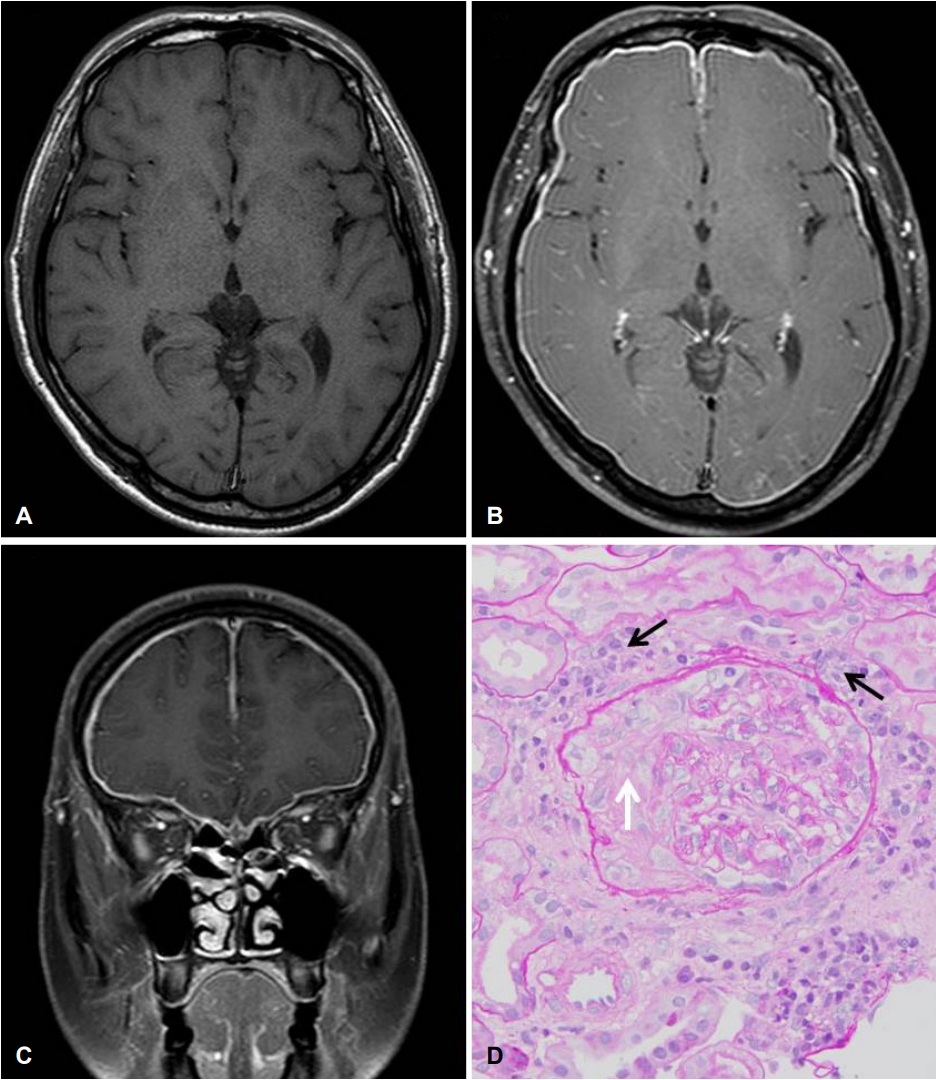
혈액검사에서 백혈구 13,400/μL였고, C-반응단백질이 7.50 mg/dL로 증가된 것 이외에 특이 소견은 없었다. 뇌자기공명영상에서 경막이 전체적으로 비후되어 있었고 조영증강되었다(Fig. A-C). 비후경수막염에 의한 두통으로 판단하고 비후경수막염의 원인을 찾기 위한 검사를 하였다. 뇌척수액검사에서 압력 29 cmH2O, 단백질 33 mg/dL, 포도당 77mg/dL, 적혈구 0/μL, 백혈구 8/μL (단핵구 100%)였고 뇌척수액 배양검사, 결핵균에 대한 중합효소연쇄반응, 크립토코쿠스 항원검사는 음성이었다. 뇌척수액의 세포검사에서 악성세포는 없었고 뇌척수액과 혈액의 종양표지자도 정상 범위였으며 말초혈액펴바른표본(peripheral blood smear)에서도 악성세포는 없었다. 또한 흉부 및 복부의 컴퓨터단층촬영도 정상이었다. 자가면역질환을 감별하기 위한 검사에서 류마티스인자, 항핵항체, 안지오텐신전환효소, 루푸스항응고인자는 모두 음성이었고 항인지질항체, 항트롬빈 제3인자도 정상 범위였다. 단백분해효소-3 (proteinase-3, PR3) ANCA (PR3-ANCA)는 음성이었으나 골수세포형과산화효소(myeloperoxidase, MPO) ANCA (MPO-ANCA)는 98.0 U/mL (참고 범위 <18.0 U/mL)로 양성이었다.
MPO-ANCA와 관련된 비후경수막염으로 진단하고 프레드니솔론 60 mg을 매일 투여하기 시작하였다. 프레드니솔론을 투여한 다음날부터 두통은 시각 아날로그 척도 1-2 정도로 호전되었고 1주일 후 C-반응단백질도 3.64 mg/dL로 감소하여 프레드니솔론 20 mg을 매일 투여하면서 퇴원하였다. 프레드니솔론을 하루 10 mg으로 유지하면서 문제없이 지내던 중 퇴원 3개월 후부터 전신에 부종이 발생하였다. C-반응단백질은 6.82 mg/dL로 상승하였고 총단백질(5.8 g/dL), 알부민(2.8 g/dL)은 감소하였고 혈중요소질소(38.8 mg/dL), 크레아티닌(1.99 mg/dL)이 상승하였다. MPO-ANCA는 >100 U/mL로 양성이었다. 소변검사에서 요단백(2+), 현미경적 혈뇨(적혈구 20-29/HPF)가 보였고 이형성적혈구가 88%로 급성신부전 및 신증후군 소견을 보여 신장내과에 입원하여 신장조직검사를 하였다. 광학현미경검사에서 사구체 14개 중 12개에서 사구체경화증이 보였고, 3개에서 반월상(crescent)이 관찰되었으며 간질(interstitium)에서는 혈관염, 심한 염증세포의 침윤과 섬유화가 관찰되었다(Fig. D). 면역형광현미경검사에서 면역글로블린침착은 없었고 전자현미경검사에서 면역복합체 침착이 관찰되지 않아 소수면역(pauci-immune) 사구체신염으로 판단되었다. 스테로이드충격요법(methylpredenisolone 1,000 mg/일, 3일)을 시행하였고 이후 프레드니솔론과 시클로포스파미드(cyclophosphamide)를 투여하였으며 약 8개월이 경과한 시점의 크레아티닌은 2.5 mg/dL 정도이며 두통은 없는 상태이다.
약 5개월간 중이염으로 치료를 받았던 64세 남자가 아급성으로 점차 심해지는 두통으로 내원하였고 뇌자기공명영상에서 비후경수막염이 발견되었다. 원인을 찾기 위한 검사를 통하여 MPO-ANCA와 관련된 비후경수막염으로 진단한 후 스테로이드치료로 두통은 호전되었으나 경과중에 소수면역 급성진행사구체신염이 발생하였던 드문 증례이다.
ANCA가 생기는 기전과 이 항체가 질병을 일으키는 기전은 명확하지 않으나 이 항체가 광범위한 조직손상에 직접적으로 관여한다고 알려져 있다[4]. ANCA는 면역형광염색에서 보이는 양상에 따라 세포질형과 핵주위형으로 분류하는데 세포질형은 PR3-ANCA이고 핵주위형은 MPO-ANCA이다.
ANCA와 연관된 혈관염의 흔한 증상은 피로, 열, 체중감소, 관절통, 비염, 기침 등의 전신증상이며 이러한 증상이 특정한 장기를 침범하지 않고 수주 혹은 수개월간 지속될 수 있다. 코, 귀, 호흡기, 신장, 피부, 신경계 등을 주로 침범하며, 재발할 때는 처음과는 다른 장기를 침범할 수 있다. 본 증례처럼 중이염, 부비동염, 비염으로 자주 발현하고 많은 환자가 중이염으로 인하여 청력을 잃는데[5] 비후경수막염 환자에서 중이염이나 부비동염을 앓은 병력이 있는 경우 세균이 경수막을 침범한 것을 배제하면 ANCA와 관련된 경수막염을 의심해볼 수 있다. 신장의 침범 여부가 임상적으로 매우 중요하며 일단 신장기능이상을 시사하는 임상증상이 발생하는 경우 적절히 치료하지 않으면 대부분 만성신부전으로 이행한다[3]. 신경계는 다발성단일신경염(mononeuritis multiplex), 감각신경병증, 뇌신경장애, 중추신경계의 종괴성병변, 경수막염 등으로 침범될 수 있다. 활동 사구체신염, 폐출혈, 뇌혈관염, 진행 말초신경병증 또는 뇌신경병증, 안와거짓종양(orbital pseudotumor) 등 장기의 기능을 심하게 손상시킬 수 있는 양상으로 발현하는 경우 초치료로 글루코코르티코이드와 시클로포스파미드나 rituximab을 사용한다[6]. 본 증례는 초치료로 시클로포스파미드나 rituximab을 사용하지 않았다는 점에서 아쉬운 점이 있다.
ANCA와 연관된 비후경수막염은 중년 이상의 연령대에서 두통이나 뇌신경이상으로 발현하고 면역억체치료에 비교적 잘 반응하나 재발할 수 있다[7]. ANCA와 연관된 혈관염을 앓았던 병력이 있는 경우도 있지만[7] 대부분은 없으며 특발 비후경수막염에 비하여 재발빈도가 높고 대부분은 혈관염의 증상이 주로 중추신경계에 한정되어 나타난다[2].
ANCA와 연관된 비후경수막염은 혈관염의 증상이 대부분 중추신경계에 제한적으로 나타난다고 알려져 있으나 본 증례처럼 신장 등 다른 장기를 침범할 수 있고 이러한 경우 신속하게 진단하고 치료해야 장기의 기능을 유지할 수 있으므로 비후경수막염 치료후에도 꾸준히 추적관찰하여 다른 장기의 침범 여부를 관찰하는 것이 중요하다.
REFERENCES
1. Brüggemann N, Gottschalk S, Holl-Ulrich K, Stewen J, Heide W, Seidel G. Cranial pachymeningitis: a rare neurological syndrome with heterogeneous aetiology. J Neurol Neurosurg Psychiatry 2010;81:294-298.


2. Yokoseki A, Saji E, Arakawa M, Kosaka T, Hokari M, Toyoshima Y, et al. Hypertrophic pachymeningitis: significance of myeloperoxidase anti-neutrophil cytoplasmic antibody. Brain 2014;137(Pt 2):520-536.


3. Langford CA, Fauci AS. The vasculitis syndromes. Kasper D, Fauci A, Hauser S, Longo D, Jameson J, Loscalzo J. Harrison's Principles of Int ernal Medicine. 19th ed. New York: McGraw-Hill, 2014.
4. Jennet JC, Falk RJ. Pathogenesis of antineutrophil cytoplasmic autoantibody-mediated disease. Nat Rev Rheumatol 2014;10:463-473.


5. Seo P, Stone JH. The antineutrophil cytoplasmic antibody-associated vasculitides. Am J Med 2004;117:39-50.


Figure.
Radiological and pathologic findings of the patient. T1 weighted axial (A) and gadolinium-enhanced T1 axial (B) and coronal (C) images exhibit diffuse enhancement and thickening of the pachymeninx. (D) The glomerulus shows segmental sclerosis with cellular crescent (white arrow) in the Bowman space and many mononuclear inflammatory cells (black arrows) are accumulated in the interstitium (hematoxylin & eosin stain, ×400).
- TOOLS
-
METRICS

-
- 0 Crossref
- 0 Scopus
- 4,320 View
- 113 Download
- Related articles
-
Clinical Reasoning: Two Patients Presenting with Neuropathic Pain in Lower limbs2022 August;40(3)
Neurofibromatosis Type 1 with Idiopathic Hypertrophic Pachymeningitis2022 May;40(2)
A 59-Year-Old Man Presenting with Dyspnea and Limb Paralysis2022 May;40(2)
A 52-Year-Old Female Presenting with Dysphagia2021 August;39(3)
Neurolymphomatosis Presenting as Hypertrophic Brachial Plexopathy2021 May;39(2)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



