심장이식 후 발생한 가역적뇌혈관수축증후군
Reversible Cerebral Vasoconstriction Syndrome after Heart Transplantation
Article information
Trans Abstract
Reversible cerebral vasoconstriction syndrome (RCVS) is characterized by severe headaches with or without other acute neurological symptoms, and diffuse segmental constriction of cerebral arteries that resolves spontaneously within 3 months. A 44-year-old woman underwent heart transplantation due to primary amyloidosis with heart involvement. She started to have a seizure after three hours after the heart transplantation, and her consciousness was not recovered. Computed tomography and transcranial doppler sonography were used to diagnose RCVS, and contracted vessels were recovered after oral nimodipine administration.
가역적뇌혈관수축증후군(reversible cerebral vasoconstriction syndrome)은 벼락두통(thunderclap headache) 시 반드시 감별해야 하는 질환 중 하나로, 광범위한 뇌혈관수축으로 인해 발생하며 대개 3개월 이내 호전되는 경과를 보인다[1]. 가역적뇌혈관수축증후군은 다양한 원인에 의해 발생하지만, 심장수술 이후 발생하는 경우는 매우 제한적으로 보고되고 있다.
최근 저자들은 심장이식 후 의식의 변화가 있던 환자에서 가역적뇌혈관수축증후군을 진단한 경험이 있어, 두개경유도플러(transcranial doppler, TCD)를 통한 뇌혈동학적 변화와 함께 보고하고자 한다.
증 례
다발골수종(multiple myeloma) 및 원발아밀로이드증(primary amyloidosis)의 심장 침범에 의해 심한 호흡곤란을 호소하는 44세 여성이 심장이식을 위해 입원하였다. 다발골수종은 항암 치료 후 혈액학적으로 완전관해 상태였으나, 심장아밀로이드증으로 인한 심손상이 비가역적이었기 때문에 심한 심부전 상태였다. 심장초음파검사상 심박출률은 20-25%로 감소되어 있었고, New York Heart Association (NYHA) 기능분류 3의 호흡곤란을 동반하였으며, 오랜 병상 생활로 제대로 걷지는 못하는 상태였으나 의사소통에는 아무런 문제가 없었고, 두통 등 중추신경계 증상은 호소하지 않았다. 수술 전 수축기 혈압은 80-100 mmHg 정도로 유지되었다. 2016년 12월 29일 심장이식수술이 끝난 후 3시간 정도 경과한 뒤 환자는 오른쪽 입과 팔을 움찔거리는 경련을 하기 시작하였고, 경련이 지속되어 뇌전증지속상태(status epilepticus) 진단하 미다졸람(midazolam) 6 mg, 로라제팜(lorazepam) 6 mg을 투약하였으나 증상의 호전이 없어 레비티라세탐(levetiracetam) 1,000 mg, 발프로에이트(valproate) 1,200 mg 투약하였고, 이후 케타민(ketamine), 펜토바르비탈(pentobarbital)로 혼수 치료를 시작하였다. 치료 시작 후 12시간 경과 후부터 임상적으로 경련을 하지 않게 되었고, 뇌파에서도 돌발파억제(burst suppression) 소견이 관찰되었다. 심장수술 뒤 삽입된 임시심장조율와이어 때문에 뇌 자기공명영상(magnetic resonance imaging, MRI)은 촬영할 수 없어서 시행한 비조영증강 뇌컴퓨터단층촬영(computed tomography, CT)상 이상 소견은 관찰되지 않았다. 경련의 원인을 감별하기 위해 시행한 요추천자에서 뇌압이 37 cmH2O로 측정되었고, 뇌척수액(cerebrospinal fluid) 분석결과는 백혈구 1/μL, 적혈구 1/μL, 단백 61.6 mg/dL, 당 56 mg/dL 소견이었다. 뇌졸중 등을 감별하기 위해 시행한 CT혈관조영술 및 CT관류영상에서는 전대뇌동맥, 중대뇌동맥, 후대뇌동맥, 뇌기저동맥 등 주요 뇌내혈관에서 염주알실(string of beads) 모양으로 뇌혈관이 광범위하게 수축되어 있는 소견(Fig. 1-A)과 왼쪽 전두엽의 혈류감소 소견이 확인되었다. 뇌혈관의 수축을 추적검사하기 위해 시행한 TCD검사에서 좌측 중대뇌동맥의 평균혈류속도가 101-107 cm/sec으로 증가되어 있었으며, 박동성지수(pulsatility index)는 0.81-0.85였다(Fig. 2-A). CT혈관조영술 및 TCD 소견을 바탕으로 가역적뇌혈관수축증후군 진단하 니모디핀(nimodipine) 30 mg을 하루 세 번 투약하였다. 투약을 시작하고 5일 뒤부터 여전히 협조는 되지 않는 상태였으나 스스로 눈을 뜨는 시간이 더 길어졌다. 그리고 환자는 이식거부반응 예방을 위해 예정되어 있던 타크롤리무스(tacrolimus) 투약을 하였다. 5일 뒤 재시행한 TCD 결과 평균 혈류속도는 비슷하였으나 좌측 중대뇌동맥의 혈류는 이전과 비교하여 더 뚜렷하게 관찰되었다(Fig. 2-B). 환자는 심한 혈압 변동이 있어 니모디핀 30 mg을 하루 세 번에서 두 번으로 감량하였다. 그리고 6일 뒤 세 번째 TCD를 시행한 결과, 좌측 중대뇌동맥의 평균혈류속도가 72-85 cm/sec로 이전보다 호전되었고, 파형도 이완기 혈류의 경사도 완만해지는 변화가 관찰되었다(Fig. 2-C). 하지만 더 이상 신경학적인 호전은 보이지 않고 의식상태가 혼돈에서 반혼수 정도로 유지되는 모습을 보였다. 2개월 만에 다시 시행한 CT혈관조영술에서는 좌측 중대뇌동맥이 거의 정상으로 회복되어 있는 소견이 관찰되었다(Fig. 1-B). 환자는 3개월간 니모디핀을 투약하였고, 현재는 투약을 중단하였다. 현재 환자의 의식은 여전히 반혼수 정도로 유지되고 있고, 주변의 자극에도 크게 반응이 없는 모습으로 증상은 거의 호전되지 않았다. 이후 비조영증강 뇌 CT 촬영을 하였으나, 이전과 거의 변화가 없었다.
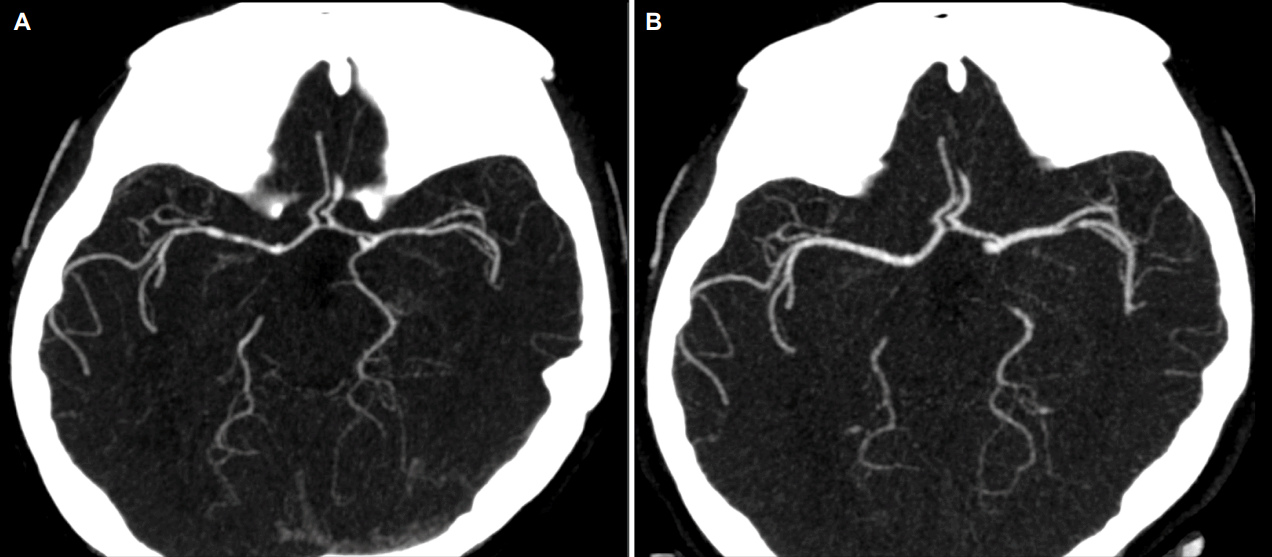
Brain computed tomography (CT) angiography. Initial CT angiography performed at 13 days after symptom onset revealed diffuse string-bead patterned vasoconstriction of entire basal cerebral arteries on both sides (A). The vasoconstriction improved in repeated CT angiography at 71 days from symptom onset (B).

Sequential changes of transcranial doppler sonographic findings. Initial transcranial doppler sonography performed at 14 days after symptom onset (A) showed the high mean flow velocity. On repeated exam at 5 days (B) and 11 days (C) after nimodipine infusion, mean flow velocity and pulsatility index decreased. PSV; peak systolic velocity, EDV; end diastolic velocity, MnV; mean blood flow velocity, PI; pulsatility index.
고 찰
가역적뇌혈관수축증후군에 대해서는 1960년대부터 보고되었는데, 초기에는 대뇌혈관의 가역적인 수축에 대해 여러 논문에 기술이 되어 있다. 그러다 2007년 Calabrese 등에 의해 ‘Reversible cerebral vasoconstriction syndrome’이라는 용어가 쓰여졌으며, 처음 진단기준이 제안되었다[2]. 이 기준에 따르면, 벼락두통이 있어야 하며, 증상 후 한 달 후에는 다른 증상이 생기지 않으며, 동맥파열성 거미막하출혈의 증거가 없어야 하고, 뇌척수액 분석에서 거의 정상이어야 하며, 뇌동맥에서 다양한 부분에 혈관수축이 관찰되어야 하고, 12주 이내에 회복이 되어야 한다[3].
가역적뇌혈관수축증후군에서 벼락두통이 대표적인 증상이지만, 그 외에도 경련(seizure), 뇌경색이나 가역적후뇌병증(posterior reversible encephalopathy syndrome, PRES)으로 인한 국소신경학적결손 증상이 동반될 수 있다. 가역적뇌혈관수축증후군의 약 25-60%에서는 유발인자가 알려져 있는데, 대표적인 유발인자로는 교감신경흥분제(sympathomimetic drug), 혈관작용약(vasoactive drug)과 임신 중과 출산 후, 수영, 편두통, 외상 등이 있다[1,4,5].
가역적뇌혈관수축증후군의 병태생리는 아직 명확히 밝혀지지는 않았지만, 교감신경의 과활동과 엔도텔린(endothelin) 기능 이상, 혈관긴장도의 조절장애, 혈액뇌장벽(blood-brain barrier) 파괴 등이 원인으로 지목되고 있다[3,6]. 그리고 가역적뇌혈관수축증후군에서 가역적후뇌병증이 동반되는 경우에도 혈압이 상승되어 있는 상태에서 뇌혈류자동조절능력의 저하와 면역억제제 사용으로 인한 엔도텔린 기능 이상이 혈액뇌장벽의 파괴를 일으킨다는 것이 가설로 제시되고 있다[7]. 가역적뇌혈관수축증후군은 보통 벼락두통과 함께, CT나 MRI의 혈관조영술로 진단하게 되며, 혈관 이상이 호전되는 가역성을 확인하는 것도 진단기준에 들어간다[1]. 가역적뇌혈관수축증후군의 치료는 우선 외부 원인인자를 제거하고, 니모디핀, 베라파밀(verapamil), 니페디핀(nifedipine) 등의 칼슘통로차단제(calcium channel blocker)를 경구 혹은 정맥 내로 투약할 수 있다[1,3,8]. 이러한 칼슘통로차단제는 수축되어 있는 혈관을 다시 이완시켜주는 역할을 하며, 4-12주 정도 투약하게 된다[1]. 만약 PRES가 동반되어 있는 경우 면역억제제 등의 유발약물이 있다면 중단하고 혈압을 낮추는 것이 필요하다[1,3].
본 증례는 심장이식 후 발생한 가역적뇌혈관수축증후군을 CT와 TCD로 진단한 예이다. 본 환자에서 가역적뇌혈관수축증후군을 일으킨 유발인자로는 심장이식 수술과 관련된 심한 스트레스, 심장 이식 후 급격한 심박출량 상승으로 인한 뇌혈류량의 급격한 변화, 또한 이에 동반하여 갑작스런 수축기혈압이 상승(20-30 mmHg)한 것 그리고 면역억제제 사용을 원인으로 생각해볼 수 있으나, 본 환자는 경련 후 면역억제제로 타크롤리무스를 사용하였다는 점에서 처음 증상은 면역억제제와 관련이 없으나 환자의 증상이 악화된 상태로 유지되는 것은 면역억제제 사용이 영향을 주었을 가능성도 있을 것으로 보인다. 이에 이식 후 면역반응 억제를 위해 타크롤리무스를 사용하였으나 단기간 사용 후 중단하였다. 동반된 경련은 광범위 혈관수축에 의한 혈관성부종으로 인한 증상으로 판단할 수 있다. 본 환자는 뇌 MRI를 촬영할 수 없어 증상이 호전되지 않는 명확한 원인을 알 수는 없으나 장기간 뇌전증지속상태에 있어 뇌가 광범위 손상을 받았을 가능성을 생각해볼 수 있다. 현재까지 심장이식 후 발생한 가역적뇌혈관수축증후군은 1예가 보고되어 있다. 50세 남자가 확장성 심근병증으로 심장이식수술을 받고 4일 후 전신간대발작이 발생하였고, 수술 후 7, 8일째 다시 전신간대발작이 있어 뇌 MRI 촬영 후 가역적뇌혈관수축증후군과 가역적후뇌병증이 진단되었다[9]. 그리고 폐이식수술 후 면역억제제를 사용하고 PRES가 진단된 5예가 있다. 모두 면역억제제를 사용하였고 시클로스포린(cyclosporine), 미코페놀레이트(mycophenolate), 타크롤리무스를 사용하였으나 다섯 번째 증례에서는 본환과 마찬가지 로 증상 발생 당시에는 면역억제제를 사용하지 않았고, 증상 발생 후 면역억제제를 사용하였으나 증상의 악화가 없었다[10]. 본 증례의 경우, 의식이 없는 환자가 대상으로, 환자가 벼락두통을 호소할 수 없었다는 것과 편측징후(lateralizing sign)가 없고, 뇌 MRI를 촬영할 수 없는 상황에서 진단이 이루어졌다는 점 그리고 치료과정 중 혈동학적 관찰을 위해 TCD를 이용할 수 있다는 점을 제시한 것이 이 증례의 성과라 할 수 있을 것이다.
최근 심장이식의 적응증이 점점 확대됨에 따라 심장이식을 받는 환자의 수도 늘어나고 있으며, 이에 따라 뇌경색, 뇌출혈, 과관류증후군 및 가역적뇌혈관수축증후군 등의 다양한 신경계 합병증이 발생하는 경우도 점점 많아질 것이라고 예측할 수 있다. 하지만 심장 이식 후에는 혈압 등 활력징후가 불안하고 의식이 없는 경우가 많고, 본 증례와 같이 인공심박동기를 삽입하는 등 MRI검사를 시행하기 어려운 경우가 있어서 뇌혈관계의 적절한 검사에 제한이 있는 경우가 종종 있다. 이러한 점을 고려하면 이동검사가 가능하고, 방사선 노출의 걱정이 없으며, 비침습적인 신경초음파검사는 심장이식 등 전후의 중환자에서 안전하고 간단하게 진단에 도움을 주고, 뇌혈관계의 변화를 모니터할 수 있으며 치료 중인 환자의 추적 관찰에도 유용한 검사로 생각된다[8].
본 증례를 통해 심장이식 후 갑작스럽게 발생한 신경학적 이상이 있을 경우 가역적뇌혈관수축증후군을 감별하는 것이 필요하며, 뇌혈동학적 변화의 추이를 관찰하기 위해서는 TCD 등 신경초음파검사가 유용하게 사용될 수 있다는 점을 제시하고자 한다.