자화율강조영상을 이용한 알츠하이머병과 뇌경색 환자의 뇌미세출혈 분포 분석
Distribution Analysis of Cerebral Microbleeds in Alzheimer's Disease and Cerebral Infarction with Susceptibility Weighted MR Imaging
Article information
Trans Abstract
Background
Cerebral microbleeds (CMBs) reflect cerebral small vessel disease and has a pathological role in Alzheimer's disease (AD) and stroke according to their distribution. We investigated to determine whether association of CMBs distribution in Korean patients with AD and cerebral infarction by susceptibility weighted imaging (SWI) which is a most sensitive magnetic resonance imaging technique for enhanced detection and localization of CMBs.
Methods
Seventy-one patients (AD 30, recent cerebral infarction 21, control 20) were included and 1.5 Tesla SWI was used to image. The Microbleed Anatomical Rating Scale (MARS) was used to localize each CMBs distribution (lobar versus basal ganglia/thalamus [deep], and infratentorial).
Results
The prevalence of CMBs was higher in AD and cerebral infarction than controls (p=0.004). Predilection of the total CMBs (n=71) were in order of lobar, basal ganglia/thalamus (deep), and infratentorial region (p=0.029). There was only significant predilection of CMBs in basal ganglia/thalamus (deep) region in cerebral infarction compared with AD (p=0.037) and controls (p=0.011). However, predilection of CMBs in lobar region than infratentorial region (p=0.019) in AD, and predilection of CMBs in basal ganglia/thalamus (deep) region than infratentorial region (p=0.033) in cerebral infarction were significant. Hypertension, a strong risk factor for hypertensive angiopathy was not significant in contributing CMBs prevalence in three groups even though the incidence of hypertension was higher in cerebral infarction than AD and controls.
Conclusion
Characteristic predilection pattern of CMBs distribution between AD and cerebral infarction through SWI might provide an imaging biomarker for differentiation between dementia due to cerebrovascular disease and cerebral degenerative disorders.
서 론
뇌미세출혈(cerebral microbleeds, CMBs)은 뇌의 소혈관 손상에 의해 초래되는 작은 출혈로서 혈철소(hemosiderin) 파괴로 인해 뇌자기공명영상(magnetic resonance imaging, MRI) 중 T2강조영상 혹은 기울기에코영상(gradient-echo imaging)에서 5-10 mm 이하의 저신호강도 병변(hypointense lesion)으로 관찰되는 병변이다. 뇌미세출혈은 백질고음영(white matter hyperintensity)이나 무증상뇌경색(silent infarct)처럼 일반적으로 우연히 발견되는 피질 혹은 피질하 혈관성 병변이지만 다발성일 경우, 뇌출혈의 위험도와 재발률이 증가하고, 급성기 혈관재관류치료나 만성기 항응고제 치료 시 출혈합병증을 가증시킬 수 있으며, 분포 영역과 개수에 따라 인지기능장애나 보행 및 운동장애를 초래할 수 있다고 하나[1], 아직까지 더 자세한 연구가 필요한 실정이다.
뇌미세출혈은 대뇌의 소혈관질환(small vessel disease)을 반영하는 소견으로 뇌아밀로이드 혈관병증(cerebral amyloid angiopathy, CAA)과 고혈압혈관병증(hypertensive angiopathy)에서 흔히 관찰된다. 따라서 뇌아밀로이드혈관병증과 고혈압혈관병증이 각각 주요한 병리소견의 하나인 알츠하이머병(Alzheimer's disease, AD)과 뇌졸중(stroke)에서 뇌미세출혈의 역할은 중요하다. 그러므로 혈관성 병태생리가 공존하는 알츠하이머병과 혈관치매(vascular dementia, VaD), 혹은 뇌졸중에서 뇌미세출혈의 발생빈도 및 분포 차이 등에 대한 분석이 인지기능장애나 치매 환자에서 퇴행질환과 뇌졸중의 감별에 유용할 수 있고[2], 특히 알츠하이머병에서 뇌미세출혈의 분포나 정도는 인지기능장애의 악화와 뇌미세출혈의 증가를 예측할 수 있으며, 뇌졸중에서는 뇌백질변화를 예측할 수 있는 등, 질환의 예후 예측 및 치료 방침에 도움을 줄 수 있다.
뇌미세출혈은 임상적으로 대부분 특별한 증상이 없어 환자가 스스로 자각하기 어려운 점, T1 혹은 T2강조영상과 같은 고식적인 MRI 기법만으로는 발견이 어려운 점으로 인해 간과되기 쉽다. 그러나 뇌미세출혈은 기울기에코영상 또는 자화율강조영상(susceptibility weighted image, SWI)에서 5 mm 이하의 둥근 저신호강도를 보이는 특징적인 병변을 보이는데, 특히 자화율강조영상에서 가장 고감도의 영상을 얻을 수 있다. 따라서 이러한 뇌영상 기법이 발전하면서 최근, 뇌미세출혈의 발견율이 높아지고 있고, 임상적으로도 다른 진단과의 감별에 응용하고자 뇌미세출혈의 영상화에 대한 관심이 점차 증가하고 있는 추세이다[2].
특히 자화율강조영상은 자기신호강도를 강화시키는 가공 과정에서 T2강조영상의 해상도를 증대시킬 수 있는 효과가 있어 기존의 기울기에코영상에 비해 다른 상자성을 지니는 물질에 대해 더 높은 감도의 이미지를 만들 수 있고, 또한 탈산소혈색소(deoxyhemoglobin) 혹은 혈철소(hemosiderin)가 포함된 출혈성 병리소견을 지니는 병변에 대한 높은 민감도 때문에 컴퓨터단층촬영에서 잘 발견되지 않는 출혈병변이나[3] 뇌경색 후 출혈변환(hemorrhagic transformation)을 찾는데 유용하다는 연구결과가 있으며[4] 신경학적 증상이 없던 파브리병(Fabry disease) 환자에서 기울기에코영상에서 보이지 않던 뇌미세출혈을 자화율강조영상에서 발견한 사례에서 그 유용성을 알 수 있다[5].
기존의 연구에서 기울기에코영상을 시행하였을 때, 정상인의 4.7% [6] 혹은 19% [7]까지 뇌미세출혈이 관찰되나 이는 나이가 많을수록 증가하여 80세 이상에서 약 36%까지 발견되며, 뇌졸중의 위험 인자가 있을 경우 더욱 증가한다[7]. 실제로 뇌경색 혹은 일과성허혈 발작 환자에서는 뇌미세출혈 발생율이 상당히 늘어나 23-31%에서 뇌미세출혈이 관찰될 수 있다고 보고된 바 있고[6], 특히 혈관치매 환자에서는 65-85%까지도 관찰된다고 한다[7]. 이에 못지 않게 경도인지장애(mild cognitive impairment, MCI)나 알츠하이머병 환자들에서도 뇌미세출혈이 각각 20-43%, 18-32% 정도 관찰되며, 더구나 안정MCI 환자(36%)에 비해 인지기능장애가 빠르게 진행되는 진행MCI 환자(31-58%)에서 뇌미세출혈이 더 많이 발견된다[7]. 따라서 뇌미세출혈의 정도나 분포양상은 이러한 질환에서 임상적으로 유용한 정보를 제공한다.
그러나 한국인에서 알츠하이머병 환자와 뇌졸중 환자의 뇌미세출혈의 유병률(prevalence) 및 분포에 대한 비교연구는 드물고, 기존의 기울기에코영상보다 뇌미세출혈의 발견율이 높은 자화율강조영상을 이용한 연구는 없어 이에 관한 정확한 정보를 얻기 어렵다[8,9].
따라서 본 연구는 한국인을 대상으로 뇌미세출혈에 대한 민감도가 높은 자화율강조영상을 이용하여, 알츠하이머병 환자와 뇌경색 환자의 뇌미세출혈의 빈도와 뇌미세출혈 영역 분포의 차이를 알아보고자 하였고, 또한 뇌경색의 주요한 위험인자이며 동시에 알츠하이머병에서도 위험인자로 고려되는 나이나 성별, 그리고 고혈압같은 요인이 뇌미세출혈 발생에 영향을 미치는지 조사하였다.
대상과 방법
영남대학교병원 신경과에서 2012년 6월부터 2년 동안 알츠하이머병과 급성뇌경색으로 진단을 받은 두 환자군을 대상으로 하였고, 주관적인 인지기능 장애를 주소로 내원한 건강한 성인을 대조군으로 하였다.
1. 대상
알츠하이머병군은 국소신경학적결손이 없으면서 DSM-IV(Diagnostic and Statistical Manual of Mental Disorders, fourth edition)의 치매 정의를 만족하고, NINCDS-ADRDA (National Institute for Neurological and Communicative disorders and Stroke/Alzheimer‘s Disease and Related Disorder Association)의 추정알츠하이머병(probable AD) 진단기준을 동시에 만족시키며 자기공명영상에서 인지기능장애를 일으킬 만한 기타 뇌병변이 없는 환자를 대상으로 하였다[10].
알츠하이머병군은 자기공명영상에서 관찰되는 백질변성(leukoaraiosis)이 Fazekas척도[11] 2 (moderate degree) 이하일 경우 포함시켰고, 뇌경색군은 급성뇌경색으로 입원한 환자로 알츠하이머병과 혼합 병태생리를 최대한 배제하기 위해 통괄피질위축척도(Global Cortical Atrophy Scale) [12] 2 (moderate atrophy) 이하만 포함하였으며, 대조군은 이 둘을 다 만족한 경우 포함되었다. 각 군의 나이와 성별에 대한 정보를 Table 1에 명시하였다.
모든 환자는 전반적인 인지기능을 확인하기 위해 한국판간이정신상태검사(Korean version of mini-mental status examination, K-MMSE)를 시행하여 평가하였다[13]. 또한 뇌경색의 주요한 위험인자 중 하나인 고혈압이 뇌미세출혈 분포에 영향을 미치는지 알아보고자 임상정보에 포함시켰다. 고혈압의 정의는 본원 내원 전부터 고혈압약을 복용하고 있었거나, 2회 이상의 방문에서 각각 2회 이상 반복 혈압측정 시 수축기혈압 140 mmHg 이상, 혹은 이완기혈압이 90 mmHg 이상인 경우 고혈압으로 정의하였다[14]. 본 연구는 영남대학병원 임상연구윤리심의 위원회(Institutional Review Board, IRB)의 승인을 받아 진행되었다.
2. 자기공명영상
모든 대상 환자들은 뇌자기공명영상(Intera Zyroscan 1.5T; Philips Medical System, Amsterdam, The Netherlands)을 시행하였다. 검사기법은 T2강조영상, T1강조영상, 액체감쇠역전회복영상(fluid attenuated inversion recovery imaging, FLAIR), 기울기에코영상, 자화율강조영상), 그리고 확산강조영상(diffusion weighted image, DWI)을 포함하였고 자화율강조영상을 제외한 영상의 절편두께는 5 mm로 하였다. 자화율강조영상의 영상조건(parameters)은 관심영역(field of view, FOV) 200 mm, 절편두께(slice thickness) 2 mm, 영상 수 70 slices, TR (repetition time) 33 msec, TE (echo time) 15 msec, 경사각도(flip angle) 15°, 여기횟수(number of excitation, NEX) 1로 하였다.
3. 뇌미세출혈의 평가
자기공명영상의 분석은 임상정보를 알지 못하는 2명의 신경과 전문의가 시행하여 합의하였다. 뇌미세출혈의 진단기준은 자화율강조영상 및 T2강조영상, T1강조영상을 이용하여 ⑴ 자화율강조영상에서 5 mm 이하의 원형의 저신호강도를 보이는 병변이면서, ⑵ T2강조영상에서 저신호강도로, 원형 또는 타원형의 모양이며, ⑶ 불루밍(blooming)효과를 가지는 병변으로 하되, ⑷ T1 및 T2 강조영상에서 고신호강도를 보이지 않아야 하며, 저신호강도 병변의 절반 이상은 뇌실질로 둘러싸여 있는 경우로, ⑸ 철분 및 칼슘 침착, 두개골 및 혈관신호가 아니며, ⑹ 외상성 광범위축삭손상의 과거력이 없는 경우로 하였다[6]. 이 진단기준을 만족하는 뇌미세출혈을 MARS (The Microbleed Anatomical Rating Scale)를 이용하여 다음과 같이 분포영역을 구분하였다[15]. 대뇌엽영역(lobar region), 기저핵/시상영역(basal ganglia/thalamus, deep region), 그리고 천막하영역(infratentorial region)의 세 영역으로 나누었고, 좌우 뇌미세출혈 개수를 합산하여 각 영역마다 총 개수를 구하였다(Fig. 1, 2).
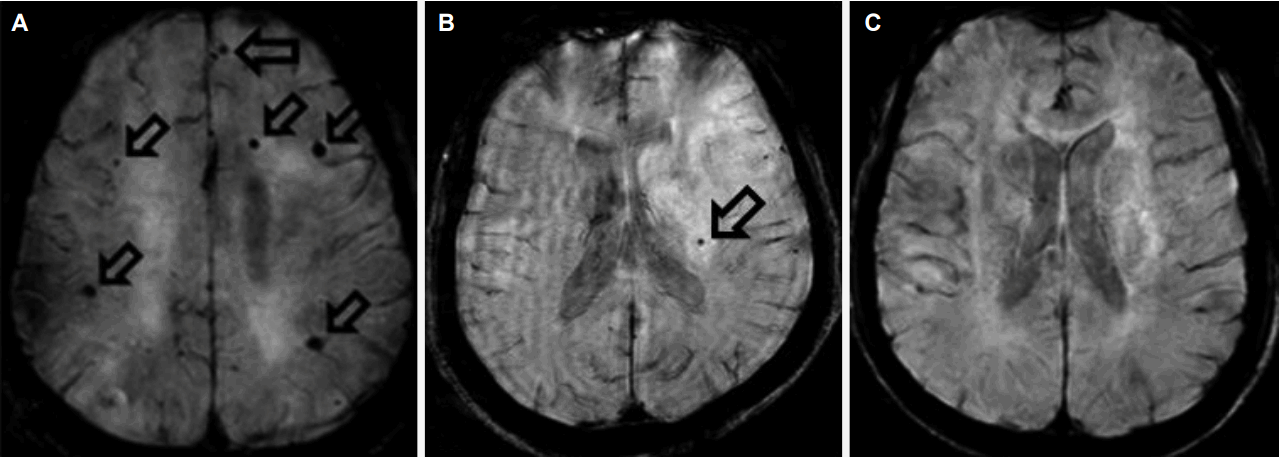
Representative cerebral microbleeds cases in Alzheimer’s disease, cerebral infarction, and control. (A) A 70-year old woman with Alzheimer's disease without arterial hypertension. Her K-MMSE score was 12. On axial SWI, 6 small hypointense foci are seen in the bilateral cerebral hemispheres (empty arrows, lobar microbleeds). (B) A 77-year old man with right occipital lobe infarction without arterial hypertension. His K-MMSE score was 15. On axial SWI, 1 small hypointense focus is seen in the left medial thalamus (empty arrow, basal ganglia/thalamus, deep microbleeds). (C) A 73-year old man in control patient. His K-MMSE score was 26. Any microbleeds are not seen on axial SWI. K-MMSE; Korean version of mini-mental status examination, SWI; susceptibility weighted imaging.
4. 자료 분석
통계분석은 SPSS version 19.0 (SPSS Inc., Chicago, IL, USA)을 이용하여 다음과 같이 하였다. 알츠하이머병군과 뇌경색군의 임상정보 분석을 위해 인구학적 특성과 임상특성은 백분율과 평균, 표준편차로 제시하였다. 각 그룹 간의 차이를 보기 위해 나이와 K-MMSE는 일원배치분산분석(One-way ANOVA)과 Bonferroni 사후검정(Bonferroni correction)으로, 성별의 차이는 Pearson카이제곱검정(Pearson's Chi-square test), 그리고 고혈압의 유무는 기대빈도가 낮아서 Fisher의 정확검정(Fisher's exact test)으로 각각 비교 검증하였다.
알츠하이머병군, 뇌경색군 그리고 대조군 간의 뇌미세출혈의 유병률의 비교는 Pearson카이제곱검정으로 하고, 대조군을 기준으로 두 질환군에서의 뇌미세출혈 발생의 교차비는 로지스틱회귀분석(logistic regression test)을 사용하여 교차비(odds ratio)를 구하였다. 또한 각군에서 MARS [15]에 따라 나눈 세 영역 중 뇌미세출혈의 발생이 많은 영역과 질환군에 따라 특징적으로 뇌미세출혈이 우세하게 발생하는 영역이 있는지 확인하기 위한 분석은 각군에서 영역마다 총 뇌미세출혈 개수의 평균값으로 반복측정분산분석(repeated measure ANOVA)을 시행하고 결과의 사후분석은 Bonferroni사후검정을 이용하였다.
연령, 성별, 그리고 고혈압이 뇌미세출혈의 발생에 미치는 영향은 독립t-검정(Indepenedent t-test), Pearson카이제곱검정 그리고 Fisher정확검정으로 각각 검증하였다. 모든 통계적 유의수준은 0.05 미만으로 하였다.
결 과
총 71명의 환자를 대상으로 하였으며 각 군의 평균 연령은 대조군 67세, 알츠하이머병군 73세 그리고 뇌경색군 72세로 대조군 보다 알츠하이머병과 뇌경색 환자의 연령이 높았고, 세 군 모두 남자가 여자보다 더 많았으나 세 군에서 나이와 성별에 통계적으로 유의한 차이는 없었다(나이: p=0.068, 성별: p=0.617). 그러나 K-MMSE점수와 고혈압 유무는 세 군 사이에서 유의한 차이를 보여 알츠하이머병군과 뇌경색군에서 대조군 보다 K-MMSE점수가 유의하게 낮았고(p<0.001), 고혈압은 뇌경색군에서 유의하게 많았다(p<0.001).
뇌미세출혈의 유병률은 대조군(6명/20명, 30%)에 비해 두 질환군에서 유의하게 높았고(알츠하이머병군 22명/30명, 73%; 뇌경색군 15명/21명, 71%; p=0.004), 대조군을 기준으로 뇌미세출혈 유병률의 교차비(odds ratio, OR)를 95% 신뢰구간(95% confidence interval, CI)으로 보았을 때 알츠하이머병군(p=0.004)과 뇌경색군(p=0.010) 모두 대조군보다 유의하게 높았다(Table 1). 이를 연령, 성별(남자), 고혈압 등의 세 위험인자가 뇌미세출혈의 발생에 영향을 주는지 보기 위해 분석하였을 때, 전체 연구대상(n=71)에서 뿐만 아니라 두 환자군 간의 비교에서도 세 인자 모두 뇌미세출혈의 발생에 미치는 영향은 유의하지 않았다(p>0.05).
MARS [15]의 세 영역에 따른 뇌미세출혈의 분포는 대조군과 알츠하이머병군에서는 대뇌엽, 기저핵/시상, 그리고 천막하 순으로 높았고, 뇌경색군에서는 기저핵/시상, 대뇌엽 그리고 천막하 순으로 분포가 높았다. 이를 전체를 대상(n=71)으로 분석하였을 때 세 영역에서 유의한 차이를 보여, 대뇌엽, 기저핵/시상, 그리고 천막하순으로 높았다(p=0.029, repeated measure ANOVA). 이를 다시 각군을 대상으로 사후검정(Bonferroni correction) 결과 상대적으로 뇌미세출혈의 수가 적은 천막하를 기준으로 각군에서 세 영역의 분포를 비교하였을 때 알츠하이머병군에서는 대뇌엽에서 천막하보다 뇌미세출혈의 분포가 유의하게 높은 반면에(p=0.019), 뇌경색 환자에서는 기저핵/시상 영역에서 천막하보다 뇌미세출혈의 분포가 유의하게 높았다(p=0.033). 그러나 대조군에서는 세 영역간에 유의한 분포차이는 없었다. 각군에서 뇌미세출혈의 분포의 대표적인 예를 그림으로 제시하였다(Fig. 2).
이러한 뇌미세출혈의 영역별 분포 차이를 세 군에서 비교하였을 때 뇌경색군에서 알츠하이머병군(p=0.037)과 대조군(p=0.011)에 비해 기저핵/시상 영역이 유의하게 우세하였다. 그러나 알츠하이머병군에서 대뇌엽 영역에 우세한 분포를 나타낼 거라는 예상과는 달리 알츠하이머병군이 뇌경색군과 대조군에 비해 유의한 차이는 없었다(Table 2).
고 찰
이 연구는 본원 신경과를 방문한 환자를 대상으로 뇌미세출혈에 대해 민감도가 높은 자화율강조영상을 이용하여 알츠하이머병 환자와 뇌경색 환자의 뇌미세출혈의 빈도와 뇌영역 분포 차이를 조사 하였고, 또한 뇌경색의 주요한 위험인자이며 동시에 알츠하이머병에서도 위험인자로 고려되 나이나 성별(남자) 그리고 고혈압등의 요인이 고령의 한국인 뇌미세출혈의 발생에 영향을 미치는지 알아보고자 하였다.
본 연구 결과 뇌미세출혈의 발생이 알츠하이머병군과 뇌경색군에서 대조군에 비해 유의하게 높아 두 질환 다 뇌미세출혈의 병리가 연관됨을 시사하였다. 또한 각 군에서의 영역별 분포가 알츠하이머병군은 천막하에 비해 대뇌엽이, 뇌경색군은 천막하에 비해 기저핵/시상 영역에 각각 우세한 것은 알츠하이머병과 뇌졸중의 뇌미세출혈 발생에 천막상부의 특징적 혈관병리가 작용할 것이라는 것을 예측하게 한다. 다만 본 연구에서 세 군 모두의 뇌미세출혈 발생율이 주로 기울기에코영상이나 T2강조영상으로 관찰한 과거 보고에 비해 높아 자화율강조영상의 출혈병변에 대한 민감성을 시사하였다.
본 연구에서 뇌미세출혈의 발생요인은 전체 연구대상군을 분석하였을 때나 알츠하이머병과 뇌경색군 만을 대상으로 분석하였을때도 연령이나 성별, 그리고 고혈압 등의 변수에는 영향을 받지 않는 것으로 나타나, 뇌경색 환자의 기저핵/시상 부위에서 뇌미세출혈 빈도가 높은 것은 뇌경색 환자에서 상대적으로 고혈압의 유병률이 높은 요인이 기여할 것이라는 예측과는 달랐다. 과거, 고혈압 환자에서 뇌내출혈(intracerebral hematoma)이 기저핵 부위에서 호발하고, 고혈압으로 인한 소혈관질환(small vessel disease)이 심해질수록 뇌미세출혈이 증가하는데 이는 소혈관질환의 위험인자 중 하나인 고혈압이 소혈관질환의 호발 부위인 기저핵에서 뇌미세출혈의 위험을 증가시킬 수 있으며, 뇌미세출혈이 열공경색과 동일한 병리학적 질환군이라는 것을 시사한다고 하였다[16-18]. 하지만 본 연구결과는 뇌미세출혈의 발생에 연령이나 고혈압 등의 이차요인이 영향을 미치지 않는 것으로 나타나 각 질환군에서 일차적인 병리기전이 뇌미세출혈의 발생에 더욱 중요하다는 것을 알 수 있다.
뇌미세출혈은 T2강조영상에서 5 mm 이하의 작고 명료한 저음영으로 보이는 병변으로 대뇌엽형(lobar type)과 비대뇌엽형(nonlobar type, deep or infratentorial)으로 나뉜다[19,20]. 일반적으로 뇌미세출혈의 발생기전은 크게 뇌아밀로이드혈관병증(cerebral amyloid angiopathy)와 고혈압혈관병증(hypertensive angiopathy) 두 가지로 나뉜다. 전자는 알츠하이머병에서 연수막(leptomeninges)과 대뇌엽에 영향을 미쳐 주로 대뇌엽미세출혈(lobar CMBs)이 발생하고[21], 아밀로이드의 양(amyloid burden) [22], 혹은 APOE ε4 [22,23] 등이 위험요인이며, 후자는 소혈관질환(small vessel disease)으로 인한 관통동맥(perforating artery) 부전으로 뇌기저부(deep brain)에 주로 미세출혈이 발생하면서 고혈압이 중요한 요인인 점[24]이 다르다. 최근 신기능저하(estimated glomerular filtration rate, eGFR)가 비대뇌엽미세출혈(nonlobar CMBs) 발생과 관련있음이 보고되었는데 이는 고혈압에서 대뇌와 신장의 심부관통동맥(deep perforating artery)의 내피손상으로 인한 산화질소(nitric oxide) 생성, 활성산소 증가, 그리고 세포부착분자의 활성화(up-regulation of cellular adhesion molecules) 등의 공통병리로 인해 초래된다고 한다[25]. 따라서 신기능저하는 뇌졸중이나 심혈관질환의 위험인자로도 눈여겨보아야 한다.
본 연구에서 각 군마다 뇌미세출혈의 발생빈도와 개수로 세 영역에서 분포의 양상을 비교하였을 때, 알츠하이머병군에서는 대뇌엽에, 그리고 뇌경색군에서는 기저핵/시상 영역에서 가장 우세하게 많이 발생하였고, 알츠하이머병군에서는 기저핵/시상 부위에서 대뇌엽 부위로 갈수록 뇌미세출혈의 분포가 많아지는 경향성을 보이는 점 등은 다른 기존의 연구에서 뇌미세출혈과 연관된 병리가 알츠하이머병에서는 주로 뇌아밀로이드혈관병증으로 인한 것이고 발병 위치는 대뇌엽인 측두엽과 특히 후두엽에서 호발하며, 반면에 뇌졸중에서는 고혈압혈관병증(hypertensive angiopathy)으로 인해 뇌미세출혈이 발생하고 발병 위치는 주로 뇌심부인 기저핵, 시상, 뇌간(brain stem)에 호발한다는 이론과 유사하였다[7,26]. 심지어 Boston진단기준(Boston criteria for cerebral amyloid angiopathy)에서 제시하는 추정아밀로이드혈관병증은 대뇌엽(cortical 혹은 subcortical)미세출혈이 존재하되 기저핵, 시상, 뇌간 등에 미세출혈이 존재하는 것은 반드시 배제하도록 되어있다[27,28]. 본 연구결과에서도 각 군간의 비교 시 뇌경색군이 알츠하이머병군이나 대조군에 비해 기저핵/시상 영역에 유의하게 뇌미세출혈의 분포가 높은 결과를 보여, 주로 소혈관질환에 의한 미세출혈을 보이는 뇌경색은 대뇌엽의 퇴행질환인 알츠하이머병과는 대조를 보인다는 것을 알 수 있다.
기저질환 및 관련 병태생리에 따른 뇌미세출혈의 호발 부위는 연구마다 다소 차이가 있는데, 뇌경색 환자에서 서양인에서는 피질 및 피질하 영역에서 호발하였고[29,30], 일본인을 대상으로 한 연구에서는 피질 및 피질하 영역과 시상을 포함한 기저핵에서 뇌미세출혈의 유병률이 비슷하였다[31]. 한국인 고혈압 환자를 대상으로 한 이전 연구에서 뇌미세출혈이 가장 호발하였던 부위는 피질 및 피질하 영역이었는데(38%) [32], 이는 기저핵/시상 부위(63%)에서 가장 많이 호발한 본 연구와 차이가 있다. 또한알츠하이머병 환자(일본인 550명 대상, 평균 나이 78세) 연구[33]에서 다발뇌미세출혈(8개 이상인 경우로 정의할 때)의 유병율은 17%였고 대뇌엽미세출혈과 심부/천막하미세출혈(deep/infratentorial CMBs) 비는 1.1로 나타났지만, 다발뇌미세출혈일 경우 치매가 빠르게 악화되고 미세출혈의 수와 뇌출혈도 더 증가하는 것과 연관되었으며, 다발성 심부/천막하미세출혈인 경우 고혈압과 대뇌 백질고음영이 더 심한 것으로 나타났다.
이러한 연구 결과 차이가 인종 간 차이 때문인지, 아니면 연구대상 환자군에서 알츠하이머병 병리와 뇌아밀로이드혈관병증 병리가 공존하는 환자가 포함된 정도 차이 때문인지는 확실하지 않다. 본 연구 결과도 기존의 연구결과와 다소 차이가 나는 것은 알츠하이머병군에서 뇌졸중 환자는 배제되었으나 백질변성(leukoaraiosis)을 보이는 환자를 포함하였고, 또한 뇌경색군에서도 알츠하이머병의 병리기전인 뇌아밀로이드혈관병증의 요소가 일부 관여되었을 가능성을 배제할 수 없기 때문이라고 생각된다. 그럼에도 불구하고 여전히 알츠하이머병에서 대뇌엽미세출혈의 임상영상학적 의미는 중요한데, 그 이유는 심부/천막하미세출혈과는 다르게, 대뇌엽미세출혈이 3개 이상이면 뇌척수액의 베타아밀로이드는 감소되고, 뇌척수액 p-tau가 비정상적으로 증가되어 있으며 이는 점진적인 인지기능저하를 가속시키기 때문이다[34]. 최근 다발뇌미세출혈이 있는 환자에서 뇌미세출혈이 없는 환자에 비해 뇌척수액의 베타아밀로이드42 (amyloid β 42)가 감소되어있다는 연구결과는[34,35] 기억장애나 인지기능저하 환자에서 자화율강조영상을 활용한 뇌미세출혈 측정이 알츠하이머병 조기진단의 생물표지자로 활용될 수 있음을 시사한다. 일부 보고에서는 자화율강조영상이 기울기에코영상보다 뇌미세출혈의 발견에 2배까지도 효과적일 수 있으나 임상적으로는 차이를 줄 정도로 의미는 없다고 한 연구도 있다[36]. 하지만 뇌미세출혈에 강력한 민감도를 가진 자화율강조영상 검사는 연구대상 수를 줄일 수 있고[35] 예상치 못한 질환의 감별에도 유용하다[5].
뇌미세출혈의 임상적 의의는 아직 명확하지 않으며, 더 연구가 필요하다. 왜냐하면 뇌미세출혈은 이전에 생각되어온 것처럼 무증상이 아니고, 인지기능장애와 연관있기 때문이다. 그러나 뇌미세출혈 자체가 인지기능저하를 일으키는 것인지, 아니면 고혈압성 소혈관질환이나 뇌아밀로이드혈관병증과 같은 어떤 기저 혈관질환으로 인해 인지기능저하가 나타나고 뇌미세출혈은 그와 동반된 하나의 현상일 뿐 일지 원인 관계가 현재로서는 아직 뚜렷하지 않다.
이 연구의 제한점으로는 첫째, 1.5 Tesla 자기공명영상 기계를 사용하였기 때문에 3 Tesla에 비해 뇌미세출혈에 대한 민감도가 떨어질 수 있다. 하지만 본 연구는 자화율강조영상 외에도 T2강조영상, T1강조영상, 기울기에코영상 및 불루밍효과를 종합적으로 보고 판단하여 기기의 한계를 최소화하기 위해 노력하였다. 둘째, 각 군마다 대상수가 다소 부족하다는 점과 표본의 편중 가능성인데, 세 군간의 연령 정합(age matching)과 혼합치매 환자를 배제하기 위해 통괄피질위축척도(Global Cortical Atrophy Scale) [12] 2 이하의 뇌경색 환자와 뇌심부백질 허혈변화 Fazekas척도[11] 2 이하의 알츠하이머병 환자만으로 대상을 제한하였기 때문이며, 또한 본 연구의 대조군(주관적 기억장애군, 평균연령 67세)에서 고혈압이 한 명도 없음에도 불구하고 뇌미세출혈이 30%로 나타나고, 알츠하이머병과 뇌경색군에서도 기존의 연구[7]에 비해 뇌미세출혈의 발생율이 높게 나타났는데 이는 자화율강조영상이 기울기에코영상에 비해 약 2배 정도 뇌미세출혈의 발견율이 높다고는[36] 하나 본 연구의 대상인 주관적 기억장애군에 이미 알츠하이머병 병리를 소지한 자가 포함되었거나 알츠하이머병군의 치매 정도가 심하였기 때문일 수 있으며, 더구나 뇌경색군에서는 이미 인지기능장애가 공존하였기 때문인 것으로 사료된다[7]. 따라서 충분한 대상으로 뇌심부 허혈정도를 분류하여 알츠하이머병과 뇌경색 환자의 뇌미세출혈 분포 차이에 대하여 정상인을 대조군으로 한 비교연구가 더 필요하다. 셋째, 창백핵(globus pallidus)에 위치한 석회화(calcification)는 뇌미세출혈과 유사하게 보일 수 있어 석회화가 뇌미세출혈로 합산되었을 가능성(brain CT를 확인하지 못한 경우)도 있다[35]. 마지막으로 고혈압 외 소혈관질환을 유발할 수 있는 다른 심혈관계 위험인자 및 사회력(술, 담배)에 대한 분석은 시행하지 않았다.
본 연구로 평균연령 67-73세의 노인에서 뇌미세출혈의 발생은 대조군에 비해 알츠하이머병군과 인지기능장애가 포함된 뇌경색군에서 약 2배 정도 많이 발생하였고, 나이나 성별, 그리고 고혈압의 유무에 영향을 받지 않았으며, 알츠하이머병군과 대조군에서는 대뇌엽 영역(lobar region)에 가장 호발하여 유사한 양상을 보이는 반면 뇌경색군에서는 기저핵/시상 영역(basal ganglia/thalamus, deep region)에 호발하여 대조적인 양상을 보임을 알 수 있었다. 이는 전자의 경우 뇌아밀로이드혈관병증과, 후자의 경우 소혈관질환에 의한 고혈압성 뇌병증을 반영하는 소견이다. 이러한 병리에 따른 뇌미세출혈의 분포 영역과 심한 정도를 활용하여 관련 질환, 즉 알츠하이머병, 레비소체치매(dementia with Lewy bodies) 등의 퇴행질환과 혈관치매와의 감별진단 및 병의 예후 예측과 나아가 치료계획에 도움 받을 것을 기대한다.
Acknowledgements
본 연구는 2014년 영남대학교의료원 연구비 지원으로 수행됨.


