| J Korean Neurol Assoc > Volume 34(1); 2016 > Article |
|
Abstract
Background:
The verbal fluency test consists of two separate tests of semantic fluency and phonemic fluency. The performance patterns of these tests differ with the type of dementia. We studied the patterns of verbal fluency between Alzheimer’s disease (AD) and subcortical vascular dementia (SVaD), and assessed the clinical utility of these tests.
Methods:
The 1,475 selected participants comprised 73 normal control subjects, 673 patients with amnestic mild cognitive impairment (aMCI), 535 AD patients, 42 patients with subcortical vascular mild cognitive impairment (svMCI), and 152 SVaD patients. We analyzed the z-score for the total number of animal items as a semantic fluency index and the z-score of the phonemic total score as a phonemic fluency index.
Results:
The performance of semantic fluency was lower than that of phonemic fluency in all groups. The SVaD group showed the worst scores and abnormal performances on both tests, while the AD group presented abnormal performance only for semantic fluency. Dividing the patients with dementia according to severity revealed a different pattern between AD and SVaD for the clinical dementia rating (CDR) stage of 0.5. The performance of the AD group declined gradually with CDR. However, the SVaD group performed very poorly in both tests even for very mild dementia (CDR stage of 0.5). The aMCI and svMCI groups exhibited similar performance patterns.
언어유창성검사는 제한된 시간 내에 자발적으로 단어를 많이 생성해내는 능력을 측정하는 검사로, 특정 범주에 속한 단어를 생성하는 의미유창성검사와 특정 철자로 시작하는 단어를 생성하는 음소유창성검사가 있다. 이 검사들은 집행기능장애를 측정하기 위해 주로 사용되고, 전두엽이 손상된 환자들은 언어유창성검사에 장애를 보이는 것으로 알려져 있다[1-5]. 그러나 임상에서 전두엽 손상이 있음에도 의미와 음소유창성검사 간에 장애 정도가 다르게 나타날 수 있고, 전두엽 외에 다른 영역에 손상이 있을 때에도 장애를 보이며 손상 영역에 따라 유창성 장애 패턴이 달라지기도 한다[6,7]. 이것은 의미유창성과 음소유창성을 생성하는 인지적 기제가 기본적으로 다르기 때문에 나타나는 현상일 수도 있고, 아니면 집행기능이라는 동일한 인지적 기제를 사용하지만 집행기능이 관여하는 정도의 차이 때문에 다른 패턴을 보일 수도 있다[8].
단어를 유창하게 생성하기 위해서는 머릿속에 조직화되어 있는 정보 중에서 조건에 맞는 정보를 효율적으로 인출할 수 있는 전략이 필수적이다. 이런 전략적 인출은 집행처리에 의해 이루어지는데 의미와 음소유창성 모두에서 공통적으로 요구되는 능력이다[9]. 그중에서 의미유창성은 의미기억과 밀접한 관련이 있는데, 의미기억은 장기기억 중의 하나로 사물, 사실, 개념, 단어, 의미와 같은 지식에 대한 표상이라고 할 수 있다[10]. 기본적으로 특정 범주(동물, 가게 물건)에 속하는 단어를 적절하게 인출하기 위해서는 의미기억이 온전해야 하며, 다음으로 의미저장소에 있는 단어 중 해당 범주의 단어를 효율적으로 인출할 수 있어야 한다. 둘 중 하나에 문제가 발생하더라도 의미유창성검사에서 장애가 나타날 수 있다[11]. 음소유창성은 의미유창성과 달리 의미 기억 처리가 요구되지 않고 특정 음소(ㄱ/ㅇ/ㅅ)로 시작하는 단어를 효율적으로 인출하는 것이 필수적이다. 대신에 의미생성과 같이 익숙하고 습관적인 반응을 억제하고 친숙하지 않은 방식으로 어휘적 표상에 접근하여 단어를 생성하기 때문에 집행기능이 더 요구되고 이를 평가하는데 더 적합한 검사로 간주된다[2,12]. 그래서 음소유창성에서 장애를 보일 경우 집행기능장애로 직접적으로 해석하는 것이 가능하다[8].
의미와 음소유창성은 효율적 단어 인출이라는 공통적인 처리를 공유하고 있지만 처리과정에서 차이가 있기 때문에 치매의 원인질환에 따라 다른 유창성 장애 패턴을 나타낼 수 있다. 알츠하이머병 환자들은 언어유창성에 손상을 보이는 것으로 알려져 있고[13-15], 음소보다는 의미유창성에서 더 손상을 보이는 것으로 비교적 일관되게 보고된다[9,13,15-17]. 알츠하이머병의 초기에는 전두엽 기능이 덜 손상되고 의미기억과 관련된 측두엽 손상이 먼저 일어나기 때문에 음소보다는 의미유창성이 더 영향을 받는 것으로 이해될 수 있다[18-21]. 이것은 알츠하이머병을 대상으로 한 메타분석연구에서 확인되었고[9-11,14,22], 전단계로 알려진 경도인지장애 연구에서도 확인되었다[23-25]. 알츠하이머병에서의 의미유창성 장애는 인출의 문제라기보다 의미저장소의 손상 자체가 원인임을 알 수 있다. 그러나 알츠하이머병이 진행됨에 따라서 뇌의 전반적인 영역으로 손상이 확산되는데 이런 경과에 따른 유창성장애 패턴의 변화에 대해서는 거의 알려진 바가 없다.
혈관치매는 알츠하이머병과 달리 의미보다는 음소유창성이 더 손상되는 것으로 알려져 있는데[26-29], 두 질환 간 패턴차이가 없다는 보고도 있다[16,30-32]. 비교적 일관된 연구결과를 보이는 알츠하이머병과 달리 혈관치매에서 이런 불일치를 보이는 것은 인지장애를 야기하는 원인이 다르고 혈관치매 내에서도 손상위치나 특징에 따라서 다양한 패턴의 인지장애가 나타날 수 있고 그것이 유창성 패턴의 불일치에 영향을 미칠 수 있다[1,8]. 여러 가지 요소들을 배제한 메타분석연구에서는 측두엽 병변이 있는 경우 음소보다 의미유창성이 더 저하되었고 이는 알츠하이머병 환자들의 패턴과 유사함을 보고하였다[8]. 그러나 전두엽 병변이 있는 경우에는 반대 패턴의 결과가 나오는 것이 아니라 의미와 음소유창성이 모두 영향을 받아 손상되는 것을 확인하였다. 이것은 집행기능손상으로 인해 인출 자체가 방해를 받아 생기는 결과라고 할 수 있다.
피질하혈관치매는 피질하 영역에 다발성열공경색이나 백질변성이 발생하여 치매로 진행되는 질환이다. 발병기전 상 다른 혈관치매에 비해 비교적 동질적인 환자집단이며 전두엽/집행기능장애가 유의미하게 관찰되는 임상특징을 가진 것으로 알려져 있다. 그러나 알츠하이머병과 피질하혈관치매 모두 서서히 발생하여 점진적으로 진행하는 비슷한 임상양상을 가지고 있으며 초기 치매단계에서는 인지장애패턴이 비슷하기 때문에 신경심리검사를 통해 원인질환을 구별하고 예측하는 것이 쉽지 않다[18,19,33]. 실제로 이런 유사성은 치매로 진행되기 전 약 3년 동안 비슷한 패턴을 보이는 것으로 보고된다[20,21]. 이전 연구에서도 혈관치매와 알츠하이머병에서 언어유창성 수행의 차이를 비교하였으나, 혈관치매 환자군에 피질병변과 피질하병변 환자가 구별되지 않고 포함된 경우가 많았으며, 피질하혈관치매 환자와 알츠하이머병 환자의 유창성 수행 차이를 비교한 연구도 많지 않으며, 의미와 음소유창성 패턴을 비교한 연구는 거의 없었다[26,34]. 두 환자 집단의 유창성 패턴을 비교한 최근 연구에서 알츠하이머병 환자들은 음소보다 의미유창성이 더 낮은 수행을 보이지만 피질하혈관치매 환자들은 2개의 유창성 모두 낮은 패턴을 보고하였다[35]. 그러나 특성이 다른 유창성 검사의 원점수를 사용해 직접 패턴을 비교한 문제가 있어 그 결과를 임상에 적용하여 해석하는데 제한이 있을 수 있다. 또한 각 환자군의 초기 단계부터 진행에 따른 유창성 패턴의 변화에 대한 자세한 분석이 없어 두 환자군의 유창성 패턴 특성을 확인하거나 초기 임상 양상을 변별하는데 유용하지 않을 수 있다.
본 연구에서는 알츠하이머병과 피질하혈관치매의 의미유창성과 음소유창성 수행 패턴 차이를 알아보고, 경도인지단계를 포함해서 치매 진행단계에 따라 패턴이 어떻게 달라지는지 규명하고자 한다.
이 연구는 2005년부터 2011년까지 노인성치매임상연구센터(Clinical Research Center for Dementia of South Korea, CREDOS)에 등록된 병원 환자를 대상으로 하였다. CREDOS에서 정한 프로토콜에 따라서 모든 환자에게 포괄적인 임상면담, 신경학적검사, 검사실검사, 뇌자기공명영상검사와 서울신경심리검사[36]를 하였다[37-39].
모든 환자들은 인지기능 측면에서 신경심리검사 결과를 기준으로 CREDOS에서 정한 기준에 따라 정상, 경도인지장애, 경증치매, 중증치매로 인지기능수준을 구분하였다. 언어기능, 시공간기능, 기억력, 전두엽/집행기능의 모든 인지영역에서 객관적인 인지장애가 없는 경우는 정상 인지기능수준으로 분류하였다. 1개 이상의 영역에서 객관적 인지장애가 관찰되고 임상치매척도(Clinical Dementia Rating; CDR) [40]가 0.5, 서울복합일상생활기능검사(Seoul-Instrumental Activities of Daily Living; S-IADL) [41] 8점을 기준으로 일상생활수행능력에 제한이 없는 경우는 경도인지장애로 분류하였다. 치매는 객관적 인지장애가 있으며, 서울복합일상생활기능검사 8점 이상인 환자로 CDR이 0.5, 1, 2인 경우는 경증치매, 3은 중증치매로 구분하였다.
CREDOS에서 모든 환자의 백질변성 정도는 T2강조영상(T2-weighted imaging)이나 액체감쇄역전회복영상(fluid attenuated inversion recovery imaging)에서 Fazekas 척도[42]에 따라 평가하였다. 심부백질변성(deep white matter, D)은 10 mm와 25 mm를 기준으로 D1: <10 mm, D2: D1과 D2 사이, D3: ≥25 mm으로 심한 정도를 구분하였으며 뇌실주변백질변성(periventricular white matter, P)은 5 mm와 10 mm를 기준으로 P1: <5 mm, P2: P1과 P3 사이, P3: ≥10 mm으로 심한 정도를 구분하였다. CREDOS에서는 이 기준을 종합하여 백질변성정도를 D1P1, D1P2는 경한 백질변성, D1P3, D2P1, D2P2, D2P3, D3P1, D3P2는 중등도 백질변성, D3P3는 심한 백질변성으로 수준을 분류하였다. 경한 백질변성을 가진 경우 기억상실형경도인지장애와 알츠하이머병 환자로 포함시켰고, 심한 백질변성이 있는 환자만 피질하혈관경도인지장애와 피질하혈관치매로 포함하였다. 중등도 백질변성을 가진 환자들은 어느 진단그룹에도 포함시키지 않았다.
위에 언급한 인지기능수준, 백질변성수준, 국소신경학적징후의 세가지 기준에 따라서 환자들을 정상통제군, 기억상실형경도인지장애, 피질하혈관경도인지장애, 알츠하이머병, 피질하혈관치매로 환자그룹을 구분하였다. 정상통제군은 신경심리검사 상 정상인지기능수준, 뇌자기공명영상검사 상 경한 백질변성만 관찰되며, 국소신경학적징후는 없는 주관적인지장애 환자로 구성되었다. 기억상실형경도인지장애 환자는 모두 Petersen [43] 기준, 알츠하이머병 환자는 모두 National Institute of Neurological and Communicative Disorders and Stroke and AD and Related Disorders Association (NINCDS-ADRDA) [44] 기준을 만족하였으며 경한 백질변성만 관찰되며 국소신경학적징후가 없는 환자들로 구성되었다. 피질하혈관경도인지장애와 피질하혈관치매 환자는 심한 백질변성을 가지며 국소신경학적징후가 객관적으로 관찰되었으며 피질하혈관치매 환자는 Diagnostic and Statistical Manual of Mental Disorders, Fourth edition (DSM-IV) [45] 기준을 모두 만족하였다.
신경심리검사 중 의미유창성은 60초 동안 동물이름을 가능한 많이 말하도록 하여 평가되었으며, 음소유창성은 ‘ㄱ’, ‘ㅇ’, ‘ㅅ’으로 시작하는 단어를 각각 60초 동안 많이 말하도록 하여 총점으로 평가하였다. 원점수 자체로 의미유창성과 음소유창성의 패턴을 직접 비교할 수 없기 때문에 환자의 나이와 교육수준에 맞는 z점수를 사용하였다.
8,124명의 자료에서 추적자료를 제외하고 6,136명의 1차 검사자료를 선별하였다. 사용된 서울신경심리검사의 규준은 55세부터 80세까지 적용되도록 만들어졌기 때문에 z점수 분석을 하기 위해서 해당 나이 범위에 속하는 5,076명 선별하고, 문맹의 경우 음소유창성 규칙을 이해하는데 어려움이 있어 연구에서 제외하고 2개의 유창성 중 하나라도 평가되지 않은 환자들도 모두 제외하여 3,872명의 환자 자료를 선별하였다. 그 중에서 진단그룹에 따른 유창성 수행 패턴 차이를 분석하기 위해 앞에서 제시한 진단기준에 부합하는 환자를 최종 선별하였다. 정상통제군은 73명, 기억상실형경도인지장애는 673명, 알츠하이머병은 535명, 피질하혈관경도인지장애는 42명, 피질하혈관치매는 152명이 분석에 포함되었다. 그리고 병의 진행단계에 따른 패턴 분석을 위해 기억상실형경도인지장애 그룹을 단일영역 기억상실형경도인지장애(n=240)과 다중영역 기억상실형경도인지장애(n=433)로 구분하였으며 치매 그룹은 CDR에 따라서 0.5, 1, 2로 구분하여 분석하였다. 알츠하이머병 환자 1명, 피질하혈관치매 환자 중 6명은 CDR 3에 해당하였으나 피험자수가 너무 적어 그룹 분석에서는 제외하였다. 각 진단그룹 내에서 유창성 패턴을 분석하기 위하여 모든 환자를 4가지 유형으로 구분하였다. 한 개인의 의미유창성과 음소유창성 수행을 1 표준편차기준(z=-1)에 따라서 둘 다 정상인 경우(SPnl), 의미만 비정상인 경우(SabPnl), 음소만 비정상인 경우(SnlPab), 모두 비정상인 경우(SPab)로 모든 환자를 분류한 후 각 진단그룹별로 포함된 네 가지 유형의 환자 비율을 통해 유창성 패턴을 확인하였다.
5개 진단그룹에 속한 환자들의 인구통계학적 변수와 의미와 음소유창성 수행의 원점수를 Table 1에 제시하였으며 z점수는 Fig. 1에 제시하였다. 2개의 유창성검사를 반복 측정하였으므로 5 (진단그룹) × 2 (유창성) 2요인 혼합변량분석을 실시하였다. 상호작용은 유의하였으며(F(4, 1,470)=7.39, p<.001) 그룹에 의한 주효과(F(4, 1,470)=155.56, p<.001), 유창성에 의한 주효과(F(1, 1,470)=49.98, p<.001) 모두 유의하였다. 정상통제군과 피질하혈관경도인지장애에서 2개의 유창성 차이는 나타내지 않았으나, 기억상실형경도인지장애, 알츠하이머병, 피질하혈관치매에서는 음소보다 의미유창성이 통계적으로 유의하게 낮았으며, 피질하혈관치매에서 의미, 음소 모두 가장 낮은 수행을 나타냈다. 유창성에 따른 그룹간 차이를 분석하면, 의미유창성이 기억상실형경도인지장애보다 피질하혈관경도인지장애에서 더 낮은 수행을 보이기는 하였으나 통계적 차이를 없었으며, 다른 모든 그룹 간에는 통계적으로 유의한 차이가 있었다. 이에 비해 음소유창성은 모든 그룹 간에 차이를 나타냈으며, 특히 피질하혈관경도인지장애 환자들이 기억상실형경도인지장애보다 낮은 수행을 보이는 통계적 유의성이 나타났다.
치매의 진행정도에 따른 유창성 패턴을 분석하기 위해 치매군에서는 CDR에 따라 구분하였으며 경도인지장애는 단일영역 기억상실형경도인지장애와 다중영역 기억상실형경도인지장애로 구분하였으며 각 환자들의 인구통계학적 변수와 유창성 원점수를 Table 2에 나타냈다. 각 그룹 간 유창성 수행의 z 점수는 Fig. 2에 제시하였다. 알츠하이머병과 피질하혈관치매를 독립적인 질환으로 가정하여 알츠하이머병 진행에 따른 유창성 차이를 확인하기 위하여 단일영역 기억상실형경도인지장애, 다중영역 기억상실형경도인지장애, 알츠하이머병 CDR 0.5, 알츠하이머병 CDR 1, 알츠하이머병 CDR 2 그룹 간에 유창성 차이를 분석하고, 피질하혈관치매 진행에 따른 유창성 차이를 확인하기 위하여 피질하혈관경도인지장애, 피질하혈관치매 CDR 0.5, 피질하혈관치매 CDR 1, 피질하혈관치매 CDR 2 그룹 간에 유창성 차이를 각각 분석하였다. 알츠하이머병 진행에 따른 5 (진단그룹) × 2 (유창성) 2요인 혼합변량분석에서 상호작용은 유의하였으며(F[4, 1,202]=4.77, P=0.001), 그룹에 의한 주효과(F[4, 1,202]=167.30, p<0.001), 유창성에 의한 주효과(F[1, 1,202]=144.61, p<0.001)는 모두 유의하였다. 의미유창성과 음소유창성은 모든 그룹 간에 차이를 보였다. 의미유창성과 음소유창성은 모두 단일영역 기억상실형경도인지장애보다 다중영역 기억상실형경도인지장애에서 유의하게 더 낮은 수행을 보였다. 피질하혈관치매 진행에 따른 4 (진단그룹) × 2 (유창성) 2요인 혼합변량분석에서 상호작용은 통계적으로 유의하지 않아 질병의 진행에 따라서 의미와 음소유창성의 패턴 차이는 나타나지 않았다(F[3, 184]=2.03, P=0.112). 그러나 그룹에 의한 주효과(F[3, 184]=29.68, p<0.001), 유창성에 의한 주효과(F[1, 184]=43.54, p<0.001)는 통계적으로 유의한 차이를 보였다. 피질하혈관치매 CDR 0.5와 피질하혈관치매 CDR 1 그룹 간에는 의미와 음소유창성 모두 통계적으로 유의한 차이를 나타내지 않았으나 그 외에 다른 그룹 간에는 2개 유창성 모두 통계적인 차이를 나타냈다.
알츠하이머병과 피질하혈관치매의 전단계로 알려진 다중영역 기억상실형경도인지장애와 피질하혈관경도인지장애 간 2 (진단그룹) × 2 (유창성) 2요인 혼합변량분석에는 상호작용효과는 유의하지 않았으며(F[1, 473]=0.09, P=0.77) 진단그룹 간 주효과도 유의하지 않았다(F[1, 473]=0.08, P=0.78). 유창성의 주효과는 유의하였으며(F[1, 473]=10.95, P=0.001), 의미유창성 수행이 음소유창성보다 더 낮았다. 다중영역 기억상실형경도인지장애와 피질하혈관경도인지장애에서 2개의 유창성 수행 간의 단순 주효과를 각각 분석하면, 다중영역 기억상실형경도인지장애에서는 2개 유창성 수행 차이가 통계적으로 유의하였으며(t[433]=-6.06, p<0.001), 의미유창성이 음소유창성보다 더 낮은 수행을 나타냈다. 피질하혈관경도인지장애에서도 의미유창성이 음소유창성보다 더 낮은 수행을 나타냈지만 통계적으로 유의하지 않았다.
각 개인에서 의미유창성과 음소유창성 수행을 정상/비정상으로 구분하였으며, 각 환자는 4개 중 1개의 유형에 속하게 된다: 의미-정상/음소-정상(SPnl), 의미-비정상/음소-정상(SabPnl), 의미-정상/음소-비정상(SnlPab), 의미-비정상/음소-비정상(SPab). 각 진단그룹별, 진행정도에 따른 그룹별로 어떤 유형의 환자들이 많은지 패턴을 알아보기 위해 환자수를 %로 표시하였다(Fig. 3). 기억상실형경도인지장애에서는 42.2% 환자가 2개 유창성 모두 정상이었으나 26.7%의 환자는 의미 유창성만 이상을 보이는 패턴을 나타냈다. AD로 진행하게 되면 50.1%의 환자가 2개 유창성 모두 이상을 나타내고 CDR이 진행할수록 그 비율은 점진적으로 많아진다. 단일영역 기억상실형경도인지장애는 정상 그룹과 비슷한 패턴을 나타내고 있으며 다중영역 기억상실형경도인지장애에서 알츠하이머병 CDR 1까지 진행하더라도 음소유창성은 정상이면서 의미유창성만 이상을 보이는 환자가 꾸준히 30%정도 차지하는 것을 볼 수 있다. 이에 비해서 피질하혈관경도인지장애에서 피질하혈관치매로 진행하는 초기 단계에서부터 73.2%의 환자들이 2개의 유창성검사에서 모두 이상을 나타내는 편향된 패턴을 보였으며 이런 패턴은 CDR 1, 2로 진행될수록 더 편중 분포되어 97.7%에서 2개 유창성검사 모두 이상이 있는 패턴을 나타냈다.
본 연구에서는 알츠하이머병과 피질하혈관치매 환자들이 의미유창성과 음소유창성 수행에 있어서 어떻게 다른 패턴을 보이는지와 진행경과에 따라 패턴이 어떻게 변화하는지 알아보았으며, 경도인지장애 단계에서 두 질환의 차이도 추가적으로 확인하였다.
알츠하이머병 환자와 피질하혈관치매 환자 모두 음소유창성보다 의미유창성에서 더 낮은 수행을 보였다. 그러나 각 집단에서 수행의 양적 손상수준을 고려하면 피질하혈관치매 환자는 2개의 유창성 모두 크게 손상된 패턴을 보이는데 반해 알츠하이머병 환자의 경우 의미유창성은 뚜렷한 손상을 보이지만 1표준편차를 정상/비정상 기준으로 삼았을 때 음소유창성은 거의 정상 범위 수행수준(z=-1.2)을 보여 집단 간 다른 양상의 패턴이 나타남을 알 수 있었다. 이러한 결과는 전두엽 손상으로 집행기능의 주된 장애가 있을 때는 인출 과정에 영향을 미쳐 2개의 유창성검사 모두에서 큰 어려움을 보이지만, 의미저장소의 주된 손상이 있을 때는 음소 유창성에는 덜 영향을 미치고 의미유창성에만 영향을 주는 것으로 해석될 수 있고 이전 연구결과와도 일치하는 것을 알 수 있다[35].
본 연구의 가장 흥미로운 점은 초기치매단계에서 알츠하이머병과 피질하혈관치매 간에 의미유창성과 음소유창성의 수행 차이가 뚜렷하게 나타난다는 것이다. 이전 연구들은 치매집단에서 유창성 차이만 비교하였을 뿐 치매의 진행에 따른 유창성 차이, 특히 치매초기단계에서 유창성 차이나 특성은 보고된 바가 없었다. 치매초기단계인 CDR 0.5에서 두 질환의 인지기능은 비슷한 수준임에도, 피질하혈관치매 환자의 유창성은 의미, 음소 모두 크게 저하되어 있으나, 이에 비해서 CDR 0.5의 알츠하이머병 환자들은 의미유창성에서만 뚜렷한 저하를 보이고 음소유창성은 정상수행(z=-1.0)을 보임을 확인할 수 있었다. 즉 각 질환의 유창성 패턴차이는 CDR 0.5인 초기 단계부터 확연히 구분됨을 알 수 있다. 심지어는 이런 패턴차이가 지속되어 알츠하이머병 환자들은 CDR 2 단계에 이르러서야 CDR 0.5 단계의 피질하혈관치매 환자와 유사한 수준과 패턴을 나타냈다. 피질하혈관치매 환자들은 인지기능이 경미하더라도 심한 백질변성에 의해 전두엽수행기능장애가 발생하여 적절한 단어를 효율적으로 인출하는데 영향을 미치기 때문에 의미인지 음소인지와 무관하게 2개의 유창성 모두를 저하시키게 된다. 즉, 전두엽은 유창성의 초기 처리에 중요한 관문의 역할을 하는 것으로 이해될 수 있겠다. Henry와 Crawford의 연구[8]에서도 전두엽에 국소적인 병변이 있는 경우 음소유창성 뿐만 아니라 의미유창성도 비슷한 정도의 저하를 보이는 것으로 보고되었는데 우리의 해석과 일치하는 것으로 볼 수 있다.
우리는 진단그룹별 또는 진행단계별로 개별 환자의 유창성 수행 패턴을 4개로 분류하여 분포를 살펴보았는데, 다중영역 기억상실형경도인지장애와 피질하혈관경도인지장애 단계에서는 역시 비슷한 분포 양상을 보였으나 다중영역 기억상실형경도인지장애는 의미유창성 장애만 있는 환자가 약간 더 많았으며 피질하혈관경도인지장애는 유창성에서 모두 장애가 있는 환자가 약간 더 많은 경향을 보였다. 이런 패턴은 치매 단계로 들어가면 차이가 더 명확해지면서 확연히 다른 분포를 나타내는데 특히 CDR 0.5 단계에서 피질하혈관치매 환자에서 분포가 매우 특이하였다. 알츠하이머병은 병이 진행할수록 2개 유창성에서 모두 이상을 보이는 환자가 점진적으로 많아지지만 약 30%의 환자는 CDR 1까지도 의미유창성 장애만 있는 양상 특징을 보이는데 반해, 피질하혈관치매는 CDR 0.5 단계에서 이미 2개의 유창성에서 모두 장애를 보이는 환자가 다수이며 이런 패턴은 병이 진행할수록 거의 비슷한 양상으로 대부분의 환자가 2개의 유창성 수행 장애를 보이는 것을 알 수 있다.
기존의 연구에서는 유창성의 양적 비교를 통해서만 치매 환자의 수행차이를 연구하였을 뿐 유창성 패턴에 대한 질적 차이를 확인한 연구는 전혀 없었으나, 본 연구에서는 양적, 질적 차이를 종합하여 알츠하이머병과 피질하혈관치매에서 차이를 더 명확하게 확인하였다. 결과를 종합하면, 경도인지장애 단계에서 양적인 측면에서는 심한 백질변성 유무와 상관없이 의미와 음소유창성 패턴의 뚜렷한 차이가 나타나지 않지만 질적인 측면에서는 각 치매 단계에서 보이는 유창성 차이 특성을 나타내기 시작하였으며, 치매초기단계에서는 양적, 질적 차이가 모두 나타나는 뚜렷한 패턴 차이를 보여 알츠하이머병과 피질하혈관치매를 감별하는데 있어서 의미유창성과 음소 유창성 패턴이 유용한 지표가 될 수 있음을 확인할 수 있었다.
본 연구는 다른 연구들과 달리 대규모 환자자료를 기반으로 도출된 결과이기 때문에 더 신뢰할 수 있다. 또한 과제특성이 다른 검사를 양적으로 비교함에 있어 원점수가 아니라 z점수를 사용하였기 때문에 검사 간에 또는 환자군 간에 수행수준을 직접 비교하고 해석할 수 있었다. 또 기존 연구에서 혈관치매 환자군의 동질성 문제로 불일치하는 결과들이 도출되었는데 본 연구에서는 피질하혈관치매라는 동질적인 특성을 가진 환자로 구성하였고 피질하혈관치매 환자의 의미유창성과 음소유창성 수행 특징에 대한 해석의 정확성을 높일 수 있었다.
그럼에도 불구하고 본 연구는 몇 가지 제한점이 있다. 후향적 연구의 특성 상 각 환자군의 수를 임의적으로 제한할 수 없어 각 환자군에 포함된 환자수의 차이가 크다. 피질하혈관경도인지장애 환자가 다른 집단에 비해서 소수로 구성되어 있고 알츠하이머병에 비해 피질하혈관치매 환자의 수가 적어 결과에 영향을 미쳤을 가능성을 완전히 배제할 수 없겠다. 또한 두 질환이 공존하는 혼합치매를 배제하기 위해 중등도의 백질변성을 가진 환자를 연구에서 제외하였음에도 피트버그화합물B-양전자방출단층촬영(Pittsburgh Compound-B Positron Emission Tomography, PIB-PET), 뇌척수액아밀로이드(CSF amyloid), 뇌척수액타우(CSF tau) 등의 생물표지자검사나 병리검사를 시행하지 않았으므로 피질하혈관경도인지장애나 피질하혈관치매 환자 중 알츠하이머병의 병리를 가지고 있을 가능성도 완전히 배제할 수 없는 제한점이 있다.
결론적으로 본 연구에서는 의미유창성과 음소유창성 수행 패턴이 2개의 다른 원인을 가지는 알츠하이머병과 피질하혈관치매의 전단계인 경도인지장애에서는 변별할 수 있는 통계적 유의성이 없지만 임상적 경향성을 보이며 초기 치매 단계에서 2개의 질환을 감별하는데 있어 신경심리학적으로 중요한 역할을 한다는 것을 확인할 수 있었다. 추후에는 뇌영상자료를 이용하여 직접적으로 각 환자 집단에서 유창성검사 수행에 영향을 미치는 요인에 대한 분석이 이루어진다면 본 연구 결과를 정확하게 해석하는데 도움이 될 것이다.
Acknowledgements
본 논문은 국민건강보험 일산병원 연구비 지원으로 이루어졌으며, 보건복지부 보건의료연구개발사업의 지원(HI10C2020)과 2014년도 정부(미래부)의 재원으로 한국연구재단 뇌과학원천기술개발사업의 지원을 받아 수행된 연구임(No. 2014M3C7A1064752).
REFERENCES
1. Stuss DT, Alexander MP, Hamer L, Palumbo C, Dempster R, Binns M, et al. The effects of focal anterior and posterior brain lesions on verbal fluency. J Int Neuropsychol Soc 1998;4:265-278.

2. Phillips LH. Do “frontal tests” measure executive function? Issues of assessment and evidence from fluency tests. In: Rabbit PMA, ed. Methodology of frontal and executive function. Hove, England: Psychology Press, 1997;191-213.
3. Crawford JR, Henry JD. Assessment of executive deficits. In: Halligan PW, Wade DT, eds. The effectiveness of rehabilitation for cognitive deficits. London: Oxford University Press, 2005.
4. Parker DM, Crawford JR. Assessment of frontal lobe function. In: Crawford JR, Parker DM, Mckinlay WW, eds. A handbook of neuropsychological assessment. London: Erlbaum, 1992;267-291.
5. Reitan RM, Wolfson D. A selective and critical review of neuropsychological deficits and the frontal lobes. Neuropsychol Rev 1994;4:161-198.


6. Martin RC, Loring DW, Meador KJ, Lee GP. The effects of lateralized temporal lobe dysfunction on formal and semantic word fluency. Neuropsychologia 1990;28:823-829.


7. Loring DW, Meador KJ, Lee GP. Effects of temporal lobectomy on generative fluency and other language functions. Arch Clin Neuropsychol 1994;9:229-238.


8. Henry JD, Crawford JR. A meta-analytic review of verbal fluency performance following focal cortical lesions. Neuropsychology 2004;18:284-295.


9. Rosser A, Hodges JR. Initial letter and semantic category fluency in Alzheimer’s disease, Huntington’s disease, and progressive supranuclear palsy. J Neurol Neurosurg Psychiatry 1994;57:1389-1394.



10. Hodges JR, Salmon DP, Butters N. Semantic memory impairment in Alzheimer’s disease: failure of access or degraded knowledge? Neuropsychologia 1992;30:301-314.


11. Henry JD, Crawford JR, Phillips LH. Verbal fluency performance in dementia of the Alzheimer’s type: a meta-analysis. Neuropsychologia 2004;42:1212-1222.


12. Perret E. The left frontal lobe of man and the suppression of habitual responses in verbal categorical behaviour. Neuropsychologia 1974;12:323-330.


13. Butters N, Granholm E, Salmon DP, Grant I, Wolfe J. Episodic and semantic memory: a comparison of amnesic and demented patients. J Clin Exp Neuropsychol 1987;9:479-497.


14. Martin A, Fedio P. Word production and comprehension in Alzheimer’s disease: the breakdown of semantic knowledge. Brain Lang 1983;19:124-141.


15. Monsch AU, Bondi MW, Butters N, Salmon DP, Katzman R, Thal LJ. Comparisons of verbal fluency tasks in the detection of dementia of the Alzheimer type. Arch Neurol 1992;49:1253-1258.


16. Barr A, Brandt J. Word-list generation deficits in dementia. J Clin Exp Neuropsychol 1996;18:810-822.


17. Pasquier F, Lebert F, Grymonprez L, Petit H. Verbal fluency in dementia of frontal lobe type and dementia of Alzheimer type. J Neurol Neurosurg Psychiatry 1995;58:81-84.



18. Caramazza A, Shelton JR. Domain-specific knowledge systems in the brain the animate-inanimate distinction. J Cogn Neurosci 1998;10:1-34.


19. Gabrieli JD, Cohen NJ, Corkin S. The impaired learning of semantic knowledge following bilateral medial temporal-lobe resection. Brain Cogn 1988;7:157-177.


20. Stefanacci L, Buffalo EA, Schmolck H, Squire LR. Profound amnesia after damage to the medial temporal lobe: A neuroanatomical and neuropsychological profile of patient E. P. J Neurosci 2000;20:7024-7036.

21. Tippett LJ, Glosser G, Farah MJ. A category-specific naming impairment after temporal lobectomy. Neuropsychologia 1996;34:139-146.


22. Braak H, Braak E. Neuropathological stageing of Alzheimer-related changes. Acta Neuropathol 1991;82:239-259.


23. Murphy KJ, Rich JB, Troyer AK. Verbal fluency patterns in amnestic mild cognitive impairment are characteristic of Alzheimer’s type dementia. J Int Neuropsychol Soc 2006;12:570-574.

24. Adlam AL, Bozeat S, Arnold R, Watson P, Hodges JR. Semantic knowledge in mild cognitive impairment and mild Alzheimer’s disease. Cortex 2006;42:675-684.


25. Brandt J, Manning KJ. Patterns of word-list generation in mild cognitive impairment and Alzheimer’s disease. Clin Neuropsychol 2009;23:870-879.



26. Lafosse JM, Reed BR, Mungas D, Sterling SB, Wahbeh H, Jagust WJ. Fluency and memory differences between ischemic vascular dementia and Alzheimer’s disease. Neuropsychology 1997;11:514-522.


27. Mendez MF, Cherrier MM, Perryman KM. Differences between Alzheimer’s disease and vascular dementia on information processing measures. Brain Cogn 1997;34:301-310.


28. Starkstein SE, Sabe L, Vazquez S, Teson A, Petracca G, Chemerinski E, et al. Neuropsychological, psychiatric, and cerebral blood flow findings in vascular dementia and Alzheimer’s disease. Stroke 1996;27:408-414.


29. Tierney MC, Black SE, Szalai JP, Snow WG, Fisher RH, Nadon G, et al. Recognition memory and verbal fluency differentiate probable Alzheimer disease from subcortical ischemic vascular dementia. Arch Neurol 2001;58:1654-1659.


30. Bentham PW, Jones S, Hodges JR. A comparison of semantic memory in vascular dementia and dementia of Alzheimer’s type. Int J Geriatr Psychiatry 1997;12:575-580.


31. Crossley M, D’Arcy C, Rawson NS. Letter and category fluency in community-dwelling Canadian seniors: a comparison of normal participants to those with dementia of the Alzheimer or vascular type. J Clin Exp Neuropsychol 1997;19:52-62.


32. Fischer P, Gatterer G, Marterer A, Danielczyk W. Nonspecificity of semantic impairment in dementia of Alzheimer’s type. Arch Neurol 1988;45:1341-1343.


33. Spencer D. Seizures and epileptiform activity in early Alzheimer disease: how hard should we be looking? Epilepsy Curr 2014;14:73-75.



34. Carew TG, Lamar M, Cloud BS, Grossman M, Libon DJ. Impairment in category fluency in ischemic vascular dementia. Neuropsychology 1997;11:400-412.


35. Herbert V, Brookes RL, Markus HS, Morris RG. Verbal fluency in cerebral small vessel disease and Alzheimer’s disease. J Int Neuropsychol Soc 2014;20:413-421.


36. Kang Y, Na DL. Seoul neuropsychological screening battery. Incheon: Human Brain Research & Consulting Co, 2003.
37. Park HK, Na DL, Han SH, Kim JY, Cheong HK, Kim SY, et al. Clinical characteristics of a nationwide hospital-based registry of mild-to-moderate Alzheimer’s disease patients in Korea: a CREDOS (Clinical Research Center for Dementia of South Korea) study. J Korean Med Sci 2011;26:1219-1226.



38. Choi SH, Kim S, Han SH, Na DL, Kim DK, Cheong HK, et al. Neurologic signs in relation to cognitive function in subcortical ischemic vascular dementia: a CREDOS (Clinical Research Center for Dementia of South Korea) study. Neurol Sci 2012;33:839-846.


39. Yoon B, Shim YS, Hong YJ, Kim YD, Lee KO, Na SJ, et al. Which symptoms can distinguish between subjective cognitive impairment (SCI) and mild cognitive impairment (MCI)? Arch Gerontol Geriatr 2012;54:325-329.


40. Morris JC. The Clinical Dementia Rating (CDR): current version and scoring rules. Neurology 1993;43:2412-2414.

41. Ku HM, Kim JH, Kwon EJ, Kim SH, Lee HS, Ko HJ, et al. A study on the reliability and validity of Seoul-Instrumental Activities of Daily Living (S-IADL). J Korean Neuropsychiatr Assoc 2004;43:189-199.
42. Fazekas F, Kleinert R, Offenbacher H, Schmidt R, Kleinert G, Payer F, et al. Pathologic correlates of incidental MRI white matter signal hyperintensities. Neurology 1993;43:1683-1689.


44. McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM. Clinical diagnosis of Alzheimer’s disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer’s Disease. Neurology 1984;34:939-944.


45. American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders. 4th ed. American Psychiatric Association, Washington DC: 1994.
Figure 1.
Z-score for semantic and phonemic fluency in the patient groups. NC; normal control, aMCI; amnestic mild cognitive impairment, svMCI; subcortical vascular mild cognitive impairment, AD; Alzheimer’s disease, SVaD; subcortical vascular dementia, *p<.05 **p<.01 ***p<.001, aThe mean differences from the other groups are all significant at the .05 level, bThe mean difference from NC group is significant at the .05 level, cThe mean difference from aMCI group is significant at the .05 level, dThe mean difference from svMCI group is significant at the .05 level, eThe mean difference from AD group is significant at the .05 level, fThe mean difference from SVaD group is significant at the .05 level.

Figure 2.
Z-score for semantic and phonemic fluency by disease severity in the groups. aMCI; amnestic mild cognitive impairment, saMCI; single-domain amnestic mild cognitive impairment, maMCI; multiple-domain amnestic mild cognitive impairment, AD; Alzheimer’s disease, svMCI; subcortical vascular mild cognitive impairment, SVaD; subcortical vascular dementia, CDR; clinical dementia rating, *p<.05 **p<.01 ***p<.001, aThe mean differences from the other groups are all significant at the .05 level, bThe mean difference from saMCI group is significant at the .05 level, cThe mean difference from maMCI group is significant at the .05 level, dThe mean difference from svMCI group is significant at the .05 level, eThe mean difference from AD-CDR 0.5 group is significant at the .05 level, fThe mean difference from AD-CDR 1 group is significant at the .05 level, gThe mean difference from AD-CDR 2 group is significant at the .05 level, hThe mean difference from SVaD-CDR 0.5 group is significant at the .05 level, iThe mean difference from SVaD-CDR 1 group is significant at the .05 level, jThe mean difference from SVaD-CDR 2 group is significant at the .05 level, The significant level of mean difference is presented at the Supplementary Table.
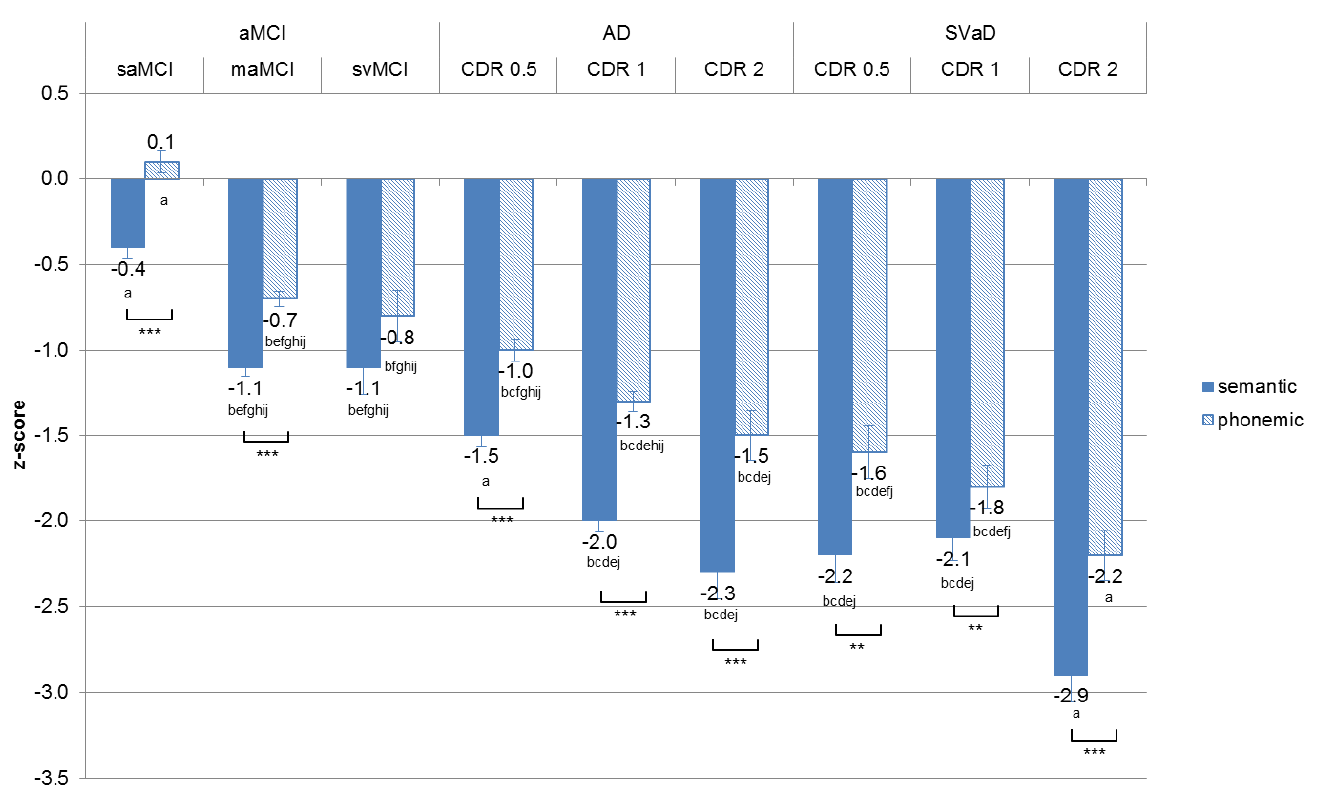
Figure 3.
Pattern of verbal fluency abnormality in disease groups. (A) Percentage in disease groups (B) Percentage by severity in Alzheimer’s disease (C) Percentage by severity in subcortical vascular dementia. SPnl; semantic-normal and phonemic-normal, SabPnl; semantic-abnormal and phonemic-normal, SnlPab; semantic-normal and phonemic-abnormal, SPab; semantic-abnormal and phonemic-abnormal, NC; normal control, aMCI; amnestic mild cognitive impairment, svMCI; subcortical vascular mild cognitive impairment, AD; Alzheimer’s disease, SVaD; subcortical vascular dementia, saMCI; single-domain amnestic mild cognitive impairment, maMCI; multiple-domain amnestic mild cognitive impairment, CDR; clinical dementia rating.
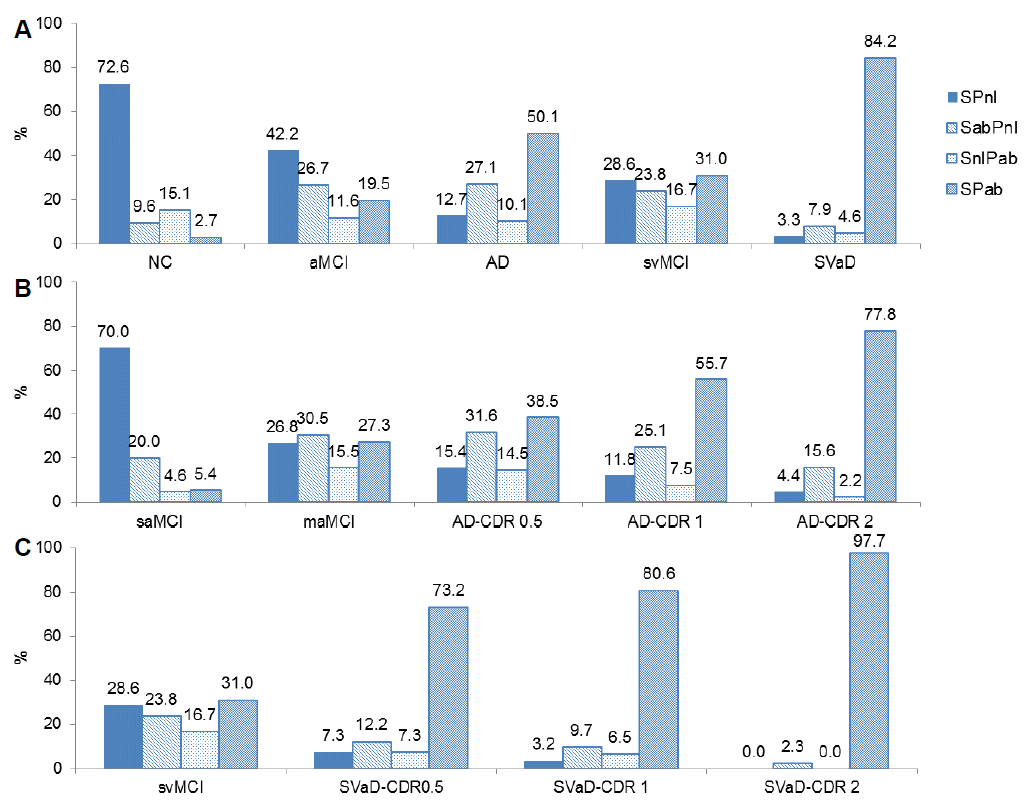
Table 1.
Demographics and raw scores of verbal fluency tasks
Table 2.
Demographics and raw scores of verbal fluency tasks
saMCI; single-domain amnestic mild cognitive impairment, maMCI; multiple-domain amnestic mild cognitive impairment, AD; Alzheimer’s disease, svMCI; subcortical vascular mild cognitive impairment, SVaD; subcortical vascular dementia, CDR; clinical dementia rating, K-MMSE; Korean mini-mental status examination, CDR-SB; clinical dementia rating-sum of boxes.
- TOOLS
-
METRICS

-
- 1 Crossref
- 0 Scopus
- 10,798 View
- 233 Download
- Related articles



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Supplement
Supplement Print
Print