뇌자기공명영상에서 비특이적인 혈관성 부종을 보인 하시모토뇌병증
Hashimoto's Encephalopathy Presented with Nonspecific Vasogenic Edema in Brain Magnetic Resonance Imaging
Article information
Trans Abstract
Hashimoto’s encephalopathy (HE) is a rare autoimmune disorder characterized by a nonspecific encephalopathy with high titers of serum anti-thyroid antibody in the absence of other defined causes. A 54-year-old woman was admitted due to recurrent seizures and confusion. Her serum anti-thyroid antibody level was elevated, and brain MRI showed multiple instances of vasogenic edema. Her symptoms disappeared after treatment with high-dose steroids and antiepileptic drugs. We propose that HE should be considered in the differential diagnosis of multiple vasogenic edema on brain imaging.
하시모토뇌병증은 인지기능저하, 정신병증, 발작 등 비특이적인 임상증상과 함께 항갑상선항체의 높은 역가 및 스테로이드에 대한 양호한 치료반응을 특징으로 하는 드문 자가면역질환이다[1-6]. 최근 연구에서 제안된 기준에 의하면 급성 또는 아급성의 의식변화, 항갑상선항체의 증가, 스테로이드치료 후 의식변화의 빠른 호전을 보이고 이를 설명할 만한 다른 기질, 감염, 대사성 요인이 없는 경우 진단이 가능하다[3]. 하시모토뇌병증의 뇌자기공명영상(brain magnetic resonance imaging, MRI)소견은 절반에서는 정상이며, 나머지는 세포독성부종, 미만성 탈수초병변, 혈관성 부종 등 비특이적 소견을 보인다[5]. 중추신경계 혈관염, 재발성 발작, Creutzfeldt-Jakob병, 뇌염 등의 다른 질환들에서도 유사한 임상 증상 및 뇌영상 소견을 보일 수 있어 감별해야 하고 뇌MRI 소견은 감별진단에 유용한 단서를 제공하기도 한다[7-10]. 우리는 하시모토뇌병증 환자에서 보일 수 있는 비특이적인 뇌MRI 소견들 중 드물게 관찰되는 혈관성 부종을 보인 증례를 경험하였기에 그 발병 기전과 감별질환에 대한 고찰과 함께 보고한다.
증 례
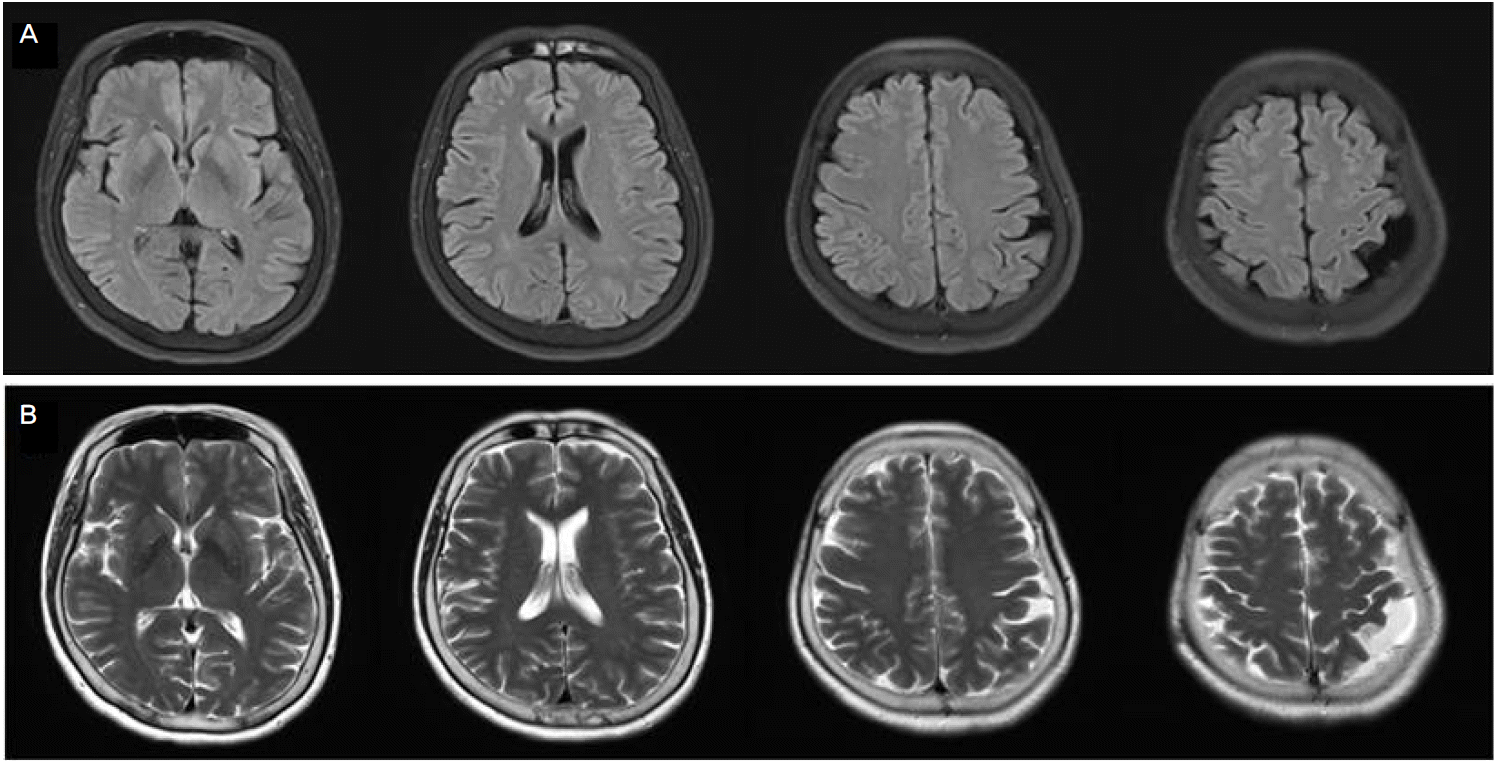
평소 고혈압 외에 다른 병력이 없던 54세 여자 환자가 일하던 중 갑자기 온몸에 열이 나면서 누구와 싸울 것 같은 기분이 수분간 들어 귀가하여 휴식을 취하였고, 이후 샤워하고 나오려는데 다시 이상한 기분 직후에 발생한 발작을 주소로 내원하였다. 보호자의 진술에 의하면 쿵 하는 소리가 들려 가보니 침을 흘리고 바닥에 쓰러진 채 약 1분가량 전신간대발작을 보이다가 멈추었고, 이후 약 20-30분가량 불러도 멍하니 반응이 떨어지는 모습을 보인 후 의식을 회복하였다. 증상 발생 전후로 복시나 언어장애, 위약감, 두통 등의 동반은 없었다. 입원 당시 혈압은 113/82 mmHg, 심박동수 79회/분, 체온은 37.1℃였다. 신경학적 진찰에서 의식은 명료하였고 국소 신경학적 결손은 없었다. 초기 혈액 검사에서 CPK 238 IU/L (참고치 26-140), 적혈구침강속도 27 mm/hr (참고치 0-20), C-반응단백질 2.57 mg/dL (참고치 0-0.3)로 다소 상승된 것 외 특이소견은 없었다. 입원 이후로 멍하니 허공을 주시하는 증상, 지남력 저하, 인지기능의 변동 등은 의료진에 의해 목격된 바는 없으나 보호자에 의하면 입원 이틀째 오전부터 하루에 수차례 허공을 가만히 응시하거나 주위자극에 대한 반응이 떨어지면서 대화 도중에 말이 끊기는 일이 반복된다고 하였다. 증상 발생 20시간째 시행한 뇌MRI 및 혈관조영술에서 유의한 대뇌혈관의 협착이나 폐색 소견은 없었으나 양측 기저핵, 우측 시상, 우측 꼬리핵머리, 우측 전두엽 그리고 두정후두엽의 피질과 백질에 다발성의 혈관성 부종이 관찰되었다(Fig. 1). 입원 2일째 발작간 뇌파에서 이상 소견은 없었고, 뇌자기공명 정맥조영술에서도 대뇌정맥의 폐쇄 및 혈전은 관찰되지 않았다. 반복적인 복합부분발작이 나타나는 것을 의심해서 레베티라세탐(levetiracetam)을 하루 1,000 mg 투여하기 시작하였다. 이후로 발작이나 감정의 변화는 없었으나 인지기능의 변동은 호전 없이 하루 수차례 반복되었고, 입원 3일째 시행한 간이정신상태검사(Mini Mental State Examination, MMSE)는 19점(초등학교 졸업, 시간 및 장소 지남력 -2점, 주의 집중 및 계산 -5점, 기억회상 -1점, 따라 말하기 -1점, 오각형 그리기 -1점, 쓰기 -1점)이었다. 뇌척수액검사에서 압력은 110 mmH20, 백혈구 0/mm3 , 포도당 74 mg/dL, 단백 15.5 mg/dL이었고, 항미크로솜항체, 항티로글로불린항체, 톡소포자충증, 개회충증, 크립토코쿠스 항원, AFB stain, HSV PCR, VZV PCR, VDRL 등은 음성이었다. 혈액검사에서 갑상선자극호르몬농도는 0.472 uIU/mL (참고치 0.55-4.78), Free T4는 1.61 ng/dL (참고치 0.89-1.76), T3는 69.6 ng/dL (참고치 60-181)이었으나, 항미크로솜항체 농도는 1,300 ng/dL 이상 (참고치 0-60)으로 매우 높았다. 그 외 류마티스인자, 항핵항체, 항중성구세포질항체 등은 음성이었다. 입원 4일째부터 고용량의 스테로이드(methylprednisolone, 500 mg/day) 투여를 시작하여 5일간 유지하였고, 입원 5일째부터 하루 수차례 반복되던 인지기능의 변동은 더 이상 보이지 않았고, 입원 9일째 추적한 MMSE는 30점으로 호전되었다. 퇴원 시 프레드니솔론 하루 50 mg으로 전환하여 2주 간격으로 10 mg씩 감량하였다. 증상 발생 60일째 추적한 뇌MRI에서 기존의 병변은 사라졌고(Fig. 2), 퇴원 3개월 후 프레드니솔론 격일로 하루 5 mg 유지 중이며 증상의 재발은 보이지 않고 있다.
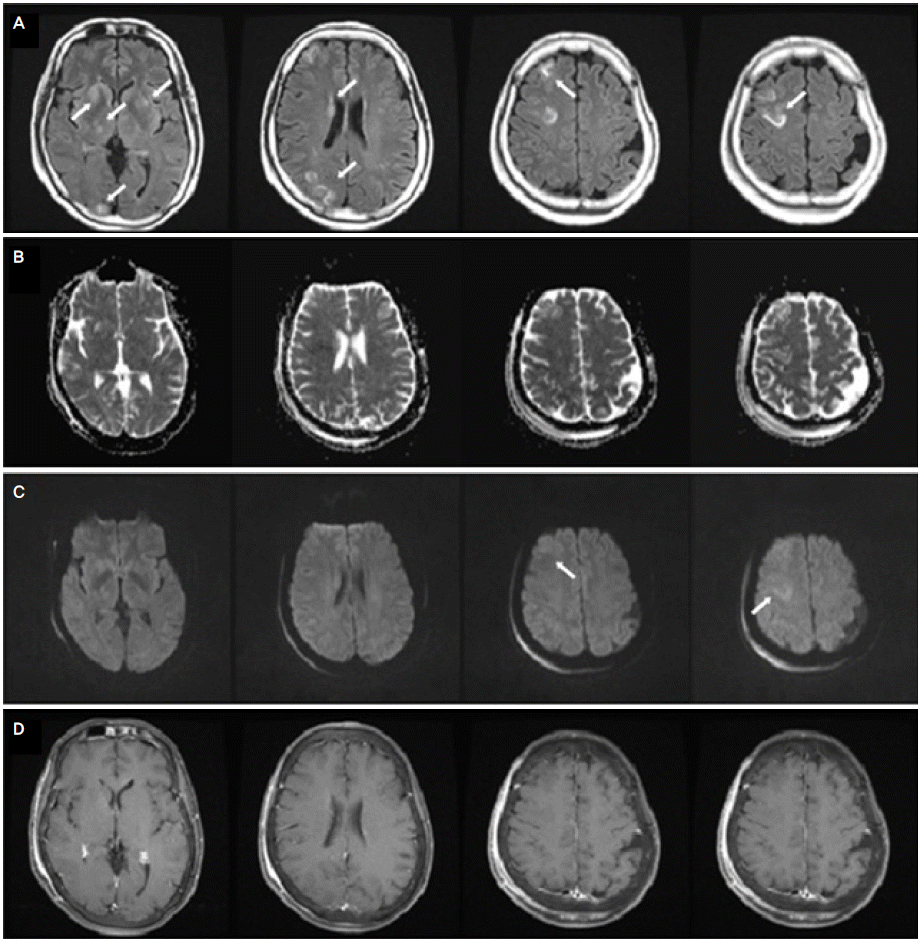
Initial FLAIR (A) MRI and ADC (B) image showed multiple high signal intensity, but subtle high signal intensity was observed in right high frontal cortex and subcortex on diffusion-weighted image (C) (arrows). The lesions are not enhanced with gadolinium (D). FLAIR; fluid-attenuated inversion recovery imaging, MRI; magnetic resonance imaging, ADC; apparent diffusion coefficient.
고 찰
하시모토뇌병증은 여러 가지 신경계증상과 더불어 갑상선항체의 역치가 상승하는 것이 특징인데, 정확한 병인은 알려진 바가 없다. 하시모토뇌병증의 발병기전에 대한 여러 가설들 중 항갑상선항체의 경우 그 역가가 질환의 중등도에 잘 비례하지 않고 정상인에서도 높게 검출될 수 있어 직접적인 병인이라고 말하기는 어렵다. 그 외에도 자가면역반응에 의한 혈관염, 갑상선과 중추신경계에 의해 공유되는 다른 자가항원 등의 가설들이 제시되고 있으며[1,3,5,6], 몇몇 보고들에서는 뇌생검에서 혈관벽의 림프구성 염증 소견을 보인 증례들이 있어 혈관염에 의한 것이라 설명하기도 한다[1,4,6]. 본 환자의 확산강조영상(diffusion weighted imaging, DWI)에서는 우측 전두엽 피질 및 피질하 부위의 미약한 고신호 강도를 제외하고 특이소견이 없었으나 액체감쇠역전회복영상(fluid-attenuated inversion recovery imaging, FLAIR), 겉보기확산계수지도(apparent diffusion coefficient map, ADC map)에서 양측 기저핵, 우측 시상, 우측 꼬리핵머리, 우측 전두엽 그리고 두정후두엽에 고신호 강도가 관찰되었다. 이는 하시모토뇌병증의 비특이적 뇌MRI 소견 중 혈관성 부종에 부합되는 소견이다[1-5]. 이전에 혈관성 부종과 항갑상선항체의 증가를 보인 하시모토 뇌병증 환자에서 시행한 뇌생검 상 혈관염 소견을 보였던 1예가 있었다[4]. 또한 뇌MRI에서 이상소견을 보였던 중추신경계 혈관염 환자들 대다수에서 FLAIR, T2강조영상에서 백질의 비특이적인 고신호 강도를 보였다는 점에서[1-7], 본 환자는 뇌조직검사를 시행하지는 않았으나 임상 및 영상소견에서 유사점이 있어 혈관염이 하시모토 뇌병증의 병인으로 작용했을 가능성을 고려할 수 있었다.
하시모토뇌병증을 진단하기 위해서는 비슷한 증상을 보일 수 있는 여러 질환들에 대한 배제적 진단이 필수적이다. 우리 환자의 경우, Creutzfeldt-Jakob병은 DWI에서 피질의 뇌이랑 부위에 국한된 고신호 강도가 백질의 침범 없이 나타나는 것이 특징적[8]이므로 배제가 가능하였다. 원발성 혈관염은 서서히 심화되는 두통, 뇌경색, 발작 등의 신경계 증상과 함께 뇌척수액 검사상 대부분 경한 백혈구 및 단백질의 증가를 보이면서 뇌MRI 소견은 대개 정상이라는 점[9]에서 배제가 가능하였다. 그 외에 결핵, 바이러스, 기생충, 자기면역질환 등에 의한 이차성 혈관염 또한 임상증상 및 항핵항체, 류마티스 인자, 항중성구세포질항체 등의 검사실 소견이 음성이었다는 점에서 배제가 가능하였다. 다발성의 혈관성 부종의 경우 대뇌정맥동혈전증에 의한 경우도 있어[10] 뇌자기공명정맥조영술을 실시했고, 검사상 특이 소견이 없어 배제하였다. 위에 열거한 모든 질환에 대한 배제와 더불어, 항미크로솜항체의 현저한 상승 및 스테로이드 치료에 의한 증상의 호전을 보이는 임상경과를 통해 하시모토뇌병증을 진단할 수 있었다[1-6].
본 증례는 뇌MRI에서 다발성의 비특이적 혈관염 소견을 보이는 하시모토뇌병증에 관한 최초의 보고이다. 이전에도 혈관염을 보이는 하시모토뇌병증의 증례보고는 있었으나 다발성 병변을 보인 국내 증례는 없었다. 진단을 위해서는 다른 원인에 의한 혈관염 및 대뇌 정맥동 혈전증과 감염질환 등을 배제한 후 항갑상선항체의 상승을 확인하고 스테로이드에 좋은 반응을 보이는 것으로 진단이 가능하다. 진단 및 치료가 늦어질 경우 비가역적인 신경계장애가 후유증으로 남을 수 있으므로 신속한 진단 및 치료를 요한다.